
Introducción
La cinética química se encarga del estudio
del cambio que a su vez se ve reflejado en la ciencia
farmacéutica, ya que es una ciencia que estudia, el
cómo obtener un determinado producto bajo condiciones
apropiadas.
Las reacciones se pueden clasificar cinéticamente
en Homogéneas y Heterogéneas, la primera ocurre en
una fase y la segunda en más de una fase.
La cinética química viene siendo
relacionada con el ámbito farmacéutico debido a que
gracias a estos cambios se obtiene un producto fármaco
químico con fines terapéuticos. Su fundamento
es la investigación y desarrollo
de productos químicos medicinales para prevenir
o tratar las diversas enfermedades y
alteraciones.

OBJETIVO:
Permitir que el lector entienda la importancia de esta
ciencia en diferentes campos con mayor énfasis para la
transformación de sustancias farmacéuticas con
fines terapéuticos.
Medir la velocidad de las reacciones químicas y
encontrar ecuaciones que relación en la velocidad de una
reacción con variables experimentales.
Cinética
química y la industria farmacéutica
Es la determinación experimental de la rapidez de
las reacciones y depende de la concentración, temperatura,
efecto de los catalizadores, naturaleza de los reactivos y
superficie de reactivos.
VELOCIDAD DE REACCION
La velocidad de una reacción se expresa como el
cambio en la concentración de los reactivos con el
tiempo.

Uno de los factores más importantes es la
concentración de los reactivos. Cuantas más
partículas existen en un volumen, mas colisiones hay entre
las partículas por unidad de tiempo. Al principio, cuando
la concentración de reactivos es mayor, también es
mayor la probabilidad de que se den colisiones entre las
moléculas, y la rapidez es mayo. A medida que la
reacción avanza, al ir disminuyendo la
concentración de los reactivos, disminuye la probabilidad
de colisión y con ella la rapidez de la
reacción.

La medida de la rapidez de la reacción implica la
medida de la reacción de uno de los reactivos o productos
a lo largo del tiempo, esto es, para medir la rapidez de una
reacción necesitamos medir, bien la cantidad de reactivo
que desaparece por unidad de tiempo, o bien la cantidad de
producto que aparece por unidad de tiempo.
LA LEY DE LA RAPIDEZ DE FORMACION ES LA
SIGUIENTE.

ORDEN DE REACCION:
Reacciones de orden cero:
El orden de reacción específica y la
dependencia empírica de la rapidez con las concentraciones
puede ser cero, un número fraccionario. Se puede usar la
ley de rapidez para determinar la concentración de los
reactivos en cualquier momento durante el trascurso de la
reacción.
L n CA = – K t
Reacciones de primer orden:
Es la velocidad de la reacción que depende solo
de la concentración del reactivo, elevado a la primera
potencia.
[A]= [A]0 e – k t
Vida media de una reacción:
Se define como el tiempo que trascurre para que la
concentración del reactivo disminuya a la mitad de su
valor original.

La vida media de una reacción de primer orden es
independiente de la concentración inicio.
[A] / M

Reacciones de segunda orden.
Existen dos tipos:
En el primero solo hay un reactivo. El segundo implica
dos reactivos diferentes. El primer tipo se representa por la
reacción general.

Existen varios factores que afectan la
rapidez de una reacción química:

Temperatura: la aplicación
de calor para aumentar la velocidad de una
reacción química es
un procedimiento habitual de laboratorio. En
1889 Arrhenius observo que la variación de la
constante de velocidad de las reacciones químicas con
la temperatura podía expresarse por:
K=Ae[-E/RT]
Estado físico de los
reactivos: Si en una reacción interactúan
reactivos en distintas fases, su área de contacto es
menor y su rapidez también es menor. En cambio, si el
área de contacto es mayor, la rapidez es
mayor.
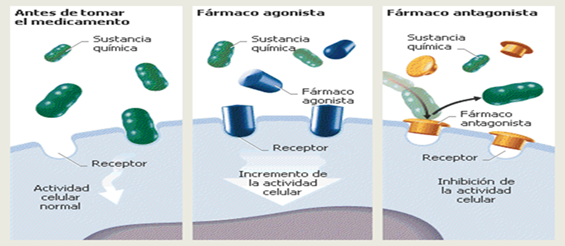
Presencia de un catalizador: Los
catalizadores aumentan o disminuyen la rapidez de una
reacción sin transformarse. Suelen empeorar la
selectividad del proceso, aumentando la obtención de
productos no deseados. La forma de acción de los
mismos es modificando el mecanismo de reacción, empleando
pasos elementales con mayor o menor energía de
activación.
Catálisis: El termino
catalizador se refiere a las sustancias que aceleran la
velocidad de la reacción.
Cuando el catalizador no aparece en la
ecuación de la reacción es porque se regenera en el
transcurso de la reacción. El catalizado aumenta la
velocidad de la reacción de vida a que disminuye la
energía de activación.
Los catalizadores se clasifican
en:
HOMOGENEOS: el catalizador se encuentra
en la misma fase que los reactivos.HETEROGENEOS: El catalizador se
encuentra en una fase diferente de la de los
reactivos
MOLECULARIDAD DE UNA REACCION:
La reacción global es la suma de varias etapas o
pasos, cuya secuencia se denomina mecanismo de reacción.
El conocimiento del mecanismo de una reacción permite
saber cómo se aproximan entre si las moléculas
durante una colisión, se rompen y se forman los enlaces
químicos, como se trasfieren las cargas y lo que sude
cuando se aproximan las moléculas de los
reactivos.
Ejemplos:

Aquí apreciamos un pequeño
ejemplo:
PRODUCCIÓN DE LACTITOL, PRODUCTO DERIVADO DE
LA LACTOSA
Alternativa viable para aprovechamiento del
suero de queso.
Este poliól se obtiene a
través de la hidrogenación catalítica de
lactosa y muy usada en la industria química, alimenticia y
farmacéutica, debido a ventajas tales como su bajo poder
calórico, no cariogénico y es apto para
diabéticos.

En el esquema presentado a continuación, se
describen las etapas de adsorción, reacción
química y desorción, representando el mecanismo que
involucra interacción en sitios activos (S) vecinos, con
formación de productos.

Siendo L, OL, H2, S, H2.S, L.S y OL.S
representan, respectivamente, las especies lactosa, lactitol,
hidrógeno, sitios libres y sitios ocupados del
catalizador.
La cinética de cada reacción
heterogénea, que incluye etapas de adsorción,
desorción y reacción química, se identifican
con los modelos del tipo Langmuir-Hinshelwood. Para las cuatro
etapas presentadas con anterioridad, las velocidades de
adsorción, desorción y reacción son
destacadas a continuación:

Siendo kn y k.n las constantes de
velocidad de adsorción, desorción y
reacción, y ?L, ?H2 y ?ol las fracciones de
sitios ocupados por los componentes de la
reacción.
Desarrollando los balances molares para
cada especie presente en el sistema de reacción se
obtiene, para lactosa:
Para el H2 enlazado al
sitio:

Siendo [L.S], [OL.S] y [H2.S] las
concentraciones de sitios ocupados, respectivamente, por las
especies lactosa, lactitol e hidrógeno.
El modelo matemático fue
desarrollado basándose en el sistema de ecuaciones
diferenciales ordinarias (EDOs) formado por las ecuaciones. Se
admiten cinéticas de reacción, dadas por las
ecuaciones anteriores. Las condiciones iniciales del sistema de
EDOs son dadas acorde consideraciones presentadas a
continuación. La reacción ocurre a partir de una
concentración inicial dada de lactosa:
CL(0) = CL¡ (14)
Se admite que la concentración
inicial de lactitol es igual al valor experimental
inicial:
Col(0) = Col¡ (15)
La concentración inicial de
hidrógeno fue calculada basándose en la
concentración de gases reales:

Siendo P la presión del gas en el sistema, la
cual es mantenida constante, T la temperatura de reacción,
que también es constante, Z es el factor de
compresibilidad del H2 y R es la constante universal de los
gases.
Para resolver el modelo matemático propuesto, a
partir de las condiciones iniciales presentadas, se implemento un
código en Fortran y se empleó el método de
Runge-Kutta de 4° orden. Los parámetros
cinéticos del modelo (k1/k-1, k2/k_2, k3, k4/k-4) fueron
evaluados minimizando la suma de los cuadrados de la
función objetivo, presentada a
continuación:

Siendo nexp es el número de datos
experimentales; CL es la concentración de lactosa;
Col es la concentración de lactitol. Los
índices sobrescritos "exp" y "cale" representan,
respectivamente, los datos experimentales y los valores
calculados por el modelo. Para minimizar la función
objetivo (Fo), se empleó el método
estocástico basado en enjambre de partículas
(Particle Swarm Optimization -Pso), propuesto por (Kennedy et.
al., 1995).
Hidratación alrededor del
anión y posteriormente se favorece la interacción
del anión con el catalizador.
Además, con bajos valores de pH hay una tendencia
al aumento en la densidad de cargas positivas en la superficie
del catalizador y bajo éstas condiciones, la
adsorción en metales es dificultada debido a la
competencia con los iones H+. Con el aumento del pH, la densidad
de carga negativa de la superficie del adsorbente aumenta,
resultando en una menor repulsión electrostática
entre la superficie y el ion metálico, así como hay
un decrecimiento en la competencia entre el protón y el
metal por el mismo grupo funcional y, en consecuencia, aumentando
la adsorción.

Hidrogenación de la lactosa con
Mo2C y pH = 3,5.

Hidrogenación de la lactosa con
Mo2C y pH = 8,0

Hidrogenación de la lactosa con
Mo2N y pH = 4,5

Hidrogenación de la lactosa con
Ni-Mo/C y pH = 7
Además, con el objetivo de evaluar la influencia
de los iones cloruros y de las proteínas en la actividad
del catalizador, se hidrogenaron catalíticamente muestras
de suero bruto y muestras de suero desproteinizado (con un 26,11%
de proteínas residuales) y desalinizado (con un 21,3 % de
iones cloruros residuales presentes en la fase líquida),
en presencia del Ni-Mo/C, siguiendo la misma metodología
empleada para la solución de lactosa. En
las Figuras se presentan los resultados de la
conversión de la lactosa del suero en lactitol con valores
experimentales y calculados por el modelo
cinético.
Desalinizado Esa reducción puede ser
atribuida, en principio, a la presencia de proteínas e
iones cloruros remanentes que ocupan áreas activas,
conduciendo a una reducción de la actividad del
catalizador. Constantes cinéticas de
adsorción, desorción y
reacción.
Valores de los parámetros del modelo
cinético.

Siendo:
1 – Mo2C (pH 3,5) 2- Mo2C (pH =
8,0) 3- Mo2N (pH = 4,5) 4-Ni-Mo/C – Lactosa (pH =
7). 5- Ni-Mo/C – suero de queso bruto (pH = 6,3). 6-
Ni-Mo/C – suero desproteinizado (pH = 6,5).
Se observa a través de la constante
cinética k1 empleando el carburo Mo2C, que el pH del
medio reactivo influye significativamente en la adsorción
de la lactosa en la zona catalítica. La adsorción
se favorece en pH básico, reflejando también en la
fuerte adsorción y mayor consumo de H2 (mayor valor
de k2) en la zona catalítica es decir, que aumentando el
pH de reacción, aumenta la adsorción de lactosa en
la superficie del catalizador, aumentando la velocidad de
reacción y aumentando el consumo de
hidrógeno.
NOMENCLATURA
C = Concentración (mmol/L). EP
(%) = porcentaje de extracción de
proteínas k1, k2 = constante de adsorción
(L/min.g) k3 = constante de producción de
lactitol (mmol/min. g) k4= constante de desorción
(L/min. g) mcat = masa del catalizador (g). P =
presión (atm). r = tasa de reacción
(mmol/g.min). ST = concentración de zonas. t =
tiempo (minuto). V = volumen (Litro). ? = sitio
catalítico.
Bibliografía
Fisicoquímica
………………………………………………
Raymond Chang
Fisicoquímica…………………………………………………..Jorge
Raúl Valdeigleias J.
Autor:
Delia Flores
