- Principio de
exclusión de Pauli - Diagrama de niveles
de energía - Regla de Hund (
máx. multiplicidad) - Sistema
periódico - Distribución
electrónica y sistema
periódico - Propiedades
atómicas periódicas - Guía de
ejercicios configuración
electrónica
Cuadro resumen de los orbitales que hay en cada nivel de
energía
Nivel de energía n | N° de orbitales s p d f | N° total de orbitales n2 | Máximo de electrones 2n2 |
1 | 1 – – – | 1 | 2 |
2 | 1 3 – – | 4 | 8 |
3 | 1 3 5 – | 9 | 18 |
4 | 1 3 5 7 | 16 | 32 |
Para distribuir los electrones dentro de un átomo
, se han establecido una serie de reglas que responden a los
principios de la Teoría Mecánico-Cuántica, y
que permiten representar las configuraciones
electrónicas de los átomos o la
distribución de los electrones en los diferentes orbitales
atómicos.
REGLAS PARA ESCRIBIR LAS CONFIGURACIONES
ELECTRÓNICAS.
1.- Principio de
exclusión de Pauli :
2e- en un átomo no pueden tener el mismo conjunto
de 4 números cuánticos. Por lo tanto el nº
máx. de e- por orbital es 2
2.- Diagrama de
niveles de energía :
Para átomos con más de un e- ,la
energía queda determinada por los nºs
cuánticos n, l,así se pueden establecer los
distintos niveles de energía de los orbitales de un
átomo.

Los orbitales se llenan de acuerdo a su
energía ,principio de AUFBAUF
(construcción), este principio establece que la
adición de un e- a un átomo este ocupará un
nivel de más baja energía disponible; será
más atraído por el núcleo.
3.- Regla de Hund
( máx. multiplicidad)
Cuando existen disponibles orbitales de energía
idéntica ( orbitales degenerados) por ejemplo p ó d
los e- tienden a ocuparlos de uno en uno y no de a pares
.
Ejemplo : escribir la configuración
electrónica de un elemento cuyo Z=18

UN EJEMPLO: EL ÁTOMO DE OXÍGENO
¿Qué debo tener en cuenta si realizo la
configuración electrónica para el átomo de
oxígeno?
Necesitamos saber el orden en que se van llenando los
distintos subniveles. Los electrones van ocupando los subniveles
disponibles en el orden en que aumenta su
energía.
La configuración electrónica del
átomo de oxígeno resultante es: 8O: 1 s2 2 s2 2
p4
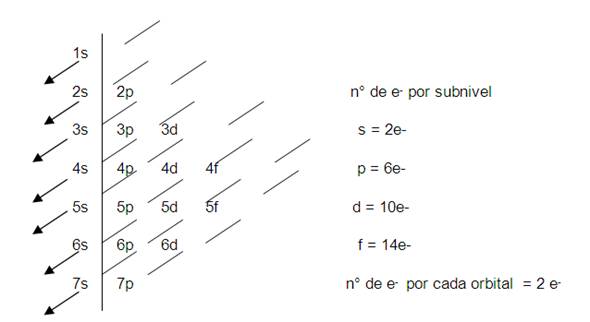
Recuerda la regla de las diagonales
¿Qué debo tener en cuenta para usar los
casilleros cuánticos?
Para representar la configuración
electrónica de cualquier átomo mediante casilleros
cuánticos O DIAGRAMA DE ORBITALES debo tener presente la
REGLA DE HUND. 3 px 2 3 py 2 3 pz 1



Regla de Hund: En un mismo subnivel, los
electrones no se aparean hasta que no haya un electrón en
cada orbital.
Representación mediante casilleros
cuánticos para el OXÍGENO



| 1 s2 | 2 s2 | 2 px2 | 2 py1 | 2 pz1 |
Para escribir fácil y correctamente la
configuración electrónica de cualquier
átomo, debes seguir la regla de las diagonales que aparece
en el esquema siguiente, sólo debes seguir la flecha e ir
completando el número máximo de electrones que
acepta cada orbital. Este mismo diagrama aparece en el reverso de
la tabla periódica.




Ejemplo: Escribe la configuración
electrónica del hidrógeno H Z=1
RESPUESTA: Si Z=1 significa que el átomo
tiene 1 electrón, y si este es un átomo neutro
tendrá 1 electrón, este único
electrón se distribuirá , según las reglas
anteriores, en el nivel 1 ( de menor energía) y en el
orbital s, lo que se representa 1s1 Ejemplo: Escribe la
configuración electrónica del Helio He
Z=2
RESPUESTA: 1s2 , significa que en el nivel 1, en
el orbital s hay 2 electrones ( uno con spin +1/2 y otro con spin
–1/2) Ejemplo: escribe la configuración
electrónica del Litio Li Z=3
RESPUESTA: 1s2 2s1 , esta configuración
también se puede representar por un diagrama de orbitales
como el siguiente:
 1s2
1s2
 2s1
2s1
En el diagrama de orbitales las flechas representan los
electrones, con diferente spin (+1/2 o –1/2) y cada cuadro
representa un orbital.
EJERCITA: 1.- a.- Escribe la
configuración electrónica de los átomos con
n°atómicos desde 4 a 10, escribe también el
nombre y el símbolo del elemento respectivo.
b.- Dibuja el diagrama de orbitales para cada
elemento
N° atómico | Nombre del elemento y | Configuración | Diagrama de orbitales | |||||
4 | ||||||||
5 | ||||||||
6 | ||||||||
7 | ||||||||
8 | ||||||||
9 | ||||||||
10 | ||||||||
2.- Completa el siguiente
cuadro:
Elemento y símbolo del | N°atómico | Configuración | Diagrama de orbitales | ||||
Sodio | |||||||
Magnesio | |||||||
Aluminio | |||||||
Silicio | |||||||
Fósforo | |||||||
azufre | |||||||
Sistema
periódico
Las configuraciones electrónicas nos sirven de
criterio para clasificar los diferentes elementos
químicos, pilares básicos de la materia : agrupados
según su configuración electrónica, podemos
comprender porque presentan propiedades comunes .
Por ejemplo la clasificación hecha por ti en
el ejercicio anterior, dice que H, Li, Na y K tiene la misma
configuración electrónica; igual, Cl y Br ; esto
significa que H, Li, Na y K pertenecen a un mismo grupo de
elementos, que tienen todos sólo 1 electrón de
valencia .
Pertenecen al Grupo IA del Sistema Periódico,
en cambio el Cl y el Br que tiene 7 electrones de valencia,
pertenecen al Grupo VIIA del Sistema Periódico. Como
puedes ver en el Sistema periódico, existe un orden, que
se basa en el número atómico de cada
elemento; estos se ubican de menor a mayor Z en la Tabla y
se disponen en filas, llamadas períodos y en
columnas verticales llamadas grupos.
GRUPOS: Líneas verticales que contienen
átomos con igual configuración electrónica
externa (último nivel). Es decir todos los átomos
de un mismo grupo poseen igual número de electrones de
valencia
Distribución electrónica y
sistema periódico
Veamos en la Tabla Periódica: el Grupo al
que pertenece un elemento depende de su configuración
electrónica. Esto quiere decir que el orden en que se
llenan los subniveles electrónicos es el que establece la
estructura del sistema periódico. Referencias:
— Elementos representativos con el electrón
de valencia en subnivel s –Elementos representativos con
el electrón de valencia en subnivel p –Elementos de
transición con el electrón de valencia en subnivel
d — Elementos de transición interna con el
electrón de valencia en subnivel f
RECUERDA QUE LOS ELECTRONES DE VALENCIA CORRESPONDEN
A LOS ELECTRONES DEL ULTIMO NIVEL DE ENERGIA Y CORRESPONDEN EN
NUMERO AL NUMERO DEL GRUPO AL CUAL PERTENECE EL
ATOMO.
Por ej. el oxigeno pertenece al grupo via eso indica que
el número de electrones de valencia de este atomo es de
seis.compruébalo: escribe la configuración del 80
z= 8

GRUPO I A
H 1s1 Li 1s22s1 Na 1s22s22p63s1 K
1s22s22p63s23p64s1
TODOS LOS ELEMENTOS DEL GRUPO IA POSEEN 1
ELECTRÓN DE VALENCIA.
GRUPO II A
Be 1s2 Mg 1s22s22p63s2 Ca 1s22s22p63s23p64s2
TODOS LOS ELEMENTOS DEL GRUPO IIA POSEEN 2 ELECTRONES
DE VALENCIA.
Los electrones de valencia son muy importantes ya que
son los que pueden pasa de un átomo a otro para formar
enlaces y formar compuestos químicos, por lo que hablan de
la reactividad de cada átomo.
PERÍODOS: Son las líneas
horizontales de la tabla y también se relacionan con la
configuración electrónica del último nivel.
El período al que pertenecen queda indicado por el
número que precede al orbital. Todas las configuraciones
externas que poseen 1s pertenecen al período 1. Todas las
configuraciones externas que se escriben 2s2p pertenecen al
período 2.
EL PERÍODO INDICA EL NIVEL DE
ENERGÍA. EJEMPLO: H Z=1 1s1 He Z=2 1s2 ,
pertenecen al período 1 Li Z=3 1s22s1 ,Be Z=4 1s22s2 ,B
Z=5 1s22s22p1 ,C Z=6 1s22s22p2, pertenecen al período
2
EJERCICIO: Escribe las configuraciones
electrónicas de los siguientes elementos y di a que grupo
y período pertenecen: N Z=7 S Z= 16 RbZ= 37 Cl Z=
17

De acuerdo a la configuración electrónica
los elementos químicos se clasifican como:
GASES NOBLES ELEMENTOS
REPRESENTATIVOS ELEMENTSO DE
TRANSICIÓN GASES NOBLES: Se ubican en el
extremo derecho de la tabla periódica , en el grupo 0 o 18
, a este grupo pertenecen los elementos Helio He, Neón Ne,
Argón Ar, Kriptón Kr, Xenón Xe, y
Radón Rn. Todos los átomos de este grupo excepto el
helio, tienen 8 electrones de valencia , lo que les confiere una
gran estabilidad ya que presentan sus orbitales completos con una
configuración ns2np6, donde n representa el nivel
de energía más externo. La característica
principal de estos elementos es su escasa reactividad debida a
que por tener completo su último nivel, no ceden ni
aceptan electrones.
ELEMENTOS REPRESENTATIVOS: Se ubican en los
grupos A del Sistema Periódico y tienen sus electrones de
valencia ubicados en los orbitales s o p . Sus
configuraciones externas van desde ns1 hasta ns2np5, excluyendo
el ns2 que corresponde al helio que es un gas noble por tener el
orbital completo.
ELEMENTOS DE TRANSICIÓN: Se ubican el los
grupos B de la tabla periódica ;estos átomos
presentan configuraciones más complejas , ya que los
electrones de valencia se ubican en los orbitales d o
f EJERCICIO: Escribe la configuración
electrónica de los elementos Na Z=11, O Z=8, P Z=15 , Co
Z=27, Cu Z=29, Si Z=14 y de acuerdo a su configuración
electrónica di a que grupo y a que período
pertenece cada elemento y que tipo de elemento es (gas noble,
elemento representativo o elemento de
transición).
Los elementos químicos adoptan "actitudes" para
obtener estabilidad tratando siempre de parecerse a los gases
nobles, según la actitud que adoptan los elementos se
pueden clasificar en: elementos metálicos y no
metálicos: Los elementos metálicos son
aquellos que ceden electrones para estabilizarse y
espontáneamente reaccionan con los elementos no
metálicos que necesitan electrones para alcanzar la
estabilidad, por lo tanto los no metálicos captan los
electrones que ceden los metálicos.
EJERCICIO: Busca en tu tabla periódica 3
elementos representativos y 3 elementos de transición ,
escribe su configuración electrónica y
clasifícalo como metálico o no
metálico.
EJERCICIOS 1. Escriba el número máximo de
electrones que se puede localizar en cada uno de los siguientes
sitios:
un orbital b) el subnivel p c) un átomo de
litio
d) el segundo nivel de energía e) el subnivel 3p
del átomo de azufre f) el tercer nivel de energía
del Sí
Identifique la especie química para las
siguientes configuraciones electrónicas (en caso de
estar mal asignadas corrígelas
1s2 2s2 2p6 3s2 b) 1s2 2s2 2p6 3s2 3p6 4s2 4p1
3d9
c) 1s2 2s2 2p6 3s2 3p6 3d10 d) 1s2 2s2 2p2 3s2 3p2 3.
Escriba la configuración electrónica del ión
Cl- Z=17 e indique a lo menos 4 especies isoelectrónicas.
4. Escriba la configuración electrónica para los
átomos con las siguientes características e indique
sin mirar la tabla periódica el grupo, periodo y tipo de
elemento.
el primer átomo del grupo IA con un
electrón exterior 3sátomo(s) del grupo VIIA con electrones
4pátomo(s) del grupo IA sin orbitales d
ocupadosátomos del 3° periodo que contienen
más de 4 electrones exterioresátomo(s) que contiene(n) únicamente
electrones s y p
5. Identifica el orbital de menor energía entre
a) 4s y 3d b) 5d y 6p 6. Identificar el grupo, familia y tipo de
elemento y/u otra localización en la tabla
periódica de cada uno de los elementos con la
configuración electrónica más
externa.
ns2np3
ns2(n-1)d10np5
ns2
7.Las configuraciones electrónicas para los
siguientes átomos son incorrectas. Explique qué
errores se han cometido en cada una y escriba las configuraciones
correctas:
(Al( : 1s22s22p43s23p3 (B( : 1s22s22p5 (F( : 1s22s22p6
8.Identifique a qué atomo corresponde cada
configuración electrónica. Reescriba cada
configuración en términos de aquella del gas noble
precedente (KERNELL).
a) 1s22s22p63s2
b) 1s22s22p63s23p64s23d104p3
9.Escriba la configuración
electrónica de los siguientes iones y la carga cuando
corresponda,
a) 7 N-3 =
b) 13 Al+3 =
c) 29 Cu+ n, n°e- = 27
d) 4 Be +2 =
10 .Un cierto elemento neutro tiene 2 electrones
en el primer nivel, 8 electrones en el segundo nivel, 18
electrones en el tercer nivel y 3 electrones en el cuarto nivel.
Enuncie la información siguiente para este
elemento:
a) número atómico
b) número total de electrones
sc) número total de electrones
pd) número total de electrones
de) número de protones
f) grupo y periodo a los cuales
perteneceg) nombre y símbolo del
elementoh) configuración electrónica
usando el kernel de gas noble
Propiedades
atómicas periódicas
La configuración electrónica de los
elementos muestra una variación periódica al
aumentar el número atómico Z . Como consecuencia de
esta variación, los elementos también presentan
variaciones en sus propiedades físicas y en su
comportamiento químico. Algunas de estas propiedades
son: a.- Radio atómico: Corresponde a la mitad
de la distancia entre 2 núcleos de 2 átomos
adyacentes , suponiendo que el átomo es una esfera
.

La variación del radio atómico en la tabla
periódica es la siguiente:
En un período el radio atómico
disminuye de izquierda a derecha , al aumentar Z.. Esto
ocurre porque el tamaño de los átomos
está determinado por la fuerza de atracción
entre los electrones de valencia y el núcleo, entonces
mientras mayor es el número de electrones de valencia
y mayor es la cantidad de electrones en el núcleo,
mayor será la carga nuclear efectiva ( fuerza de
atracción entre protones y electrones) y menor el
tamaño
En los grupos, el radio atómico aumenta desde
arriba hacia abajo ya que los electrones externos
están ubicados en niveles cada vez más alejados
del núcleo, la fuerza nuclear es menor.

Variación periódica de radios
atómicos.
b.- Potencial de ionización (PI): Es la
energía necesaria para arrancar un electrón de un
átomo neutro, gaseoso, para convertirlo en un ión
positivo o catión, según la siguiente
ecuación:
M(g) +  I
I
M+(g) + 1e- Donde M es un elemento metálico I es el
potencial de ionización e- es un electrón que sale
del átomo neutro por efecto de la energía aplicada
El potencial de ionización varía en forma inversa a
la variación de tamaño o radio atómico, a
mayor radio atómico menor será I , se necesita
menos energía para arrancar 1 electrón externo
puesto que la fuerza nuclear sobre este electrón
será menor. Mientras menor es el radio atómico, mas
costará sacar el electrón externo, puesto que
estará más atraído por el
núcleo.
En un grupo, el potencial de ionización,
disminuye de arriba hacia abajo. En un período, el
potencial de ionización aumenta de izquierda a
derecha. c.- Electroafinidad (EA). Así como la
formación de un catión requiere energía I.
La formación de un anión también requiere
energía, esta energía es la electroafinidad, es la
cantidad de energía que se libera cuando un átomo
neutro en estado gaseoso capta un electrón y se convierte
en un ión negativo, según la siguiente
expresión:
X(g) + 1e X- + EA Donde X es un elemento no
X- + EA Donde X es un elemento no
metálico e- es el electrón que se agrega al
átomo X- es el anión que se forma EA es la
energía que se libera.
En un grupo la electrafinidad disminuye de arriba hacia
abajo, a mayor tamaño del átomo se libera menor
cantidad de energía.
En un período la electrafinidad aumenta de
izquierda a derecha, a menor tamaño del átomo mayor
energía se libera. d.- Electronegatividad (EN);
también es una magnitud energética pero que
sólo tiene sentido en las moléculas , sirve para
predecir el tipo de enlace que se forma entre 2 átomos (
covalente polar, covalente apolar o iónico ). Es una
medida de la fuerza con que un átomo es capaz de atraer
electrones externos de otro átomo adyacente a el. La
electronegatividad en un período aumenta de izquierda a
derecha ya que mientras más pequeño sea el
átomo mayor será su fuerza nuclear para atraer
electrones de otro átomo. En los grupos la
predicción no es tan clara.
Esta magnitud se estudiará con más detalle
cuando se analicen los tipos de enlace entre los
átomos.
Guía de
ejercicios configuración
electrónica.
1.- La configuración electrónica del
elemento 21X es:
a.- 1s22s22p63s13p64s23d2 b.-
1s22s2p63s23px23py23pz24s13d2 c.- 1s22s22p63s23px23py23pz24s23d1
d.- 1s22s22p63s23p64s3 2.- La configuración
electrónica de un átomo neutro: 1s22s22p63s2 I.-
pertenece a un elemento con Z=12 II.- pertenece a un elemento con
12 electrones de valencia III.- Pertenece a un elemento con 12
electrones SON CORRECTAS:
a.- I c.- I y II b.- II d.- I y III 3.- La
configuración electrónica de la capa más
externa del átomo:1s22s22p63s23p4 indica que:
I.- hay 6 electrones de valencia II.- Los electrones de
valencia se ubican en el nivel 3 III.- hay 3 electrones de
valencia IV.- los electrones de valencia se ubican en el nivel 2
SON CORRECTAS:
a.- I c.- I y II b.- III d.- todas 4.- La
configuración electrónica del Se Z=34 es: a.-
1s22s22p63s23p64s23d104p4 b.- 1s22s22p63s23p64s23d84p6 c.-
1s22s22p63s23p63d104s24p4 d.- ninguna es correcta 5.- La
configuración electrónica 1s22s22p6 indica que el
átomo:
a.- tiene 8 electrones en su último nivel b.- es
un gas noble c.- tiene un Z=10 d.- todas son correctas 6.- En la
configuración 1s2:
I.- el 1 representa el nivel de energía II.- el 2
representa el nivel de energía III.- la s representa la
región dónde se puede encontrar al electrón
SON CORRECTAS:a.- I c.- I y II b.- II d.- I y III 7.- En el
Sistema Periódico los elementos se ordenan
según:
a.- aumento en el número de protones b.- aumento
en el volumen atómico c.- aumento de la masa
atómica d.- ninguna es correcta 8.- A partir de los Z de
los siguientes pares de átomos¿ Cuál de
ellos tendrá un comportamiento químico semejante?
a.- Li y Be Li Z=3 Be Z=4 b.- F y H F Z=9 H Z=1 c.- O y Se O Z=8
Se Z=34 d.- Cl y S Cl Z=17 S Z=16 9.- A partir de la
configuración electrónica del elemento de Z=20
¿A qué grupo y a qué período.
Pertenece? a.- Grupo IIA P2 b.- Grupo IIA P4 c.- Grupo IIIA P4
d.- Grupo IIA P4 10.- Un elemento de transición es aquel
que tiene en su último nivel:
a.- sólo orbitales s ocupados b.- orbitales d y f
ocupados c.- orbitales s y p ocupados d.- ninguna es correcta
11.- Los gases nobles se caracterizan por:
i.- Su gran estabilidad II.- tener su nivel de valencia
completo III.- no ceder ni captar electrones.
SON CORRECTAS:
a.- I c.- III b.- II d.- todas son correctas 12.- El
átomo de configuración electrónica
1s22s22p63s23p2 se debe clasificar como:
a.- gas noble b.- elemento de transición c.-
elemento representativo d.- no se puede clasificar con esa
información 13.- Los grupos A de la tabla periódica
se caracterizan por:
I.- tener sólo elemento representativos II.- ser
todos metálicos III.- que los electrones externos se
ubican en los orbitales s o p SON CORRECTAS:a.- I c.- I y III b.-
I y II d.- todas 14.- Es un gas noble:
a.- 1s2 b.- 1s22s22p6 c.- 1s22s22p63s23p6 d.- todos los
anteriores 15.-Es un elemento de transición:
a.- 1s22s22p3 b.- 1s22s22p63s23p64s23d4 c.- 1s22s22p63s1
d.- ninguno 16.- Los elementos metálicos son aquellos
que:
a.- ceden electrones para estabilizarse b.- captan
electrones para estabilizarse c.- son estables como los gases
nobles d.- ninguna alternativa es correcta 17.- Hidrógeno,
litio, helio, calcio, aluminio son respectivamente:
a.- He, Li, H, Ca, Al b.- H, Li, He, Al, Ca c.- H, Li,
He, Ca, Al d.- Li, H, He, Ca, Al 18.- Es un elemento no
metálico.
a.- 1s22s22p6 b.- 1s22s22p5 c.- 1s22s22p63s1 d.- ninguno
19.- Es un elemento metálico:
a.- 1s22s22p6 b.- 1s22s22p5 c.- 1s22s22p63s1 d.- ninguno
20.- El radio atómico es una propiedad periódica
porque varía de una manera periódica y ordenada en
la tabla:
I.- En los grupos aumenta hacia abajo II.- en los
períodos disminuye hacia la derecha III.- en los grupos
disminuye hacia abajo SON CORRECTAS:
a.- I y II c.- II y III b.- I y III d.-
ninguna
Autor:
Pablo Turmero
