
John Dalton Para él tenía que cumplirse, ante todo,
que los átomos de un mismo elemento debían tener la
misma masa. Con esta idea, Dalton publicó en 1808 su
Teoría Atómica que podemos resumir: La materia
está formada por partículas muy pequeñas,
llamadas átomos , que son indivisibles e indestructibles.
Todos los átomos de un mismo elemento tienen la misma masa
atómica. Los átomos se combinan entre si en
relaciones sencillas para formar compuestos. Los cuerpos
compuestos están formados por átomos diferentes.
Las propiedades del compuesto dependen del número y de la
clase de átomos que tenga.

Físico Británico estudió las propiedades
eléctricas de la materia, especialmente la de los gases.
Joseph John Thomson (1856-1940) Descubrió que los rayos
catódicos estaban formados por partículas cargadas
negativamente (hoy en día llamadas electrones), de las que
determinó la relación entre su carga y masa. En
1906 le fue concedido el premio Nóbel por sus trabajos.
Millikan calculó experimentalmente el valor de la carga
eléctrica negativa de un electrón mediante su
experimento con gotas de aceite entre placas de un condensador.
Dió como valor de dicha carga e = 1,6 * 10 -19 culombios.
La medida directa del cociente carga-masa, e/m, de los electrones
por J.J.Thomson en 1897 puede considerarse justamente como el
principio para la compresión actual de la estructura
atómica.

El clásico experimento de Thomson se desarrolló a
partir del estudio de las descargas eléctricas en gases.
Tubo de rayos catódicos utilizado por Thomson Cuando se
sitúan unas aberturas en A y B, el brillo se limita a un
punto bien definido sobre el vidrio, este punto puede desviarse
mediante campos eléctricos o magnéticos.

Thomson define así su modelo de átomo : Considera
el átomo como una gran esfera con carga eléctrica
positiva, en la cual se distribuyen los electrones como
pequeños granitos (de forma si-milar a las semillas en una
sandía) (Gp:) Modelo atómico de Thomson
Concebía el átomo como una esfera de carga positiva
uniforme en la cual están incrustados los
electrones.

Tras las investigaciones de Geiger y Mardsen sobre la
dispersión de partículas alfa al incidir sobre
láminas metálicas, se hizo necesario la
revisión del modelo atómico de Thomson, que
realizó Rutherford entre 1909-1911. Ernest Rutherford,
(1871-1937) Físico Inglés, nació en Nueva
Zelanda, profesor en Manchester y director del laboratorio
Cavendish de la universidad de Cambridge. Premio Nobel de
Química en 1908. Sus brillantes investigaciones sobre la
estructura atómica y sobre la radioactividad iniciaron el
camino a los descubrimientos más notables del siglo.
Estudió experimentalmente la naturaleza de las radiaciones
emitidas por los elementos radiactivos. Puesto que las
partículas alfa y beta atraviesan el átomo, un
estudio riguroso de la naturaleza de la desviación debe
proporcionar cierta luz sobre la constitución de
átomo, capaz de producir los efectos observados. Las
investigaciones se produjeron tras el descubrimiento de la
radioactividad y la identificación de las
partículas emitidas en un proceso radiactivo.

Experimento para determinar la constitución del
átomo La mayoría de los rayos alfa atravesaba la
lámina sin desviarse, porque la mayor parte del espacio de
un átomo es espacio vacío. Algunos rayos se
desviaban, porque pasan muy cerca de centros con carga
eléctrica del mismo tipo que los rayos alfa (CARGA
POSITIVA). Muy pocos rebotan, porque chocan frontalmente contra
esos centros de carga positiva.

El modelo del átomo de RUTHERFORD: con los protones en el
núcleo y los electrones girando alrededor. El Modelo
Atómico de Rutherford quedó así: – Todo
átomo está formado por un núcleo y corteza.
El núcleo, muy pesado, y de muy pequeño
tamaño, formado por un número de protones igual al
NÚMERO ATÓMICO, donde se concentra toda la masa
atómica. Existiendo un gran espacio vacío entre el
núcleo y la corteza donde se mueven los electrones.
NÚMERO ATÓMICO= número de protones del
núcleo que coincide con el número de electrones si
el átomo es neutro.

- Puesto que la materia es neutra el núcleo
deberá tener un número de cargas positivas protones
( número atómico=Z ) igual al de electrones
corticales. En el núcleo es donde están
también los neutrones Girando alrededor en órbitas
circulares, un número de electrones igual a de protones.
Los electrones giran a grandes distancias del núcleo de
modo que su fuerza centrífuga es igual a la
atracción electrostática, pero de sentido
contrario. Al compensar con la fuerza electrostática la
atracción del núcleo evita caer contra él y
se mantiene girando alrededor. En 1932 el inglés Chadwik
al bombardear átomos con partículas observó
que se emitía una nueva partícula sin carga y de
masa similar al protón, acababa de descubrir el
NEUTRÓN En el núcleo se encuentran los neutrones y
los protones.

(Gp:) Partícula (Gp:) Carga (Gp:)
Masa (Gp:) PROTÓN p+ (Gp:) +1 unidad
electrostática de carga = 1,6. 10-19 C (Gp:) 1
unidad atómica de masa (u.m.a.) =1,66 10-27kg (Gp:)
NEUTRON n (Gp:) 0 no tiene carga eléctrica,
es neutro (Gp:) 1 unidad atómica de masa (u.m.a.)
=1,66 10-27 kg (Gp:) ELECTRÓN e- (Gp:)
-1 unidad electrostática de carga =-1,6. 10-19C
(Gp:) Muy pequeña y por tanto despreciable comparada con
la de p+ y n PARTÍCULAS FUNDAMENTALES Los
protones y neutrones determinan la masa de los átomos y
los electrones son los responsables de las propiedades
químicas. NÚCLEO = Zona central del átomo
donde se encuentran protones y neutrones CORTEZA =Zona que
envuelve al núcleo donde se encuentran moviéndose
los electrones

NÚMERO ATÓMICO (Z) al número de protones que
tiene un átomo. Coincide con el número de
electrones si el átomo está neutro. Todos los
átomos de un mismo elemento tienen el mismo número
de protones, por lo tanto, tienen el mismo número
atómico. NÚMERO MÁSICO (A) a la suma de los
protones y los neutrones que tiene un átomo.
ISÓTOPOS a átomos de un mismo elemento que se
diferencian en el número de neutrones. Tienen por tanto el
mismo número atómico(Z) pero diferente
número másico(A). Un átomo se representa
por: · Su símbolo = una letra
mayúscula o dos letras, la primera mayúscula que
derivan de su nombre. Ca , H , Li, S, He….
· Su número atómico (Z) que
se escribe abajo a la izquierda. Su número másico
(A) que se escribe arriba a la izquierda. IONES a átomos o
grupos de átomos que poseen carga eléctrica porque
han ganado o perdido electrones. Pueden ser: CATIONES si poseen
carga positiva y, por tanto, se han perdido electrones. ANIONES
si poseen carga negativa y , por tanto, se han ganado
electrones.

Crítica del modelo de Rutherford: Fue fundamental la
demostración de la discontinuidad de la materia y de los
grandes vacíos del átomo. Por lo demás,
presenta deficiencias y puntos poco claros: -
Según la ya probada teoría electromagnética
de Maxwell, al ser el electrón una partícula
cargada en movimiento debe emitir radiación constante y
por tanto, perder energía. Esto debe hacer que disminuya
el radio de su órbita y el electrón
terminaría por caer en el núcleo; el átomo
sería inestable. Por lo tanto, no se puede simplificar el
problema planteando, para un electrón , que la fuerza
electrostática es igual a la centrífuga debe haber
algo más Era conocida en el momento de diseñar su
teoría la hipótesis de Planck que no la tuvo en
cuenta. -Tampoco es coherente con los resultados de los espectros
atómicos. Los experimentos de Rutherford eran definitivos,
pero el planteamiento era incompleto y lógicamente,
también los cálculos.

ORÍGENES DE LA TEORÍA CUÁNTICA A mediados
del siglo XIX James Clerk Maxwell elaboró una
teoría sobre la luz que explicaba todo lo que se
conocía de ella hasta ese momento. Sin embargo, a
principios del siglo XX, una serie de descubrimientos
experimentales obligó a elaborar nuevas teorías
sobre la luz. Según la teoría de Maxwell, la luz es
una onda electromagnética.

LA RADIACIÓN ELECTROMAGNÉTICA. Una onda
electromagnética consiste en la oscilación de un
campo eléctrico y otro magnético en direcciones
perpendiculares, entre sí, y a su vez, perpendiculares
ambos a la dirección de propagación. Viene
determinada por su frecuencia “?” o por su longitud
de onda “?”, relacionadas entre sí por:
ESPECTRO ELECTROMAGNÉTICO:Es el conjunto de todas las
radiaciones electro-magnéticas desde muy bajas longitudes
de ondas (rayos ? 10–12 m) hasta kilómetros (ondas
de radio) Espectro continuo de la luz es la descomposición
de la luz en todas su longitudes de onda mediante un prisma
óptico. C= velocidad de la luz =3.108m/s

? ? Espectro electromagnético.

Espectro atómico de absorción Cuando la
radiación atraviesa un gas, este absorbe una parte, el
resultado es el espectro continuo pero con rayas negras donde
falta la radiación absorbida. ESPECTRO DE ABSORCIÓN
(Gp:) Espectro de absorción

(Gp:) Espectro de emisión ESPECTRO DE EMISIÓN
Cuando a los elementos en estado gaseoso se les suministra
energía (descarga eléctrica, calentamiento…)
éstos emiten radiaciones de determinadas longitudes de
onda. Estas radiaciones dispersadas en un prisma de un
espectroscopio se ven como una serie de rayas, y el conjunto de
las mismas es lo que se conoce como espectro de
emisión.

Cada elemento tiene un espectro característico; por tanto,
un modelo atómico debería ser capaz de justificar
el espectro de cada elemento.




(Gp:) cobre ALGUNOS ESPECTROS DE EMISIÓN (ensayo a la
llama) (Gp:) cobalto Cada elemento presenta un espectro de
emisión diferente identificable a simple vista mediante el
ensayo a la llama.

TEORÍA CUÁNTICA DE PLANCK La teoría
cuántica se refiere a la energía: Cuando la
energía está en forma de radiación
electromagnética (es decir, de una radiación
similar a la luz), se denomina energía radiante y su
unidad mínima recibe el nombre de fotón. La
energía de un fotón viene dada por la
ecuación de Planck: E = h · ? h: constante de
Planck = 6.62 · 10-34 Joule · segundo ?:
frecuencia de la radiación Cuando una sustancia absorbe o
emite energía, no puede absorberse o emitirse cualquier
cantidad de energía, sino que definimos una unidad
mínima de energía, llamada cuanto (que será
el equivalente en energía a lo que es el átomo para
la materia). O sea cualquier cantidad de energía que se
emita o se absorba deberá ser un número entero de
cuantos.

MODELO ATÓMICO DE BÖHR. (En qué se
basó) El modelo atómico de Rutherford llevaba a
unas conclusiones que se contradecían claramente con los
datos experimentales. La teoría de Maxwell echaba por
tierra el sencillo planteamiento matemático del modelo de
Rutherford. El estudio de las rayas de los espectros
atómicos permitió relacionar la emisión de
radiaciones de determinada “? ” (longitud de onda)
con cambios energéticos asociados a saltos entre niveles
electrónicos. La teoría de Planck le hizo ver que
la energía no era algo continuo sino que estaba cuantizada
en cantidades hn.

Segundo postulado Sólo son posibles aquellas
órbitas en las que el electrón tiene un momento
angular que es múltiplo entero de h
/(2 · p) ÓRBITAS ESTACIONARIAS
Así, el Segundo Postulado nos indica que el
electrón no puede estar a cualquier distancia del
núcleo, sino que sólo hay unas pocas órbitas
posibles, las cuales vienen definidas por los valores permitidos
para un parámetro que se denomina número
cuántico principal n. Primer postulado El electrón
gira alrededor del núcleo en órbitas circulares sin
emitir energía radiante. Tercer Postulado La
energía liberada al caer el electrón desde una
órbita a otra de menor energía se emite en forma de
fotón, cuya frecuencia viene dada por la ecuación
de Planck: Ea – Eb = h · ? Así, cuando el
átomo absorbe (o emite) una radiación, el
electrón pasa a una órbita de mayor (o menor)
energía, y la diferencia entre ambas órbitas se
corresponderá con una línea del espectro
atómico de absorción (o de emisión). MODELO
ATÓMICO DE BÖHR

Niveles permitidos según el modelo de Bohr(para el
átomo de hidrógeno) (Gp:) n = 1 E = –21,76
· 10–19 J (Gp:) n = 2 E = –5,43 ·
10–19 J (Gp:) n = 3 E = –2,42 · 10–19 J
Energía (Gp:) n = 4 E = –1,36 · 10–19 J
(Gp:) n = 5 E = –0,87 · 10–19 J (Gp:) n = ? E
= 0 J


SERIES ESPECTRALES: y su explicación con el modelo de Bohr
Los espectroscopistas habían calculado y estudiado a fondo
las rayas del espectro atómico más sencillo, el del
átomo de hidrógeno. Cada uno estudió un
grupo de rayas del espectro: Serie Balmer: aparece en la zona
visible del espectro. Serie Lyman: aparece en la zona
ultravioleta del espectro. Serie Paschen Serie Bracket Serie
Pfund (Gp:) Aparecen en la zona infrarroja del espectro

CORRECCIONES AL MODELO DE BÖHR: NÚMEROS
CUÁNTICOS. En el modelo original de Böhr, se precisa
un único parámetro (el número
cuántico principal, n), que se relaciona con el radio de
la órbita circular que el electrón realiza
alrededor del núcleo, y también con la
energía total del electrón. n indica los diferentes
niveles electrónicos (órbitas estacionarias en el
modelo de Bohr). Los valores que puede tomar este número
cuántico principal son los enteros positivos: 1, 2, 3…
Sin embargo, pronto fue necesario modificar el modelo para
adaptarlo a los nuevos datos experimentales, aparición de
nuevas rayas espectrales con lo que se introdujeron otros tres
números cuánticos para caracterizar al
electrón: número cuántico secundario o
azimutal (l) número cuántico magnético (m)
número cuántico de espín (s)

Número cuántico secundario o azimutal (L):
corrección de Sommerfeld En 1916, Sommerfeld
modificó el modelo de Böhr considerando que las
órbitas del electrón no eran necesariamente
circulares, sino que también eran posibles órbitas
elípticas; esta modificación exige disponer de dos
parámetros para caracterizar al electrón. Una
elipse viene definida por dos parámetros, que son los
valores de sus semiejes mayor y menor. En el caso de que ambos
semiejes sean iguales, la elipse se convierte en una
circunferencia. Así, introducimos el número
cuántico secundario o azimutal (l), cuyos valores
permitidos son: L= 0, 1, 2, …, n – 1 Por ejemplo, si n =
3, los valores que puede tomar L serán: 0, 1, 2 El
desdoblamiento de algunas rayas espectrales observado con las
mejoras técnicas de algunos espectroscopios llevó a
la necesidad de justificar estas nuevas rayas y por tanto de
corregir el modelo de Bohr.

Número cuántico magnético (m). Indica las
posibles orientaciones en el espacio que puede adoptar la
órbita del electrón cuando éste es sometido
a un campo magnético externo (efecto Zeemann). Valores
permitidos: – L, …, 0, …, + L Por ejemplo, si el
número cuántico secundario vale L= 2, los valores
permitidos para m serán: -2, -1, 0, 1, 2 El efecto Zeemann
se debe a que cualquier carga eléctrica en movimiento crea
un campo magnético; por lo tanto, también el
electrón lo crea, así que deberá sufrir la
influencia de cualquier campo magnético externo que se le
aplique. Aplicando un campo magnético a los espectros
atómicos las rayas se desdoblan lo que indica que deben
existir diferentes orientaciones posibles . Número
cuántico de espín (s). Indica el sentido de giro
del electrón en torno a su propio eje. Puede tomar
sólo dos valores para el electrón: +1/2,
-1/2.

Modelo mecanocuántico En 1926 se dispone ya de un modelo
de átomo plenamente cuántico (Schrodinger) , donde
han desaparecido dos conceptos básicos del modelo
anterior: Los electrones no son considerados como
partículas sino como ondas No existen órbitas
electrónicas sino orbitales.

Modelo Mecanocuántico Basado en las ecuaciones propuestas
por W Heisenberg y por E. Schrödinger por separado y
llegando a resultados similares Los aspectos más
importantes de este modelo quedan reflejados en las siguientes
teorías: Dualidad onda partícula Principio de
indeterminación de Heisenberg Principio de
exclusión de Pauli Regla de la máxima multiplicidad
de Hund Principio de construcción (Aufbau)

MODELO MECANOCUÁNTICO El átomo está formado
por un núcleo donde se encuentran los neutrones y los
protones y los electrones giran alrededor en diferentes
orbitales. ORBITAL: ZONA DEL ESPACIO EN TORNO AL NÚCLEO
DONDE LA POSIBILIDAD DE ENCONTRAR AL ELECTRÓN ES
MÁXIMA Los electrones se sitúan en orbitales, los
cuales tienen capacidad para situar dos de ellos: 1ª capa: 1
orb. “s” (2 e–) 2ª capa: 1 orb.
“s” (2 e–) + 3 orb. “p” (6
e–) 3ª capa: 1 orb. “s” (2 e–) + 3
orb. “p” (6 e–) 5 orb. “d” (10
e–) 4ª capa: 1 orb. “s” (2 e–) + 3
orb. “p” (6 e–) 5 orb. “d” (10
e–) + 7 orb. “f” (14 e–) Y así
sucesivamente… Primero se indica el nivel que es el
número cuántico principal n Los valores del
número cuántico L (subnivel) indican la letra del
orbital que corresponde: (L=0 es s ; L=1 es p ; L=2 es d ; L=3 es
f) Los valores de m indican los diferentes orbitales que caben en
cada subnivel. En cada orbital solo caben dos electrones uno
girando de un lado y otro del otro+1/2 y –1/2 número
de spin s2 p6 d10 f14

DUALIDAD ONDA PARTÍCULA Según la hipótesis
de De Broglie, cada partícula en movimiento lleva asociada
una onda, de manera que la dualidad onda-partícula puede
enunciarse de la siguiente forma: una partícula de masa m
que se mueva a una velocidad v puede, en condiciones
experimentales adecuadas, presentarse y comportarse como una onda
de longitud de onda, ?. La relación entre estas magnitudes
fue establecida por el físico francés Louis de
Broglie en 1924. cuanto mayor sea la cantidad de movimiento (mv)
de la partícula menor será la longitud de onda (?),
y mayor la frecuencia (?) de la onda asociada. En la siguiente
dirección puedes encontrar un experimento que te ayude a
comprender la dualidad onda-partícula:
http://www.colorado.edu/physics/2000/schroedinger/two-slit2.html
http://www.colorado.edu/physics/2000/schroedinger/two-slit3.html

Principio de indeterminación de Heisenberg W. Heisenberg
(Premio Nobel de Física 1932) enunció el llamado
principio de incertidumbre o principio de indeterminación,
según el cual es imposible medir simultáneamente, y
con precisión absoluta, el valor de la posición y
la cantidad de movimiento de una partícula. Esto
significa, que la precisión con que se pueden medir las
cosas es limitada, y el límite viene fijado por la
constante de Planck. ?x : indeterminación en la
posición ?px : indeterminación en la cantidad de
movimiento h: constante de Planck (h=6,626 · 10-34 J
· s) Es importante insistir en que la incertidumbre no se
deriva de los instrumentos de medida, sino del propio hecho de
medir. Con los aparatos más precisos imaginables, la
incertidumbre en la medida continúa existiendo.
Así, cuanto mayor sea la precisión en la medida de
una de estas magnitudes mayor será la incertidumbre en la
medida de la otra variable complementaria. La posición y
la cantidad de movimiento de una partícula, respecto de
uno de los ejes de coordenadas, son magnitudes complementarias
sujetas a las restricciones del principio de incertidumbre de
Heisenberg. También lo son las variaciones de
energía ( E) medidas en un sistema y el tiempo, t empleado
en la medición.

n = 1, 2, 3, 4, … (nº de capa o nivel) l = 0, 1, 2, … (n
– 1) (forma del orbital o subnivel) m = – l, … , 0,
… L (orientación orbital o orbital) s = – ½
, + ½ (spín rotación del electrón )
Al resolver las ecuaciones de la mecánica cuántica
para un átomo, aparecen como una consecuencia
matemática, los números cuánticos. Estos
describen el comportamiento de los electrones dentro del
átomo. Los valores de éstos son los siguientes:
Números cuánticos.

Significado de losNúmeros cuánticos. n, principal,
se refiere a la energía de las órbitas, o los
niveles energéticos y al tamaño do órbita l
, orbital, se refiere a un subnivel energético, cuando
hablamos de una órbita especifica ml, magnético, se
refiere a la orientación del orbital ms, spin, se refiere
al movimiento de rotación del electrón o su
orientación en un campo magnético externo.

Ejemplo: a) Establezca cuáles de las siguientes series de
números cuánticos serían posibles y
cuáles imposibles para especificar el estado de un
electrón; b) diga en que tipo de orbital atómico
estarían situados los que son posibles Series n l m s??? I
0 0 0 +½ II 1 1 0 +½ III 1 0 0 –½ IV 2
1 –2 +½ V 2 1 –1 +½ Imposible. (n <
1) Imposible. (l = n) Posible. Orbital “1 s”
Imposible (m ? -1,0,1) Posible. Orbital “2 p”

EL ORBITAL ATÓMICO El concepto de orbital es básico
para entender el comportamiento de los átomos. El
siguiente enlace le permite ver los diferentes orbitales del
átomo de hidrógeno: Para observar los ORBITALES DEL
HIDRÓGENO pulsa en este enlace:
http://www.falstad.com/qmatom/

Geometría de losORBITALES ATÓMICOS

COLOCACIÓN DE LOS ELECTRONES EN UN DIAGRAMA DE
ENERGÍA Se siguen los siguientes principios: Principio de
mínima energía (aufbau) Principio de máxima
multiplicidad (regla de Hund) Una vez colocados se cumple el
principio de exclusión de Pauli. Principio de
mínima energía (aufbau) Se rellenan primero los
niveles con menor energía. No se rellenan niveles
superiores hasta que no estén completos los niveles
inferiores. Principio de máxima multiplicidad (regla de
Hund) Cuando un nivel electrónico tenga varios orbitales
con la misma energía, los electrones se van colocando lo
más desapareados posible en ese nivel electrónico.
No se coloca un segundo electrón en uno de dichos
orbitales hasta que todos los orbitales de dicho nivel de igual
energía están semiocupados (desapareados).
Principio de exclusión de Pauli. “No puede haber dos
electrones con los cuatro números cuánticos iguales
en un mismo átomo”

Principio de exclusión de PauliL A CONFIGURACIÓN
ELECTRÓNICA En un determinado sistema cuántico
(átomo o molécula) no pueden existir dos electrones
con los cuatro números cuánticos idénticos
Por tanto, en un orbital sólo caben dos electrones que
compartirían tres números cuánticos y se
diferenciarían en el número cuántico de spin
(s)

Regla de la máxima multiplicidad de Hund:
CONFIGURACIÓN ELECTRÓNICA Cuando una serie de
orbitales de igual energía (p, d , f) se están
llenando con electrones, éstos permanecerán
desapareados mientras sea posible, manteniendo los espines
paralelos

DISTRIBUCIÓN DE ORBITALES Y ELECTRONES POR NIVELES

DISTRIBUCIÓN DE ORBITALES Y ELECTRONES POR NIVELES

Principio de construcción (Aufbau): CONFIGURACIÓN
ELECTRÓNICA En su estado fundamental la
distribución electrónica de un elemento se
construye a partir del inmediato anterior, adicionándole
un electrón de modo que le confiera la máxima
estabilidad (menor energía)

(Gp:) 1 s (Gp:) 2 s (Gp:) 3 s (Gp:) 2 p (Gp:) 3 p (Gp:) 4 f (Gp:)
Energía (Gp:) 4 s (Gp:) 4 p (Gp:) 3 d (Gp:) 5 s (Gp:) 5 p
(Gp:) 4 d (Gp:) 6s (Gp:) 6 p (Gp:) 5 d (Gp:) n = 1; l = 0; m = 0;
s = – ½ (Gp:) n = 1; l = 0; m = 0; s = + ½
(Gp:) n = 2; l = 0; m = 0; s = – ½ (Gp:) n = 2; l =
0; m = 0; s = + ½ (Gp:) n = 2; l = 1; m = – 1; s =
– ½ (Gp:) n = 2; l = 1; m = 0; s = – ½
(Gp:) n = 2; l = 1; m = + 1; s = – ½ (Gp:) n = 2; l
= 1; m = – 1; s = + ½ (Gp:) n = 2; l = 1; m = 0; s =
+ ½ (Gp:) n = 2; l = 1; m = + 1; s = + ½ (Gp:) n =
3; l = 0; m = 0; s = – ½ (Gp:) n = 3; l = 0; m = 0;
s = + ½ (Gp:) n = 3; l = 1; m = – 1; s = –
½ (Gp:) n = 3; l = 1; m = 0; s = – ½ (Gp:) n
= 3; l = 1; m = + 1; s = – ½ (Gp:) n = 3; l = 1; m =
– 1; s = + ½ (Gp:) n = 3; l = 1; m = 0; s = +
½ (Gp:) n = 3; l = 1; m = + 1; s = + ½ (Gp:) n = 4;
l = 0; m = 0; s = – ½ (Gp:) n = 4; l = 0; m = 0; s =
+ ½ (Gp:) n = 3; l = 2; m = – 2; s = –
½ (Gp:) n = 3; l = 2; m = – 1; s = – ½
(Gp:) n = 3; l = 2; m = 0; s = – ½ (Gp:) n = 3; l =
2; m = + 1; s = – ½ (Gp:) n = 3; l = 2; m = + 2; s =
– ½ (Gp:) n = 3; l = 2; m = – 2; s = +
½ (Gp:) n = 3; l = 2; m = – 1; s = + ½ (Gp:)
n = 3; l = 2; m = 0; s = + ½ (Gp:) n = 3; l = 2; m = + 1;
s = + ½ (Gp:) n = 3; l = 2; m = + 2; s = + ½ (Gp:)
n = 4; l = 1; m = – 1; s = – ½ (Gp:) n = 4; l
= 1; m = 0; s = – ½ (Gp:) n = 4; l = 1; m = + 1; s =
– ½ (Gp:) n = 4; l = 1; m = – 1; s = +
½ (Gp:) n = 4; l = 1; m = 0; s = + ½ (Gp:) n = 4; l
= 1; m = + 1; s = + ½ (Gp:) n = ; l = ; m = ; s = ORDEN EN
QUE SE RELLENAN LOS ORBITALES
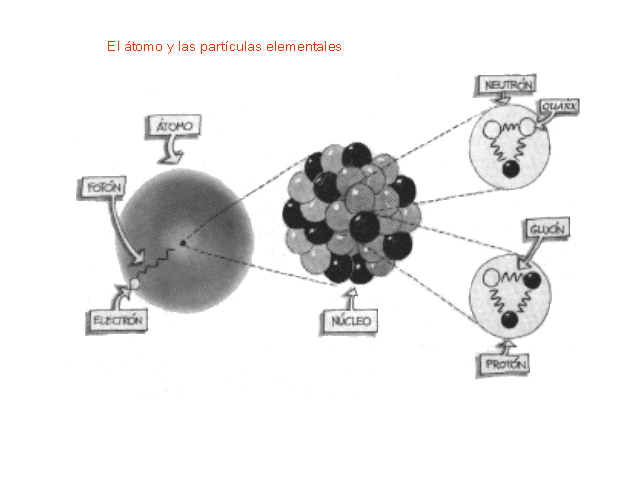
El átomo y las partículas elementales

LA TABLA PERIÓDICA SE ORDENA SEGÚN EL NÚMERO
ATÓMICO, como es el número de protones pero
coincide con el de electrones cuando el átomo es neutro,
la tabla periódica queda ordenada según las
configuraciones electrónicas de los diferentes elementos.
http://center.acs.org/periodic/tools/PT.html
