
Sistemas Dispersos
En la forma farmacéutica solución, el o los principios activos se hallan en un grado de división máximo (molecular o iónico), disueltos en un vehículo adecuado que puede ser por ej. acuoso o hidroalcohólico.
Desde el punto de vista biofarmacéutico la disolución de los principios activos en los fluidos biológicos es un factor indispensable para poder atravesar las membranas biológicas y absorberse.
El empleo de la forma farmacéutica solución facilita ese proceso.

Sistemas Dispersos
Muchas veces, la forma farmacéutica solución resulta galénicamente irrealizable:
Por problemas de estabilidad de los principios activos que pueden alterarse en solución;
porque el principio activo es poco soluble a la concentración que se utiliza para preparar el medicamento;
porque interesa acelerar, disminuir o prolongar la acción del medicamento.
Se recurre entonces al empleo de Sistemas Dispersos.

Sistemas Dispersos
Son aquellos sistemas constituidos por dos fases o más no miscibles entre sí. Una de las fases está uniformemente distribuida en forma de partículas o gotas finamente divididas en el seno de otra fase que las engloba o encierra.
La fase subdividida:
FASE INTERNA – DISPERSA – DISCONTINUA (es la fase que conforma las partículas o gotitas)
La fase que engloba o encierra las partículas o gotas:
FASE EXTERNA–DISPERSANTE– CONTINUA (es el medio en que las partículas se encuentran dispersas)
Fase dispersante
Fase dispersa

Sistemas Dispersos
Desde el punto de vista fisicoquímico estos sistemas son termodinámicamente inestables.
Las características más representativas de estos sistemas son:
La existencia de una superficie de separación entre la dos fases llamada interfase
La superficie de contacto entre las partículas y el medio de dispersión (área interfasial) es muy elevada. En esta interfase se concentra la mayor cantidad de energía del sistema.
Gran inestabilidad
El exceso de energía libre, asociada a la gran superficie existente entre las partículas y el medio, da lugar a que las partículas tiendan a aglomerarse, para reducir su energía libre interna.

Clasificación de los Sistemas Dispersos
De acuerdo al estado físico de la materia.
Desde el punto de vista estructural.
De acuerdo al tamaño de las partículas.

De acuerdo al estado físico de la materia
Pueden existir sistemas dispersos de:
Líquido en gas: aerosoles líquidos, nebulizaciones, niebla.
Sólido en gas: aerosoles sólidos, humos.
Gas en líquidos: espuma.
Sólido en líquidos: dispersiones coloidales, suspensiones.
Líquido en líquido: emulsiones.
Gas en sólido: lava, piedra pómez.
Sólido en sólido: oro coloidal.
Cristales líquidos: estado intermedio entre sólido cristalino y líquido.

Desde el punto de vista estructural
Sistemas incoherentes
Sistemas coherentes
Sistemas incoherentes: formados por dos fases bien definidas. La fase dispersa se puede encontrar en forma de partículas sólidas (dispersiones coloidales y suspensiones) o en forma de gotitas (emulsiones).
Sistemas coherentes: formados por dos fases entremezcladas. Las partículas dispersas se contactan entre sí formando una estructura tridimensional en las que ambas fases se interpenetran, dando al sistema propiedades fisicoquímicas y reológicas específicas. Ej: geles.

De acuerdo al tamaño de las partículas
Dispersiones groseras: mayor de 1 micrón, se pueden ver a simple vista o con microscopio óptico.
Dispersiones coloidales: partículas que tienen un tamaño entre 1 micrón -1 nm, visibles al ultramicroscopio y al microscopio electrónico.
Soluciones: menor a 1 nm.

Estabilidad de los sistemas dispersos
Es necesario formularlos adecuadamente para obtener preparados estables.
Factores de los que depende la estabilidad de los sistemas dispersos:
Grado de dispersión de la fase interna.
Carga eléctrica de las partículas dispersas.

Estabilidad de los sistemas dispersos
Grado de dispersión de la fase interna:
Si el grado de dispersión de la fase interna es elevado y homogéneo, aumenta la estabilidad del sistema.
Viscosidad:
El agregado de sustancias con propiedades reológicas a un sistema disperso favorece la estabilidad. Al aumentar la viscosidad del medio dificulta la movilidad de las partículas impidiendo que se aproximen.

Estabilidad de los sistemas dispersos
Carga eléctrica de las partículas dispersas:
Las partículas dispersas en un medio líquido tienden a cargarse eléctricamente por adsorción de iones del medio o por pérdida de iones de la partícula. Se forma una doble capa eléctrica que origina fuerzas de repulsión entre partículas de cargas eléctricas similares (evitando su acercamiento).
Temperatura:
El aumento de la temperatura reduce la estabilidad de los sistemas dispersos al disminuir la viscosidad y aumentar la movilidad de las partículas o gotitas dispersas.

Dispersiones Coloidales (coloides: de la palabra griega que significa goma o cola)
Estos sistemas coloidales están constituidos por dos fases, y para cada partícula existe una superficie de separación entre ella y el medio. En esta interfase se manifiestan las propiedades características de los sistemas coloidales.
FASES
Fase interna, dispersa o discontinua.
Fase externa, dispersante o continua.

Clasificación de las Dispersiones Coloidales
Se clasifican en función del grado de atracción entre la fase dispersa y el medio dispersante.
Si el medio dispersante es un líquido, estos sistemas coloidales se llaman soles.
Estos soles se clasifican:
LIÓFOBOS O DISPERSIONES COLOIDALES LIÓFOBAS: (del griego: aversión al líquido). Poca atracción entre la fase dispersa y el medio dispersante. Son los coloides verdaderos. Si el medio de dispersión es agua, se denominan HIDROFOBOS
LIÓFILOS O DISPERSIONES COLOIDALES LIÓFILAS : (del griego: afición al líquido). Gran atracción entre la fase dispersa y el medio dispersante. Si el medio de dispersión es agua se denominan HIDROFILOS

Propiedades de los sistemas coloidales
La fase interna por su tamaño le confiere al sistema propiedades características: cinéticas, ópticas y eléctricas.
Propiedades ópticas:
– Dispersión de la luz (Efecto Tyndall)
Propiedades cinéticas:
– Movimiento Browniano
Propiedades eléctricas:
– Las partículas coloidales están cargadas eléctricamente con respecto al medio dispersante.

Al hacer pasar un rayo de luz a través de una dispersión coloidal, el rayo de luz se ve en forma clara y nítida al atravesar el coloide, fenómeno que no sucede en una solución.
Este efecto se debe a que las partículas coloidales son lo suficientemente grandes como para dispersar la luz.
A partir del estudio de esta propiedad (nefelómetro), es posible obtener datos de la forma, tamaño e interacciones de las partículas coloidales
Propiedades ópticas: Efecto Tyndall

EFECTO TYNDALL

Movimiento Browniano:
Cuando se observa un coloide con un microscopio, se observa que las partículas dispersas se mueven al azar en la fase dispersante.
Lo que en realidad se ve son los reflejo de las partículas coloidales, ya que su tamaño permite reflejar la luz.
Propiedades cinéticas

Todo sólido sumergido en un líquido tiende a cargarse eléctricamente en su superficie:
1- Por adsorción de iones del medio.
2- Por ionización de grupos funcionales en su superficie (en este caso, el pH del medio juega un papel importante).
Propiedades eléctricas: potencial zeta

Doble capa eléctrica
POTENCIAL Z
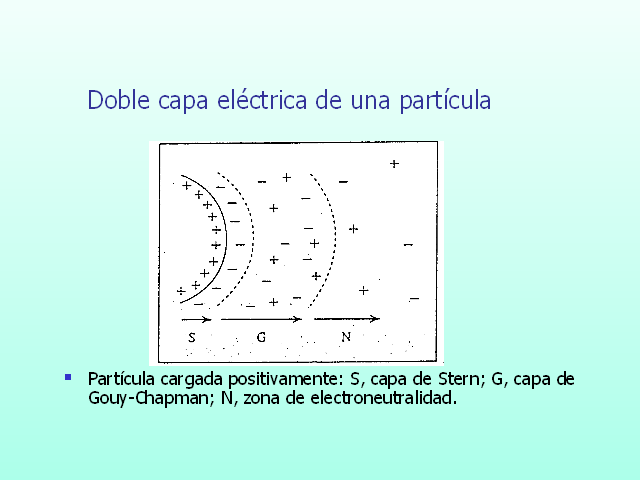
Doble capa eléctrica de una partícula
Partícula cargada positivamente: S, capa de Stern; G, capa de Gouy-Chapman; N, zona de electroneutralidad.

La partícula positiva atrae iones negativos. Sólo una parte de estos iones de signo opuesto a la partícula quedan firmemente adheridos a su superficie formando una capa monomolecular de contraiones llamada Capa de Stern o Capa fija.
Los demás iones se distribuyen en distintos niveles de acuerdo a la carga de la partícula formando la Capa difusa o de Gouy-Chapman.
Hay un punto de la capa difusa donde la carga de la partícula no se hace sentir más; se lo denomina punto de neutralidad.
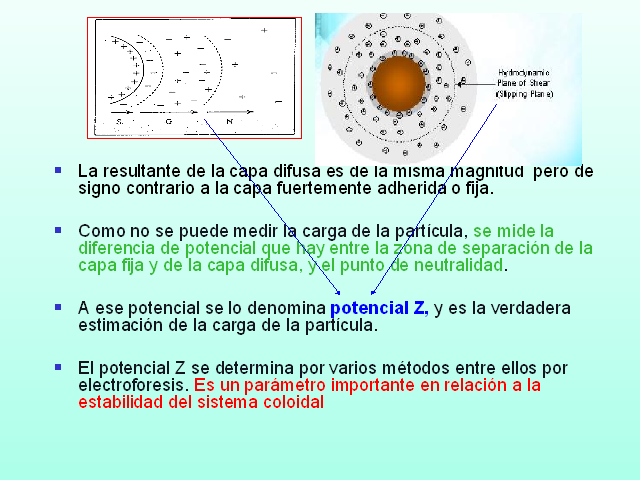
La resultante de la capa difusa es de la misma magnitud pero de signo contrario a la capa fuertemente adherida o fija.
Como no se puede medir la carga de la partícula, se mide la diferencia de potencial que hay entre la zona de separación de la capa fija y de la capa difusa, y el punto de neutralidad.
A ese potencial se lo denomina potencial Z, y es la verdadera estimación de la carga de la partícula.
El potencial Z se determina por varios métodos entre ellos por electroforesis. Es un parámetro importante en relación a la estabilidad del sistema coloidal

Determinación del potencial Z
La electroforesis es probablemente el método de más amplia aplicación para la determinación del potencia Z. Consiste en el paso de una corriente eléctrica a través de la dispersión, puesta en una célula adecuada, como la que se señala en la figura (célula Burton).
Las partículas cargadas emigran al electrodo de carga opuesto y, de acuerdo con la dirección y velocidad de migración, puede determinarse el signo y la magnitud del potencial zeta.

Purificación de las dispersiones coloidales
Los métodos son:
Diálisis: es el pasaje a través de una membrana. Las partículas coloidales quedan retenidas en la membrana y pasa la solución verdadera. Se utilizó primero pergamino, luego celofán, y actualmente nitrato y acetato de celulosa.
Electrodiálisis: La dispersión coloidal (conteniendo electrolitos para eliminar) se coloca entre dos membranas. A los costados de las membranas hay un compartimiento con agua. Se coloca un electrodo en cada compartimiento, al aplicar una FEM hay migración de iones de la dispersión coloidal hacia el agua. La dispersión coloidal queda privada de la solución verdadera.

Coloides hidrófobos (Características)
No modifican la viscosidad, ni la tensión superficial del medio dispersante.
Alta sensibilidad a los electrolitos que influyen sobre la carga eléctrica que circunda a la partícula.
Inestabilidad por efecto de la diálisis (eliminación total de electrolitos hace al sol inestable).
Pequeñas cantidades de electrolitos estabilizan un coloide hidrófobo.
Presentan efecto Tyndall debido a la diferencia en el índice de refracción de las fases dispersa y dispersante. Las partículas coloidales por su tamaño pequeño reflejan la luz produciendo este efecto (fácilmente detectadas con el ultramicroscopio).
No se ven al microscopio ordinario, sí al electrónico.
Partículas generalmente inorgánicas.
No se forman espontáneamente.
Presentan movimiento Browniano (movimiento errático de las partículas). Consiste en un movimiento desordenado continuo con trayectorias de zig-zag (mantiene a las partículas dispersas).

Estabilización de coloides hidrófobos
1. Con una pequeña cantidad de electrolitos.
Se forma una doble capa eléctrica sobre la superficie de las partículas. Las partículas se cargan todas iguales, se repelen, evitando la coagulación (aumenta el potencial zeta).
2. Con coloides protectores:
son coloides hidrofílicos que forman alrededor de cada partícula un retículo altamente hidrofílico (película protectora), que evita el choque de partículas.
Según la concentración de electrolitos que se agregue a un coloide éstos pueden actuar:
Como peptizantes : cantidades pequeñas de electrolitos (dispersan las partículas coloidales).
Como coagulantes: cantidades grandes de electrolitos producen coagulación. El potencial Z disminuye, tiende a 0, y se rompe el equilibrio del sistema.

Coloides hidrófobos
A) SUSPENSIONES: SÓLIDO FINAMENTE DIVIDIDO EN UN MEDIO ACUOSO U OLEOSO
B) EMULSIONES: son sistemas de al menos dos fases en los cuales un líquido se dispersa en otro líquido en la forma de glóbulos o gotitas pequeñas.

UTILIDAD Y APLICACIONES
Ciertos agentes medicinales que tienen un sabor
desagradable se han hecho más aceptables por vía
oral cuando se formulan como emulsiones. Por lo
tanto, el aceite mineral (un laxante), el ácido valproico
(un anticonvulsionante), las vitaminas liposolubles, los
aceites vegetales y las preparaciones para
alimentación entérica se formulan a menudo en la
forma de una emulsión (O/W) para mejorar su sabor.
La utilidad de las emulsiones depende de su habilidad
para penetrar en la piel.
EMULSIONES

PRINCIPALES COMPONENTES DE LAS EMULSIONES
EMULSIONES
Medio dispersante (fase continua).
Glóbulos dispersos (fase discontinua).
Emulsionante (estabilizante)
Partículas sólidas finamente divididas insolubles en la fase dispersa y el medio dispersante, pero con una cierta afinidad por éstas.
Sustancias anfifílicas con una cierta afinidad con la fase dispersa y el medio dispersante y que son solubles en, por lo menos, una de las fases (tensioactivos).

PARTÍCULAS SÓLIDAS FINAMENTE DIVIDIDAS

EMULSIONES ESTABILIZADAS POR TENSIOACTIVOS

BALANCE HIDROFÍLICO-LIPOFÍLICO (HLB)
Es un concepto ideado por Griffin (1949). En una emulsión, el valor del HLB del emulsionante intenta estimar la atracción simultánea que experimenta por las fases acuosa y oleosa.

BALANCE HIDROFÍLICO-LIPOFÍLICO (HLB)
HLB ˜ 10
HLB bajo
HLB alto

TIPOS DE EMULSIONES
Aceite en agua.
o/w
Agua en aceite.
w/o

EMULSIÓN DEL TIPO ACEITE EN AGUA

EMULSIÓN DEL TIPO AGUA EN ACEITE
emulsionante

Coloides hidrofílicos
Existe otro tipo de preparaciones farmacéuticas constituidas por una dispersión de macromoléculas fuertemente hidrofílicas debido a la presencia de grupos polares.
Estos sistemas adquieren consistencia espesa cuando la concentración de la fase dispersa tiene determinado valor (diferente en cada caso), y se los llama Mucílagos o Coloides Hidrofílicos.
Las sustancias capaces de formar dispersiones acuosas homogéneas altamente hidrofílicas pertenecen a distintas especies químicas y suelen conocerse como agentes espesantes.

Características de los coloides hidrofílicos
Viscosidad superior a la del medio dispersante. Moléculas fuertemente hidratadas que aumentan la viscosidad del medio.
Tensión superficial un tanto menor que la del medio dispersante.
Poca sensibilidad frente a los electrolitos (no modifican mayormente su aspecto por el agregado de sales).
Más estables con el tiempo (por su gran hidrofília y carga eléctrica); no separan la fase dispersa. Salvo si someten a cambios bruscos de temperaturas y de pH.
Presentan efecto Tyndall débil (no es fácil detectarlo con el ultramicroscopio).
Por pérdida de agua pueden formar geles, pero son fácilmente redispersables (coloides reversibles o emulsoides). Sol a Gel y de Gel a Sol.
No presentan movimiento browniano notable, las moléculas están inmovilizadas por el manto de hidratación.

Coloides de asociación
“soluciones micelares”. Son dispersiones límpidas y termodinámicamente estables.
Se forman micelas de tensiaoctivo, en el agua, de tamaño coloidal.

TENSIOACTIVOS

TENSIOACTIVOS
Los tensioactivos tienden a concentrarse en la interfase alterando la energía libre de la superficie, reduciendo la tensión superficial del sistema.
Son moléculas que tienen una parte polar (cabeza hidrofílica) y otra no polar (cola hidrófoba).
Para que una molécula sea tensioactiva su afinidad por la interfase es mayor que por cada una de las fases.

Coloides de asociación
Cuando se preparan dispersiones de concentración creciente de un tensioactivo de predominio hidrofílico (HLB elevado), a partir de cierta concentración llamada CMC (concentración micelar crítica) las moléculas de tensioactivo se agrupan en forma de micelas.
Se producen cambios en las propiedades físicas del sistema, que indican que se ha alcanzado la CMC.

Coloides de asociación
Los tensioactivos se agregan a partir de una determinada concentración llamada concentración micelar crítica (CMC), dando lugar a partículas de tamaño coloidal, con diámetro equivalente en los límites de 30-100 Å o sea de dimensiones coloidales, por eso se los denomina coloides de asociación o asociaciones coloidales.

Coloides de asociación
La figura muestra la acción de un tensioactivo sobre la tensión superficial (?). Al aumentar la cc. de tensioactivo en agua, la tensión superficial disminuye (línea ab) debido a que las moléculas se adsorben en la superficie del agua.
Al agregar más tensioactivo se alcanza el punto (b) donde las moléculas están empaquetadas por completo en la superficie.
La parte hidrofílica hacia el agua y la lipofílica hacia el aire.
Si se continua agregando tensioactivo, no caben más moléculas en la superficie y se agregan en micelas. La tensión superficial no disminuye más y permanece cte.
La cc. en la que comienza la micela- ción se llama CMC.

Micelas
Las micelas pueden estar integradas por un número grande de moléculas de tensioactivo, el tamaño es variable y depende de la naturaleza del tensioactivo, de la concentración, de la temperatura y de iones presentes.
El número de agregación n es el número de moléculas de tensioactivo (monómero) presentes en una micela.

Inserción en las micelas
Inserción a nivel profundo : hidrocarburos (A).
Inserción menos profundo: alcoholes y ácidos grasos (B y C).
Inserción en superficie: por ejemplo, ftalato de metilo (D).
Inserción en cadenas de óxido de etileno: cuando se trata de tensioactivos polioxietilenados (E).

Micelas invertidas
En líquidos no polares, los tensioactivos pueden formar micelas invertidas, donde las cabezas polares se dirigen hacia el centro y la parte no polar hacia el medio dispersante.
Como ejemplo podemos citar: dioctilsulfosuccinato de sodio y los monoésteres del sorbitano, cuando se dispersan en aceites u otros líquidos no polares.

Micelas
La facilidad de formar micelas depende del tensioactivo y decrece en el siguiente orden:
no iónico > anfótero > iónico.
Las micelas no son agrupados estáticos, se disocian, se reagrupan, se disocian nuevamente con gran rapidez.

Micelas
Las micelas formadas en soluciones diluidas de tensioactivo son aproximadamente esféricas.
Al aumentar la concentración las micelas aumentan de tamaño. Siendo demasiado grandes para conservar la forma esférica, adoptan estructura elipsoidal, cilíndricas y finalmente laminares.
Estas fases afectan: la viscosidad, la reología de la formulación y la solubilidad del principio activo.

Micelas
Micelas: (a) esféricas, (b) elipsoidal, (c) cilíndricas, (d) vermiforme.
Dibujo cedido por el Ing. Dr. Ricardo Pasquali. Farmacotecnia I

La “solubilización” micelar se emplea en Farmacia:
se llevan a cabo “solubilizaciones acuosas” de iodo, antisépticos fenólicos, hormonas esteroides, vitaminas liposolubles, antibióticos, sulfamidas, barbitúricos, aceites y esencias.
