Indice
1.
Estructura y función
2. Un poco de
historia…
3. Análisis de
disacáridos
4. Métodos
espectrofotométricos
5. Métodos no
enzimáticos
6. Métodos
enzimáticos
7. Bibliografía

1. Estructura y
función
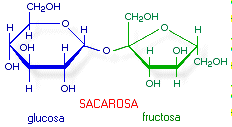
La sacarosa (azúcar
de mesa) es un disacárido de glucosa y fructosa. Se
sintetiza en plantas pero no
en animales
superiores. No contiene ningún átomo de
carbono
anomérico libre, puesto que los carbonos anoméricos
de sus dos unidades monosacáridos constituyentes se hallan
unidos entre sí covalentemente mediante un enlace
O-glucosídico. Por esta razón, la sacarosa no es un
azúcar
reductor y tampoco posee un extremo reductor.
Su nombre abreviado puede escribirse como Glc(a -1à 2)Fru o como
Fru(b
2à
1)Glc. La sacarosa es un producto
intermedio principal de la fotosíntesis, en muchas plantas
constituye la forma principal de transporte de
azúcar desde las hojas a otras partes de la planta. En las
semillas germinadas de plantas, las grasas y proteínas
almacenadas se convierten en sacarosa para su transporte a
partir de la planta en desarrollo.

Los disacáridos no pueden entrar directamente en
la ruta glucolítica, desde luego no pueden entrar en las
células
sin haber sido previamente hidrolizados a monosacáridos
extracelularmente. En los vertebrados, los disacáridos
ingeridos se han de hidrolizar primero por enzimas unidos a
la superficie externa de las células
epiteliales que cubren el intestino delgado para dar sus unidades
monosacáridas.
Los monosacáridos así formados se transportan al
interior de las células que tapizan el intestino, desde
las que pasan a la sangre siendo
transportados a hígado. Allí son fosforilados y
canalizados hacia la secuencia glucolítica.
La mayor parte de las triosas fosfato generadas por
fijación del CO2 en las plantas se convierte en
sacarosa o almidón. La sacarosa puede haber sido
seleccionada durante la evolución como forma de transporte del
carbono debido
a que su unión poco usual, que une el C-1 anomérico
de la glucosa al C-2 anomérico de la fructosa, no es
hidrolizada por amilasas u otras enzimas que
escinden glúcidos comunes. La sacarosa se sintetiza en el
citosol, empezando con la dihidroxiacetona fosfato y
gliceraldehído – 3 – fosfato exportadas del cloroplasto.
Después de la condensación a
fructosa-1,6-bisfosfato (por la aldolasa), la hidrólisis
por la fructosa-1,6-bisfosfatasa forma fructosa-6-fosfato. La
sacarosa-6-fosfato sintasa cataliza la reacción de la
fructosa-6-fosfato con UDP-glucosa (glucosa activada) para formar
sacarosa-6-fosfato. Finalmente, la sacarosa-6-fosfato fosfatasa
elimina el grupo fosfato
haciendo que la sacarosa esté disponible para su exportación desde la célula
a otros tejidos.
La
comunicación y coordinación entre síntesis
de sacarosa en el citosol y fijación de carbono y síntesis
de almidón en el cloroplasto están mediadas por el
sistema de
cotransporte antiparalelo Pi-triosas fosfato. Si la
síntesis de sacarosa es demasiado rápida, el
transporte del exceso de Pi al cloroplasto dará lugar a la
eliminación de demasiada triosa fosfato, esto tiene un
efecto deletéreo sobre la velocidad de
fijación de carbono porque se sintetizan cinco de cada
seis moléculas de triosa fosfato producidas en el ciclo de
Calvin para regenerar la ribulosa-1,5-bisfosfato y completar el
ciclo. Si la síntesis de sacarosa es demasiado lenta,
habrá una insuficiencia de Pi en el cloroplasto para la
síntesis de triosa fosfato.
La síntesis de sacarosa está regulada
principalmente en tres pasos, los catalizados por la
fructosa-1,6-bisfosfatasa, sacarosa-6-fosfato sintasa y sacarosa
fosfato fosfatasa. Cuando la luz incide por
primera vez sobre la hoja por la mañana, aumentan los
niveles de triosa fosfato en el citosol (provenientes de la
fijación de carbono en el cloroplasto). Las triosas
fosfato inhiben la actividad de la fosfofructoquinasa-2
disminuyendo los niveles de fructosa-2,6-bisfosfato. Esto libera
la inhibición de la fructosa-1,6-bisfosfatasa, lo que
permite la síntesis de fructosa-6-fosfato y así de
otras hexosas fosfato, incluida la glucosa-6-fosfato. La
glucosa-6-fosfato es un activador alostérico de la
sacarosa-6-fosfato sintasa. La sacarosa fosfato fosfatasa
cataliza el paso final en la síntesis de sacarosa a medida
que dispone de sustrato.
2. Un poco de historia…
La historia de la investigación de disacáridos
está íntimamente ligada al desarrollo de
la bioquímica.
El esfuerzo por entender la estructura de
los azúcares, el proceso de
fermentación, la naturaleza de los
enzimas, la catálisis biológica, y la ruta del
carbono asimilado durante la fotosíntesis y el seguimiento del curso de
las rutas metabólicas, a menudo involucran el estudio de
disacáridos, especialmente la sacarosa.
La forma de preparar azúcar de caña cristalina pura
(sacarosa) se conocía desde los tiempos antiguos, pero su
naturaleza
química
era un misterio hasta mediados del siglo XIX. Este fue el caso
también del disacárido lactosa, el cual fue aislado
por primera vez por Bartoletti en 1619. Fue Sigismud Andreas
Marggraf quien entre 1747 y 1762 logró aislar
azúcar cristalina a partir de remolacha y otras plantas
por extracción en una solución etanólica
caliente en presencia de cal. Él afirmó,
basándose en el sabor, forma de los cristales y
"estabilidad" en soluciones
alcalinas que el material obtenido de esas fuentes era el
mismo que el obtenido de la caña de azúcar. Se
necesitó un período adicional de doscientos
años de investigación para finalmente establecer la
naturaleza química de este
compuesto y para entender como es sintetizado en la naturaleza.
Dos de las técnicas
que empleó Marggraf, extracción con alcohol
caliente y el uso de una solución alcalina en la cual la
sacarosa es estable, siguen siendo métodos
prácticos fundamentales usados para la extracción,
purificación y análisis de sacarosa.
Entre 1810 y 1830, se estableció la composición
química del azúcar, por GayLussac, Berzelius y
Dumas. Dumas en 1828, Presoz en 1833, Peligot en 1838 y Biot en
1842, concluyeron que la sacarosa puede ser dividida por
ácido o por un "fermento" derivado de la levadura u otras
fuentes
biológicas, produciendo un azúcar "reductor". Fue
Dubrunfaut quien en 1847 finalmente estableció que esta
reacción provee glucosa y una cetosa, la cual mostraba ser
fructosa. La invertasa de levadura fue identificada como una
entidad catalítica individual por Berthelot en 1860.
Estudios posteriores de O´Sullivan, E. Fisher y Armstrong
hacia finales del siglo XIX, y por C.S. Hudson entre 1908 y 1915,
transformaron a la invertasa en un agente comúnmente usado
en el análisis de sacarosa y azúcares en
general.
En la segunda mitad del siglo XIX se aislaron y caracterizaron
otros disacáridos, y junto con la identificación
química de estos compuestos, se obtuvieron los enzimas que
causan su hidrólisis.
Aunque los científicos de esa época percibieron el
potencial que tenían estos enzimas para el análisis
específico de disacáridos, sus esfuerzos en esta
dirección se vieron frustrados porque las
preparaciones de enzimas usadas en esa época eran impuras,
conteniendo más de una actividad hidrolasa.
A principios del
siglo XIX, el análisis de soluciones de
sacarosa se basaba en la determinación de la gravedad
específica, una técnica que está
todavía en uso en la industria
azucarera, la cual es útil para la determinación de
soluciones de azúcar en el rango 0.1-99%.
En 1842, Biot y Ventzke descubrieron las propiedades
ópticas de los azúcares, y la "inversión" de la rotación óptica
que ocurre cuando la sacarosa es hidrolizada por ácidos.
Esto inmediatamente llevó al desarrollo de métodos
polarimétricos para la determinación de
azúcares en solución, usando
polarímetros.
En 1831, Becquerel se encontró con que unos
azúcares pueden reducir cobre
alcalino, y Barreswill (1846) usó esta reacción
para la cuantificación de azúcares en
solución. H. Fehiling en 1849 mejoró el procedimiento y
estableció la permanencia de uno de los reactivos
más importantes disponibles para el análisis de
azúcares. El método de
Fehiling permite la determinación de azúcares en
solución del orden de 2-300mg.
Hacia finales del siglo XIX, se desarrollaron reacciones
adicionales para el análisis de azúcares basadas
principalmente en la reactividad del carbono carbonílico,
como por ejemplo, oxidaciones, aminaciones, formación de
hidrazonas, entre otros.
Se desarrollaron tests colorimétricos cualitativos
específicos para azúcares, tales como reacciones
con variados compuestos fenólicos en medio
ácido.
Al comienzo del siglo XIX, estas reacciones
colorimétricas, como también los clásicos
métodos redox, se convirtieron en ensayos
espectrofotométricos cuantitativos, y la sensibilidad de
la determinación de azúcares aumentó a un
nivel de 0.1-1m
mol por muestra.
Entre 1928 y 1938, reactivos bioquímicos clave como ATP,
NAD+ y NADP+, hexoquinasa, fosfoglucoisomerasa y mutasa, y la
glucosa-6-fosfato deshidrogenasa fueron descubiertos por
Meyerhof, Lohman, Von Euler, Warbug y Cori entre otros. El uso de
estos enzimas en un procedimiento
espectrofotométrico para el análisis de glucosa al
nivel de mmol surgió como un bonus de estos estudios
bioquímicos.
La introducción de la cromatografía, el uso de
radioisótopos, y el desarrollo de las técnicas
espectroscópicas en el período 1940-1950 abrieron
puertas para la determinación de azúcares en
estudios biológicos. El desarrollo y la
sofisticación de técnicas e instrumentación nos traen donde nos
encontramos ahora, que podemos estudiar y analizar
azúcares de forma rápida, precisa y en los niveles
de sensibilidad del orden de pmol.
Con respecto a la estructura de la sacarosa, el análisis
de metilación de Irvine y Haworth, entre 1903 y 1927, y
los estudios polarimétricos de Hudson en el mismo
período, proporcionaron el modelo
estructural del disacárido tal como lo conocemos hoy. La
espectroscopia NMR en 1960 determinó la
conformación espacial exacta de la molécula. En
1953, Lemieux y Huber sintetizaron químicamente la
sacarosa por primera vez. La síntesis enzimática de
sacarosa utilizando sacarosa fosforilasa bacteriana fue lograda
por Hassid, Doudoroff y Barker en 1944, y la síntesis por
sacarosa sintasa de plantas fue lograda por Leloir y Cardini en
1955.
Estrategia
Antes de aplicar un procedimiento analítico
específico es necesario tener una buena idea de cuales
carbohidratos
están presentes y los rangos de concentración de
las soluciones estudiadas.
Si el sistema es
completamente desconocido, una evaluación
cualitativa por TLC y un
análisis de los azúcares totales presentes deben
ser obtenidos primero.
La elección de la metodología cuantitativa específica
va a depender de muchos factores:
- El objetivo del
análisis. - El rango de concentración del
disacárido. - La presencia de otros carbohidratos u otros compuestos que puedan
interferir con el método
particular para el disacárido de interés. - El grado de precisión requerido.
- El disacárido no debe ser degradado antes ni
durante el análisis dado que se podrían obtener
datos
erróneos. - La disponibilidad del reactivo analítico
específico, su costo y
eficacia. - La accesibilidad a la instrumentación específica
necesaria.
Cabe notar que para muchos fines, una técnica
simple y barata para el análisis de carbohidratos puede
lograr excelentes resultados- casi tan buenos como los obtenidos
con técnicas e instrumentos sofisticados y caros.
Recordar que la caracterización de un disacárido
por una técnica dada, debe ser siempre verificada por un
segundo método independiente.
4. Métodos
espectrofotométricos
El término espectrofotometría se refiere
al uso de la luz para medir
las concentraciones de sustancias químicas.
Cuando una molécula absorbe un fotón, su
energía se incrementa. Se dice que pasa a un estado
excitado. Si por el contrario emite un fotón, su
energía disminuye. El estado de
menor energía de una molécula se denomina estado basal o
fundamental.
En la siguiente figura se describe un esquema básico de un
espectrofotómetro:
Monocromador – Celda con el analito – Detector de luz Fuente de
luz – (Selección
de longitud de onda)
Una fuente de luz se hace pasar por un monocromador. Éste
permite seleccionar un haz de luz con una única longitud
de onda. Este haz de luz monocromática incide sobre una
celda de ancho b que contiene la solución con el analito.
Si la solución absorbe la luz, la potencia radiante
incidente (Po) (1) del haz de luz disminuye
al emerger de la celda. Los valores de
la potencia radiante
emergente (P) tienen que cumplir necesariamente la siguiente
relación:
P £
Po
(1) La potencia radiante se define como
energía por unidad de tiempo y por
unidad de área o sección.
– Magnitudes en Espectrofotometría
La transmitancia se define de la siguiente forma:
![]()
En tanto, la absorbancia se define como:
![]()
Cuando no se absorbe luz, P = Po y por lo
tanto A = 0. Cuando se absorbe 90 % del haz de luz, 10 % de
éste se transmite, por lo que P = Po / 10 y A =
1.
– Ley de
Beer
![]()
Donde:
- A es la absorbancia (magnitud
adimensional) - e es un
coeficiente de proporcionalidad denominado absortividad molar.
Indica la absorbancia de una determinada sustancia a una
longitud de onda dada y se expresa en M-1.
cm-1. - b es el ancho o espesor de la celda donde se deposita
la muestra y se
expresa en cm. - c es la concentración expresada en moles /
Litro (M)
La ley de Beer
establece que la absorbancia es proporcional a la
concentración de las especies absorbentes. Dicha ley se
verifica muy bien en un rango definido de concentraciones
(£ 0.01
M). Las fallas aparentes de la ley de Beer en soluciones
más concentradas pueden atribuirse a cambios en las
propiedades de las especies absorbentes de la solución.
Conforme una solución se vuelve más concentrada,
las moléculas de soluto interactúan entre sí
debido a su proximidad, modificando sus propiedades de absorber
la luz. De ello resulta que la gráfica de Absorbancia en
función
de la concentración pierde su linealidad.
Este es probablemente el procedimiento más
común para la estimación del contenido total de
azúcares reductores y glucósidos. Una muestra
de 0.01 – 0.25 m mol de azúcar en 0.3 mL se mezcla
con 0.01mL de fenol 10%. Se agrega 1.0mL de
H2SO4 concentrado de grado
analítico a la mezcla azúcar – fenol.
Después de mezclar, se incuba por 30 minutos a
temperatura ambiente.
Luego se mide la absorbancia a 490nm.
Algunas sustancias tales como cationes de metales
pesados, compuestos azo- y tio- podrían
interferir.- Fenol – H2SO4
- Antrona – H2SO4
El medio ácido hidroliza el enlace
glicosídico de la sacarosa y los monosacáridos
resultantes reaccionan con la antrona produciendo un color verde
– azulado.
Para el análisis de sacarosa, una muestra de
100m L
(0.05-0.4m mol
de sacarosa) se mezcla con 100m L de NaOH 30%, y se calienta por 10 minutos a
100°C. Se deja enfriar a temperatura
ambiente y se
agregan 3.0mL del reactivo de antrona (0.15% en 80%
H2SO4).
Después de 15 minutos a 40°C, se mide la absorbancia a
620nm.

Antrona
- Introducción
Desde un punto de vista analítico, la capacidad
de los enzimas para catalizar reacciones específicas con
un alto grado de eficacia, ha dado
lugar a diferentes aplicaciones en diversos campos del
análisis como análisis clínicos,
análisis de productos
alimentarios, análisis de preparados farmacéuticos
etc.
El análisis enzimático o análisis mediante
el empleo de
enzimas puede ser utilizado en:
1. La determinación de los sustratos de la reacción
enzimática, siendo posible determinar
específicamente cada una de las sustancias de una mezcla
sin necesidad de separar. Para la cuantificación de
sustratos se pueden utilizar dos métodos generales:
a. Métodos de cambio total,
de equilibrio o
de punto final. En este tipo de métodos (los más
utilizados en la práctica) se permite que la
reacción enzimática se complete o llegue al
equilibrio y
se mide la variación producida en la concentración
de un producto de
reacción o de un reactivo presente inicialmente en
exceso.
b. Métodos cinéticos, en los que se utilizan
medidas de la velocidad
inicial de la reacción enzimática para deducir la
concentración inicial de sustrato. Los procedimientos de
medida son idénticos a los utilizados para reacciones
catalíticas en general.
2. Determinación de los mismos enzimas mediante el
empleo de
métodos cinéticos en los que se mide la velocidad
de desaparición del sustrato o de generación del
producto, relacionada con la concentración de enzima en
disolución.
- Determinación de otras sustancias mediante el
empleo de reactivos marcados con enzimas:
enzimoinmunoanálisis.
El objetivo de
esta práctica es determinar el contenido de sacarosa en un
preparado empleando para ello un método enzimático
espectrofotométrico de tiempo
fijo.
2. Fundamentos
Aunque la glucosa puede determinarse por métodos
químicos, estos en su mayoría carecen de
especificidad y no pueden distinguir la glucosa de otros
monosacáridos. Tanto en análisis clínicos
como en la industria
alimentaria y farmacéutica se utilizan métodos
enzimáticos para la determinación de glucosa.
La glucosa oxidasa es una flavoproteína altamente
específica que cataliza la oxidación de la glucosa
a b
-D-gluconolactona, sin que ningún otro azúcar
natural reaccione en extensión apreciable.
C6H12O6 + O2
C6H10O6 +
H2O2
Esta reacción en la que se
consume oxígeno
podría seguirse manométricamente o mediante un
electrodo de oxígeno. Sin embargo, para poder seguir
el curso de esta reacción espectrofotométricamente
es necesario acoplar a la misma una segunda reacción
enzimática indicadora adecuada. Así, para la
determinación colorimétrica de glucosa por el
método de la oxidasa, se añade al medio peroxidasa
de rábano silvestre (HRP), que elimina el peróxido
de hidrógeno a medida que se forma, a la vez que se genera
un colorante adecuado según el siguiente esquema de
reacción:
H2O2 + Aceptor de oxígeno Producto
coloreado + H2O
(DH2) (D)
Se podrían utilizar como aceptores de oxígeno
benzidina, o-toluidina, o-dianisidina. Sin embargo, la naturaleza
carcinogénica de estos compuestos ha impulsado la
búsqueda de aceptores alternativos. Uno de estos sistemas es la
4-aminoantipirina, que reacciona con el p-hidroxibencensulfonato
y el peróxido de hidrógeno en presencia de HRP para
formar un colorante quinonaimina con un máximo de
absorción a 505 nm, de acuerdo al siguiente esquema de
reacción.

Este método, propuesto por Trinder (1) en 1972,
será el empleado en esta práctica para la
determinación de glucosa en un preparado. A
continuación se resumen las distintas reacciones acopladas
que se utilizarán para la determinación de la
glucosa. La cantidad de colorante generada, y por tanto la
absorbancia medida a 505 nm, será directamente
proporcional a la cantidad de glucosa.
El disacárido sacarosa puede también determinarse
específicamente basándose en el esquema de
reacciones anterior, previa hidrólisis enzimática
del mismo con el enzima fructofuranosidasa o invertasa. Este
enzima cataliza la transformación de la sacarosa en una
molécula de fructosa y una molécula de glucosa
(azúcar invertido).
3. Material, reactivos, instrumentación
a. Instrumentación
–
Espectrofotómetro con cubetas de 1 cm de paso de
luz.
b. Material
- 4 matraces de 100 ml
- 8 matraces de 25 ml
- 1 vaso de 250 ml, 2 vasos de 100 ml
- 1 embudo, papel de
filtro, vidrio de
reloj.
c. Reactivos
- Reactivo Trinder: Disolución que contiene
todos los reactivos necesarios para la determinación de
la glucosa por el método propuesto en las
concentraciones que se indican a
continuación: - 4-aminoantipirina 0,5 mmol/L
- p-hidroxibencensulfonato 20 mmol/L
- Glucosa oxidasa (GOD) obtenida de Aspergillus
Niger 15 U/mL - Peroxidasa de rábano silvestre
(Horseradish peroxidase, HRP) 10 U/mL
Pesar las cantidades adecuadas de los reactivos
indicados y disolver en una disolución reguladora de Tris
0,02 M de pH 7,0. Llevar
a volumen en un
matraz de 100 mL. Esta disolución debe almacenarse en
botellas color topacio y
en el refrigerador.
- Disolución de invertasa 72 U/ml en
tampón de citrato 0,1 M de pH 4,6.
Preparar 25 mL - Disolución patrón de glucosa 0,01
M
Procedimiento
Se empleará un método de tiempo fijo para la
cuantificación de sacarosa en una muestra de un
preparado.
Para la construcción de la línea de
calibrado deben prepararse cinco disoluciones de glucosa de
concentraciones comprendidas entre 5´ 10-5 M y
5´
10-4 M por dilución del patrón de
glucosa. Añadir a la cubeta del espectrofotómetro 1
mL de reactivo Trinder y 250 µL de patrón, mezclar e
incubar exactamente 18 minutos a temperatura ambiente.
Medir a continuación la absorbancia de la mezcla de
reacción a 505 nm frente a un blanco de reactivos.
Para la determinación de glucosa y sacarosa en la muestra,
esta se disolverá y/o diluirá con agua en la
proporción adecuada según el contenido de glucosa y
sacarosa esperado.
Para determinar el contenido de sacarosa se llevará a cabo
en primer lugar su hidrólisis enzimática a glucosa
y fructosa (inversión) con invertasa. Para ello se
toman 2 mL de la disolución de muestra y se mezclan con 8
mL de la disolución de invertasa. Se incuban 15 minutos a
55 ºC. La suspensión fría se filtra, se lava
el filtro y se recoge cuantitativamente en un matraz aforado
enrasando con agua hasta la
marca.realizando a continuación la
determinación del contenido total de glucosa según
el procedimiento anteriormente descrito. El contenido de sacarosa
se obtiene por diferencia entre las concentraciones de glucosa
obtenidas antes y después de la inversión
enzimática. Expresar el contenido de glucosa y sacarosa en
la muestra en g/g de muestra.
- D. Barham, P. Trinder; Analyst,1972, 97,
142-145 - P.M. Dey, J.B. Harborne; Methods In Plant
Biochemistry. Vol. 2. - L. Stryer; Bioquímica. 4ta.
Edición. - A. Lehninger; Principios de
bioquímica. 2da. Edición. - L.G. Wade, Jr.; Química Orgánica. 2da.
Edición. - F.A. Carey; Química Orgánica. 3ra.
Edición. - Tinoco, Jr.; Physical Chemistry. 3ra.
Edición. - Internet: www.chemfinder.com
www.chemweb.com
www.spectragalactic.com
www.probes.com/handbook
www.netbiochem.com
Autor:
Marcie Jiménez Riani
