Modelamiento y simulación de un reactor flujo pistón en estado estacionario con intercambio
- Objetivos
- Fundamentos
teóricos - Modelos
matemáticos - Método de
solución - Algoritmo de
solución - Código del
programa
- Diseñar un RFP en estado estacionario con
intercambio de calor para una ecuación reversible
elemental. - Formular los modelos
matemáticos para su resolución. - Simular el comportamiento del volumen con
respecto a la temperatura.
La cantidad de un componente seleccionado ,A ,que se
convierte o que se produce por unidad de tiempo,
por cantidad unitaria de una variable de referencia, y, en un
sistema
que reacciona químicamente ,se define como velocidad
de reacción, rA.
Por definición, rA
es negativa, si A se refiere a un reactivo, en tanto que
será positiva , si se refiere a un producto
de la reacción.
Reacciones reversibles
Este tipo se refiere al caso en que la
conversión de reactivos a productos
en el equilibrio
no es completa y, en consecuencia, la reacción inversa
adquiere importancia. Por ende para el siguiente conjunto de
reacciones reversibles, cada una de las cuales es
elemental,
La velocidad de desaparición del componente A
se describe por medio de
La constante de proporcionalidad K se denomina
constante de velocidad específica de la
reacción, o simplemente constante de velocidad .El
valor de k
depende enormemente de la temperatura al igual que la
presión .Las unidades y el valor de K
varía en función del componente
específico al que se refiere dicha constante, el orden
de la reacción y las unidades de la
concentración.La dependencia de la expresión de la
velocidad en función de la temperatura se representa
casi siempre mediante la constante de velocidad a
través de la ecuación de Arrhenius:
En esta ecuación, A se denomina factor de
frecuencia ,E es la energía de
activación.REACTOR DE FLUJO PISTON
Otro tipo de reactor de uso
común en la industria
es el reactor tubular, que consiste en un tubo
cilíndrico y normalmente se opera en estado
estacionario.En el reactor tubular , los reactivos se consumen
continuamente a medida que fluye a lo largo del
reactor.Por consiguiente, la velocidad de reacción,
que es una función de la concentración para
todas las reacciones con excepción de las de orden
cero, también varía axialmente. La
ecuación general del balance de moles está dada
por la ecuación (1-4):
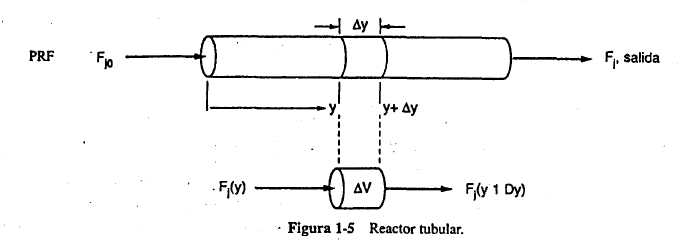
Para obtener la
ecuación de diseño del PFR dividiremos
(conceptualmente) el reactor en varios subvolúmenes de
modo que dentro de cada subvolumen V la velocidad de
reacción se pueda considerar espacialmente uniforme
(figura 1-5). Ahora dirigimos nuestra atención al subvolumen situado a una
distancia y de la entrada del reactor.Representamos con Fj(y) la velocidad de flujo
molar de la especie j hacia el volumen Ven y, y con
Fj(y + y), el flujo molar de la especie; desde el
volumen que está en (y + y). En un
subvolúmen espacialmente uniforme V,

- FUNDAMENTOS
TEÓRICOSReactor tubular de estado
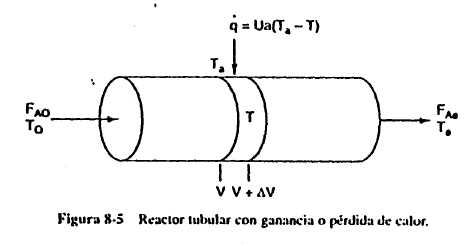
estacionario con intercambio de calorEn esta sección consideraremos un reactor
tubular en el que se añade o elimina calor a
través de las paredes cilíndricas del reactor.
Al modelar el reactor supondremos que no hay gradiente radial
en el reactor y que el transporte
de calor a través de la pared por unidad de volumen
del reactor es como se muestra en la
figura.
Recordando la ecuación e ignorando
cualquier trabajo
efectuado sobre el fluido de reacción,
obtenemos
Diferenciamos respecto al volumen V y reunimos
términos para llegar a
Recordando que –rA =
FAO(dX/dV), y sustituyendo la ecuación por
(dQ/dV), podemos reacomodar la ecuación para
obtener
La ecuación diferencial que describe el
cambio de
temperatura con el volumen de reactor (es decir, distancia
reactor abajo),
se debe acoplar con el balance de
moles:
- MODELOS
MATEMÁTICOS
Dado que las ecuaciones
que se plantearon anteriormente son EDOs, donde
la variable independiente es el volumen, se resolverán
por el método numérico de RUNGE
KUTTA de cuarto orden.

RK4:










- MÉTODO DE
SOLUCIÓN - ALGORITMO DE
SOLUCION
ALGORITMO
Método de Runge-Kutta de
cuarto orden para sistemas de dos
ecuaciones
diferenciales ordinarias.
Para aproximar la solución al (PVI)
X´ = F(V,X,T)
T´ = G(V,X,T)
X(Vo) = Xo , X(Vf) = ?
T(Vo) = To , T(Vf) = ?
Proporcionar las funciones
F(V,X,T) y G(V,X,T).
DATOS: La ecuación inicial Vo,Xo,To el
valor Vf y el numero de N de subintervalos por
emplear.
RESULTADOS: La aproximación a los valores
X(Vo) y T(Vf) : Xo , To
PASO 1 : hacer H = (Vf – Vo )/N
PASO 2 : Hacer I = 1
PASO 3 : Mientras I <=N repetir los pasos 4 a
15
PASO 4 : Hacer K11 = F(Vi,Xi,Ti)
PASO 5 : Hacer K12 = G(Vi,Xi,Ti)
PASO 6 : Hacer K21 = F(Vi + h/2 , Xi + h/2*K11 ,
Ti + h/2*K12)
PASO 7 : Hacer K22 = G(Vi + h/2 , Xi + h/2*K11 ,
Ti + h/2*K12)
PASO 8 : Hacer K31 = F(Vi + h/2 , Xi + h/2*K21 ,
Ti + h/2*K22)
PASO 9 : Hacer K32 = G (Vi + h/2 , Xi + h/2*K21 ,
Ti + h/2*K22)
PASO 10 : Hacer K41 = F( Vi + h , Xi +h*K31 , Ti
+ h*K32)
PASO 11 : Hacer K42 = G(Vi + h , Xi +h*K31 , Ti +
h*K32)
PASO 12 : Hacer Xi+1 = Xi + h/6*(K11 + 2*K21 +
2K31 + K41 )
PASO 13 : Hacer Ti+1 = Ti + h/6*( K12 + 2*K22 +
2*K32 + K42 )
PASO 14 : Hacer Vo = Vo + h
PASO 15 : Hacer I = I + 1
PASO 16 : Imprimir Xi , Ti y terminar.
ALGORITMO
- Conversión como variable de
reacción
![]()
1.- BALANCE DE MOLES
![]()
2.- ley de
velocidad

3.- estequiometria
(fase gaseosa, sin variación de P) :

4.- balance de energía:

- Velocidades de flujo molar variable de
reacción
1.- balance de moles :
2.- ley de velocidad:

3.- Estequiometria (fase gaseosa si variación
de P):

4.- balance de energía:
![]()
Introducir valores de
parámetros:
![]()
Introducir valores iniciales: ![]()
Usar revolvedor de EDO
- Métodos numéricos aplicados a la
ingenieria "Antonio Nieves Hurtado; Federico C.
Dominges" - Ingenieria de las reacciones
químicas "Sccot Fogler "
Igor Cañapataña Larico
Estudiante de Ingeniería Química
Alumno de la Universidad
Nacional de San
Agustín "Arequipa-Perú"