1. SISTEMA
RENAL
1.1. ANATOMÍA DEL SISTEMA RENAL
1.1.1. RIÑÓN
Los riñones son dos órganos de color
pardo-rojizo situados retroperitonealmente en la parte dorsal del
abdomen, a cada lado de la columna vertebral. Los riñones
están recubiertos por una cápsula de tejido
fibroso.
El parénquima renal puede dividirse en dos zonas:
corteza en la parte externa y médula en la
parte interna. La corteza cubre la base de cada una de las
unidades cónicas de la médula, denominadas
pirámides medulares, cuyo ápice se prolonga
en la pelvis renal dando lugar a la papila. Un
examen macroscópico permite distinguir que la corteza
tiene un aspecto ligeramente granular que no se observa en la
médula.
Cada pirámide medular puede dividirse en una zona
exterior, adyacente a la corteza, y una zona interior que incluye
la papila (Bulger y Doyban, 1982). Las estrías que
aparecen en las pirámides corresponden con la
porción tubular de las nefronas. La estructura
general del riñón se observa en la figura
1.

Figura 1: Estructura general del
riñón. (Modificado de Netter, 2003.)
1.1.2. NEFRONA
La unidad funcional del riñón es la
nefrona, compuesta por un corpúsculo renal donde se
produce la filtración del plasma sanguíneo, y un
sistema tubular donde el líquido filtrado es convertido en
orina en su camino hacia la pelvis renal.
Se distinguen dos tipos de nefronas. Las nefronas
yuxtamedulares tienen el glomérulo cerca de la
médula renal y presentan un asa de Henle larga,
fundamentalmente a expensas de la porción estrecha, que se
encuentra profundamente extendida dentro de la médula. Las
nefronas que tienen el glomérulo cerca de la superficie
del riñón o nefronas corticales, funcionan
de manera muy similar a como lo hacen las yuxtamedulares, aunque
no tienen largos segmentos delgados de sus asas de
Henle.
El riñón está irrigado por la
arteria renal, que procede de la aorta abdominal. La arteria
renal se bifurca en arteria dorsal y ventral,
subdividiéndose en ramas de menor calibre: interlobulares,
arciforme, interlobulillares, hasta la arteriola aferente. En
condiciones normales se filtra el 20% del plasma que llega al
corpúsculo renal, el resto abandona el glomérulo o
red de capilares
por la arteriola eferente que se subdivide en capilares
peritubulares distribuidos por todas las porciones del
túbulo. Estos capilares se reúnen en un sistema
venoso paralelo al arterial, que finalmente forma la vena renal
por la cual sale la sangre del
riñón (Beeuwkes, 1980).
CORPÚSCULO RENAL
El corpúsculo renal o de Malpighi está
compuesto por el glomérulo capilar y la
cápsula de Bowman que lo recubre (figura 2). Existe
un espacio dentro de la cápsula, espacio de Bowman,
hacia donde pasa el líquido filtrado procedente del
glomérulo. La barrera de filtración del
corpúsculo renal o membrana glomerular, consta de tres
capas: el endotelio de los capilares glomerulares, la membrana
basal y una capa de células
epiteliales especializadas con fenestraciones. La membrana basal
es una red compuesta
principalmente por glicoproteínas y
mucopolisacáridos. Las células epiteliales que
descansan sobre la membrana basal son muy diferentes de las
células simples y aplanadas que revisten el resto de la
cápsula de Bowman y se denominan podocitos, tienen
gran número de extensiones podálicas o
pedicelos integradas en la membrana basal. Las hendiduras
entre pedicelos adyacentes constituyen la vía de paso del
filtrado, que una vez atraviesa las células endoteliales y
la membrana basal, penetra en el espacio de Bowman y desde
allí pasa a la primera porción del túbulo
proximal (Berne y Levi, 2001).

Figura 2: Sección longitudinal de un
corpúsculo renal y del aparato yuxtaglomerular. 1)
Arteriola aferente. 2) Arteriola eferente. 3) Capilares
glomerulares. 4) Músculo liso vascular. 5)
Células yuxtaglomerulares. 6) Lacis. 7) Mácula
densa. 8) Túbulo distal. 9) Podocitos. 10)
Células endoteliales. 11) Células mesangiales.
12) Membrana basal glomerular. 13) Membrana basal. 14) Epitelio
parietal. 15) Espacio de Bowman. 16) Túbulo proximal.
(Adaptado de Somlo y Mundel, 2000.)
Las células mesangiales, se sitúan
en la parte central del glomérulo entre las asas
capilares, a veces penetrando en ellas de forma que conectan
íntimamente con la célula
endotelial. Estas células tienen las siguientes funciones:
– Contráctil, gracias a los filamentos de
actina y miosina que les permiten regular el coeficiente de
ultrafiltración en respuesta a distintos
agonistas.
– Fagocítica.
– Síntesis y
degradación de matriz
extracelular.
– Síntesis de determinados autacoides y
factores de crecimiento que pueden actuar de forma autocrina y
paracrina.
SISTEMA TUBULAR
En toda su longitud está constituido por una sola
capa de células epiteliales que descansan sobre una
membrana basal. La estructura y función de
estas células varía de un segmento a otro del
túbulo, de acuerdo con las distintas funciones y
capacidades del mismo, pero con una característica en
común: la unión estrecha entre células
adyacentes. La siguiente figura muestra la
localización y morfología
de las células epiteliales que constituyen el sistema
tubular renal.

Figura 3: Esquema de la morfología celular
del sistema tubular urinario. (Modificado de Ganong,
2003.)
El segmento del túbulo donde drena la
cápsula de Bowman se denomina túbulo
proximal, el cual, inicialmente forma varias espiras, de
ahí su nombre contorneado, y después se
vuelve recto y desciende.
El túbulo proximal está delimitado por
células cuboidales con un abundante borde en cepillo,
compuesto de invaginaciones de la membrana apical o
microvilli, aumentando en más de 40 veces la
superficie celular.
A continuación comienza la rama estrecha
descendente del asa de Henle, donde las células son
relativamente planas y sólo se ensanchan en la zona del
núcleo. Presentan interdigitaciones laterales complejas
con uniones estrechas, relativamente laxas y sin
desmosomas.
En la zona luminal tienen un número no muy
elevado de microvilli cortos y romos. El túbulo
gira, asciende y posteriormente se ensancha dando lugar a la
rama gruesa ascendente del asa de Henle. La
transición entre asa estrecha y ancha suele ser gradual,
las células planas van aumentando en altura, y acaban
siendo cuboidales, con numerosas interdigitaciones laterales de
la membrana basal que ocupan gran parte del volumen de las
células, y en cuyo interior hay un gran número de
mitocondrias grandes, alargadas y perpendiculares a la membrana
basal.
También tienen un número no muy elevado de
microvilli cortos y romos. Los núcleos son grandes
y están situados en la zona apical.
El siguiente segmento es el túbulo contorneado
distal, que comienza en la mácula densa y presenta
células cuboidales con microvilli cortos y romos, y
mitocondrias alargadas que se encuentran perpendiculares a la
membrana basal. Esta porción continúa en el
túbulo colector cortical.
Los túbulos colectores en la parte medular
constan de células denominadas claras o
intercaladas, que son cuboidales con núcleo central
y pocas mitocondrias. Estas células se encuentran unidas
muy estrechamente y son muy impermeables, con microvilli
bien desarrollados y cortos. A medida que el túbulo se
adentra en la médula aparecen las células
oscuras o intercalares, que tienen más
mitocondrias, microvilli más desarrollados y los
orgánulos subcelulares situados en la zona apical
(Hernando-Avendaño, 1986).
APARATO YUXTAGLOMERULAR
El aparato yuxtaglomerular está situado entre la
primera porción del túbulo contorneado distal y la
arteriola aferente y eferente pertenecientes al corpúsculo
renal de su propia nefrona (Figura 3). Está compuesto por
tres tipos de células:
– Células yuxtaglomerulares. Son
células mioepiteliales que rodean el final de la
arteriola aferente, ricas en gránulos de
secreción y secretan el 90% de la renina (figura
4).
– Células de la mácula densa. Son
células epiteliales diferenciadas de la pared del
túbulo recto distal ascendente que en esta zona de
contacto con el glomérulo se vuelven más altas y
estrechas. Controlan la secreción de renina y la
velocidad de
filtración glomerular.
– Células de Goormaghtigh o del lacis.
Son células mesangiales extraglomerulares que responden
a múltiples mediadores y controlan la superficie de
filtrado.

Figura 4: Esquema del aparato yuxtaglomerular.
(Adaptado de Netter, 2003.)
1.1.3. VÍAS URINARIAS
Los uréteres son dos tubos pequeños
formados por músculo liso, que se originan en la pelvis
renal, descendiendo a la vejiga. Cuando la orina llega a la
pelvis renal, la presión
aumenta e inicia una contracción peristáltica que
comienza en la pelvis renal y se extiende de forma descendente a
lo largo del uréter para propulsar la orina hasta la
vejiga.
Cada uréter tiene inervación
simpática y parasimpático. La estimulación
parasimpática estimula la frecuencia de las ondas y la
intensidad de las mismas, mientras que la simpática las
disminuye.
En su extremo inferior, el uréter entra en la
vejiga de forma oblicua a través del
trígono. El uréter tiene un trayecto por
debajo del epitelio de la mucosa vesical, de forma que la
presión de la vejiga lo comprime evitando el reflujo de
orina cuando aumenta la presión en la vejiga, coincidiendo
con la micción (Guyton, 1992).
1.2. FISIOLOGÍA RENAL
1.2.1. FILTRACIÓN GLOMERULAR
El riñón realiza muchas funciones entre
las que cabe destacar: regulación del equilibrio
hidroelectrolítico, excreción de productos
metabólicos y sustancias extrañas,
regulación de la presión arterial,
regulación de la eritropoyesis, formación de
vitamina D activa, gluconeogénesis y amortiguador de
pH.
En estas funciones, la misión
fundamental del riñón es estabilizar el volumen y
las características fisicoquímicas del
líquido extracelular, e indirectamente del compartimento
intracelular, mediante la formación de la orina. Conserva
el agua y los
electrolitos principales de los fluidos del organismo, sobre todo
sodio, potasio, cloruro y bicarbonato, en la concentración
normal en el organismo, y elimina el exceso de agua y los
productos metabólicos de desecho como urea, creatinina,
ácido úrico e hidrogeniones, o productos
endógenos y tóxicos que han penetrado en el
organismo.
El líquido que se filtra a través del
glomérulo hacia la cápsula de Bowman se denomina
ultrafiltrado, y está prácticamente libre de
proteínas.
El ultrafiltrado atraviesa tres capas distintas antes de
adentrarse en la cápsula de Bowman, pero la permeabilidad
de las mismas es varios cientos de veces superior a la de las
membranas capilares habituales, lo que determina la gran cantidad
de filtrado glomerular que se forma en el tiempo. No
obstante, en cuanto al paso de moléculas, la membrana
glomerular tiene cierta selectividad, condicionada por el
tamaño, la carga y configuración
molecular.
Así, para un peso molecular de 5200 Da como la
inulina, la permeabilidad es del 100%, mientras que para la
proteína plasmática más pequeña, la
albúmina, que tiene un peso molecular de 69.000 Da, la
permeabilidad es del 0,5%. Por ello, la membrana glomerular es
prácticamente impermeable a todas las proteínas
plasmáticas, pero completamente permeable al resto de
sustancias disueltas en el plasma, dejándolas pasar
libremente.
Por otro lado, los poros están recubiertos de una
red de proteoglicanos cargados negativamente que repelen
sustancias con carga neta negativa. Así, los poros de la
membrana permiten el paso de moléculas de hasta 8 nm, pero
no de la albúmina cuya carga negativa impide su paso a
pesar de tener 6 nm de diámetro de la albúmina. De
esta manera, sustancias con el mismo peso molecular son filtradas
de forma distinta debido a su carga. (Guyton, 1992).
La relación entre el filtrado glomerular y el
flujo plasmático renal se denomina fracción de
filtración. La formación de este líquido a
través de las membranas capilares glomerulares no necesita
gasto de energía metabólica, ya que la
presión necesaria la produce el sistema
cardiovascular. El proceso de
filtración glomerular está condicionado por la suma
neta de las siguientes fuerzas en el capilar glomerular y en la
cápsula de Bowman (Vander, 1993):
– Favorecen la filtración la presión
hidrostática en el capilar glomerular
(Pg), que es la presión media que hay en los capilares
glomerulares y tiene un valor de 60
torr, y la presión oncótica de la
cápsula de Bowman (πi),
sin embargo, como en la cápsula de Bowman la
concentración de proteínas es muy pequeña,
este factor es despreciable y se considera cero.
– Se oponen a la filtración la
presión oncótica de los capilares
glomerulares (πg), que es la
presión que ejercen las proteínas del plasma y
tiene un valor de 32 torr, y la presión
hidrostática de la cápsula de Bowman (Pi),
que tiene un valor de 18 torr.
La presión efectiva de
ultrafiltración (PEF), se define como la diferencia
entre la presión que favorece la filtración, es
decir Pg, y las que se oponen, que son Pi y πg.
Su valor aproximado es de 10 torr.
PEF = Pg
– (Pi + πg)
El coeficiente de filtración (Kf), es el
producto de la
permeabilidad hidráulica de la membrana basal por el
área disponible para la filtración. En
función de Kf y PEF, se define la tasa de
filtración glomerular (TFG):
TFG = Kf x PEF
1.2.2. REABSORCIÓN Y SECRECIÓN
TUBULAR
El filtrado glomerular pasa a través de los
segmentos tubulares, donde el epitelio tubular reabsorbe y
secreta de forma selectiva distintas sustancias, de forma que el
líquido resultante entra en la pelvis renal como
orina.
La reabsorción es cuantitativamente mayor que la
secreción, pero esta última determina las
concentraciones finales urinarias de potasio, hidrogeniones y
otras sustancias.
En el túbulo contorneado proximal se reabsorben
activamente glucosa,
bicarbonato y aminoácidos, acoplados a un mecanismo activo
de reabsorción de sodio (figura 5). El anión
cloruro se reabsorbe pasivamente. El agua y el cloruro
sódico se reabsorben por transporte
pasivo a favor de un gradiente osmótico efectivo. Una
parte del sodio se reabsorbe por sí mismo, activamente,
sin estar ligado a otros transportes.
El manejo de cloruro sódico, agua y urea por el
asa de Henle juega un papel muy importante en los mecanismos de
concentración y dilución urinarias. La rama
descendente presenta una elevada permeabilidad al agua, pero poca
para el cloruro sódico y la urea, de manera que la
osmolalidad del líquido tubular puede aumentar hasta 4
veces cuando desciende por ella. La rama ascendente es más
permeable al cloruro sódico que a la urea pero totalmente
impermeable al agua. La dilución que se consigue en esta
parte del túbulo es debido a un transporte activo de
anión cloruro, que permite el transporte pasivo de iones
calcio, magnesio y potasio. El líquido que entra en el
túbulo distal es hipoosmótico respecto al plasma, y
se mantiene así hasta que aparecen las primeras
células de tipo túbulo colector sensibles a ADH. La
reabsorción activa de sodio se ve favorecida por la
presencia de aldosterona, y asímismo induce la
excreción activa de potasio en el túbulo
distal.
La permeabilidad al agua del túbulo colector es
baja en ausencia de ADH y alta en presencia de esta hormona. En
esta parte de la nefrona también hay reabsorción de
cloruro sódico y excreción de potasio e
hidrogeniones. Las células claras secretan hidrogeniones
por tansporte activo primario, desempeñando un papel
fundamental en la acidificación de la orina. (Guyton,
1992).
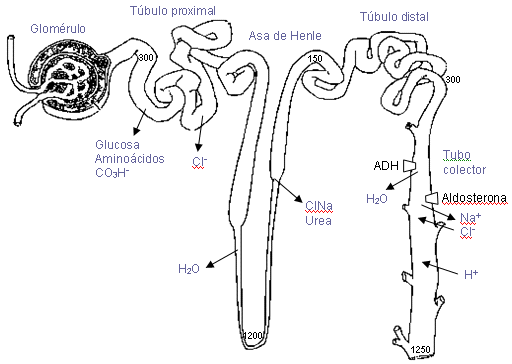
Figura 5: Esquema de los procesos de
reabsorción y secreción en el sistema tubular
urinario. Unidades indicadas en miliosmoles (Adaptado de
Traub, 1996.)
1.3. FIBROSIS RENAL
1.3.1. TEJIDO CONJUNTIVO
El tejido conjuntivo forma un compartimento extenso y
continuo en todo el organismo, limitado por la lámina
basal de los diferentes epitelios de revestimiento y de las
glándulas secretoras. El tejido conjuntivo se caracteriza
morfológicamente por presentar diversos tipos de
células, separadas por abundante material
intercelular sintetizado por ellas, denominado matriz
extracelular. Este tejido constituye una estructura polimorfa
y compleja que presenta una notable dinámica funcional y se encuentra
ampliamente distribuido por el organismo.
Los tejidos
conjuntivos se originan a partir del mesodermo,
específicamente del tejido mesenquimal, formado por
células mesenquimales sumergidas en abundante sustancia
intercelular amorfa poco viscosa.
Las funciones más importantes del tejido
conectivo son:
Sostén y relleno. El tejido epitelial y
muscular están asociados al tejido conjuntivo que les
sirve de soporte.
Almacenamiento. Debido a su riqueza en
mucopolisacáridos almacena agua y electrolitos;
también almacena lípidos
por lo que representa una notable reserva nutritiva. Se calcula
que 1/3 de las proteínas del organismo se encuentra en los
espacios intercelulares del tejido conjuntivo.
Reparación. Las áreas de tejido
conjuntivo, debido a una inflamación o una lesión
traumática, son reconstruidas nuevamente por la
proliferación del tejido adyacente.
Transporte. El tejido conjuntivo transporta
sustancias nutritivas de los capilares sanguíneos a los
diversos tejidos. Transporta también productos de desecho
del metabolismo en
el sentido inverso.
El tejido conjuntivo está formado por
células y matriz extracelular como se muestra en el
siguiente esquema:

Las células propias de cada tipo de tejido
conjuntivo se ocupan de la síntesis y organización de la matriz extracelular que
lo caracteriza. Entre estas células que sintetizan la
matriz extracelular se encuentran:
Fibroblastos. Sintetizan
procolágeno, tropoelastina, proteoglucanos y otras
macromoléculas de la matriz extracelular. En respuesta al
daño se
activan y proliferan, siendo los principales responsables de la
producción de matriz extracelular (Norman,
1999).
Miofibroblastos. Son responsables
del exceso de producción de matriz extracelular en
condiciones patológicas y derivan de la activación
local de los fibroblastos intersticiales. Difieren de las
células musculares lisas porque carecen de lámina
externa.
Fibrocitos. Son los fibroblastos que han
disminuido su actividad, no se dividen.
Adipocitos. Son células
especializadas para sintetizar y almacenar
lípidos.
En la matriz extracelular también podemos
encontrar con células infiltradas, principalmente
macrófagos, linfocitos y
monocitos.
Las integrinas son proteínas transmembrana
semejantes a los receptores de la membrana celular porque forman
enlaces con ligandos. Constituyen heterodímeros cuyos
extremos carboxilo están enlazados con talina y α
actina del citoesqueleto. Sus regiones citoplasmáticas
están fijas al citoesqueleto y sus ligandos son miembros
estructurales de la matriz extracelular como colágeno,
laminina y fibronectina (figura 6).
La matriz extracelular está formada por
macromoléculas segregadas de forma local, especialmente
por los fibroblastos distribuidos en la matriz. La matriz
extracelular fibrilar está compuesta
por:
Colágeno. Es la proteína
más abundante de los mamíferos. Las fibras de colágeno
constan de una formación escalonada de moléculas de
colágeno, también llamadas tropocolágeno,
que están constituidas por tres cadenas
polipeptídicas del mismo tamaño. Cada cadena
polipeptídica tiene cerca de mil aminoácidos; la
tercera parte corresponde a glicina, la prolina
aparece en mayor proporción que en la mayoría de
las proteínas, y la hidroxiprolina e
hidroxilisina, presentes en muy pocas proteínas, se
encuentran en una proporción de 10% y 3% respectivamente.
Algunos azúcares, generalmente disacáridos de
glucosa y galactosa, se unen covalentemente a hidroxilisina; el
número de unidades de carbohidrato incorporado por unidad
de tropocolágeno depende del tejido. Las tres cadenas
polipéptidicas tienen una conformación
levógira cada una, que se trenzan en sentido
dextrógiro. Los principales tipos de colágeno
encontrados en el tejido conjuntivo son los colágenos
fibrilares: I, II, III, V y XI. Los tipos IX y XII son los
colágenos asociados a fibrillas, que unen
las fibrillas de colágeno entre sí y a otros
componentes de la matriz extracelular. Los tipos IV y VII son los
denominados colágenos formadores de redes (van der
Rest, 1991).
Elastina. Constituye la mayor parte de la
fibra elástica, especialmente del tejido maduro. La
elastina está formada por unidades de tropoelastina,
constituidas a su vez por una cadena polipeptídica de unos
830 aminoácidos, que oscila entre diversas conformaciones
al azar parcialmente extendidas. Las moléculas de
tropoelastina se unen entre sí mediante enlaces covalentes
dando lugar a una extensa red entrecruzada. Al igual que el
colágeno es rica en prolina y en glicina
pero a diferencia del colágeno contiene muy poca
hidroxiprolina y nada de hidroxilisina, y también
contiene los aminoácidos poco frecuentes
isodesmosina y desmosina, que forman un enlace
cruzado responsable de la elasticidad de
estas fibras. Las fibras de colágeno entretejidas con las
elásticas limitan el grado de
distensión.
La sustancia básica de la matriz
extracelular está compuesta por:
Proteoglucanos. Constan de una parte
proteica asociada a GAG, que son largas cadenas de
polisacáridos no ramificadas compuestas por unidades
repetidas de disacáridos. Las cadenas de GAG, al ser muy
hidrofílicas, atraen grandes cantidades de agua, formando
geles hidratados que permiten la rápida difusión de
moléculas hidrosolubles, la migración
de células y el desarrollo de
procesos celulares.
Glucoproteínas. Median la
adhesión entre las células y los componentes de la
matriz extracelular. La glucoproteína fibronectina
es un dímero de dos subunidades polipeptídicas
unidas por sus extremos carboxílicos mediante puentes
disulfúricos y sintetizadas principalmente por
fibroblastos; marca las
vías migratorias de las células embrionarias, de
modo que las células del organismo que están
migrando puedan llegar a su destino. La glucoproteína
laminina está formada por tres cadenas
polipeptídicas de gran tamaño, y se encuentra
restringida prácticamente a la lámina basal. Otras
glucoproteínas son: entactina, tenascina,
condronectina y osteonectina.
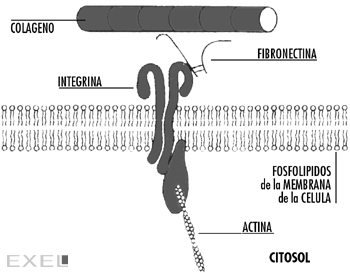
Figura 6: Esquema de la
organización de la matriz extracelular.
(Adaptado de Robertis, 2000.)
En condiciones normales, la matriz extracelular de los
mamíferos está sometida a un continuo recambio,
gracias al equilibrio que mantienen los mecanismos de
señalización que regulan los sistemas de
síntesis y degradación de los componentes de la
matriz. Ante una lesión, los mecanismos de
reparación tisular responden con un aumento de la
síntesis de citocinas y diversos factores de crecimiento.
Estas moléculas regulan la deposición de
componentes de la matriz extracelular en un proceso de
cicatrización normal. Si este proceso se perpetúa,
el exceso de deposición de matriz o fibrosis causa la
destrucción y la pérdida de la función
tisular.
Los modelos de
nefropatías experimentales han demostrado que el
incremento de ciertas citocinas como Ang II y de factores de
crecimiento, contribuyen de manera importante a la
producción de fibrosis renal, y por lo tanto, a la
progresión de la enfermedad renal
crónica.
Los fibroblastos intersticiales, que en condiciones
fisiológicas producen y mantienen la matriz extracelular,
son las principales células implicadas en el exceso de
deposición de matriz. Estas células se activan en
respuesta al daño ante la presencia de determinadas
moléculas, siendo las principales responsables del exceso
de matriz en la fibrosis intersticial renal progresiva. El
daño renal, induce un cambio
fenotípico en los fibroblastos, que evolucionan a
miofibroblastos expresando de forma característica
α-SMA.
1.3.2. NEFROPATIA OBSTRUCTIVA
Una obstrucción del tracto urinario superior
ocasiona inicialmente un aumento de la actividad
peristáltica y de la potencia
contractiva, que si no compensa el efecto de la
obstrucción, origina una hipertrofia del músculo
pieloureteral y descompensación por dilatación con
incremento de la presión intraluminal. Este aumento de la
presión origina un daño estructural y funcional del
riñón, induciendo daño
tubulointersticial.
La nefropatía obstructiva en niños
se debe, casi siempre, a malformaciones congénitas, por
ejemplo debido a una entrada anormal del uréter en la
vejiga, originando reflujo ureterovesical. En la mujer adulta
suele originarse por cálculos, presencia de tumores
pélvicos y embarazo. En
el hombre
adulto las causas más frecuentes son la hipertrofia
prostática, cálculos y estenosis
ureteral.
La obstrucción ureteral unilateral (OUU), es un
modelo de nefropatía obstructiva experimental muy
utilizado en la investigación de los mecanismos implicados
en la patología fibrótica tubulointersticial. Se
trata de una maniobra que causa de forma aguda la
obstrucción completa del uréter y que presenta la
ventaja de que la evolución de la fibrosis es altamente
reproducible y refleja de forma acelerada la secuencia de
acontecimientos patológicos de la nefropatía
obstructiva. Muchos experimentos
corroboran la utilidad de este
modelo para identificar las moléculas y procesos
involucrados en la patogénesis de la fibrosis renal
(Klahr, 2002).
La obstrucción origina inicialmente una
vasodilatación que aumenta el flujo sanguíneo
renal. A continuación hay una vasoconstricción que
reduce un 75% el valor normal del flujo sanguíneo
renal.
La obstrucción del uréter estimula la
fosfolipasa y la ciclooxigenasa responsables de la
liberación de ácido araquidónico, y la
producción de PGs vasodilatadoras como PGE y
prostaciclinas. Si la obstrucción persiste, se libera Ang
II, TXA2 y endotelina-1, que producen
vasoconstricción en la arteriola aferente (Klahr, 1998).
Se observa hidronefrosis y reducción de la
filtración glomerular. Las alteraciones
tubulointersticiales constituyen la característica
patológica fundamental del riñón obstruido:
infiltración de células en el intersticio tubular,
apoptosis y proliferación de células tubulares e
intersticiales, atrofia tubular, acumulación de
miofibroblastos e incremento de la deposición de matriz
extracelular intersticial. El epitelio tubular sintetiza
moléculas quimiotácticas que favorecen la
infiltración de macrófagos y de linfocitos T
citotóxicos en el intersticio tubular, contribuyendo a la
lesión inducida por el daño tubular y promoviendo
la fibrosis intersticial (Diamond, 1995).
La fibrosis tubulointersticial se manifiesta de forma
temprana en el riñón obstruido, detectándose
un aumento del volumen del intersticio y un incremento en la
deposición de colágenos I, III y IV (Kaneto, 1994).
Se desarrolla una red fibrótica con la deposición
de colágenos, fibronectina, proteoglicanos y
heparán sulfato y un incremento en el número de
fibroblastos (González-Ávila, 1988).
Existe un elevado número de células
tubulares que se encuentran en un estado de
transición entre epitelio y mesénquima. Estas
células adquieren características de
mesénquima al expresar α-SMA,
vimentina, y conservan la expresión de marcadores
tubulares como la lectina, a la vez que dejan de expresar el
marcador de adhesión celular cadherina E y producen
componentes de la matriz extracelular como fibronectina y
colágeno tipo I (Yang, 2002; Iwano, 2002).
En el riñón no obstruido o contralateral,
se observa una hipertrofia compensadora como adaptación a
la respuesta del daño, que compensa la pérdida de
la función renal del riñón
obstruido.
2.
SISTEMA RENINA-ANGIOTENSINA-ALDOSTERONA
La renina es una enzima proteolítica que se
libera en las células yuxtaglomerulares en respuesta a la
disminución de la volemia o de la presión arterial,
detectadas gracias a los barorreceptores presentes en estas
células que rodean la arteriola aferente. También
responden a una estimulación de las células de la
mácula densa, que detectan un aumento de la
concentración salina del líquido que fluye por el
túbulo contorneado distal. La estimulación
simpática β1 también aumenta la
liberación de renina.
Las células yuxtaglomerulares sintetizan y
acumulan prorrenina, forma inactiva de la renina, en los
gránulos. Cuando se libera, la mayor parte de la renina
llega a circulación general, aunque una pequeña
parte permanece en los riñones desencadenando reacciones
locales. En la circulación general, actúa sobre el
angiotensinógeno, glucoproteína sintetizada en el
hígado, dando lugar a la angiotensina I, péptido de
diez aminoácidos, vasoconstrictor débil, pero
incapaz de producir cambios funcionales importantes en
circulación. La angiotensina I, mediante la ECA,
sintetizada en las células endoteliales, se transforma en
el octapéptido Ang II, principalmente en los
pequeños vasos sanguíneos pulmonares.
La presencia en el riñón de todos los
componentes de la cascada renina-angiotensina y el elevado
contenido de Ang II intrarrenal, mucho mayor que el detectado
sistémicamente, ponen de manifiesto la existencia de un
sistema renina-angiotensina local.
2.1. EFECTO DE LA ANGIOTENSINA II
La Ang II es un péptido multifuncional con
numerosos efectos. La vasoconstricción es un efecto muy
rápido, afecta sobre todo a las arteriolas y en menor
grado a las venas. La vasoconstricción aumenta la resistencia
vascular periférica. Por otro lado disminuye la
eliminación renal de agua y sal. Estimula la
liberación de aldosterona. La aldosterona se sintetiza en
la corteza de la glándula suprarrenal, en la zona
glomerulosa externa; es un mineralocorticoide que estimula la
reabsorción de sodio y agua en los túbulos distal y
colectores de las nefronas. La neutralidad se mantiene secretando
potasio o hidrogeniones mediante la reabsorción
concomitante de cloruro.
La Ang II estimula el centro de la sed y aumenta la
liberación de vasopresina o ADH, que produce
vasoconstricción y reabsorbe agua en el túbulo
colector de las nefronas.
El sitema renina-angiotensina-aldosterona, además
de regular la actividad renal vasomotora, mantener la homeostasis de
agua y sodio, y controlar el crecimiento tisular en el
riñón, puede tener consecuencias
fisiopatológicas derivadas de una
estimulación elevada. A través de la
retención de sodio, este sistema activado promueve la
hipertensión sistémica y la de los
capilares glomerulares, pudiendo inducir un daño
hemodinámico en el endotelio y en el
glomérulo.
Por otro lado, los componentes del sistema que se
expresan locamente en el glómerulo, túbulo proximal
e intersticio renal, además de regular la función
normal del riñón, están implicados en los
mecanismos de respuesta al daño en el mismo.
La Ang II, además de modular la
contracción celular, regula el crecimiento, la apoptosis y
la diferenciación; influye también sobre la
migración y la deposición de la matriz
extracelular, es proinflamatoria y estimula la producción
de otros factores de crecimiento como CTGF, PDGF,
TGF-β y transactiva receptores de factores de
crecimiento como IGF, PDGF y EGF (Kim, 2000). La
estimulación de los factores de crecimiento TGF-β,
PDGF, EGF y CTGF, produce proliferación celular. La Ang II
también estimula citocinas como IL-6 y
TNF-α, metaloproteínasasas
y PAI-1. El conjunto de efectos de Ang II hace que aumente la
síntesis de matriz extracelular y disminuya su
degradación, acumulándose y originando
fibrosis.
2.2. RECEPTORES DE LA ANGIOTENSINA II
La Ang II media sus efectos a través de, al
menos, dos tipos de receptores: receptor de angiotensina tipo 1
(AT1) y tipo 2 (AT2). A través de la
unión a los receptores AT1, la Ang II induce la
contracción celular, proliferación,
migración, producción de componentes de la matriz
extracelular y respuesta inflamatoria, mientras que la interacción con el receptor AT2
parece actuar como antagonista de los efectos mediados por
AT1, promoviendo la apoptosis e inhibiendo la
proliferación y la hipertensión (Allen, 2000). Los
receptores AT1 y AT2 pertenecen a la familia de
receptores transmembrana acoplados a proteínas
G.
La estimulación de receptores AT1 por
Ang II, induce como respuesta inmediata la activación por
fosforilación de PLC, capaz de hidrolizar
PIP2 produciendo DAG e IP3, que moviliza el
calcio intracelular (figura 6). La unión de Ang II a sus
receptores AT1 también activa PLD, capaz
de hidrolizar fosfolípidos, como fosfatidilcolina, y
generar ácido fosfatídico, implicado en la
señalización celular asociada a mitogénesis.
La unión del ligando a su receptor también activa
proteínas kinasas por fosforilación en
residuos tirosina, activando kinasas de la familias SRC, Janus y
PI3K. Estos efectos pueden ser también mediados por
transactivación de receptores con actividad kinasa como
EGF, PDGF e IGF. Las TK pueden activar numerosas dianas
efectoras, entre otras, la vía de MAPKs, a través
de la fosforilación de la proteína adaptadora Src,
que se asocia al complejo de proteínas Shc-Grb2-Sos, para
inducir el intercambio de nucleótidos GDP-GTP en la
proteína Ras. La vía de señalización
Ras-MAPKs interviene en la regulación de los procesos de
proliferación. La unión de Ang II al receptor
AT1 también activa PLA2,
capaz de hidrolizar fosfolípidos para liberar ácido
araquidónico que produce distintos eicosanoides como PGs,
TXs y leucotrienos, así como otros metabolitos que activan
la vía de Ras-MAPKs (Touyz, 2000).

Figura 6: Rutas de activación celular por
interacción de Ang II con los receptores
AT1. (Adaptado de Touyz, 2000.)
2.3. INHIBICIÓN DEL RECEPTOR TIPO 1 DE
ANGIOTENSINA II
Los antagonistas de los receptores AT1 son
agentes antihipertensivos cuya acción
no sólo se asocia a la actividad antagonista sobre
receptores AT1, sino también a la unión
de Ang II a los receptores AT2. Previenen el
desarrollo de nefropatía en pacientes con diabetes tipo 2,
hipertensión y microalbuminuria, y un porcentaje elevado
de estos pacientes presentan una regresión a los niveles
de albuminuria normales (Brenner, 2001).
El losartán,
2-butil-4-cloro-1-[[2`-(1H-tetrazol-5-il)-(1,1`bifenil)-4-il]metil]-1H-imidazol-5-metanol,
y su metabolito activo, E-3174, son antagonistas no
peptídicos que funcionan como inhibidores competitivos de
los receptores AT1 de Ang II (figura 7).
Losartán es ampliamente empleado como antihipertensivo.
Mientras que los IECAs bloquean la síntesis de la Ang II a
partir de la angiotensina I, el losartán impide que la Ang
II formada pueda interaccionar con su receptor
endógeno.
El metabolito activo del losartán es 10-40 veces
más potente que el mismo losartán como ligando de
los receptores AT1, siendo el principal responsable de
los efectos farmacológicos del losartán. El
losartán reduce las resistencias
vasculares sin producir cambios significativos de la frecuencia
cardiaca.

Figura 7: Estructura de Losartán y de su
metabolito más activo E-3174. (Avendaño,
2001.)
3.1. FAMILIA
RAS
Las proteínas Ras son pequeñas
proteínas G monoméricas, también llamadas
pequeñas GTPasas. Pertenecen a la superfamilia Ras en la
que se han identificado más de 100 proteínas
diferentes subdivididas en 5 subfamilias: Ras, Rho, Rab, Arf y
Ran (Barandier y col, 2003), con masa molecular entre 20 y 40
kDa. Estas pequeñas proteínas, ejercen gran
variedad de funciones como la regulación de la
expresión génica, proliferación celular,
migración, organización del citoesqueleto,
tráfico intracelular de vesículas y transporte de
proteínas entre el núcleo y el citoplasma
(Barandier y col, 2003).
La subfamilia Ras se caracteriza por tener gran
similitud en el dominio efector o
región switch I. Esta subfamilia está
formada por:
– Proteínas Ras clásicas o p21; H-Ras,
K-RasA, K-RasB, N-Ras.
– Proteínas Rap; Rap1A, Rap1B, Rap2A,
Rap2B.
– Proteínas similares a R-Ras; R-Ras, TC21,
R-Ras23.
– Proteínas Ral; RalA, RalB.
– Proteínas Rheb y M-Ras.
3.2. GENES RAS
Los genes ras se descubrieron en los años
60 como elementos del virus de la cepa
Harvey y Kirsten que producía sarcomas en roedores
recién nacidos (Harvey, 1964; Kirsten y Mayer, 1967). A
principios de
los 80 se identificaron distintos alelos mutados de genes
ras como oncogenes dominantes presentes en un gran
porcentaje de tumores sólidos.
Los genes codificantes de los distintos miembros de la
familia Ras están muy conservados evolutivamente, lo que
sugiere que estas proteínas son muy importantes en los
procesos celulares. En mamíferos hay tres genes cuya
estructura y función es muy parecida: H-ras,
K-ras y N-ras. Están compuestos por cinco
exones codificantes y un exón 5´ no codificante, y
difieren estrechamente en el tamaño y en la secuencia de
intrones. Los genes K-ras tienen dos alternativas para el
cuarto exón codificante: 4A y 4B, dando lugar a dos
proteínas que difieren en 25 aminoácidos del
extremo carboxilo terminal (Barbacid y cols, 1987; Lowy y cols,
1993).
3.3. SÍNTESIS Y MODIFICACIÓN
POSTRADUCCIONAL DE RAS
Los genes ras se expresan en todos los tipos
celulares y órganos, aunque existen diferencias en cuanto
a expresión pre- y postnatal, y en ciertos tejidos adultos
se expresan preferentemente uno u otro miembro de la familia.
H-ras se expresa mayoritariamente en cerebro,
músculo y piel.
K-ras se expresa mayoritariamente en estómago,
pulmón y timo, mientras que N-ras se expresa
mayoritariamente en testículos
y timo.
Los genes ras codifican proteínas de 189
aminoácidos, N-Ras y H-Ras y K-Ras4B y de 188
aminoácidos, K-Ras4A. Las proteínas Ras tienen un
alto grado de homología en sus primeros 164
aminoácidos, siendo idénticas en los primeros 86
aminoácidos y con un 79% de homología en los 78
residuos restantes. Sin
embargo, entre los aminoácidos 165 y 185, llamada
región heterogénea, son completamente distintas en
los 20 aminoácidos carboxilo terminales, a
excepción de la Cys186 (Santos y Nebreda,
1989).
Las proteínas Ras contienen cinco dominios
contiguos necesarios para su función, y el extremo
carboxilo terminal con la secuencia Cys186-A-X-COOH, siendo A un
aminoácido alifático y X cualquier
aminoácido (Barbacid y cols, 1987) .
La proteína Ras presenta dos regiones importantes
para su activación y su función
llamadas: switch
I y switch II, con residuos
hidrofílicos localizados en la cara externa de la
molécula (Ma y Karplus, 1997). El switch I,
aminoácidos 32-40, es el principal sitio de unión
del efector y también es el responsable, en parte, de la
interacción con GAPs. El switch II,
aminoácidos 60-72, se encarga en parte de la
interacción con los GEFs. Las regiones switch
están cercanas al fosfato γ del GTP y
exhiben distintas conformaciones segϊn
estén unidas a GTP o GDP. De este modo, los cambios
conformacionales de estas regiones están implicados en la
unión a las proteínas reguladoras y en la
transmisión de la señal a los efectores de Ras
(Malumbres y Pellicer, 1998).
Las proteínas Ras de mamíferos
están localizadas en la cara interna de la membrana
plasmática como homodímeros o heterodímeros
(Santos y cols, 1988). Para la unión de la proteína
Ras a la membrana son necesarias una serie de señales
moleculares que determinan la ruta por la cual esta
proteína se ancla en la membrana y su localización
en islotes lipídicos (rafts o caveolas, regiones
ricas en colesterol) o en zonas desorganizadas de la membrana
(Hancock y cols, 1990).
Los miembros de la subfamilia de Ras presentan un motivo
carboxilo terminal CAAX, donde la Cys186 va seguida de dos
residuos alifáticos y un aminoácido aleatorio, que
es una señal para el procesamiento por enzimas que
añaden un grupo prenilo
(farnesilo o geranilgeranilo), facilitándose así el
anclaje de la proteína Ras a la membrana. Se produce una
rotura proteolítica de los residuos AAX y una
carboxi-metilación del extremo C-terminal (Casey,
1995).
Estas modificaciones aumentan la hidrofobicidad, aunque
son insuficientes para el anclaje funcional a la membrana
(Hancock y cols, 1990). Para ello es necesaria una segunda
transformación. En el extremo C-terminal existen residuos
de cisteína en la región heterogénea que
pueden sufrir S-acilación (palmitoilación) en
H-Ras, N-Ras y K-Ras4A o, la unión de una cola
polibásica rica en lisina en el caso de K-Ras4B. La cadena
de grupos S-acilo
aumenta la hidrofobicidad de la proteína y confieren una
unión estrecha a la membrana (Hancock y cols, 1989 y 1990)
(figura 8).
La palmitoilación de H-Ras y N-Ras permite su
transporte hacia la membrana plasmática a través
del aparato de Golgi (Apolloni y cols, 2000; Choy y cols,1999).
Sin embargo, el segmento carboxilo terminal polibásico
enriquecido en lisina de K-Ras4B probablemente interacciona
electrostáticamente con fosfolípidos (Magee y
Marshall, 1999) y dirige su transporte a la membrana mediante la
unión con microtúbulos (Apolloni y cols, 2000;
Thissen y cols, 1997).
Por otro lado, la localización de Ras en la
membrana también depende de estas modificaciones
postraduccionales. Así, se sabe que H-Ras está
localizada en islotes lipídicos, mientras que K-Ras se
localiza en zonas desorganizadas de la membrana (Prior y cols,
2001; Roy y cols, 1999). Esta localización puede regular
la proximidad de diferentes tipos de receptores y de GEFs,
provocando que existan diferencias en la susceptibilidad de
activación por distintos estímulos (Cheng y cols,
2001). Por otra parte, en caso de estimulación por
factores de crecimiento, la diferente localización
también determina la activación de distintos
efectores.
Por ejemplo, se ha observado que la localización
de H-Ras en islotes lipídicos es esencial para la
activación de efectores como Raf 1 y PI3K (Roy y cols,
1999; Jaumot y cols, 2001) (figura 8).

Figura 8: Modificaciones postraduccionales y
transporte de Ras a la membrana. (Adaptado de Rojas y
Santos, 2002.)
3.4. ACTIVACIÓN DE RAS
Una vez localizadas en la membrana, las proteínas
Ras alternan un equilibrio entre la forma inactiva, unida a GDP,
y la forma activa, unida a GTP, que le permite interaccionar con
las moléculas efectoras (figura 9).
En respuesta a señales extracelulares
estimuladoras, las actividades GTPasa e intercambiadora de
GDP/GTP intrínsecas de Ras resultan demasiado lentas para
la velocidad que demanda el
rápido intercambio transitorio GDP/GTP funcional (Rojas y
Santos, 2002). Para que Ras sea efectivo en respuesta a las
señales extracelulares, requiere una interacción
directa con proteínas reguladoras de su actividad que
incluyen las GAPs y GEFs. Las GAPs inactivan Ras al aumentar la
velocidad de hidrólisis del GTP unido (Wittinghofer, 1997)
y los GEFs promueven el reemplazo del GDP unido a Ras y la
posterior captación de GTP del citosol (Downward,
1996).

Figura 9: Esquema de la activación e
inactivación de Ras.
Los receptores TK activados se unen a GAPs directamente
y a GEFs indirectamente, siendo ésta última
responsable de conducir a Ras a su estado activo, Ras-GTP. Sos es
uno de los GEFs que juega un papel clave en la
estimulación de Ras a través de receptores TK y
receptores acoplados a proteínas G activados (Rojas y
Santos, 2002).
3.5. EFECTORES DE RAS
La proteína activada Ras media la
proliferación celular a través de la
estimulación de MAPKs, activando mediante la
serina-treonina kinasa Raf a la proteína ERK1/2, esencial
para la regulación del crecimiento celular y la
diferenciación y regulación de la apoptosis. Otra
ruta de señalización estimulada por Ras es la
vía de la proteína PKB o Akt mediante la
activación de la PI3K. Akt regula la expresión de
numerosos genes, induce la síntesis proteica, protege a
las células de la apoptosis y promueve la supervivencia
celular (Dhanasekavan y Premkumar, 1998).
3.5.1. CASCADA DE MAPKs
Las proteínas kinasas de la familia Raf, son los
primeros efectores de Ras identificados en células de
mamíferos. Ras-GTP se une al efector citoplasmático
clásico de Ras, Raf-1 (Vojtek, 1993), y lo trasloca a la
membrana plasmática donde Raf se activa por un mecanismo
que parece independiente de Ras (Stokoe, 1994) (figura 10). Raf
activado fosforila las MAPKKs MEK1 y MEK2, que a su vez
fosforilan las MAPKs ERK1 y ERK2. La fosforilación de
ERK1/2 promueve su homodimerización y su
translocación al núcleo, donde activa por
fosforilación directa la transcripción de factores
como Elk-1. La activación de la kinasa Raf es necesaria y
suficiente para la activación de la cascada de kinasas MEK
y ERK iniciada por Ras (Marshall, 1994), constituyendo una de las
vías clave de señalización a través
de la cual Ras ejerce su efecto proliferativo.

3.5.2. CASCADA DE PI3K
Otro de los efectores mejor conocidos de Ras es la
kinasa lipídica PI3K, que cataliza específicamente
la fosforilación en la posición 3 del PI en
presencia de numerosos factores de crecimiento y citocinas
(Malumbres, 1998). Esta enzima está constituida por las
subunidades p110, con actividad catalítica, y p85, con
actividad reguladora.
En respuesta a la estimulación, la subunidad
reguladora p85 de PI3K es reclutada en la membrana
plasmática donde interacciona directamente con residuos de
tirosina fosforilados (Kapeller, 1994) (figura 11). Ante los
agentes estimuladores de PI3K, la subunidad catalítica
p110 media la generación de PIP2 y
IP3. Ras se une directamente y activa la subunidad
p110 de manera GTP dependiente (Rodríguez-Viciana, 1994),
dando niveles elevados de IP3 y PIP2. Estos
productos lipídicos intervienen como segundos mensajeros
en vías que controlan la síntesis de ADN, la
inhibición de la apoptosis, el tráfico intracelular
y secreción de vesículas, y los cambios
metabólicos a través de la fosforilación de
dos proteína kinasas: Akt y p70S6K. La
unión de IP3 a Akt recluta a esta kinasa a la
membrana donde es fosforilada por las kinasas PDK1 y
2.

Figura 11: Esquema de la organización de la
cascada Ras-PI3K-Akt/PKB. (Adaptado de Malumbres,
1998.)
La vía PI3K/Akt controla diversos procesos
celulares entre los que se encuentra la estimulación de la
supervivencia celular (Downward, 1998).
Akt es una serina-treonina kinasa con un dominio kinasa
amino terminal y un dominio regulador carboxilo terminal. Para la
completa activación de la proteína es necesaria la
fosforilacion de los residuos treonina 308 en el dominio kinasa,
y serina 473 en el dominio carboxilo terminal (Vanhaesebroeck y
Waterfield, 1999). Para una máxima activación es
necesaria una segunda fosforilación en el residuo serina
473. Esta última fosforilación se desconoce quien
la lleva a cabo, pudiendo ser PDK1 o un proceso de
autofosforilación del propio Akt (Coffer y cols, 1998;
Galetic y cols, 1999).
Después de la activación Akt puede
fosforilar un gran número de sustratos, tanto en el
citoplasma como en el núcleo, relacionados con la
regulación de funciones celulares que incluyen el
crecimiento celular, la supervivencia, el metabolismo de la
glucosa y la traducción de proteínas (Galetic y
cols, 1999).
Maite Grande Rodriguez
