Desarrollo
ENFERMEDAD
CEREBROVASCULAR
Las células
cerebrales mueren cuando dejan de recibir oxígeno
y nutrientes de la sangre o cuando
son dañadas por una hemorragia repentina en el cerebro o
alrededor del mismo. Isquemia cerebral es el
término utilizado para describir la pérdida de
oxígeno y nutrientes en las células cerebrales
cuando no existe un flujo adecuado de sangre. La isquemia conduce
finalmente a un infarto, la muerte de
células cerebrales que con el tiempo son
sustituidas por una cavidad llena de fluido en el cerebro
lesionado (Castillo, Martí-Vilalta, Martínez-Vila E,
Matías-Guiu, 1999).
Accidente cerebrovascular
isquémico
Un accidente cerebrovascular isquémico
ocurre cuando una arteria que suministra sangre al cerebro queda
bloqueada, reduciendo repentinamente, o interrumpiendo el flujo
de sangre y, con el tiempo, ocasionando un infarto en el
cerebro. Aproximadamente un 80 % de todos los accidentes
cerebrovasculares son de tipo isquémico. Los coagulos de
sangre son la causa más común de bloqueo arterial y
de infarto cerebral (Lainez & Santonja, 1999). La isquemia
cerebral puede producirse por diferentes causas que disminuyan el
flujo sanguíneo cerebral por debajo de un nivel
crítico (desde 55ml/100g/min hasta menos de
12ml/100g/min).
La consecuencia primaria es la falta de oxígeno y
glucosa
necesarios para el metabolismo
cerebral (Castillo, Martí-Vilalta, Martínez-Vila E,
Matías-Guiu, 1999; Guevara, Rodríguez,
Álvarez, Riaño, Rodríguez, 2004).
Esta interrupción o disminución del flujo
sanguíneo cerebral (FSC) en un territorio vascular
determinado genera un área de infarto circundado de otra
zona, Al producirse la cascada de procesos
durante la isquemia comienzan los síntomas clínicos
que caracterizan la enfermedad cerebrovascular (Fisher, 1999; Miranda, 2004).
La obstrucción de un vaso sanguíneo
cerebral ocasiona un gradiente de flujo de sangre en el
territorio vascular afectado que da lugar a una zona central
severamente hipoperfundida (núcleo isquémico), en
tanto que en la periferia se establece una isquemia menos
pronunciada (penumbra isquémica). La región de
penumbra isquémica, donde el flujo residual es inferior al
flujo normal e insuficiente para el mantenimiento
de la función
celular, permanece viable debido a la eficacia de la
circulación colateral. En el núcleo
isquémico, con un flujo inferior al umbral del infarto, se
produce una muerte celular
aguda, principalmente por necrosis (Castillo,
Martí-Vilalta, Martínez-Vila E, Matías-Guiu,
1999).
La presencia de la zona de penumbra en la isquemia aguda
en animales y
humanos se ha establecido por varios estudios de
tomografía por emisión de positrones y de imágenes
de resonancia magnética. En la penumbra la función
neuronal eléctrica esta abolida, pero se conserva una
actividad metabólica mínima que preserva su
integridad estructural durante algún tiempo, hasta que la
producción de ATP cae por debajo del 50% de
los niveles normales. Se ha sugerido que la muerte en la zona de
penumbra tiene características de apoptosis en lugar de
necrosis (Castillo &
Rodríguez, 2004). Fig. 1.
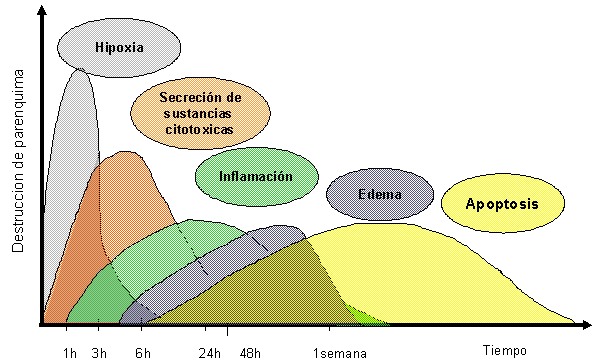
Fig.1. Evolución de los signos
clínicos y patológicos de la isquemia cerebral en
el tiempo.
Lógicamente el periodo de tiempo durante el cual
la penumbra persiste, representa una ventana potencial de
oportunidad terapéutica (Hill & Hachinski, 1998;
Castillo, Martí-Vilalta, Martínez-Vila E,
Matías-Guiu, 1999). La viabilidad de las células en
la zona de penumbra tiene un tiempo limitado ya que la
disminución de las reservas de oxígeno y glucosa
desencadena diversos procesos patológicos que pueden
conducir a la muerte celular (Hossmann, 2006).
De manera que la zona de penumbra constituye el blanco principal
para la mayoría de las intervenciones médicas
agudas aplicadas entre las 3 y 6 horas post-ictal (Kwakkel, Kollen, Lindeman, 2004).
Sin embargo, no todas las neuronas responden de forma
similar al insulto isquémico; existe una vulnerabilidad
selectiva relacionada con diferencias en los subtipos de
receptores de membranas, diversas conexiones celulares,
así como diferencias en la perfusión regional y en
la exposición a factores de crecimiento
(Castillo, Martí-Vilalta, Martínez-Vila E,
Matías-Guiu, 1999). Por ejemplo, las neuronas de la
corteza cerebral, hipocampo (en especial las de CA1),
núcleo amigdalino y cerebelo son más sensibles a la
isquemia y sufren cambios estructurales más precozmente
que las neuronas de otras localizaciones y que las células
gliales (Hacke, 1997; Hill & Hachinski, 1998; Castillo &
Rodríguez, 2004). Por otro lado, las neuronas del tallo
cerebral son más resistentes a cambios isquémicos y
pueden sobrevivir hasta 24 horas antes de que ocurra la
reperfusión.
Fisiopatología de
la Isquemia cerebral.
La deprivación absoluta de oxígeno y
glucosa al tejido neuronal activa una serie de cascadas
patológicas que conllevan a la extensión de la
muerte neuronal. Entre estas vías con un papel
crítico en el daño
isquémico, especialmente en la zona de penumbra
están la sobreactivación de receptores de
glutamato, la acumulación intracelular de iones calcio, el
reclutamiento
de células inflamatorias, el aumento de la
producción de radicales libres y procesos
patológicos de apoptosis (Cheng,
Al-Khoury, Zivin, 2004). Ver Fig.2

Fig.2. Cascada de eventos que se
producen en la isquemia cerebral
La inflamación ha sido implicada como fuente
de daño secundario después de la isquemia. Tras el
episodio de isquemia/reperfusión, el endotelio vascular
promueve la inflamación a través de la
liberación de citoquinas y la aparición de
moléculas que permiten la adhesión y migración
de los leucocitos circulantes dentro del SNC. Tan sólo una
hora después del inicio de la oclusión ya se puede
observar la diapédesis de leucocitos polimorfonucleares en
el núcleo isquémico (Abumiya, Lucero, Heo, Tagaya,
Koziol, et al, 1999).
La activación y agregación plaquetaria, la
adhesión de leucocitos al endotelio, así como el
depósito de fibrina en la luz vascular
debido a la generación intravascular de trombina (Okada,
Copeland, Fitridge, Koziol, del Zoppo, 1994), contribuyen a la
obstrucción microvascular. Conjuntamente con la
compresión por el edema, hinchazón del endotelio y
formación de microvellosidades en las células
endoteliales, contribuyen al fenómeno de "no reflujo" (del
Zoppo, 1994), por el cual los microvasos permanecen obstruidos
tras liberarse la oclusión que inicialmente causaba la
isquemia.
Un modulador importante de lesión de la isquemia
focal es edema cerebral que puede ser diferenciado en dos fases:
el citotóxico, que se produce inmediatamente y el
vasogénico o edema tardío (Hossmann, 1994) El tipo citotóxico de
edema tiene un umbral dependiente. Comienza a valores del
flujo del 30%. El fallo mitocondrial induce el paso al
metabolismo anaeróbico, que causa un acrecentamiento de la
osmolaridad del tejido del cerebro y, por tanto se produce un
incremento de la entrada de agua a
la
célula. A valores del flujo por debajo del 20%
(anoxia), se produce una despolarización debida a la
entrada de iones positivos a través de la membrana,
conjuntamente con agua (Tomita, 2005).
Con la manifestación de necrosis del tejido
después de 4-6 h de la isquemia, se produce el paso de las
proteínas séricas del plasma al
líquido intersticial. Con esta perturbación
comienza el edema tipo vasogénico. Este tipo de edema se
presenta de 1-2 días después del ataque de ischemia
y causa un incremento de volumen de
alrededor de 8 mL. Si el infarto del cerebro es grande, el
volumen del tejido cerebral aumenta y se puede producir el
fenómeno de herniación de las estructuras
cerebrales. En condiciones clínicas este proceso se
considera maligno; es la complicación más peligrosa
de proceso agudo y una indicación para aplicar terapia de
descomprensión (Dombovy, 1988; Hill & Hachinski, 1998;
Lainez & Santonja, 1999; Miranda, 2004).
Cuando disminuye el flujo sanguíneo cerebral a un
75% del normal en una región dada disminuye primeramente
la síntesis
proteica al mismo tiempo que empiezan a expresarse los genes de
respuesta inmediata, de las proteínas del estrés, de
los factores neurotróficos y los genes promotores de la
apoptosis, que determinan la supervivencia de las células
más vulnerables y la integridad de todo el sistema (Fisher,
1999).
La deficiencia progresiva de oxígeno entre 75 y
40% del flujo normal determina un tránsito paulatino hacia
la anaerobiosis, que se expresa en un incremento de la tasa
metabólica cerebral para la glucosa y el incremento de la
concentración de ácido láctico. La
despolarización de la membrana conlleva una
liberación de glutamato y la entrada de calcio a una
acidificación del sistema entre el 45 y el 30%.
A valores inferiores de flujo sanguíneo, entre 35
y 10%, el metabolismo energético se deprime y la célula ya
es incapaz de conservar el potasio intracelular. Por debajo de
este nivel ya el daño es irreversible (Hill &
Hachinski, 1998, García Salman, 2004). Estos valores
fueron determinados con bastante precisión en modelos
experimentales y son similares en diferentes especies de mamíferos, incluido el hombre,
durante las primeras horas del insulto.
Por otra parte, hay regiones vulnerables, como las que
ocupan las neuronas piramidales del sector CA1 del hipocampo
(Kirino, Tamura, Sano, 1985; Kirino,
2002), las piramidales de la V capa cortical, las neuronas
acetil colinérgicas del estriado y las células de
Purkinje del cerebelo que sufren más rápidamente
que otras. Por lo tanto, el daño por isquemia en un punto
determinado del cerebro depende no sólo de las arterias
que irrigan una determinada zona, sino también del
valor de flujo
sanguíneo en un momento determinado, del tiempo
transcurrido a valores subnormales de flujo y de la
vulnerabilidad intrínseca de las células que ocupan
esa región.
BIOMODELOS.
Consideraciones generales
sobre los modelos de isquemia cerebral.
La experimentación básica que soporta los
trabajos clínicos en el campo de la neuroprotección
está fundamentada sobre bases sólidas. En los
últimos 20 años se han llevado a cabo numerosos
estudios para tratar de comprender los mecanismos implicados en
el daño cerebral postisquémico, así como
para desarrollar estrategias que
minimicen sus repercusiones. Un elemento crucial en el estudio de
la fisiopatología y farmacología del ictus es el
uso de modelos animales adecuados.
Un modelo
experimental puede definirse como un medio artificial donde el
objeto de estudio es reproducido para verificar hipótesis sobre el mismo en condiciones
controladas.
En el caso de un modelo ideal de daño por
isquemia debe, ante todo:
- reproducir la situación
clínica - ser reproducible en sí mismo
- estar libre de falsas interpretaciones
- no ser excesivamente dependiente de recursos
tecnológicos lejos del alcance de la mayoría de
los laboratorios de investigación en el mundo en esta
temática, ni requerir de técnicas de avanzada.
Las investigaciones
que se realizan actualmente a nivel mundial en la temática
de las enfermedades
cerebrovasculares, siguen dos direcciones fundamentales: una
dirigida al conocimiento
de la fisiopatología de estas enfermedades y otra que se
orienta al desarrollo de
agentes y procedimientos
terapéuticos para disminuir los índices de
mortalidad y de discapacidad. En
ambas direcciones, el aporte conferido por los modelos animales
ha sido decisivo (Garnette, Sutherland, Gary, Roland, 1996;
Hossmann, 2006). Sin embargo, una de las causas de la disparidad
que se observa en los resultados de los ensayos
clínicos y los ensayos preclínicos radica en el
hecho de que ningún modelo hasta ahora reproduce fielmente
los hallazgos observados en la enfermedad cerebrovascular humana
(Fisher, 2004). La extensión y el origen causal del
accidente vascular han sido los determinantes de los modelos que
han sido creados por diferentes grupos de
investigadores en todo el mundo (Hossmann, 1994; Ginsberg,
Belayev, Zhao, Back, Dietrich et al, 1996; Traysman, 2003;
Hossmann, 2006). Estos pueden agruparse en:
- Modelos de isquemia global: reproducen el
daño cerebral relativo al paro
cardiaco patológico o quirúrgico, los
accidentes tromboembólicos extracraneales y el colapso
vascular sistémico - Modelos de isquemia focal: reproducen los
accidentes tromboembólicos intracraneales, el
vasoespasmo severo y la isquemia transitoria por
cirugía vascular cerebral
- Modelos de microembolismo: reproducen los focos de
infarto producidos por microémbolos debidos a placas
ateromatosas ulceradas, entre otras causas
La similitud entre el encéfalo humano y el de
otros mamíferos ha permitido modelar la isquemia cerebral
y otras enfermedades del sistema nervioso
central. De estos, los perros, gatos y
primates son más cercanos al hombre desde
el punto de vista anatómico, fisiológico y
conductual. Sin embargo, son animales caros y requieren
condiciones especiales para su mantenimiento y reproducción.
Los modelos de accidente cerebrovascular se han
desarrollado principalmente en roedores (Ginsberg, 2003;
Green, Odergren, Ashwood, 2003; Hossmann, 2006).
Aunque el encéfalo de los roedores es liso y su
volumen corporal no los hace apropiados para monitoreos de
rutina, los avances más recientes de la
imagenología y la neurofisiología ha permitido
salvar muchos de los inconvenientes relativos al pequeño
tamaño. Su menor costo
económico, la facilidad de su manejo y de su
monitorización fisiológica, así como su
mayor aceptación ética,
justifican, en parte, la elección de estos animales frente
a otros modelos llevados a cabo en especies animales mayores
(García, 1984; Ginsberg &
Busto, 1989). Además, el elevado grado de homología
genética,
así como las similitudes (en lo básico) en la
anatomía,
fisiología y reactividad de la vasculatura
cerebral entre roedores y humanos, apoyan también la
elección de estos modelos (Festing, 2003).
El desarrollo de un infarto cerebral está en
función de dos variables
esenciales: la intensidad en la reducción del flujo
sanguíneo cerebral (FSC) y el tiempo de isquemia. Los
estudios en animales han proporcionado una detallada descripción de los cambios que se producen
en el FSC y el metabolismo durante y tras la isquemia cerebral
(Hass, 1983), y que difieren según se consideren la
isquemia cerebral global o la isquemia focal (García, 1992). En estos biomodelos, se
ha evaluado un considerable número de drogas que
actúan de diversas formas, incluyendo la
disminución del área infartada.
En la isquemia global, la muerte neuronal se produce de
forma preferencial en regiones cerebrales vulnerables
selectivamente. En estas áreas, las alteraciones
morfológicas aparecen tras un período de 2 a 3
días y posiblemente como consecuencia de la
reperfusión.
En la isquemia focal el infarto se hace evidente
morfológicamente entre las 4 y las 6 horas de la
oclusión arterial y queda bien establecido a las 24 horas
(García, 1992). Tras la isquemia, existe un período
en el que, si se restaura la circulación, puede
conseguirse una recuperación completa, es la denominada
‘ventana de reperfusión’, y que es diferente
en la isquemia focal y en la global. Sin embargo, las
alteraciones fisiopatológicas inducidas por la isquemia
pueden persistir y prolongarse a pesar de reinstaurarse una
adecuada circulación cerebral y quizás
también como consecuencia de ésta. Estas
alteraciones que aparecen más tarde se han denominado
‘lesiones retardadas’ y pueden ser
teóricamente prevenidas o modificadas por los
fármacos con acción
neuroprotectora (Pulsinelli,
1992)
Entre otros factores que atentan contra la
reproducibilidad del modelo está la edad del animal
(Garnette, Sutherland, Gary, Roland, 1996; De Bow, Clark,
MacLellan, Colbourne, 2004). La mayor parte de los modelos
utiliza animales jóvenes y saludables a los cuales se
impone la oclusión artificial de una arteria, lo que no
reproduce el desarrollo progresivo del daño lesional que
va ocurriendo en los pacientes que tienen factores de
predisposición como son arteroesclerosis, hipertensión arterial, hábito de
fumar y otras enfermedades asociadas con lesiones vasculares
(Lainez & Santonja, 1999; Miranda, 2004). Reiterados reportes
demuestran que en roedores viejos el daño isquémico
produce una lesión significativamente mayor que similar
injuria en animales jóvenes, pero los laboratorios no
utilizan estos animales frecuentemente debido al el costo que
tiene envejecer los mismos (Traysman, 2003).
Existe una situación de compromiso entre los
eventos moleculares que conducen al daño cerebral, que se
hacen más graves cuanto más viejo es el animal, y
la circulación colateral, que se hace más
eficiente. Actualmente se prefiere utilizar animales infantiles o
en edad fetal cuando se pretende modelar la isquemia o la hipoxia
perinatal y animales en la segunda mitad de la vida cuando se
pretende modelar la isquemia cerebral en el adulto.
Las diferencias de género
también contribuyen a la mayor o menor reproducibilidad de
la isquemia modelada en animales. La mayor parte de los estudios
experimentales utiliza modelos donde se emplean machos, (De Bow,
Clark, MacLellan, Colbourne, 2004) con el argumento de que los
estrógenos tienen un efecto protector durante el
período fértil de las hembras, tal y como sucede
(Hacke, 1997; Hill & Hachinski, 1998; Rodríguez,
Galvizu, Alvarez, 2002; Krieglstein & Klump, 2002) con las
mujeres en el período fértil, y esto introduce una
mayor variabilidad en las hembras, por lo cual se prefieren
machos para estas investigaciones, como regla general (Hacke,
1997; Hill & Hachinski, 1998; Rodríguez, Galvizu,
Alvarez, 2002; Krieglstein & Klump, 2002). Por lo tanto, la
respuesta de las hembras al insulto isquémico
estaría influida por los niveles de estrógeno en
sangre, determinados por el momento del ciclo estral en que se
encuentra cada individuo en
el grupo
experimental correspondiente. En roedores las hembras muestran
volúmenes de área infartada menores que los machos.
Esta diferencia desaparece cuando las hembras son
ovariectomizadas antes de la lesión (Hossmann,
2006).
Entre líneas de animales de
experimentación de una misma especie se tiende a utilizar
la más vulnerable para un modelo establecido (Traysman,
2003; Hossmann, 2006). La selección
de la edad y el sexo adecuados
en el animal de experimentación donde se modela la
isquemia cerebral debe tener un peso sustancial en las
inferencias que se hagan en la evaluación
de agentes terapéuticos de uso potencial en la
clínica.
La hipotermia es un procedimiento
terapéutico con propiedades neuroprotectoras demostradas
(Corbett, Nurse, Colbourne, 1997), y se sabe por ejemplo, que
disminuyendo la temperatura
cerebral a 24 grados, es posible sobrevivir a una hora de
isquemia. Un animal anestesiado pierde el control de su
temperatura debido a que su hipotálamo se duerme, por
así decirlo, y la temperatura corporal tiende a
aproximarse a la temperatura ambiental. Se ha determinado que las
piramidales de CA1 mueren todas si en el momento de la isquemia
la temperatura cerebral del animal se mantiene a 37oC,
mientras que el mantenerlo a 300C hace que todas estas
neuronas sobrevivan. O sea, que el no controlar la temperatura
durante la isquemia puede conducir a una variabilidad inadmisible
para cualquier estudio que pretenda contrastar entre grupos
tratados y no
tratados con un agente o procedimiento terapéutico en
desarrollo.
El tamaño de la lesión es otra variable a
considerar: Al plotear una variable funcional cualquiera contra
tiempo podemos observar lo siguiente: si la lesión que
inducimos es tan leve que la recuperación con un agente
terapéutico determinado es aproximadamente igual que la
recuperación espontánea, entonces no observamos
acción alguna con el agente terapéutico. Es a lo
que se conoce como efecto techo. Si en cambio, la
lesión es tan grave que no existe suficiente sustrato
material para la recuperación, entonces no habrá
recuperación espontánea, pero tampoco habrá
recuperación con el agente terapéutico. Es a lo que
se conoce como efecto suelo. Por eso los mejores modelos
son aquellos en que la magnitud de la lesión se mueve en
un rango estrecho, entre el efecto techo y el efecto suelo (Ginsberg,
Belayev, Zhao, Back, Dietrich et al, 1996).
Los modelos de isquemia global, basados en la
oclusión de las grandes arterias que irrigan el
encéfalo, reproducen mejor las consecuencias cerebrales
del fallo cardíaco que las de un accidente cerebrovascular
(Green & Cross 1997). Los modelos de fibrilación
ventricular resultan apropiados para el estudio de la influencia
del paro quirúrgico o espontáneo sobre la
función cerebral. En este caso sucede que el periodo de
tiempo necesario que la circulación sistémica debe
star detenida para observar síntomas neurológicos,
tiende a producir tasmbién fallo multiorgánico, que
dificulta la interpretación de los resultados. Por su
parte, los modelos de estrangulación cervical, utilizados
sobre todo en perros y primates, dificultan el retorno venoso y
provocan congestión cerebral e isquemia hiperémica,
poco representativa de la situación clínica. En
cambio, los modelos de oclusión de las arterias
extracraneales permiten el drenaje de la sangre venosa al
sistema
circulatorio, provocando una isquemia anémica, mas
semejante al efecto producido por los accidentes
tromboembólicos extracraneales. Entre estos tenemos los
llamados modelo de los 4 vasos, el modelo de los 3
vasos, y diversas variantes del modelo de los 2 vasos.
(Hossmann, 1994).
En la mayoría de las especies, la oclusión
extracraneal de una de las carótidas comunes no produce
isquemia cerebral, ya que el polígono de Willis
proporciona un suministro sanguíneo colateral suficiente
para suplir las necesidades del lado afectado. Por lo tanto, la
oclusión de las arterias vertebrales y de ambas
carótidas comunes produce la llamada isquemia completa,
donde el flujo sanguíneo de todo el encéfalo cae
prácticamente a 0. Este es conocido como el modelo de los
4 vasos, donde la mortalidad es grande y sólo es posible
diseñar estudios a corto plazo. En el modelo de los 3
vasos, donde sólo se ocluye una carótida, se trata
de modelar la isquemia del hemisferio correspondiente. En los
modelos llamados de los 2 vasos, sólo se ocluyen ambas
carótidas comunes. Al colocar al animal en una
cámara hipobárica o con baja presión de
oxígeno, se trata de modelar la isquemia hipóxica.
En neonatos de rata u otros animales pequeños se modela
incluso la hipóxia perinatal sin ocluir arteria alguna. En
cambio, disminuyendo la tensión arterial por
exsanguinación controlada o por administración de hipotensores, se logra
inducir isquemia global reversible, de todos, el más
utilizado. Sin embargo, no reproduce fielmente la
situación clínica en humanos (Hossmann
1998).
El gerbilio de Mongolia presenta una anomalía
anatómica congénita en el polígono de Willis
que consiste en la ausencia de la arteria comunicante posterior,
lo que hace que la circulación carotídea sea
independiente de la vertebrobasilar (Castro, Niembro,
Pérez, Hernández, Grijalva, 2001). Muchos
investigadores han demostrado tan aproximadamente 30 a 40% de los
gerbos desarrollan un severo deficits del estado
neurológico e infarto unilateral después de la
oclusión unilateral permanente de la carótida
(Kahn, 1972). El modelo del gerbo de oclusión bilateral de
las carótidas es muy usado para realizar evaluaciones
farmacológicas de medicamentos que realizan
protección del daño cerebral (Clifton, William,
Taft, Blair, Sung et al, 1989). El modelo tiene ventajas como son
una tasa mortalidad baja, simplicidad de preparación,
morbosidad pequeña, y una incidencia alta de de
lesión isquémica cerebral. El sector CA1 del
hipocampo muestra
pérdida neuronal severa en 85-95% de los gerbos
después de 7 días de oclusión (Kirino,
1982). Es una especie muy utilizada a pesar se su variabilidad
genética por muchos investigadores en la actualidad
(Ishibashi, Kuroiwa, Endo, Okeda, Mizusawa, 2003). Las
desventajas de esta especie está dada por la limitaciones
en la evaluación neurológica; la susceptibilidad
del gerbil al procedimiento quirúrgico porque los animales
son pequeños, limitados fisiológicamente para
poderlos evaluar (Hossmann, 2006).
Por último, los modelos de isquemia focal
están basados en la oclusión permanente o
transitoria de una arteria cerebral específica.
Generalmente se llevan a cabo con la ACM, debido a que en humanos
la mayor incidencia de infartos focales se localiza en las
áreas irrigadas por ese vaso; al menos el 25% de los
infartos en pacientes que sufren el primer accidente
cerebrovascular, y hasta el 80% se asocian con daño
isquémico en ese territorio (Hill & Hachinski, 1998;
Miranda, 2004). La oclusión de una carótida,
seguida de la oclusión de la arteria cerebral media
produce isquemia en dicho territorio vascular. Este modelo
reproduce el accidente vascular más frecuente en la
clínica, si bien las diferencias en el sitio de
oclusión introducen variabilidad en los resultados
(García, 1984; Ohlsson, Johansson, 1995; Ginsberg,
Belayev, Zhao, Back, Dietrich et al, 1996; Belayev, Zhao, Busto, Ginsberg, 1997; Rogers,
Campbell, Stretton, Mackay, 1997; Corbet & Nurse, 1998;
Traysman, 2003; Hossmann, 2006).
Los principales métodos de
oclusión arterial en roedores son: trombosis inducida
fotoquímicamente, embolismo con un coágulo o con
microesferas, coagulación o ligadura, oclusión
intraluminal y, finalmente, empleo de
líneas de ratas espontáneamente hipertensas que
desarrollan infartos de forma espontánea. Uno de los
modelos más utilizados de oclusión arterial es la
aproximación subtemporal de Tamura (Tamura, Graham,
McCulloch, Teasdale, 1981): mediante una craneotomía
subtemporal se accede a una zona distal del orígen de la
ACM, que es coagulada a ese nivel. El mayor inconveniente de esta
técnica es que es irreversible, resultando en una isquemia
permanente. En determinados casos de accidente cerebrovascular el
FSC puede restablecerse, bien por disgregación
espontánea del trombo, o bien por intervención
clínica, por lo que resultan de gran interés
los modelos que permiten la inducción de isquemia focal reversible; es
decir, con reperfusión.
Entre estos modelos de isquemia focal transitoria, los
más utilizados son la compresión arterial mediante
pinzamiento o ligadura (Shigeno, Teasdale, McCulloch, Graham,
1985), la aplicación abluminal de endotelina sobre la
arteria y, sobre todo, la oclusión intraluminal de la ACM.
Este último presenta la ventaja sobre los anteriores de
que permite llevar a cabo la oclusión proximal de la ACM
de forma reversible y sin craniotomía, introduciendo una
sutura en la arteria carótida interna y haciéndola
avanzar hasta que sobrepase el orígen de la ACM (Zea
Longa, Weinstein, Carlson, Cummings, 1989). En el caso de la
oclusión proximal, la ACM se ocluye cerca de su
ramificación desde la arteria carótida interna,
inmediatamente antes del origen de las arterias
lenticuloestriadas. Tras la oclusión, el FSC no se reduce
uniformemente en toda la zona afectada. El centro de esta zona
(núcleo) se define como la región en la que el FSC
se reduce hasta un 15% o menos, y abarca la porción
lateral del estriado (caudado-putamen) y al cortex parietal. La
penumbra es la región en la que el FSC se reduce hasta un
40% o menos, y comprende al resto del neocortex, el cortex
entorhinal y el estriado medial. En cuanto a la oclusión
distal de la ACM (aproximación subtemporal), el FSC a los
núcleos basales no se interrumpe y por lo tanto la
lesión se restringe al neocortex. La reducción del
FSC en el núcleo y en la penumbra de este modelo es
similar a la que se obtiene con el modelo de la oclusión
proximal (Lipton, 1999, Mergenthaler, Dirnagl, Meisel,
2004).
Puede ser difícil de encontrar pruebas que
sean sensibles para distinguir las calidades diferentes de
insultos del cerebro con isquemia (Puurunen, 2001), no obstante
siempre deben ser tenidas en cuenta en la evaluaci’on de
cualquier modelo de isquemia cereral porque es lo que acerca al
modelo al comportamiento
de la enfermedad en el hombre desde el punto de vista
clínico.
La inyección de trombos de sangre coagulada
permite reproducir la isquemia trombótica que se produce
en el humano por la misma vía. Sin embargo, el
tamaño y número de los trombos debe ser ajustado
con mucha precisión para lograr resultados reproducibles
(Ginsberg, Belayev, Zhao, Back, Dietrich et al, 1996). Unos
años más tarde aparecieron modelos que utilizan el
colorante rosa de Bengala, que tiene la propiedad de
inducir la agregación plaquetaria cuando es transformado
por acción de un rayo de luz con una energía
suficiente. Si lo inyectamos en un animal y después
descubrimos su cráneo podríamos con un láser de
560 nm atravesar la capa ósea e incidir sobre una arteria
para que se produzcan trombos capaces de ocluirla. A pesar de las
ventajas de este modelo resulta difícil predecir la
localización final del trombo, lo cual atenta contra su
reproducibilidad.
El desarrollo de la ingeniería
genética, indiscutiblemente ha producido un salto
cualitativo en la comprensión de los mecanismos
fisiopatológicos de las enfermedades y de la enfermedad
cerebrovascular en particular. En la actualidad es relativamente
fácil producir ratones transgénicos, donde se ha
demostrado que la sobreexpresión o la anulación de
la expresión de determinados genes incrementa o reduce el
volumen de infarto ante la imposición del mismo insulto
isquémico.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
