Características morfogenéticas de la hemofilia (página 2)
Fenotipo
(Manifestaciones Clínicas):
La diátesis
hemorrágica afecta sobre todo las articulaciones,
los músculos, el sistema
genitourinario y el SNC. Sólo de forma esporádica
aparecen hemorragias en las mucosas. La frecuencia y la
intensidad de las manifestaciones hemorrágicas
generalmente guardan relación con las concentraciones de
factor VIII circulante. Cuando éstas son indetectables, la
hemofilia se clasifica como grave. Concentraciones inferiores al
5% definen la forma moderada y cifras entre el 5 y el 50%
corresponden a la forma leve.
Aproximadamente el 80% de los hemofílicos graves
durante el primer año de vida presentan equimosis y/o
hematomas, después de punciones venosas y procedimientos o
manipulaciones quirúrgicas. Durante el período de
la dentición las hemorragias gingivales son frecuentes;
éstas también aparecen ante lesiones
traumáticas en la lengua y la
cavidad bucal. Las equimosis y los hematomas se incrementan entre
el primero y el tercer años de vida, cuando se inicia la
deambulación.
En este período aparecen las primeras hemartrosis
y hemorragias musculares. Las hemorragias de mucosas no son
infrecuentes en los hemofílicos adultos, especialmente las
epistaxis o las de la cavidad bucal tras pequeños
traumatismos.
Puede existir una disociación pronunciada entre
la intensidad de la agresión y sus consecuencias.
Así, pequeños traumatismos, que incluso pasan
inadvertidos, pueden dar lugar a extensos hematomas. Si
éstos ocurren en territorios profundos, es posible la
aparición de complicaciones. Por ejemplo, grandes
hematomas de localización retroperitoneal pueden
expandirse y producir compresión de órganos
adyacentes, raíces nerviosas o vasos, y ocasionan cuadros
de shock con masa abdominal, oligoanuria por compresión
ureteral o incluso paraplejía. Las hemorragias musculares
pueden producir contracturas, atrofia muscular o incluso
parálisis nerviosa. Es característico el hematoma
de la cara palmar del antebrazo, que puede ser responsable del
síndrome de Volkmann. El cuadro clínico del
hematoma del psoas puede llegar a confundirse con el de una
apendicitis aguda. En los casos de hematomas internos
abdominales, tanto de partes blandas como musculares, la
práctica de ecografía, tomografía
computarizada (TC) o resonancia magnética (RM) tiene gran
valor diagnóstico.
Las hemorragias de mayor frecuencia e importancia por
las secuelas que dejan son las articulares, que constituyen
aproximadamente el 75% de las complicaciones hemorrágicas
en la hemofilia. Las hemartrosis de rodillas, tobillos, codos,
hombros, caderas y muñecas son las más frecuentes.
Las hemartrosis se acompañan de los signos
clásicos de la inflamación y generalmente el dolor es el
síntoma inicial. El tratamiento adecuado y rápido
de la hemorragia articular es fundamental para evitar lesiones
degenerativas residuales. Las hemartrosis de repetición
inducen una degeneración articular que se manifiesta por
hiperplasia sinovial y destrucción del cartílago
articular. La deformación articular puede verse agravada
por la atrofia muscular y la contractura de partes blandas que
presentan estos enfermos. Las lesiones producen graves secuelas
funcionales, por lo que es muy importante la instauración
de un tratamiento profiláctico, o inmediato tras una
hemartrosis, así como un adecuado tratamiento
rehabilitador y ortopédico.
Aproximadamente el 2% de los individuos
hemofílicos presenta quistes óseos y seudotumores
hemofílicos, lesiones que pueden plantear problemas
diagnósticos. Los quistes óseos corresponden a
reservorios encapsulados de sangre con
capacidad de incrementar su tamaño. El crecimiento de
estos hematomas encapsulados puede afectar la integridad
ósea, causar su progresiva destrucción y, en
ocasiones, generar nueva osteogénesis. La existencia de
los quistes hemofílicos se ha asociado a una población con recursos
terapéuticos limitados.
En la mayoría de los casos la cirugía es
el único tratamiento efectivo. En determinadas ocasiones
los seudotumores son difíciles de diferenciar de
auténticas neoplasias óseas. En estos casos los
estudios de captación ósea de isótopos, la
TC o la ecografía pueden ayudar a aclarar el
diagnóstico.
La hematuria es una manifestación frecuente en el
hemofílico grave, aunque en la mayoría de las
ocasiones es microscópica. Si la hematuria es muy intensa
pueden generarse coágulos en los uréteres y
provocar cólicos nefríticos. Las hemorragias
más graves en los hemofílicos son las del SNC, que
por lo general están asociadas a traumatismos previos. La
prevalencia de este tipo de complicaciones en los
hemofílicos graves oscila entre el 2,5 y el 8%.
Curiosamente, la mayoría de las hemorragias del SNC se
producen antes de los 20 años de edad. La tercera parte
tienen una localización subaracnoidea, mientras que en el
26% son subdurales.
Ante la aparición repentina de cefaleas intensas
en un paciente hemofílico siempre debe considerarse esta
posibilidad. En caso de sospecha clínica fundada se debe
iniciar cuanto antes tratamiento con concentrados de factor VIII.
La mortalidad de los episodios hemorrágicos en el SNC en
los hemofílicos graves se aproxima al 30%. En la
última década se ha comprobado un mayor aumento de
estas complicaciones en hemofílicos con infección
por el HIV, en los que con frecuencia existe trombocitopenia
asociada.
Incidencia de la Hemofilia:
Afecta a 1 en 5.000 o 10.000 hombres en las diferentes
poblaciones.Un 80% de los casos de hemofilia presentan
antecedentes familiares; el 20% restante se debe a mutaciones
genéticas espontáneas. La herencia es de
tipo recesivo ligado al sexo por genes
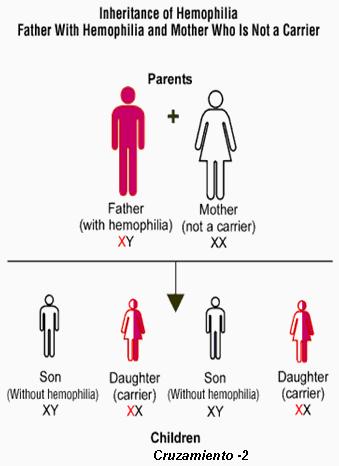
transmitidos por el cromosoma X materno. Por tanto, existe un 50%
de probabilidades de que una pareja de hombre sano y
mujer portadora
tengan un hijo varón enfermo o una hija portadora. De un
padre enfermo y una madre sana todas las hijas serán
portadoras y todos los hijos varones serán sanos. Los
varones no pueden transmitir la enfermedad, y las mujeres
portadoras no la padecen.

Diagnóstico:
La presencia de hemofilia puede sospecharse por una
historia
hemorrágica familiar de presentación exclusiva en
varones, por la existencia de una respuesta exagerada a
pequeños traumatismos o manipulaciones quirúrgicas
o por el hallazgo, en pruebas de
hemostasia sistemáticas, de una prolongación del
tiempo de
tromboplastina parcial activado (TTPA), acompañado de
tiempos de hemorragia y protrombina normales. El
diagnóstico definitivo se establece al comprobar el
descenso o la ausencia de la actividad procoagulante del factor
VIII plasmático
El análisis de los fragmentos de
restricción de longitud polimórfica (RFLP)
conseguidos tras la digestión del ADN asegura la
detección de portadoras de la enfermedad, así como
un correcto diagnóstico prenatal.
Diagnóstico prenatal:
Cada feto
varón de una madre portadora de hemofilia tiene un 50 % de
probabilidades de padecer la enfermedad. El diagnóstico
prenatal puede realizarse estudiando la sangre del feto
(varón) obtenida por fetoscopia hacia las 20-22 semanas
del embarazo (se
determinas de Von Willebrand y factor VIII). La biopsia
placentaria puede lograr el diagnóstico de la hemofilia en
los fetos con riesgo incluso a
las 10-12 semanas del embarazo.
Se puede estudiar ADN fetal en liquido amniótico
en hacia la 10-12 semana del embarazo.
Genética:
La hemofilia A es una enfermedad hereditaria de carácter recesivo que se transmite por el
cromosoma X. Se debe a mutaciones en el gen que codifica para el
factor VIII, el cual se localiza en el brazo largo del cromosoma
X (Xq28), tiene 26 exones y abarca 186 kb. El ARNm del gen del
factor VIII mide aproximadamente 9 kb, siendo la secuencia
codificante de 7.053 nucleótidos. La secuencia del ADNc
mostró que el factor VIII se sintetiza como una larga
molécula precursora de 2.332 aminoácidos. Existe
una isla CpG en el intrón 22 que se asocia a dos
tránscritos adicionales: uno de 1,8 kb que se produce en
abundancia en una gran variedad de células, y
está en orientación opuesta a la del gen del factor
VIII y no posee secuencias intrónicas; este ADNc de 1.739
nucleótidos se denomina gen A asociado al factor VIII
(F8A). El segundo tránscrito mide 2,5 kb y se transcribe
en la misma dirección que el factor VIII.
Después de un pequeño exón, que codifica
para seis aminoácidos, utiliza los exones 23 al 26 del gen
del factor VIII; este gen se denomina gen B asociado al factor
VIII (F8B). Los dos tránscritos, F8A y F8B, se originan a
122 bases uno del otro. La función de
estos tránscritos y sus productos
proteicos son desconocidos. Debemos manifestar también que
la hemofilia A se manifieste en varones, mientras que las mujeres
son portadoras de la enfermedad. Una vez que se aisló el
gen del factor VIII, y con la aplicación de metodología que analiza la secuencia del
ADN y ARN mensajero, se ha conseguido la tipificación y
caracterización genotípica del trastorno
genómico responsable de los enfermos afectos de hemofilia
A. La inversión del gen del FVIII en el
intrón 22 constituye la anomalía molecular
más frecuente en pacientes con hemofilia A grave, siendo
responsable de la enfermedad en el 45% de los casos. En un 5% se
han detectado alteraciones moleculares relacionadas a deleciones
e inversiones
del gen. Finalmente, aproximadamente el 50% de
hemofílicos
con afección grave y la práctica totalidad
de hemofílicos con diátesis hemorrágica
moderada o leve presentan mutaciones puntuales.
Tratamiento:
El tratamiento de elección en la hemofilia grave
es la utilización de preparados de factor VIII. Es
conveniente tener siempre presente que el tratamiento de los
episodios hemorrágicos debe iniciarse con la mayor
prontitud posible: en caso de duda se debe tratar, ya que una
dosis temprana de factor VIII puede acortar considerablemente el
tratamiento y limitar la lesión residual.
En los últimos 20 años se ha conseguido
disponer de una amplia gama de productos ricos en factor VIII
para el tratamiento de la hemofilia A. El crioprecipitado fue la
primera medida eficaz, aunque , al no sufrir procesos
fisicoquímicos de inactivación vírica,
mantiene su capacidad infectiva, de ahí que su uso se haya
visto desplazado por los concentrados plasmáticos
sometidos a procedimientos de inactivación
vírica.
Los concentrados plasmáticos de factor VIII
proceden de una mezcla de plasmas obtenidos en amplios colectivos
de donantes, que oscilan entre 15.000 y 30.000. Estos preparados
se han sometido a diferentes métodos de
inactivación vírica, por lo que disminuyen el
riesgo de transmisión de agentes infecciosos. Desde hace
unos años se dispone de un factor VIII obtenido por
técnica de recombinación genética,
con el que se consiguen unos resultados terapéuticos muy
satisfactorios, estando especialmente indicados en
hemofílicos que no han recibido tratamiento previo con
hemoderivados, así como en aquellos con datos
serológicos de hepatitis B, C y
VIH negativos.
Para establecer la dosis necesaria para un episodio
hemorrágico en un hemofílico grave deben tenerse en
cuenta al menos dos parámetros: el peso del paciente y la
dosis de factor VIII que se desea alcanzar
Además de la indicación de los
concentrados de factor VIII para prevenir o tratar las
complicaciones hemorrágicas inmediatas, desde hace
años se han desarrollado diferentes pautas de tratamiento
profiláctico, donde el autotratamiento domiciliario
constituye una parte básica.
Junto con el tratamiento sustitutivo es fundamental un
buen trabajo
rehabilitador de las articulaciones afectas, así como un
reforzamiento muscular articular, para una correcta profilaxis y
tratamiento de las complicaciones hemorrágicas.
Desde hace 20 años se utiliza con éxito
en el tratamiento de las formas moderadas y leves de la hemofilia
A un derivado sintético de la hormona
antidiurética, el DDAVP. Este fármaco, eficaz en el
tratamiento de la diabetes
insípida y que no dispone de efecto presor, cuando se
administra en dosis de 0,3 mg/kg por vía intravenosa o
subcutánea, o en dosis mayores por vía intranasal,
ha resultado efectivo en la profilaxis y el tratamiento de las
complicaciones hemorrágicas. Su acción
terapéutica se debe al aumento inmediato que induce en la
concentración del factor VIII. En las formas graves de
hemofilia el DDAVP no ejerce efecto terapéutico alguno.
Dado que este derivado de la vasopresina no ocasiona efectos
secundarios relevantes y evita el riesgo inherente al uso de
derivados sanguíneos, constituye el tratamiento de
elección en las formas moderadas y leves de hemofilia
A.
Los antifibrinolíticos se usan de forma
tradicional y con buen resultado en la profilaxis y el
tratamiento de ciertas complicaciones hemorrágicas,
especialmente en extracciones dentarias y gingivorragias. La
dosis recomendada para el ácido transexámico es de
0,25 mg/kg, 3 o 4 veces al día. La dosis de EACA en el
adulto es de 4 g, 4-6 veces al día. El uso de
antifibrinolíticos en hemofílicos con hematuria
está contraindicado. Finalmente, la hemofilia, como
trastorno genético del que es responsable un único
gen, puede beneficiarse en un futuro de la terapia
genética, de la que ya se dispone de los primeros
resultados experimentales.
Un aspecto importante de la asistencia del niño
hemofílico es evitar los traumatismos. Cuando el
niño es pequeño hay que almohadillar la cuna y su
zona de juegos y
cuando está aprendiendo a andar hay que vigilarlo
estrechamente. Cuando ya es mayor, hay que fomentar la actividad
física que
no entrañe riesgo de traumatismos. Es importante mantener
una actitud
intermedia entre una protección excesiva y una
permisividad peligrosa. La aspirina y otros fármacos que
alteran la función plaquetaria pueden provocar hemorragias
y deben prohibirse a los enfermos hemofílicos. Como a lo
largo de la vida los niños
con hemofilia grave han de ponerse en contacto con los
hemoderivados repetidas veces, deben ser inmunizados contra el
virus de la
hepatitis B.
Complicaciones
del tratamiento:
La
administración repetida de hemoderivados tiene el
riesgo potencial de inducir la aparición de diferentes
complicaciones. Las de carácter infeccioso han sido hasta
hace poco las más importantes, pero junto a ellas los
hemofílicos pueden desarrollar un inhibidor contra el
factor VIII. También se ha sugerido que las
administraciones repetidas de proteínas
presentes en los concentrados plasmáticos pueden generar
un estado de
inmunodepresión. Por último, la administración de concentrados
plasmáticos puede producir, aunque raras veces, reacciones
inmunoalérgicas de intensidad variable, desde
aparición de eritemas dérmicos hasta
hipotensión grave.
Complicaciones infecciosas:
A finales de los años setenta el 90% de la
población hemofílica tratada había tenido
contacto con el virus de la hepatitis B, y se supone que el 100%
se halla infectado con los virus conocidos como no-A no-B.
Estudios de muestras almacenadas indican que el 60-80% de los
pacientes en la citada época presentaban
seroconversión frente al virus de la hepatitis C. Como
secuela, un número no despreciable de dichos
hemofílicos son portadores crónicos de hepatitis B
y/o C, lo que les predispone al desarrollo de
una hepatopatía crónica o un hepatocarcinoma. La
hepatitis A puede ser transmitida por hemoderivados sometidos a
un proceso de
inactivación vírica ineficaz para los virus sin
envoltura lipídica. Aunque los nuevos preparados de factor
VIII han disminuido el riesgo infectivo para los virus de la
hepatitis, en todo hemofílico que aún no ha
recibido tratamiento está indicada la vacunación
para las hepatitis A y B.
En el inicio de la década de los años 1980
se detectaron los primeros individuos hemofílicos con un
trastorno inmunológico importante, a los que se
identificó como portadores del HIV. En España
más de la mitad del censo de la población
hemofílica ha presentado seroconversión para este
virus. Por fortuna, todos los nuevos concentrados de factor VIII
disponibles han desterrado definitivamente el peligro de
contagio.
Aunque el avance conseguido en la lucha por erradicar
las complicaciones infecciosas transmitidas a través de la
administración de concentrados
plasmáticos de factor VIII ha sido muy importante,
aún persisten algunos problemas sin resolver,
especialmente la infección por virus de la hepatitis C y
otros virus no encapsulados como el parvovirus B19 y el de la
hepatitis A. No existen datos epidemiológicos que
demuestren que los hemoderivados pueden transmitir priones con
capacidad neurodegenerativa.
Inhibidores
El 20-30% de los hemofílicos tratados
desarrollan un inhibidor contra el factor VIII. La
aparición de este inhibidor no guarda relación con
el tipo de lesión genética. Así, ni grandes
deleciones del gen del factor VIII ni mutaciones puntuales se han
podido relacionar con la aparición o el título del
inhibidor. Los inhibidores se han clasificado en dos tipos: de
baja o alta respuesta. Los primeros son aquellos que, pese a
estímulos antigénicos repetidos (transfusiones de
factor VIII), no exceden un título de 15-20 unidades
Bethesda (UB). Por el contrario, los de alta respuesta sobrepasan
las 100 UB.
La detección de un inhibidor circulante puede
complicar notablemente el tratamiento de estos enfermos. En esta
situación se han utilizado pautas terapéuticas muy
variadas, incluyendo factor VIII de origen porcino y altas dosis
de inmunoglobulinas. Hay que señalar que el uso de altas
dosis de concentrado de factor VIII humano sólo puede ser
útil en el tratamiento de los pacientes con inhibidores de
bajo título. Recientemente, se ha comprobado una gran
eficacia
terapeútica del factor VII activado conseguido por
recombinación genética. Ello hace que este
preparado se haya convertido en el tratamiento de elección
de las complicaciones hemorrágicas en enfermos con alto
título de inhibidor.
Los diferentes protocolos que
persiguen facilitar la inmunodepresión se basan en la
administración prolongada de factor VIII junto con
fármacos inmunodepresores. Con estas estrategias se
consiguen reducciones notables o la desaparición de los
títulos altos de inhibidor. También se dispone de
preparados hemostásicos eficaces que sobrepasan la
existencia del efecto inhibidor del factor VIII en el
plasma.
CONCLUSIONES
A manera de conclusión podemos manifestar que el
tratamiento de la hemofilia A implica la administración
intravenosa del factor VIII, en la actualidad derivado del plasma
humano. Sin embargo, el tratamiento de la sustitución no
es solo una bendición sin inconvenientes. Hasta mediados
de la década de 1980, antes de la instauración de
la detección sistemática de anticuerpos contra el
VIH en los hemoderivados, miles de hemofílicos recibieron
concentrados de factor VIII que contenía VIH y muchos
desarrollaron el SIDA. Con las
actuales prácticas de bancos de sangre,
el riesgo de transmisión de VIH ha desaparecido
prácticamente, pero sigue existiendo la amenaza de
infecciones no detectadas. Al final, la única fuente
segura del factor VIII derivará del gen de factor VIII
clonado. En la actualidad están en marcha ensayos
clínicos de tratamiento de sustitución con factor
VIII recombinante. También se están haciendo
esfuerzos para lograr un tratamiento de la hemofilia con terapia
génica somática en vistas de erradicar
completamente la incidencia de ésta enfermedad. Cada
año, países de todo el mundo se unen a la FMH a fin
de celebrar el Día mundial de la hemofilia, el 17 de
abril. El objetivo
común para este día es incrementar la conciencia sobre
la hemofilia y reafirmar nuestro compromiso de mejorar la
atención.
BIBLIOGRAFÍA
- Federación Mundial de Hemofilia(
) - Federación Mundial de Hemofilia
(www.hemofilia.com) - Manual Merck 10 Edición
- Temas de Medicina
Interna Reinaldo Roca Goderich 4 Edición - Tratado de Medicina Interna Farreras Rozman 14
Edición - Enciclopedia Encarta 2006
- Tratado de Anatomía
Patológica Stanley L. Robbins 5
Edición
ANEXOS

Imágenes
de la Reina Victoria de Inglaterra la
cuál transmitió la hemofilia a sus hijas y
éstas transmitieron la enfermedad a las casas reales
española y rusa.

La Reina Victoria
I

Victoria I y sus
descendientes

Árbol
Genealógico de la Reina Victoria de
Inglaterra

Paciente
hemofílico
Integrantes:
Ariel Osvaldo Castañeda
Rodríguez
Reysel Ariam Vázquez
Gómez
Rosmik Hernández Chávez
Yaima Murillo Cabrera
Herenia Almaguer Hernández
Trabajo de Genética
Instituto Superior de Ciencias
Médicas Carlos J .Finlay
Año 2007
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
