Yacimientos de arsénico en
España
Zona sur de la Comunidad de
Castilla y León, donde sale debido a la disolución
de las rocas con las
fuentes de los
ríos.
En forma de manchas y capas sobre la calcita
romboédrica de Pola de Lena y Mieres
(Asturias).
También existen indicios en Ripoll
(Gerona).
Con baritina, en Hiendelaencina
(Guadalajara).
En forma de nódulos esferoidales con plata nativa
se encontró en Guadalcanal (Sevilla).
Mezclado con plata arsenical en Cazorla (Jaén) y
en Villanueva de Córdoba.
Propiedades químicas del
arsénico
Símbolo | As | |
Clasificación | ||
Número | 33 | |
Números de | -3, 0, +3, +5 | |
Isótopos | 1 isótopo natural | 75As |
32 inestables | cuya vida media oscila entre | |
Tabla 1: Caracterización química del
arsénico
El arsénico existe en cuatro estados de
oxidación: –3, 0, +3 y +5.
Compuesto | Fórmula | Punto de | Punto de | Densidad | Solubilidad en el |
Arsénico | As | 613 | — | 5,73 a 14ºC | insoluble |
Trióxido de | As2O3 | 312,3 | 465 | 3,74 | 37 a 20 °C |
Pentóxido de | As2O5 | 315 | — | 4,32 | 1500 a 16°C |
Sulfuro de | As2S3 | 300* | 300* | 3,43 | 5×10-4 |
Ácido | (CH3)2AsO(OH) | 200 | — | — | 829 a 22 °C |
Hidrogenorseniato de | PbHAsO4 | 720 | — | 5,79 | poco soluble |
Dihidrogenoarseniato de | KH2AsO4 | 288 | — | 287 | 190 a 16 °C |
Arseniato de | K3AsO4 | — | — | — | Soluble |
Tabla 2: propiedades físicas y
químicas de algunos compuestos de
arsénico
Comportamiento ambiental dEl
arsénico en el agua
En el agua (aguas
superficiales y subterráneas) el arsénico
comúnmente se encuentra en estado de
oxidación +5 (arseniato) y +3 (arsenito).
En aguas superficiales con alto contenido de oxígeno, la especie predominante es el
arsénico pentavalente o arseniato (As+5).
Bajo condiciones de reducción, generalmente en los
sedimentos de los lagos o aguas subterráneas, predomina el
arsénico trivalente o arsenito
(As+3).
El arsenito se encuentra en solución como
H3AsO3,
H2AsO3-,
H2AsO4- y
H2AsO4-2 en aguas naturales con
pH entre 5 a
9.
El arseniato se encuentra en forma estable en aguas con
altos niveles de oxígeno como H3AsO4
en un rango de pH de 2 a 13. La conversión de
As+3 a As+5 o viceversa es bastante lento.
Los compuestos reducidos de As+3 pueden encontrarse en
medios
oxidados y los compuestos oxidados de As+5 en medios
reducidos.
Los microbios, plantas y
animales
pueden convertir todo estos compuestos químicos de
arsénico inorgánico en compuestos
orgánicos (comprometiendo átomos de carbono e
hidrógeno).
Las condiciones que favorecen la oxidación
química y biológica del arsénico inducen el
cambio a
especies pentavalentes y, a la inversa, aquellas que favorecen la
reducción cambiar疣 el equilibro al estado
trivalente.
Transporte de arsénico en
el agua
La condición esencial para que exista una alta
concentración de arsénico en las aguas
subterránea es que este no se haya perdido por flujo o
dilución, lo que dependerá del régimen
hidrogeológico y paleohidrogeológico del
acuífero.
El tiempo que
tarda el arsénico en aguas subterráneas en perderse
por flujo depende de varios factores, siendo un factor
crítico el tiempo de residencia del agua en el
acuífero: a menor tiempo de residencia, mayor tasa de
renovación, y por tanto mayor tasa de pérdida de
arsénico por flujo. La consecuencia directa es que, en
general, en acuíferos profundos y "antiguos" será
mucho más difícil encontrar altas concentraciones
de arsénico, requiriéndose en estos casos flujos
muy lentos.
Desde el punto de vista geoquímico, el
transporte de
arsénico en el agua está condicionado por la
adsorción, ya que ésta produce un retardo en el
transporte del arsénico en comparación con el
propio flujo del agua. En el caso más sencillo de una
isoterma de adsorción lineal, la relación es
directa, y esa diferencia viene definida por el coeficiente de
reparto, Kd. Sin embargo en una isoterma no lineal, el
valor de
Kd varía con la concentración y depende de
la forma de la isoterma. Por lo general, el valor de Kd
decrece con el incremento de la concentración. Por
tanto, en altas concentraciones, el transporte de arsénico
en el agua es más efectivo, pero en contrapartida hay
más disponibilidad de arsénico. La consecuencia de
ello, es que es muy difícil que el arsénico sea
completamente extraído de los acuíferos con el
flujo del agua, bien a causa de que es adsorbido, bien a causa de
que se halla en concentraciones altas.
Puesto que el arsenito y el arseniato tienen
diferentes isotermas de adsorción, serán
transportados en el agua con diferente velocidad. Algunos
experimentos
han demostrado que en condiciones oxidantes y ligeramente
ácidas, As(III) se mueve 5 ó 6 veces más
rápido que As(V), y que este último se
moverá más rápidamente en condiciones
neutras (aunque siempre más lento que As(III)); mientras
que en condiciones reductoras y alcalinas, tanto As(III) como
As(V) se mueven rápidamente.
Los valores
más altos de Kd corresponden a oxihidróxidos
de Fe, aunque son valores muy
variables que
dependen de la cantidad de óxidos y oxihidróxidos
activos en el
medio, la especiación de arsénico, la
concentración de arsénico, el pH, y la
concentración de aniones competidores.
En cuestión relativa a la atribución de la
existencia de arsénico en las aguas resulta muy
difícil establecer dicha presencia únicamente
partiendo de las concentraciones de arsénico en los
sedimentos.
La estructura
molecular de arseniatos y arsenitos
Los arseniatos tienen mayor capacidad de
ionización debido a la presencia del doble enlace. La
molécula que al perder el protón por la
disociación, queda con carga negativa formando varios
aniones según las ecuaciones:
pKs= 2,2 pKs= 6,94
pKs= 11,5
H3AsO4 H2AsO
– + H+ HAsO4 – 2 +
H+AsO4- 3 +
H+
En aguas con altos niveles de oxígeno, el
As+5 (como H3AsO4) se vuelve
estable, existiendo las especies antes mencionadas, en un rango
de pH de entre 2 a 13.
pH | 0 – 9 | 10 – 12 | 13 | 14 |
As+ 3 | H3AsO3 | H2AsO3- | H3AsO3 – | AsO3– |
pH | 0 – 2 | 3 – 6 | 7 – 11 | 12 – 14 |
As+ 5 | H3AsO4 | H2AsO4 | H3AsO4- | AsO4- |
Tabla 3: predominio de las especies de
arsénico en relación a los rangos de pH en el medio
acuático
Como resultado de la disociación del ácido
arsenioso característico en aguas subterráneas con
pH mayor de 7, el arsénico se puede presentar en alguna de
las siguientes formas:
pKs= 9,2 pKs= 14,22
pKs= 19,22
H3AsO3
H2AsO3 – + H+
HAsO3 – 2 + H+ AsO3
– 3 + H+
Bajo condiciones anaeróbicas, a pH por encima de
7 el arsénico se estabiliza en especies dominantes no
iónicas.
Los arseniatos y arsenitos se disocian a un pH muy
diferente. En un rango de pH entre 6,5 y 8,5
característico del agua natural, las formas predominantes
de arseniato y arsenitos son:
H2AsO4-; HAsO4-
2; y H2AsO3-.
La principal vía de dispersión del
arsénico en el ambiente es el
agua. Aún si se considera la sedimentación, la
solubilidad de los arseniatos y arsenitos es suficiente para que
este elemento se transporte en los sistemas
acuáticos. La concentración del arsénico en
aguas naturales frescas es muy variable y probablemente depende
de las formas de arsénico en el suelo
local.
Procedencia del arsénico en el
agua
Según diversos estudios realizados en Estados Unidos
(acuíferos detríticos en Wisconsin) una de las
fuentes naturales de arsénico en las aguas
subterráneas puede tener relación con ambientes
geoquímicos que presentan pirita y arsenopirita entre sus
constituyentes minerales y
medios reductores. En este tipo de ambiente el arsénico
inorgánico se moviliza en forma de trióxido de
diarsénico (As2O3).
Un estudio hidrogeológico también apunta
hacia un origen similar la procedencia del arsénico en
numerosas localidades castellano-leonesas: una vez que las capas de
pirita de los pozos subterráneas se ponen en contacto con
el oxígeno y, al impulsar el agua desde el interior del
pozo, se solubiliza el arsénico.
Las grandes presiones y temperaturas a que quedan
sometidas las aguas subterráneas profundas pueden originar
un medio reductor con incorporación del arsénico al
agua subterránea.
La presencia de arsénico en las aguas
subterráneas también se puede explicar como
resultado de la utilización de
productos relacionados con
actividades agrícolas, la jardinería y limpieza de
malezas, como son los fungicidas, insecticidas y
plaguicidas en general. Muchos de ellos tienen arsénico
como compuesto tóxico, por que su utilización
está indicada para erradicar plagas diversas.
Toxicidad
Las principales rutas de exposición
de las personas al arsénico son la ingesta e
inhalación. El arsénico es
acumulable en el organismo por exposición crítica
y superados ciertos niveles de concentración.
La toxicidad del arsénico depende
de:
1) El estado de oxidación.
2) La estructura química del compuesto a
estudiar.
3) La solubilidad en el medio
biológico.
La escala de
toxicidad del arsénico decrece en el siguiente
orden:
Arsina (H3As) > As+3
inorgánico >
As+ 3 orgánico > As+5
inorgánico >
As+5 orgánico > compuestos arsenicales y
arsénico elemental
La toxicidad por arsénico puede ocurrir en dos
formas: toxicidad aguda y toxicidad crítica. La toxicidad
aguda es la consecuencia de la ingesta de alto contenido de
arsénico en un tiempo corto y la toxicidad crítica
es el resultado de la ingesta de pequeñas cantidades de
arsénico en un largo periodo de tiempo.
La toxicidad aguda de compuestos de
arsénico en el ser humano es función de
la capacidad de asimilación del cuerpo humano.
La arsina es considerada la forma más tóxica,
seguida del arsenito, de arseniatos y los compuestos
orgánicos de arsénico. La dosis letal para
adultos se encuentra en el rango de 1-4 mg /kg del peso corporal
(trióxido de diarsénico). La toxicidad del arsenito
es 10 veces superior a la del arseniato.
La DL50 de trióxido de arsénico
(As2O3) es de 2 a 3 microgramos por kilo de
peso corporal, aunque en ocasiones cantidades considerablemente
mayores no han causado la muerte
debido a su expulsión inmediata por medio de
vómitos
originados por la gran irritación
gástrica.
Las combinaciones orgánicas liberan lentamente el
tóxico y no producen, en general, intoxicaciones
agudas, salvo casos especiales. La inhalación de arsenina
causa la muerte en
pocos minutos si se encuentra en cantidad de 5 mg/m3 de aire. La
concentración mínima permitida de este compuesto en
un ambiente industrial es de 0,05 ppm. En los alimentos se
puede admitir hasta 3,5 ppm. En el tabaco se ha
encontrado hasta 13 ppm, provenientes de los plaguicidas usados
en la planta de tabaco.
En el organismo humano el arsénico elemental
ingestado se absorbe lentamente pero luego es eliminado por
vía urinaria, heces, sudor y epitelio de la piel. El
riñón elimina rápida y completamente el
As+5 y arsénico orgánico, en cambio el
tracto intestinal absorbe velozmente los compuestos solubles de
arsénico. El tiempo de vida media del arsénico
inorgánico en el ser humano es de 2 a 40
días.
Algunos estudios de toxicidad del arsénico
indican que muchas de las normas actuales
basadas en las guías de la OMS son muy altas, y plantean
la necesidad de reevaluar los valores límites
basándose en estudios epidemiológicos
aumentarse dichos valores de acuerdo a las condiciones
regionales. En América
Latina ha podido apreciarse que a niveles similares de
arsénico en diferentes condiciones (climatológicas,
nutricionales y otras) el nivel de afectación es
diferente.
La OMS en las Guías de Calidad para el
Agua Potable
(1993) reduce el valor guía de arsénico en agua de
50 µg/ l a un valor provisional de 10 µg/ l,
basándose en un estudio realizado por el Foro de Evaluación
de Riesgo de la
Agencia de Protección Ambiental de los Estados Unidos
(EPA) en 1986 sobre evaluación de riesgo. La EPA estima el
riesgo de contraer cáncer de piel a partir de un
importante estudio epidemiológico realizado en
Taiwán donde se observaron más de 40.000
personas que consuman agua proveniente de pozos artesianos con
altos contenidos de arsénico, en un rango de 10 a 1820
µg/l, estando los valores más frecuentes entre 400 a
600 µg/ l.
La EPA clasifica al arsénico como cancerígeno en el grupo A debido
a la evidencia de sus efectos adversos sobre la salud. La exposición
a 0,05 mg/l puede causar 31,33 casos de cáncer de piel por
cada 1.000 habitantes. Ha considerado bajar el límite
mínimo de aceptación de 0,050 mg/l, a 0,010-0,020
mg/l.
El Centro Internacional de Investigaciones
sobre cáncer ha clasificado al arsénico en el grupo
I porque tienen pruebas
suficientes de la carcinogenicidad para seres humanos.
En los últimos años se advierte una
tendencia general en países industrializados a reducir los
límites mínimos permitidos de arsénico en
agua de bebida.
Intoxicación por ingestión de agua
contaminada por arsénico
Entre los efectos tóxicos por consumo de
agua con altos contenidos de arsénico pueden
mencionarse: hiperpigmentación, hiperqueratosis,
enfermedad del Black Foot (escoriaciones oscuras en los pies)
gangrena y cáncer de piel, cirrosis, problemas de
readsorción renal, inhibición de la síntesis
de la porfirina, afectación a los glóbulos blancos,
abortos espontáneos, neuropatía periférica,
parálisis, pérdida de la audición,
inhibición de algunas enzimas,
inhibición de la fosforilación oxidativa, que es el
principal método de
obtención de energía en la respiración aerobia, y de la
reparación del ADN, daños
al intestino.
Existen numerosos casos, ya desde los años 70,
que delatan los efectos tóxicos de una exposición
prolongada al arsénico. Notables son los casos de (1978) y
del Oeste de Bengala en los que un millón de pozos se
vieron contaminados con arsénico y más de 200.000
personas se vieron afectadas, e incluso murieron por
cáncer. También en China,
Taiwán, Pakistán y en varios países de
América
Latina por lo menos cuatro millones de personas beben en forma
permanente agua con niveles de arsénico que ponen en
riesgo su salud (por encima de 1 mg/l).
En India existen
alrededor de 6 millones de personas expuestas al arsénico,
de las cuales más de 2 millones son niños.
En Estados Unidos más de 350.000 personas beben agua cuyo
contenido es mayor que 0,5 mg/l de arsénico, y más
de 2,5 millones de personas está siendo abastecidas con
agua contaminada por arsénico en concentraciones mayores a
0,025 mg/l, especialmente aquellos que se abastecen de pozos
privados no analizados por la EPA.
La ingestión permanente de aguas contaminadas por
sales de arsénico origina el llamado
"hidroarsenicismo crítico regional
endémico" (HACRE), muy frecuente en numerosas
regiones del planeta.
En Argentina los habitantes de algunas provincias
padecen una enfermedad conocida como HACRE (hidroarsenicismo
crítico regional endémico) debido a la
ingestión permanente de agua contaminada por
arsénico, lo cual produce lesiones dermatológicas.
El arsénico de estas aguas tiene un origen
natural.
Se asocia el origen de esta enfermedad con el consumo de
agua con altas concentraciones en arsénico a lo que se une
el excesivo calor de estas
zonas. Estos dos factores hacen que los adultos de estas regiones
contraigan lesiones irreversibles que les incapacitan para
el trabajo,
incluso, ocasionalmente, les puede provocar la muerte. Los
primeros síntomas suelen aparecer entre la pubertad y la
edad adulta, aunque puede aparecer en edad
escolar.
El curso de la enfermedad puede ser dividido en 4
etapas, que pueden sucederse unas a otras o bien
superponerse:
1) Periodo hiperhidrótico: las palmas y
plantas presentan una descamación furfurácea
acompañada de prurito, disestesias y sudor, con el mismo
aspecto de una dishidrosis inespecífica.
2) Periodo hiperqueratósico:
engrosamientos epidérmicos difusos, en las mismas zonas
palmoplantares (callosidades difusas, globos córneos
circunscriptos, raras veces cuernos epiteliales y otras
deformaciones intercaladas por zonas de piel que suele fisurarse
y ulcerarse, y a su vez infectarse) con intenso dolor.
Dificultades para realizar tareas manuales e
incluso para caminar. El pelo se vuelve ralo y
quebradizo.
3) Periodo melanodérmico: aparecen manchas
que comienzan en el tronco y se extienden sin afectar las
mucosas. Este trastorno puede no aparecer en el curso de la
enfermedad.
4) Periodo final: algunas de las lesiones
ulceradas de la piel terminan por transformarse en carcinomas
(cáncer de Hutchinson). Es uno de los pocos
cánceres con etiología conocida. Otros enfermos
sufren cambios degenerativos e inflamatorios crónicos:
hepatosis, nefrosclerosis, polineuritis con sus secuelas,
cardiopatías y consunción general,
exponiéndose a que cualquier proceso
intercurrente produzca la muerte.
Tecnologías para la
eliminación del
arsénico
Se han propuestos numerosas métodos
para reducir el arsénico del agua, tanto el de origen
natural como el de origen antrópico. No obstante, la
inmensa mayoría suponen un alto coste a la vez que un
complicado uso y mantenimiento.
Los tratamientos desarrollados describen diversos
mecanismos mediante los cuales puede removerse el
arsénico, entre ellos cuando se combinan sus iones con
metales como
el hierro, el
aluminio,
principalmente, o el itrio y el lantano. Estos metales pueden
adsorber el arsénico ya que precipitan masivamente en
forma de hidróxidos.
Existen diferentes métodos de tratamiento para
reducir el arsénico presente en el agua y alcanzar los
niveles de los valores guía de agua para consumo
humano.
Debido a que el As+5 es más
fácil de remover que el As+3, el tratamiento se
inicia con la oxidación del As+3 a
As+5. Los oxidantes utilizados son: cloro, hipoclorito
de calcio y permanganato de potasio.
Técnicas de remoción de
arsénico
Es un proceso de tratamiento por el cual las cargas
eléctricas de las sustancias coloidales disueltas o
suspendidas son neutralizadas con la adición de sustancias
insolubles en el agua, lo que permite la formación de
partículas mayores o aglomerados que pueden ser eliminadas
por sedimentación o filtración.
El tipo y la dosis del coagulante y el pH influyen en la
eficiencia del
proceso. El rendimiento del sulfato de aluminio es ligeramente
menor que el del sulfato férrico. A un pH de 7,6 o menor,
ambos coagulantes tienen la misma eficiencia de remoción,
sin embargo el sulfato férrico remueve mejor a un pH menor
de 7,6. Se determina que a dosis mayores de 20 mg/l de cloruro
férrico ・40 mg/l de sulfato de aluminio se
alcanza una remoción de As+5 de más del
90 %. A bajas dosis de coagulantes la remoción de
As+5 es menor.
Es un tipo de intercambio iónico, donde los iones
presentes en el agua son adsorbidas por la superficie oxidada del
óxido de aluminio.
Es altamente selectiva para remover el
As+5 y efectiva para tratar agua con alto contenido de
sólidos disueltos totales. En la superficie de
adsorción de la alúmina
activada pueden interferir el selenio, fluoruro, cloruro y
sulfato. Este método tiene alta remoción de
arsénico a pH 8,2.
La alúmina activada adsorbe preferentemente
H2AsO4- (As+5)
más que H3AsO3 (As+3)
además de otros iones competitivos, entre los que destacan
los iones hidroxilo que es más competitivo que
H2AsO4-.
Los factores que afectan la remoción de
arsénico son pH, estado de oxidación del
arsénico, los iones competitivos, tiempo de contacto y
regenerante.
Es un proceso para eliminar las sustancias disueltas
presentes en el agua, forzando la circulación del agua por
una membrana semipermeable bajo una presión
superior a la osmótica.
Tiene una eficiencia de más de 95 % de
remoción de arsénico disuelto. Este método
es efectivo para remover arsénico de aguas
subterráneas. El rendimiento del proceso con
ósmosis inversa es afectado principalmente por la
turbiedad, hierro, manganeso y sílice.
Es un proceso físico y químico, en el cual
los iones de una especie dada son desplazados de un material
insoluble de intercambio (resina) por otros iones que se
encuentran en solución.
Remueve efectivamente el arsénico en el rango de
pH entre 8 y 9. No obstante, el selenio, fluoruro, nitrato y
sólidos disueltos totales compiten con el arsénico
y afectan la duración del proceso. Las consideraciones que
se tiene en este proceso comprende el pH, iones competitivos,
tipo de resina, alcalinidad, concentración de
arsénico en el afluente, disposición de la resina y
los regenerantes usados, efectos secundarios de la calidad del
agua y los parámetros de diseño
de la operación.
La resina básica de intercambio iónico
adsorbe los iones con la siguiente preferencia:
HCrO4->
CrO42- >ClO4-
>SeO42- > SO42-
>NO3-> Br->
(HPO42-, HAsO42-,
SeO32-,
CO32-)>CN->NO2-
> Cl- >
(H2PO42-,
H2AsO4-,
HCO3-)> OH->
CH3COO->F-
Observamos que el anión hidrógeno
arseniato es más competitivo que el dihidrógeno
arseniato.
Es un proceso de separación líquida
mediante membranas operadas bajo presión que permite el
paso de solventes y sales monovalentes, iones metálicos y
pequeñas moléculas orgánicas de peso
molecular en el rango de 200 a 1000.
Se puede remover el As+5 y el As+3
disueltos en el agua. Con este método se alcanza hasta una
remoción de 90% de arsénico disuelto en aguas
subterráneas. Este proceso no es tan apropiado para tratar
aguas superficiales debido al extensivo pretratamiento que se
requiere para remover partículas sólidas o
coloidales del agua. La remoción depende de los
parámetros de operación, propiedades de la membrana
y el estado de
oxidación del arsénico.
Es un método usado para remover la dureza del
agua y consiste en adicionar cal (Ca(OH)2) al
agua.
Este método es efectivo para remover
As+3 ・As+5 y la eficiencia de la
remoción está en función del pH. Este
método tiene un alto rendimiento para remover
concentraciones de arsénico de 50 mg/L; sin embargo para
reducir a 1mg/l se necesita de un tratamiento secundario. La
remoción de As+5 es mayor al 90 % a un pH de
10.5 o más, siendo el pH último de operación
mayor que 10.5. Por debajo del rango del pH último la
remoción disminuye a menos del 20%. En el sistema de
ablandamiento con cal se produce una considerable cantidad de
lodo.
En la selección
del método se considera la concentración del
arsénico y otros contaminantes presentes en el agua por
las interferencias que causan en el tratamiento. Otros factores a
tener en consideración son la disposición de los
regenerantes y de la alúmina usada.
En las áreas rurales se están
desarrollando sistemas de tratamiento del arsénico usando
arcillas naturales y activadas seguidos de filtración.
Como oxidante se usa el hipoclorito de calcio. Con esta
técnica se logra una remoción de arsénico de
más del 95%.
Es importante tener en cuenta el manejo de los residuos
generados en el tratamiento de aguas contaminadas por
arsénico, es decir, los lodos ya que éstos
también van a presentar altos niveles de
arsénico.
En las plantas de tratamiento de agua el As+
5 puede ser removido en forma efectiva por
coagulación con sulfato de Al o Fe y por los procesos de
ablandamiento con cal y soda. Los coagulantes señalados se
hidrolizan formando hidróxidos, sobre los cuales el
As+ 5 se adsorbe y coprecipita con otros iones
metálicos. De acuerdo con la literatura, aguas naturales
con gran cantidad de coloides requieren de altas concentraciones
de coagulantes para lograr eficiencias de remoción
semejantes a las seladas en la siguiente tabla:
Coagulante | Arseniato( As+ | Arsenito (As+ |
Remoción (%) pH | Remoción (%) pH | |
Sulfato férrico | 100 < 9,0 | 20 < 9,0 |
Sulfato de | 90 < 7,0 | 50 < 7,0 |
Tabla 4: Eficiencia de coagulantes en la
remoción de arsénico
La remoción de arsénico con procesos
convencionales de coagulación con sales de Al y Fe y
ablandamiento con soda dependen del pH del agua tratada, del tipo
y dosis de coagulante así como de la concentración
inicial de este elemento.
Cuando la concentración de arsénico en el
agua cruda es superior a 1,0 mg/l, la remoción de
arsénico disminuye a medida que aumenta la
concentración inicial, particularmente, si se usa sulfato
de aluminio. La coagulación con sulfato de aluminio o
cloruro férrico no remueve en forma tan eficiente el
As+ 3 como en el caso del As+ 5. El primero
requiere de oxidación preliminar para ser removido por
coagulación convencional y/ o ablandamiento con cal y/o
soda.
Con la precloración se obtiene una
remoción del As+3 similar a aquella alcanzada
para el As+ 5 con el mismo tratamiento. Esto se debe a
que las constantes de disociación del As+ 5 son
menores que las del As+ 3 y por lo tanto su
disociación es mayor. Esto es consecuencia de la mayor
eficiencia de remoción del arseniato frente a la del
arsenito, lo que a su vez justifica la oxidación del agua
subterránea antes del tratamiento.
H3AsO3 + H2O +[ |
H3AsO3 + H2O + [ |
Tabla 5: reacciones de oxidación
de arsenito a arseniato
Después de la oxidación, el As+
5 se debe adsorber en los llamados flocs formados
por la coagulación de los coloides presentes en la masa de
agua por acción
del hidróxido de aluminio o del hierro. Probablemente la
adsorción se produzca más por un efecto
físico que químico, debido a las fuerzas de
atracción superficiales que posibilitan el
proceso.
Probablemente los mecanismos que rigen la
remoción del arsénico por las arcillas y/o
hidróxidos metálicos dependan de interacciones
moleculares del sistema arsénico/ agua/ hidróxido-
arcilla, donde se establecen enlaces que permiten que las
superficies activas complejen al arsénico presente en el
agua, por reacciones
químicas intermoleculares entre el arsénico y
la superficie activa, y entre el arsénico y el
agua.
Para favorecer la adsorción se debe asegurar el
mayor contacto posible entre las dos fases, por ello resulta de
fundamental importancia las reacciones entre el arsénico y
la superficie, mediante enlaces coordinados formados por
hidrólisis, complejación superficial, intercambio
de ligantes y puentes de hidrógeno.
También son de importancia las interacciones
eléctricas en la superficie (electrostática y de polarización) y
las interacciones del arsénico con el agua (dependientes
del pH y pE del medio).
La desorción del arsénico adsorbido
en la fase sólida está condicionada por los cambios
en pH, la ocurrencia de reacciones redox
(reducción/oxidación), la presencia de iones
competitivos, y los cambios en la estructura cristalina de la
fase sólida.
Las reacciones de
precipitación-disolución están controladas
por la fisicoquímica de la solución,
fundamentalmente pH, temperatura,
estado redox y concentración de especies
acuosas.
Probable mecanismo de
remoción por adsorción a través de la
superficie del complejo
arcilla-hidróxido
a) En un sistema acuoso, la
superficie del floc arcillas-hidróxidos puede
presentar grupos producto de la
coordinación de los iones metálicos
con el agua. Estos grupos pueden ganar protones del agua,
confiriendo a la superficie carga positiva, o perder protones,
dando como resultado superficies con carga negativa. Los iones
que determinan el potencial de la superficie de los óxidos
hidratados no polarizables son el ion hidronio,
H3O+ y el ion hidroxilo
OH-.
En la superficie de floc se puede presentar
cambios en su grupo estructural OH-, por la
reacción con los arseniatos o ligantes disueltos,
exhibiendo propiedades de ácido fuerte. El intercambio de
ligantes puede involucrar cambios en la superficie de los
flocs de arcilla-hidróxidos de hierro o aluminio,
OH-, como en las reacciones:
La adsorción de los arseniatos en el sistema
arcilla-hidróxido, va a depender de la densidad de
grupos OH- y su selectividad con respecto a otros
aniones del agua.
Otra forma posible de remoción del
arsénico del agua es la adsorción de los
arseniatos del mismo conjunto o a través de iones de otros
elementos disueltos que producen complejos superficiales
ternarios donde el catión metálico adsorbido no
coordina completamente los ligantes superficiales y se completa
con otros ligantes (IL) disueltos en el agua.
En este caso el catión funciona como "puente"
entre la superficie y el ligante S-OM-L, el cual
produciría la adsorción del arseniato al ligante
donde el ligante L, es directamente adsorbido al centro de
coordinación S, y el catión completa la
coordinación superficial. Este tipo de complejos se forma
con ligantes L polidentados que forman un "puente" entre la
superficie y el catión S y sobre este se adsorbería
el arseniato por acción electrostática.
La carga superficial resultante y el pH son factores
determinantes en la adsorción posterior y en las
interacciones arcilla-hidróxido/arseniatos,
respectivamente. Debido a las transformaciones químicas
superficiales en los sorbentes, ésta puede cambiar sus
propiedades y su capacidad de remoción del arsénico
en los medios seleccionados.
b) Lo que habrá que evaluar es la
reacción de quimisorción entre la arcilla con carga
negativa y la superficie arcilla-hidróxido con hidroxilos
ya que podría competir con la reacción de
adsorción de los arseniatos. En estas evaluaciones
debe considerarse que las arcillas activadas son buenos
intercambiadores de iones, se comportan como un óxido
sólido y presentan un volumen de poro
medio de 600.
También habría que evaluar las
reacciones de quimisorción producidas entre las arcillas y
los grupos OH de los hidróxidos. Los precipitados
de hierro Fe(OH)3 y aluminio Al(OH)3 son
los productos
finales de la hidrólisis de los coagulantes
Al2(SO4)3, y FeCl3
disueltos en el agua y se forman en mayor cantidad relativa a un
pH de 6,5 a 7,00 para el aluminio y un pH de 7,5 a 8,0 para el
hierro. El precipitado de Fe(OH)3 es casi insoluble a
pH de 3,0 a 13,0 y, en condiciones alcalinas precipita
según la reacción
Fe+ 3 + 3OH-
à
Fe(OH)3
El floc de Fe(OH)3 a pH < 6,5 tiene
una carga superficial positiva debido a su potencial de carga
cero (PZC) y a pH > 8,0 una carga superficial negativa. En el
rango de pH entre 6,5 y 8,0 la carga superficial es mixta. La
menor solubilidad del Fe(OH)3 es a pH =
8,0.
Las especies solubles de hierro a pH < 6,0 son
Fe+ 3 con mayor concentración a pH < 3,0 y
predominio de FeOH+ 2 a pH < 4,0 y
Fe(OH)2-, con una mayor
concentración un pH entre 5 y 7. A un pH > 10.0 las
especies solubles predominantes son el
Fe(OH)4-.
A un pH < 6,0 las especies predominantes son el
Fe+3, FeOH+ 2 y
Fe(OH)2+ los cuales favorecen la
adsorción de los iones arseniato. Pero en este mismo rango
la capacidad de adsorción de los arseniatos por el
hidróxido férrico está limitada por la carga
superficial negativa del mismo. Esto puede explicar porque se
obtienen mejores remociones de arsénico con el cloruro
férrico en un rango de pH entre 7 y 7,5 en donde la
remoción de arsénico se efectuaría por
adsorción y coprecipitación tanto de las especies
catiónicas como de los precipitados del hidróxido
Fe(OH)3 con los que en forma conjunta el
arsénico coprecipita y sedimenta
rápidamente.
El precipitado de Al(OH)3 que en realidad es
AlO3xH20 tiene carga superficial positiva a
pH < 7,6 y negativa a pH > 8,2. En el rango de pH entre 7,6
y 8,2 la carga superficial es mixta. A pH = 4,0 predominan las
especies de Al+ 3, mientras que a un pH = 9,0
predominan las especies aniónicas Al(OH)4-. En
todos los casos de remoción de arsénico por
coagulación y adsorción se debe producir con mayor
eficiencia a un pH < 7,0, donde se presentan las especies
catiónicas de hierro y aluminio más efectivas, y la
competencia del
grupo hidroxilo es reducida.
Eliminación del arsénico del agua
usando luz solar y
aire
Investigadores australianos desarrollaron una
técnica muy simple para eliminar el arsénico del
agua potable (y también residuos mineros) usando
únicamente luz solar y aire. En Faridpur (Bangladesh)
existe una unidad potabilizadora de agua, de casi un siglo de
antigüedad, que reduce la concentración de
arsénico en agua, por debajo de los estándares del
país simplemente por medio de luz solar y
filtración.
La radiación
ultravioleta de la luz solar cataliza la oxidación del
arsénico disuelto a la forma menos tóxica, la cual
puede ser precipitada en forma de arseniato férrico y
posteriormente eliminada.
En Bangladesh entre 1998 y 1999 se llevaron a cabo
estudios basados en el uso de luz solar, aire, en algunos casos
hierro, recipientes de barro y filtros de arena que dieron unos
resultados sorprendes. Los efluentes del lavado ácido se
mezclan con los del lavado básico y el residuo
arsénico resultante se deposita en una fosa preparada en
el suelo con una cama de estiércol de vaca. Los
microorganismos del estiércol transforman el
arsénico en arsina gaseosa. Este método parece una
solución barata para uno de los problemas más
graves con los que se enfrentan algunas de las poblaciones
más pobres de nuestro planeta.
Eliminación del arsénico aplicando
electrotratamiento
Este método propuesto por investigadores de la
Universidad
Autónoma de México
permite la removilización del arsénico disuelto en
el agua por medio de electrodos de hierro que propician la
adsorción de los iones presentes en este elemento. Los
experimentos realizados con este método permitieron
obtener eficacias superiores al 90%.
La ventaja con la que parece contar este método
es que no requiere variar las condiciones iniciales de pH ni que
no se produce un cambio brusco de las mismas al finalizar el
proceso.
Problemática en Castilla y
León
Los análisis realizados en pozos de
abastecimiento de Castilla y León hasta el mes de
agosto de 2001 permitieron descubrir que en un total de 39 los
municipios de esta Comunidad el agua potable presentaba
importantes niveles de arsénico: 11 municipios en
Ávila, 13 en Segovia y 15 en Valladolid.
Aunque estos son los municipios que se han visto
más afectados por este tipo de contaminación, al presentar aguas potables
con niveles de arsénico superiores a 50 µg/l, parece
ser que este problema se extiende a áreas de otras
provincias, como la de Salamanca.
En este caso, y tras un estudio hidrogeológico
parece ser que la
contaminación es de origen natural: una vez que las
capas de pirita de los pozos subterráneas se ponen en
contacto con el oxígeno y, al impulsar el agua desde el
interior del pozo, se disuelve el arsénico.
Soluciones que se han dado al
problema
1) Declaración de no potabilidad de este agua por
los Ayuntamientos afectados en base a las atribuciones dictadas
en la Ley de Bases de
Régimen Local.
2) Instalación de aljibes fijos en las
localidades afectadas para abastecimiento de la población.
3) Los aljibes se recargan periódicamente
mediante cisternas
4) A medida que surgen y se detectan la
contaminación en los diferentes puntos de suministro se
estudia la forma de dar una solución urgente, estable,
definitiva y, en la medida de lo posible, integrada.
El 8 de febrero de 2001, las Cortes de Castilla y
León instan al ejecutivo regional a la ejecución de
emergencia de las obras necesarias para el abastecimiento a las
localidades afectadas. Realizados los oportunos estudios de
soluciones, se
adjudican los proyectos y obras
de las actuaciones a emprender, iniciándose las obras en
julio de 2001: se llevaron a cabo dos captaciones de aguas
fluviales, una en el río Eresma y otra en el Cega, cuyas
infraestructuras hidráulicas costarían un total de
2150 millones de las antiguas pesetas que se preveía
corriesen a cargo del Plan
Hidrológico Nacional.
Legislación aplicable en Castilla y león
relativa a las aguas continentales
En cuanto a normativa europea se refiere, la directiva
que nos ocupa es la Directiva 76/464/CEE relativa a
sustancias peligrosas en el agua. Sin embargo, los controles que
obligaba esta directiva han sido estandarizados y desarrollados
por la reciente Directiva 2000/60/ del Parlamento
Europeo y del Consejo.
En virtud de la Directiva 2000/60/CE deben adoptarse
medidas específicas a nivel comunitario contra la
contaminación de las aguas causada por determinados
contaminantes o grupos de contaminantes que representen un riesgo
significativo para el medio acuático o a través de
él, incluidos los riesgos de
esta índole para las aguas utilizadas para la
captación de agua potable. Dichas medidas tienen por
objeto la reducción progresiva de los vertidos, las
emisiones y las pérdidas y, en el caso de las sustancias
peligrosas prioritarias, la interrupción o
supresión gradual de tales vertidos, emisiones y
pérdidas en un plazo de veinte años desde su
adopción a
nivel comunitario, con el objetivo
último, tal como se reconoce en el contexto del logro de
los objetivos de
los acuerdos internacionales pertinentes, de conseguir
concentraciones en el medio marino cercanas a los valores
básicos por lo que se refiere a las sustancias de origen
natural y próximas a cero por lo que respecta a las
sustancias sintéticas artificiales.
En el caso de las sustancias de origen natural o las
sustancias generadas en procesos naturales, como el cadmio,
el mercurio o el
arsénico y los hidrocarburos
policíclicos aromáticos (HAP), no es posible la
plena eliminación de los vertidos, emisiones y
pérdidas de todas las fuentes potenciales. Esta
circunstancia debe tenerse debidamente en cuenta cuando se
elaboren las distintas directivas y las medidas que se adopten
deben estar destinadas a interrumpir los vertidos, emisiones y
pérdidas en el agua de estas sustancias peligrosas
prioritarias originadas por las actividades humanas.
La ley más importante en el ámbito
nacional y que ha marcado en los últimos años las
pautas del mecanismo normativo ambiental en cuestión de
aguas en el territorio español es
el RD 1/2001, por el que se aprueba el Texto
Refundido de la Ley de Aguas:
Esta ley es aplicable al Dominio Público
Hidráulico (DPH) formado por:
a) Las aguas continentales, tanto las superficiales como
las subterráneas renovables con independencia
del tiempo de renovación
b) Los cauces de corrientes naturales, continuas o
discontinuas
c) Los lechos de los lagos y lagunas y los de los
embalses superficiales en cauces públicos.
d) Los acuíferos, a los efectos de los actos de
disposición o de afección de los recursos
hidráulicos.
e) Las aguas procedentes de la desalación de agua
de mar una vez que, fuera de la planta de producción, se incorporen a cualquiera de
los elementos señalados en los apartados
anteriores.
Por lo tanto el caso que nos ocupa está recogido
en esta ley, ya que las aguas continentales están dentro
de la definición de DPH.
Además esta Ley establece la formación de
los llamados Organismos de Cuenca o Confederaciones
Hidrográficas, adscritas al Ministerio de Medio
Ambiente. Los organismos de cuenca dispondrán de
autonomía para regir y administrar por sí los
intereses que les sean confiados; para adquirir y enajenar los
bienes y
derechos que
puedan constituir su propio patrimonio;
para contratar y obligarse y para ejercer, ante los Tribunales,
todo género de
acciones, sin
más limitaciones que las impuestas por las Leyes. Sus actos
y resoluciones ponen fin a la vía
administrativa.
Su ámbito territorial, que se definirá
reglamentariamente, comprenderá una o varias cuencas
hidrográficas indivisas, con la sola limitación
derivada de las fronteras internacionales.
Sus funciones
son:
a) La elaboración del plan hidrológico de
cuenca, así como su seguimiento y
revisión.
b) La
administración y control del
dominio
público hidráulico.
c) La administración y control de los
aprovechamientos de interés
general o que afecten a más de una Comunidad
Autónoma.
d) El proyecto, la
construcción y explotación de las
obras realizadas con cargo a los fondos propios del organismo, y
las que les sean encomendadas por el Estado.
e) Las que se deriven de los convenios con Comunidades
Autónomas, Corporaciones Locales y otras entidades
públicas o privadas, o de los suscritos con los
particulares.
Por último, en lo que nos concierne, esta ley
incluye los objetivos de protección:
Son objetivos de la protección de las aguas y del
dominio público hidráulico:
a) Prevenir el deterioro, proteger y mejorar el estado
de los ecosistemas
acuáticos, así como de los ecosistemas terrestres y
humedales que dependan de modo directo de los acuáticos en
relación con sus necesidades de agua.
b) Promover el uso sostenible del agua protegiendo los
recursos hídricos disponibles y garantizando un suministro
suficiente en buen estado.
c) Proteger y mejorar el medio acuático
estableciendo medidas específicas para reducir
progresivamente los vertidos, las emisiones y las pérdidas
de sustancias prioritarias, así como para eliminar o
suprimir de forma gradual los vertidos, las emisiones y las
pérdidas de sustancias peligrosas prioritarias.
d) Garantizar la reducción progresiva de la
contaminación de las aguas subterráneas y evitar su
contaminación adicional.
e) Paliar los efectos de las inundaciones y
sequías.
f) Alcanzar, mediante la aplicación de la
legislación correspondiente, los objetivos fijados en los
tratados
internacionales en orden a prevenir y eliminar la
contaminación del medio ambiente marino.
g) Evitar cualquier acumulación de compuestos
tóxicos o peligrosos en el subsuelo o cualquier otra
acumulación que pueda ser causa de degradación del
dominio público hidráulico.
Anexos

Fig.1: Malformaciones plantares por
hidroarsenicismo crítico regional
endémico.


Fig.2: Arsenopirita

Fig.3: Oropimente

Fig.4: Mapa de la Comunidad
Autónoma de Castilla y León

Fig.5: Fuente contaminada por
arsénico
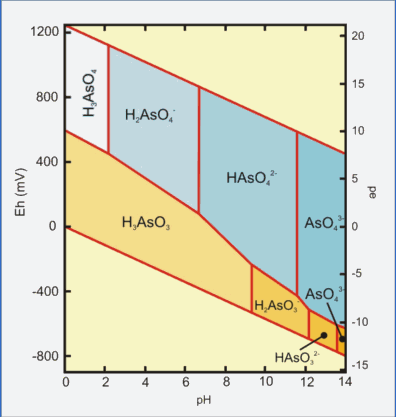
Fig.6: Diagrama Eh-pH
de especies acuosas de arsénico en el sistema
As–O2–H2O a 25ºC y 1 bar de
presión.


Fig.7: Especies de As(V) como
función de pH. b) Especies de As(III) como función
de pH.

Fig. 8: Curvas de adsorción de
As(III) y As(V), en función del pH. El área
sombreada representa el rango de pH para el cual se produce la
máxima desorción de As
Conclusiones
La elaboración de este trabajo ha
hecho que retenga conceptos ya vistos en la parte de suelos, como
especiación y que el arsénico es el único
metal pesado cuyos compuestos inorgánicos son más
tóxicos que los organometálicos.
También he aprendido nuevas técnicas
de recuperación, en este caso de aguas, lo que
servirá para tener mayor idea cuando veamos en teoría
las técnicas de recuperación de aguas.
Para terminar quería hacer hincapié en la
importancia de la normativa, ya que es el motor del
análisis de riesgos.
Bibliografía
Orozco, C. "Contaminación ambiental: Una visión
desde la Química"
Seoánez Calvo, M. "Ingeniería medioambiental aplicada: casos
prácticos"
www.miliarium.com/monografias/Arsenico/welcome.asp
www.carreteros.org/legislacionb/aguas/ley/ley.htm
www.lenntech.com/espanol/arsenico.htm
www.jcyl.es/medioambiente
www.ucm.es/info/crismine/Ambiente_Serena/Tema_As.htm
Autor:
Análisis y calidad de aguas y suelos
4º Ciencias
Ambientales
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
