Desarrollo embrionario del sistema linfático (página 2)
Más allá de los ganglios linfáticos
regionales, la linfa, que consiste en un ultrafiltrado de plasma
sanguíneo y algunos glóbulos blancos, fluye a
través de vasos aún mayores y por último
desemboca en las grandes venas cerca del corazón.
El tejido linfoide, dondequiera que se encuentre, exhibe a
grandes rasgos un aspecto microscópico similar. Este
tejido contiene un estroma que consta de células
reticulares mesenquimatosas radiadas que producen una red holgada de fibras
reticulares muy finas. Esta malla contiene linfocitos y otras
células que participan en las reacciones de defensa
inmunológicas. Es posible que las fibras nerviosas
autónomas del ritmo, el bazo y otros órganos
linfoides proporcionen un vínculo funcional
anatómico entre las funciones
inmunológicas y las actividades del sistema
nervioso.
Pese a que muchos órganos, como el timo, los ganglios
linfáticos y las amígdalas, son en esencia de
naturaleza
linfoide, el tejido linfoide en el cuerpo se relaciona
estrechamente con los tejidos que
desempeñan otras funciones. Así, en la
médula ósea, se entremezclan con el tejido
hemopoyético, en tanto que en el bazo se relaciona de
manera fundamental con el tejido que se ocupa de destruir las
células de sangre viejas. El
revestimiento epitelial del aparato gastrointestinal y en menor
grado el de los aparatos respiratorios y genital femenino,
están conformados por cantidades variantes de
células linfoides que producen un tipo especial de
anticuerpos y que sirven efectivamente como primera línea
de defensa inmunológica para estas superficies internas
del cuerpo.
II) MARCO
TEÓRICO
2.1 DESARROLLO DEL
SISTEMA LINFÁ TICO
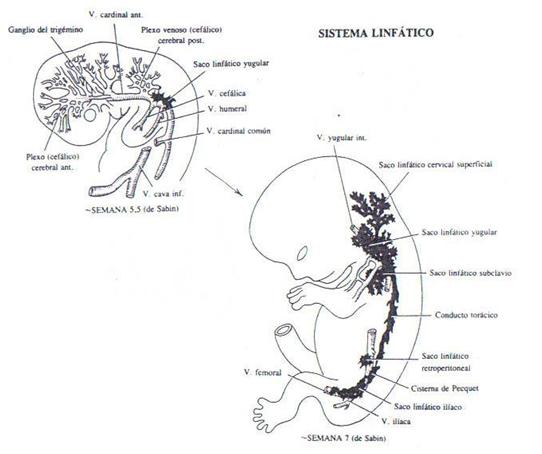
El sistema linfático comienza a fines de la quinta
semana, aproximadamente dos semanas más tarde que el
sistema
cardiovascular. Una opinión afirma que los vasos
linfáticos se originan como divertículos del
endotelio de las venas; mientras que otra afirma que, al igual
que otros vasos sanguíneos, se originan en hendiduras del
mesénquima que se comunica con el sistema venoso
más tarde.
Desde la sexta hasta la novena semana las dilataciones
locales de los canales linfáticos forman seis sacos
linfáticos primarios.
1.
Dos sacos linfáticos yugulares cerca de la unión de
las venas subclavias con las cardinales anteriores (futura vena
yugular interna).
2.
Dos sacos linfáticos ilíacos cerca de la
unión de las venas ilíacas con las venas cardinales
posteriores.
3.
Un saco linfático retroperitoneal en la raíz del
mesenterio de la pared abdominal posterior.
4.
Una cisterna de Pecquet dorsal al saco retroperitoneal a nivel de
las glándulas adrenales.
2.2 LOS VASOS LINFÁ TICOS
Estos salen de los sacos linfáticos, a lo largo de las
venas principales, y se dirigen a la cabeza, al cuello y a los
brazos desde los sacos yugulares, a la parte inferior del tronco
y a las piernas desde los sacos ilíacos y al intestino
desde los sacos retroperitoneales y cisternales.
1.
La cisterna de Pecquet se comunica con los sacos
linfáticos yugulares a través de dos canales
grandes, los conductos torácicos derecho e izquierdo. Se
forma una anastomosis entre los dos conductos, por lo tanto, el
conducto torácico definitivo está formado por la
porción caudal del conducto torácico derecho, la
anastomosis y la porción cefálica del conducto
torácico izquierdo.
2.
El conducto linfático derecho proviene de la parte
cefálica del conducto torácico derecho.
3.
Tanto el conducto torácico derecho como el izquierdo se
unen al sistema venoso en el ángulo de las venas subclavia
y yugular interna en la base del cuello.
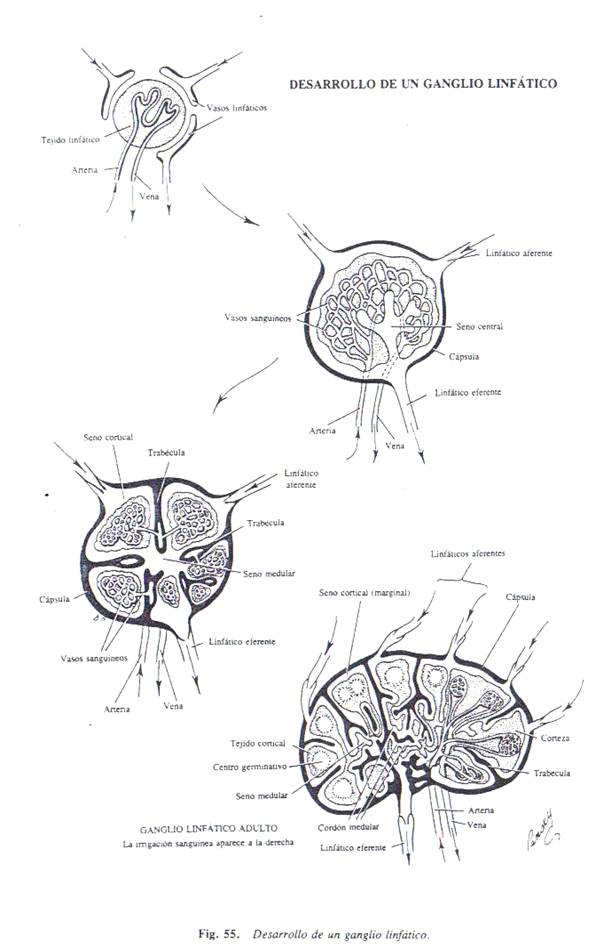
2.3 DESARROLLO DE LOS GANGLIOS LINFÁ TICOS
A
excepción de la parte superior de la cisterna de Pecquet,
que persiste, los sacos linfáticos se transforman en
grupos de
ganglios linfáticos durante el primer período de la
vida fetal, aproximadamente en el tercer mes.
1. Las células mesenquimatosas circundantes
invaden cada saco y lo fragmentan en canales linfáticos o
senos. Las células mesenquimatosas dan origen a la
cápsula del ganglio linfático y la estructura de
tejido conectivo del ganglio.
2. Los linfocitos que se observan en el
ganglio antes del nacimiento provienen de la glándula
timo.
3. El nódulo linfático y los
centros germinativos de producción de linfocitos no aparecen en los
ganglios hasta justo antes o después del nacimiento.
4. Los ganglios linfáticos también se
forman a lo largo del trayecto de otros vasos
linfáticos.
Estos se producen
como resultado de proliferación de células
mesenquimatosas relacionadas con los plexos capilares
linfáticos. Algunas de las células mesenquimatosas
se diferencian en linfoblastos que, a su vez darán origen
a los linfocitos. Otras células mesenquimatosas forman las
células del tejido conectivo, de modo que se produce una
cápsula fibrosa y se forma una red trabecular y
reticular.
Durante las
primeras etapas del desarrollo existen hemocitoblastos, y
eritroblastos dentro de los ganglios. Más adelante, la
formación de eritrocitos se confina a la médula
ósea roja. No es completa la
organización del tejido linfoide en nódulos
corticales y cordones medulares hasta después del
nacimiento.
III) OTRAS
ESTRUCTURAS
LINFÁTICAS
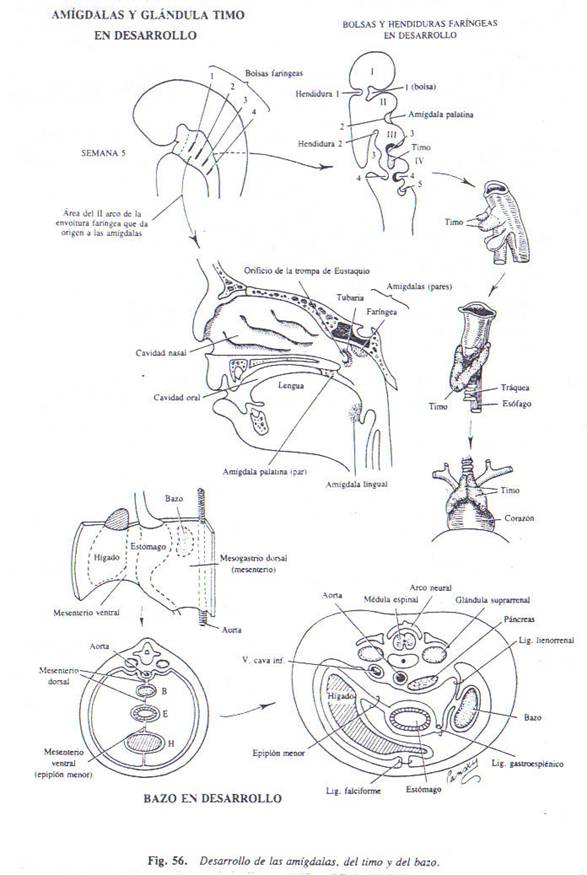
3.1BAZO
Este órgano se desarrolla como engrosamiento
circunscrito en el mesénquima del mesenterio dorsal, que
aumenta y se proyecta desde su superficie izquierda. En las
primeras etapas, el bazo está constituido por diversas
masas mesenquimatosas que más adelante, se fusionan, de
modo que, hacia el tercer mes, tiene su forma
característica. Las escotaduras a lo largo de su reborde
anterior son permanentes e indican que las masas mesenquimatosas
nunca se fusionan por completo.
La parte del mesenterio dorsal que se extiende entre hilio del
bazo y curvatura mayor del estómago se denomina
epiplón o ligamento gastroplénico, y la parte que
se extiende entre bazo y riñón izquierdo en la
pared abdominal posterior se denomina ligamento
esplenorrenal.
Las células mesenquimatosas del bazo en desarrollo se
diferencian y forman cápsulas, trabéculas y
redecilla reticular. Los linfoblastos aparecen muy al principio y
empiezan a producir linfocitos.
Durante el cuarto y quinto meses de la vida intrauterina
existen en el bazo eritroblastos, mieloblastos y megacariocitos,
de modo que, durante cierto período, en este órgano
se producen eritrocitos, leucocitos granulosos y plaquetas. Hacia
el octavo mes se suspende la formación de eritrocitos y
leucocitos granulosos. El tejido esplénico es regado por
una rama de la arteria del intestino anterior (arteria celiaca)
llamada arteria esplénica.
3.2 TIMO
El timo se origina como divertículo ectodérmico
del tercer arco faríngeo, cada divertículo crece
hasta llegar a la superficie anterior de la aorta. Al principio
es hueco, pero, mas adelante, como resultado de
proliferación celular, se convierte en una barra
sólida. Las dos barras o franjas tímicas se
fusionan en la parte alta del mediastino y rompen su
conexión con los terceros sacos faríngeos. Las
células endodérmicas se multiplican ahora para
formar acúmulos sólidos, llamados
corpúsculos de Hassall. Hacia el final del tercer mes, el
timo es invadido por células mesenquimatosas circundantes,
y estas se diferencian y forman una red reticular. Al mismo
tiempo,
aparecen dentro del retículo cantidades cada vez mayores
de linfocitos. Entretanto, se están formando a partir de
la mesénquima cápsula y trabéculas, y el
órgano queda subdividido en lóbulos. La
concentración más grande de linfocitos en la
periferia de cada lóbulo hace posible reconocer una
corteza, más densa, y una médula, más floja.
El timo, en el momento de nacer, es relativamente grande, y se
extiende desde la región del cartílago tiroides, en
cuello, a través del mediastino superior enfrente de los
grandes vasos hasta la superficie anterior del pericardio. Sigue
creciendo de manera sostenida, peor a un ritmo más lento
que el resto del cuerpo. En la pubertad ha
alcanzado su tamaño máximo, pero suele estar
restringida a la parte alta del mediastino. A continuación
empieza a disminuir de tamaño y es substituido, de manera
gradual, por tejido conectivo fibrograsoso. Sin embargo, incluso
en el adulto, puede demostrarse desde el punto de vista
histológico tejido tímico.
Hay muchas pruebas
experimentales que demuestran que los linfocitos pequeños
de los tejidos linfoides periféricos se originan en el timo durante
la vida intrauterina. En tanto está en desarrollo el timo,
bazo, ganglio linfático y otras áreas del tejido
linfoide, se están formando también, pero, al
principio están constituidas sólo por una redecilla
reticular, y faltan en ella los linfocitos pequeños. Se
cree que los linfocitos pequeños dejan el timo e invaden
el tejido linfoide periférico. Es posible, además
que el timo influya en el desarrollo del tejido linfoide
periférico por mecanismos humerales.
3.3AMÍGDALAS
Las amígdalas palatinas se desarrollan como yemas
sólidas de las células endodérmicas a partir
del segundo saco faríngeo. Las yemas se extienden hacia el
mesénquima subyacente y las células centrales de
cada yema desaparecen, de modo que se forman criptas amigdalinas.
Entretanto, las células mesenquimatosas forman una
redecilla reticular alrededor de las criptas, y, hacia el tercer
mes, aparecen en el retículo y se distribuyen en
nódulos. La cápsula de la amígdala es
formada por condensación mesenquimatosa.
La amígdala nasofaríngea se desarrolla en el
techo de la pared posterior de la nasofaringe por
acumulación del linfocito en el tejido conectivo de la
mucosa. Las células mesenquimatosas establecen una
redecilla reticular, y los linfocitos se organizan en
nódulos.
3.4
NÓDULOS LINFÁ TICOS SOLITARIOS
En la mucosa de los sistemas
respiratorios y digestivo estos nódulos se
desarrollan de manera idéntica a la observada en la
formación de la amígdala nasofaríngea.
CONCLUSIONES
1.
Los humanos producen anticuerpos, moléculas de proteínas
que reaccionan con gran especificidad ante los microorganismos o
sus productos
tóxicos.
2.
El sistema (inmunitario) linfoide se encuentra difundido por todo
el organismo humano a excepción de algunos lugares como:
el sistema nervioso
central, meninges, globo ocular y cornea, oído
interno, cartílago, epidermis.
3.
El tejido linfoide contiene un estroma que consta de
células reticulares mesenquimatosas radiadas que producen
una red holgadas de fibras reticulares muy finas.
4.
El sistema linfático comienza a formarse a finales de la
quinta semana, después del sistema cardiovascular.
5.
Los sacos linfáticos aparecen como resultado de
dilatación y fusión
de varios espacios mesenquimatosos.
6.
Los vasos linfáticos se originan de los sacos
linfáticos.
7.
Los sacos linfáticos originaron ganglios linfáticos
aproximadamente en el tercer mes de vida.
8.
El bazo se origina en un conjunto de células
mesenquimatosas en el mesenterio dorsal del estómago.
9.
Las amígdalas se formen del segundo par de bolsas
faríngeas.
BIBLIOGRAFÍA
·
Pateen, Bradley, M. Carlson, Bruce M. 1990, Embriología Básica, ED. 5ta. Edit.
Interamericana Mc Graw-Hill. Madrid
España.
· Ben
Pansky, 1985. Embriología Médica. Ed. 1ra. Edit.
Médica Panamericana. Buenos Aires.
·
José Hib. 1988. Embriología Médica. Ed. 1ra.
Edit. El Ateneo. Buenos Aires.
·
Richard S. Snell Embriología Médica. Ed. 2da. Edit.
Mc Graw-Hill Interamericana, México.
ANEXOS
QUILOTÓRAX EN EL
PERÍODO NEONATAL
Caso clínico y revisión de la literatura
Adriana Wegner A.; María Eugenia Wegner
A.; Marcela Milad A.
El quilotórax congénito es una de las causas
más frecuentes de hidrotórax neonatal descartadas
las causas inmunes, no inmunes e infecciosas. Puede ser causa de
distress respiratorio y muerte en el
período neonatal por hipoplasia pulmonar secundaria a una
ocupación pleural importante.
Su incidencia se estima muy baja, contribuyendo a esto el
subdiagnóstico en los mortineonatos con hidrotórax,
dado el aspecto aun no quiloso de la efusión. Este
artículo reporta el caso de una recién nacida con
diagnóstico antenatal de hidrotórax,
que evolucionó en el período posnatal con
progresión de la efusión pleural, concomitante a un
aumento de volumen de sus
extremidades inferiores. La punción de este líquido
pleural resultó compatible con quilo y las imágenes
de extremidades, con linfedema. Su estudio finalmente
concluyó Enfermedad de Milroy-Meige. A partir de este caso
se revisa la literatura existente discutiendo la fisiología, patogenia, clínica,
diagnóstico y tratamiento del quilotórax
congénito durante el período perinatal.
(Palabras clave: quilotórax, recién
nacido, hidrotórax, linfedema, enfermedad de Milroy.)
El hallazgo de un hidrotórax durante la vida fetal
está dado generalmente en el contexto de un hídrops
fetal ya sea inmune o no inmune. Sin embargo, otras causas
capaces de desencadenar el desarrollo de un hidrotórax son
las infecciones intrauterinas y las efusiones quilosas
congénitas. Así, el quilotórax
congénito es una de las causas más frecuentes de
efusión pleural, descartadas las demás
posibilidades. Como todas las lesiones ocupantes de espacio
pleural, el riesgo de
hipoplasia pulmonar secundaria a esto, resulta en muerte y/o
síndrome de distress respiratorio (SDR) en el
período de recién nacido, que en el caso de
óbitos o mortineonatos quedan catalogados como
hidrotórax congénito idiopático o
hídrops fetal no inmune por el aspecto aun no quiloso del
líquido pleural
En general, el quilotórax se define como la presencia
de linfa en el espacio pleural confirmado por el análisis citoquímico y
citológico de este líquido sospechoso. Durante el
período neonatal, este puede dividirse en
quilotórax congénito o adquirido.
La incidencia del quilotórax congénito no
está bien definida producto del
subdiagnóstico durante el período perinatal
(óbitos/mortineonatos), pero se estima muy baja,
reportándose en el Hospital for Sick Children
Toronto, Canadá una incidencia de 1 por cada 2.000
admisiones (promedio de admisiones 1.200 a 1.300 por
año).
A partir de la descripción de un caso clínico, el
presente artículo discute y revisa la etiopatogenia,
presentación clínica, procedimientos
diagnósticos y recursos
terapéuticos con los que se dispone actualmente para un
adecuado manejo del quilotórax, patología vascular
considerada poco frecuente durante el período
neonatal.
CASO CLÍNICO
Se presenta el caso de una recién nacida en la
Maternidad del Hospital Dr. Sótero del Río, con
diagnóstico ecográfico de hidrotórax
bilateral a las 35 semanas de edad gestacional. El manejo
obstétrico prenatal de este embarazo fue
conservador, realizándose ecografías seriadas
durante su evolución. Se programó
cesárea electiva, pero inició trabajo de
parto antes de
lo previsto. El embarazo se resolvió vía vaginal a
las 40 semanas de gestación, resultando una recién
nacida de término pequeña para la edad gestacional,
con peso de 2 090 gramos, talla de 47,6 cm, perímetro
cefálico de 34,7 cm y Apgar de 8 y 9 al 1er
y 5º minuto de vida. Se ingresó a la Unidad de
Cuidados Intensivos Neonatales para monitoreo no invasivo y
estudio. Quedó durante las primeras horas de vida en
régimen cero, con suero de mantención habitual (65
ml/kg/día). Dextro control
resultó normal (46 mg%), hematocrito de 68%, por lo que se
realizó sueroféresis. La radiografía de
tórax demostró hidrotórax derecho leve
(figura
1), el que se confirmó con ecografía pleural.
Evolucionó asintomáticamente, por lo que se
trasladó a Unidad de Cuidados Mínimos a las 12
horas de vida, iniciándose alimentación oral. Se
realizó radiografía de control a las 24 horas de
vida que no evidenció progresión del derrame
pleural. La evaluación
cardiológica en busca de etiología fue
negativa.
Evolucionó en las primeras 96 horas de vida con
aumento de peso mayor a lo esperado, pesquisándose al
examen clínico aumento de volumen duro en antepié y
pierna derecha. Una nueva radiografía de control,
demuestró aumento de imagen de
velamiento en hemitórax derecho (figura
2). Se realizó hemograma, VHS, PCR, examen de orina y
perfil bioquímico que resultaron normales. En la anamnesis
familiar apareció el antecedente de patología
linfática en el padre, tío y abuelo paterno. Al
sexto día de vida se realizó punción del
derrame bajo ecografía, dando salida a un líquido
de aspecto amarillo lechoso, con un citoquímico compatible
con quilotórax (50 mg/dl de proteína, LDH 373 U/L,
102 mg/dl de glucosa,
recuento celular de 7 100 células con 92% de
mononucleares, 934 mg% de triglicéridos, colesterol de 38
mg%). Al octavo día de vida se realizó ECO Doppler
de extremidad inferior derecha que no demostró
alteración en flujos arteriales ni venosos. A los 11
días de vida, siempre asintomática en lo
respiratorio, se realizó linfocintigrafía que
demostró franco enlentecimiento de la circulación
linfática a nivel de extremidad inferior derecha donde no
se evidenciaron claramente conductos linfáticos, con
ausencia de contraste de grupos ganglionares inguinales derechos (figura
3). Se planteó en este contexto Patología
Linfática Familiar: Diagnóstico probable de
Enfermedad de Milroy. Dada su evolución
clínica asintomática se indicó el alta a los
13 días de vida con control multidisciplinario.

Figura 1: Radiografía de
tórax que muestra
hidrotórax derecho leve a las pocas horas de vida.

Figura 2: Radiografía de
tórax a las 96 horas de vida. Se observa mayor velamiento
en base de hemitórax derecho.

Figura 3:Linfocintigrafía
realizada a los 11 días de vida. Enlentecimiento de flujo
linfático a nivel de extremidad inferior derecho.
Nótese ausencia de grupos ganglionares inguinales
derechos
Manteniendo una dieta alimentaria con restricción de
ácidos
grasos de cadena larga y sustitución calórica
equivalente en base a hidratos de carbono, se
constató en controles seriados de salud de rutina un buen
incremento pondoestatural acorde a su canal de crecimiento
inicial. Controles seriados por broncopulmonar evidenciaron
disminución y posterior desaparición de
quilotórax radiológico (figura
4). Controles en genética
corroboraron el diagnóstico inicial de Enfermedad de
Milroy al hacer un seguimiento familiar retrospectivo

Figura 4:Radiografía
realizada a los 3 meses de vida. No se evidencia presencia de
velamiento en hemitórax derecho.
En la actualidad, la niña se mantiene
asintomática en lo respiratorio (salvo por infecciones
virales respiratorias banales intercurrentes), pero con
persistencia de linfedema en la extremidad inferior derecha y
leve linfedema de extremidad superior izquierda, lo que se ha
manejado en conjunto con cirugía infantil manteniendo
manejo médico en base a vendajes compresivos.
DISCUSIÓN
El ducto torácico tiene un desarrollo
embriológico bilateral por lo que puede presentar
distintos patrones anatómicos con una alta probabilidad
de desarrollar múltiples colaterales y ricas redes linfáticas, lo
que permite ligar el ducto torácico en cualquier punto de
su trayecto como una forma de tratamiento del
quilotórax.
En 50% de los casos, el sistema linfático se desarrolla
acorde al patrón anatómico definido como normal: el
ducto se origina a partir de la cisterna quilífera
central, a nivel de L2 en la línea media, donde drenan los
linfáticos provenientes desde las extremidades inferiores,
pelvis e intestino. Desde ahí asciende al tórax a
través del hiato aórtico, a la derecha de la
línea media, para cruzarse a la izquierda a nivel de la
cuarta vértebra torácica. Asciende hasta nivel del
arco aórtico y a la izquierda del esófago, para
posteriormente entrar al cuello donde cruza hacia ventral a nivel
de la línea media de la inserción del
músculo escaleno anterior, para drenar finalmente en la
unión de las venas yugular interna y subclavia izquierda.
El conducto linfático derecho drena la linfa proveniente
del lado derecho de cabeza y cuello, el brazo derecho, el lado
derecho del tórax y ambos pulmones. El conducto derecho
drena finalmente también al ángulo
yugulo-subclavio.
Los vasos linfáticos son estructuras musculares,
regidas por el sistema nervioso
autónomo, y poseen numerosas válvulas
que impiden el reflujo de la linfa.
El flujo promedio normal de la linfa es de aproximadamente
1,38 ml/kg/h, valor que
fluctúa significativamente en relación a la ingesta
de agua y
principalmente con la ingesta de ácidos grasos de cadena
larga. Esto último se debe a que existe una
absorción intestinal diferencial de los lípidos:
los ácidos grasos de cadena corta y mediana se absorben
directo a la circulación sanguínea y los
ácidos grasos de cadena larga (* 12 átomos de
Carbono) directo a la linfa, constituyendo lo que se conoce como
quilo. Este detalle fisiológico es el pilar fundamental en
el cual se basa el tratamiento del quilotórax.
El quilo está constituido fundamentalmente por grasas
neutras, proteínas de bajo peso molecular
(albúmina, globulinas, fibrinógeno, etc.) y una
gran cantidad de linfocitos todo lo que se pierde al haber fuga
de este líquido hacia la cavidad pleural predisponiendo a
desnutrición e infecciones subsecuentes
Dentro de las causas de quilotórax, se describen en la
literatura una serie de patologías tanto congénitas
como adquiridas . La patogenia básica en todas ellas
converge en la alteración del flujo normal de linfa a
través del sistema linfático, ya sea por
obstrucción de él en forma adquirida (con aumento
de la presión
hidrostática dentro del sistema
linfático secundariamente a esto), y/o por aplasia o
hipoplasia de los vasos linfáticos producto de una
anomalía congénito-hereditaria, como en el caso de
la recién nacida presentada en este artículo, quien
resultó ser portadora de la Enfermedad de Milroy,
patología hereditaria caracterizada por el desarrollo
anómalo generalizado de los vasos del sistema
linfático.
Causas de quilotórax
I. Quilotórax congénito
Linfagiectasia pulmonar congénita
Linfagiectasia generalizada – 2ª a
defectos cardíacos obstructivos – Defecto pulmonar
primario
Linfagiomatosis generalizada
Linfedema hereditario primario
Enfermedad de Milroy-Meige
Mosaicismo XX / XY
Síndrome de uñas amarillas
Síndrome de Turner
Síndrome de Noonan
Síndrome de
Down
Asociada a trauma perinatal (en contexto de
malformación linfática)
Idiopática
II. Quilotórax adquirido
Post Cirugía torácica
Reparación de atresia
esofágica
Catéter venoso central
Trombosis de la vena cava superior
Masas mediastínicas
Sea cual fuere la anomalía primaria subyacente a la
patología linfática, todas finalmente convergen en
una mala absorción del líquido intersticial por
parte de los vasos linfáticos, resultando en la
acumulación de este en el intersticio (linfedema) y en el
espacio pleural (quilotórax) si los vasos afectados
comprometen el drenaje a este nivel
Durante el período fetal el quilotórax
desarrollado en el contexto de una anomalía hereditaria,
se manifiesta como hidrotórax, es decir, como un
líquido con características de transudado. Esto se
explica por la ausencia de absorción de grasas a nivel
intestinal en un feto que,
obviamente, no se alimenta aún por vía oral.
El quilotórax (hidrotórax fetal) puede asociarse
a polihidroamnios producto de una mala deglución de
líquido amniótico, secundaria a compresión
esofágica mecánica, lo que puede desencadenar
síntomas de parto prematuro. Una efusión pleural
masiva puede favorecer también el desarrollo de un
hídrops no inmune, como resultado de la compresión
miocárdica y la vena cava superior, y/o de la
hipoalbuminemia, secundaria al escape de albúmina hacia la
efusión pleural. Asimismo, el
hidrotórax de magnitud moderada a severa, es capaz de
provocar un SDR, una hipoplasia pulmonar fetal con el riesgo de
hipertensión pulmonar subsecuente. Este
hidrotórax puede ser detectado con ecografía
obstétrica si su magnitud lo permite.
En el caso de la recién nacida presentada en este
artículo, la detección de su hidrotórax
durante el período fetal mediante una ecografía
obstétrica, permitió el seguimiento estrecho de
este embarazo y el
conocimiento a priori de las potenciales complicaciones
perinatales que esta recién nacida podía
desarrollar lo que en definitiva motivó su
hospitalización preventiva en la Unidad de Cuidados
Intensivos Neonatales.
Durante el período neonatal el quilotórax puede
inicialmente ser asintomático en lo respiratorio. Sin
embargo, en la medida que se inicia la alimentación, la
linfa comienza a acumularse a nivel pleural y/o en las
extremidades, volviéndose entonces sintomático. En
nuestra paciente esto fue evidente, comprobando en el seguimiento
radiológico un aumento del velamiento torácico y la
aparición de linfedema en sus extremidades una vez
iniciada la alimentación oral.
El diagnóstico en el período fetal se basa en
definir la presencia de una efusión pleural con
características de hidrotórax, confirmándose
por punción pleural intrauterina, lo que está
contraindicado si hay estabilidad clínica fetal, dado los
riesgos que
este procedimiento
conlleva. En el período neonatal, la radiografía de
tórax en posición vertical antero-posterior y
lateral da una imagen sugerente, la ecografía pleural
confirma la presencia de líquido a nivel de las pleuras,
siendo la punción pleural el pilar diagnóstico del
quilotórax, siempre y cuando se haya iniciado la
alimentación. La linfocintigrafía (inyección
de radioisótopos que mapean el sistema linfático)
es el examen que permite localizar la anomalía
anatómica linfática subyacente.
En nuestra recién nacida, el manejo obstétrico
desde el punto de vista diagnóstico, fue conservador
considerando la estabilidad fetal, puncionándose este
líquido solo cuando se constató el aumento de este
a nivel pleural, lo que ocurrió a los días de
iniciada su alimentación. Cuando se confirmó el
quilotórax mediante el citoquí-mico del
líquido, se procedió a realizar la
linfocintigrafía que terminó por confirmar el
diagnóstico de su patología linfática
hereditaria, especifícamente Enfermedad de Mil-roy en el
contexto de sus antecedentes familiares.
En relación al tratamiento del quilotórax, este
va a depender de: a) el período en que se realice el
diagnóstico y b) de la sintomatología asociada.
Durante el período fetal, si el hidrotórax es
asintomático, se prefiere mantener un manejo conservador
con seguimiento ecográfico seriado ya que este puede
evolucionar hacia la resolución espontánea durante
la vida fetal y el procedimiento intrauterino invasivo puede solo
ensombrecer el pronóstico fetal,.
Considerando que la mortalidad intrauterina 2ª al
quilotórax varía entre 3 y 5%, porcentaje que es
menor al riesgo del procedimiento invasivo mismo. Si el
hidrotórax es sintomático (hipoplasia pulmonar,
polihidroamnios severo, hidrops), debe considerarse la
realización de procedimientos invasivos como son la
toracocentesis intrauterina evacuadora y/o los cortocircuitos o
shunts pleuroamnióticos.
En el período neonatal, si hay un SDR significativo al
momento de nacer, se plantean alternativas como drenaje del
quilotórax (aun hidrotórax a la macroscopia y
citoquímico), apoyo ventilatorio mecánico e inicio
de suplementación nutricional paren-teral, para disminuir
el flujo linfático hacia la cavidad pleural. Si el
quilotórax es asintomático o poco
sintomático, se sugieren las toracocentesis evacuadoras
intermitentes, el uso de sonda pleural permanente con
aspiración a baja presión para evitar la
formación de tapones de fibrina, y el manejo nutricional
pilar fundamental del tratamiento, con el fin de regular el flujo
linfático y mantener un estado
nutricional adecuado.
Esto se logra sobre la base de la instauración de
dietas
restringidas en ácidos grasos de cadena larga y reemplazo
proporcional de estos por ácidos grasos de cadena mediana
(MCTယ). Sin embargo, los recién
nacidos requieren del aporte de ácidos grasos esenciales
para un buen desarrollo del sistema nervioso central. Estas
moléculas poseen estructuras con más de 12
átomos de Carbono, lo que dificulta el manejo con este
esquema alimentario. Existe recientemente una fórmula
láctea ideal para estos casos llamada Portagen"
(Mead Johnson), la cual contiene un 86% de ácidos grasos
de cadena mediana y una cantidad adecuada de ácidos grasos
de cadena larga esenciales (350 mg% de ácido linoleico,
1,88 mg%, L-carnitina).
Ahora, si el flujo linfático es elevado y/o hay
desnutrición desde el inicio, debe plantearse el inicio de
nutrición
parenteral total. Si después de un tiempo de prueba (que
es variable) no se observa disminución del
quilotórax y no hay cierre espontáneo y/o
formación de colaterales para desviar el flujo
linfático, se plantea de ser posible la corrección
quirúrgica del defecto, la que está claramente
indicada en los siguientes casos: 1) drenaje persistente de quilo
por más de 14 días, 2) drenaje de quilo * 100
ml/año de edad/día (1 500 ml/día en
adultos), 3) quilotórax loculado y/o formación de
tapones de fibrina, 4) pleuritis constrictiva que requiera
decorticación y 5) complicaciones metabólicas
secundarias severas. Dentro de las posibilidades
terapéuticas quirúrgicas descritas se cuentan:
toracotomía exploradora (para identificar el ducto
torácico y asear la cavidad pleural), ligadura del
conducto to-rácico más colocación de un tubo
de toracostomía (método
clásico), shunt pleurope-ritoneal, pleurodesis,
pleurectomía y la radiación
mediastinal, todas técnicas
con indicación clara y particular de acuerdo al caso
enfrentado.
En el caso de nuestra paciente, y considerando su estabilidad
clínica, el manejo inicial fue conservador,
suspendiéndose la lactancia
materna e iniciando Portagen como fórmula base de
su alimentación. Con esto se logró una
disminución sustantiva del quilotórax, un buen
incremento tanto pondoestatural como de su circunferencia
craneana, y un buen desarrollo psicomotor. El seguimiento
posterior demostró que manteniendo tan solo un buen manejo
nutricional, las demás posibilidades terapéuticas
posibles no fueron necesarias.
Las complicaciones derivadas del
quilotórax pueden ser:
1) secundarias a la pérdida de quilo hacia el
tórax y/o al exterior y
2) secundarias a la ocupación del espacio pleural. En
las primeras se cuentan la hipovolemia, la hipoalbuminemia, la
desnutrición y las infecciones recurrentes, producto de la
importante pérdida de líquido, proteínas y
linfocitos presentes en el quilo. En el segundo grupo, el
riesgo tiene que ver con el desarrollo de insuficiencia
respiratoria, que puede ser de grado variable dependiendo de la
magnitud de la efusión pleural.
El pronóstico del quilotórax es variable,
teniendo una mortalidad que oscila entre el 5 al 100%
según la causa. Los factores asociados al
pronóstico tienen relación con el
diagnóstico precoz, la rapidez de instauración del
tratamiento, el apoyo nutricional adecuado y la causa subyacente
al quilotórax.
En resumen, si bien el quilotórax durante el
período neonatal cuenta con una aparente baja frecuencia,
debe ser sospechado ante la presencia de un hidrotórax de
causa no precisada, realizando una punción de este
líquido una vez iniciada la alimentación para
así confirmar el diagnóstico, posteriormente
realizar estudios imagenológicos para definir la patogenia
involucrada y así poder
instaurar un manejo terapéutico óptimo y
escalonado.
Autor:
Salirrosas Cerna, Franklin Esteban
Trujillo, Julio del 2008
DEPARTAMENTO DE
MORFOLOGÍA HUMANA
SECCIÓN EMBRIOLOGÍA
UNIVERSIDAD NACIONAL DE TRUJILLO
FACULTAD DE CIENCIAS
MéDICAS
ESCUELA ACADéMICO PROFESIONAL DE
MEDICINA
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
