Mientras que el embrión y sus membranas
crecen, la decidua capsular se compacta como resultado, los
vellos coriónicos en la parte asociada al saco
coriónico, se atrofian de forma gradual y desaparecen
(fig. 6-1A a C). Esta parte, libre de vellos del saco
coriónico, se conoce como corion
suave (corion leve). Mientras tanto los vellos
coriónicos relacionado con la decidua basal aumentan en
forma rápida en tamaño y en complejidad (fig.6-1C).
Está región del saco coriónico es conocida
como el corion frondoso o velloso.
DESARROLLO
ESTRUCTURA
DE LA
PLACENTA
La placenta es un órgano
fetomaternal formado por los tejidos tanto
fetales como maternales se reconocen dos componentes de la
placenta para el inicio de la doceava semana (1) una
porción fetal formada por el corion velloso
o frondoso, y (2) una porción materna formadad por
la decidua basal.
Las dos porciones de la placenta se mantiene
juntas por vellos primordiales que a menudo son llamados
vellos de anclaje porque están anclados en la
decidua basal por medio de la concha
citotrofoblástica. Durante la erosión de
la decidua basal por el sincitiotrofoblasto, son excavadas
grandes áreas de tejido decidual para formar espacios
intervellosos irregulare. Durante está erosión
de la decidua basal, partes de la decidua permanecen permanecen
como proyecciones sólidas llamadas septa
placentaria. Esta septa se proyecta en los espacios
intervellosos y divide la placenta en varios compartimientos:
cada uno de éstos contiene un cotiledón, que
consiste de varios vellos primordiales y sus diversas ramas.

Dibujos que ilustran la relación de
conceptos (embrión, feto y sus
membranas)
LA MEMBRANA PLACENTARIA (BARRERA
PLACENTARIA)
Esta delgada membrana fetal separa la
sangre fetal
de en los capilares de las vellosidades coriónicas de la
sangre materna en los espacios intervellosos. Durante los
primeros meses del embarazo, la
membrana placentaria consiste de cuatro capas:
- El epitelio capilar fetal.
- el tejido conectivo.
- Citotrofoblasto.
- Sincitiotrofoblasto.
Durante los estadios
finales del embarazo, el citotrofoblasto desaparece, el
sincitiotrofoblasto se adelgaza mucho, y el tejido conectivo se
reduce en gran forma. Como resultado de esto, la membrana
placentaria que separa los torrentes sanguíneos maternos y
fetales se hace delgada en extremo (alrededor de una micra).
PLACENTA A
TéRMINO
La placenta, arrojada del útero
después del nacimiento del bebé, por lo
común tiene apariencia discoide, diámetro de 15 a
20 cm, grosor de 2 a 3 cm y peso de 500 a 600 gramos. Los
márgenes de la placenta son continuos con los sacos
amnióticos y coriónicos rotos.
Superficie materna de la
placenta.- La apariencia característica de
empedrado de su superficie se debe a los
cotiledones, los cuales están
compuestos de varios vellos primordiales principales y sus ramas.
La superficie materna está cubierta por una capa delgada
de decidua basal. Sin embargo, la mayor parte de la
porción materna de la placenta permanece en el
útero y es arrojada después por un sangrado.
Superficie fetal de la
placenta.- El cordón umbilical se une a esta
superficie, a menudo cerca de su centro. El amnios cubre la
superficie fetal y es continuo con el amnios que forma la
cubierta epitelial del cordón umbilical. Los vasos
sanguíneos que erradian desde el cordón umbilical
hacia las vellosidades coriónicas y de las vellosidades
hacia el cordón, son visibles a través del amnio
transparente.
Cordón umbilical.-
Por lo general contiene dos arterias y una ven. Rodeadas por
tejido conectivo mucoide (jalea de
Wharton) .Por lo general, el cordón umbilical
es de 1 a 2 cm de diámetro y de 30 a 90 cm de longitud
(promedio de 55 cm). Los cordones umbilicales largos o cortos en
exceso, se pueden asociar con malformación
congénita.
FUNCIONES DE LA PLACENTA
Hay seis funciones
principales de la placenta:
- Respiración.- El oxígeno de la sangre materna se difunde a
través de la membrana placentaria hacia la sangre fetal
por difusión simple. El bióxido de carbono
también pasa con rapidez en la dirección opuesta. Por lo tanto la
placenta actúa como "los pulmones del feto". - Nutrición.- Agua, sales
inorgánicas, carbohidratos, grasas,
proteínas y vitaminas,
todas pasan de la sangre materna a través de la membrana
placentaria a la sangre fetal. - Excreción.- Los productos de
desecho cruzan la membrana placentaria desde la sangre fetal y
entran en la sangre maternal. Se excretan por los
riñones de la madre. - Protección.- La mayor parte de los microorganismos
no cruzan la membrana placentaria por ejemplo, bacterias,
pero algunas lo hacen, por ejemplo: toxoplasma gondii, un
parásito intracelular. No hay una mezcla apreciable
de sangre materna y fetal. - Almacenamiento.- Los carbohidratos, proteínas,
calcio y hierro se
almacenan en la placenta y se liberan hacia la
circulación fetal según se requiera. - Producción Hormonal.- Las siguiente hormonas se
producen por el sincitotrofoblasto de la placenta:
gonadotropina coriónica humana (lactogéno
placentario humano).
Aunque a menudo se refiere a la membrana
placentaria como barrera placentaria, no protege al
feto de muchos agentes dañinos tales como droga,
venenos, monóxido de carbono y ciertos virus (por
ejemplo virus de la rubeola). Una vez en el feto, estas
sustancias producen malformaciones congénicas (el virus de
la rubeola causa cataratas congénitas). Tales agentes son
denominados como teratógenos.
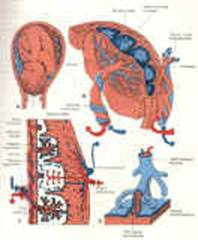
Representaciones esquemáticas del
feto y la placenta, que ilustran como la placenta provee
oxígeno y nutrición al
embrión
CIRCULACIÓN
ÚTEROPLACENTARIA
Circulación placentaria
materna.- La sangre oxigenada materna penetra los
espacios intravellosos desde los extremos erosionados de las
arterias espirales en la deciuda basasl. La presión
arterial es suficiente para dirigir la sangre hacia la placa
coriónica y desviarla sobre la rama de los vellos
coriónicos. La sangre materna desoxigenada deja los
espacios intervellosos a través de aperturas en la concha
citotrofoblástica y entra hacia las numerosas venas
endometriales pared delgada de pared delgada. Las
conrtracciones uterinas periódicas comprenden los espacios
intervellosos y fuerzan la sangre hacia estas ramas de las venas
uterinas.
Circulación placentaria
fetal.- La sangre fetal desoxigenada deja el feto por
dos arterias umbilicales que pasan a través del
cordón umbillical. Cuando alcanzan la superficie fetal de
la placenta, estos vasos se dividen en varias ramas que entran
enlos vellos oriónicos. La sangre oxigenada regresa hacia
el feto a través de las venas y venículos de los
vellos coriónicos. Estos seunen para formar la vena
umbilical en el cordón umbilical.
FISIOLOGÍA
ÚTEROPLACENTARIA
El desarrollo
adecuado de la circulación útero placentario
es de importancia fundamental en el logro de un embarazo normal.
Aproximadamente el 80% de la irrigación uterina durante el
embarazo proviene de ambas arterias uterinas, las cuales se
originan de la división anterior de la arteria
ilíaca interna. Cada rama principal llega al útero
a nivel de unión cérvico-ítsmica. A este
nivel se divide en dos ramas principales: cervical y corporal.
Esta última asciende sobre la pared lateral uterina,
dentro del ligamento ancho, dividiéndose finalmente en
ramas tubaria y meso-ovárica. Durante su curso, la arteria
uterina se ramifica en aproximadamente ocho arterias arcuatas,
que rodean la pared uterina.
Luego se transforman en arterias radiales
centrípetas, que penetran la pared uterina, y finalmente,
a nivel del tercio medio miometrial, dan lugar a aproximadamente
200 arterias espirales. Durante la invasión del
trofoblasto, primero a nivel decidual, y luego a nivel
miometrial, las arterias espirales cambian su estructura
musculo-elástica por tejido fibrinoide, disminuyendo
notoriamente la resistencia
global uterina
Como resultado de la elevación del
débito cardíaco materno, se produce un aumento
sustancial del flujo uterino a través del embarazo, desde
50 ml/min en primer trimestre a 500 ml/min hacia el
término.
La circulación umbilico-placentaria
corresponde al circuito constituido por dos arterias umbilicales
separadas, que sólo se anastomosan cercano al sitio de
inserción placentaria, y una vena umbilical, de mayor
calibre y portadora de sangre con un mayor contenido de
oxígeno.
En condiciones normales, el flujo de ambas
arterias umbilicales es comparable y aumenta progresivamente a
través del embarazo, representando el 40% del
débito cardíaco combinado fetal (Rudolph A, 1970).
El lecho vascular placentario no es inervado y, por lo tanto, es
refractario a sustancias vasoconstrictoras circulantes. De esta
manera, mecanismos regulatorios locales adquieren mayor
importancia.
La circulación útero placentaria y
umbilico placentaria son circuitos de
alto flujo y baja resistencia. Esta característica hace
que sus vasos posean ondas de velocidad de
flujo Doppler absolutamente reconocible y específica. El
flujo uterino total es compartido entre placenta y miometrio.
La velocidad de flujo sanguíneo uterino
aumenta progresivamente durante la gestación y esto es
enteramente el resultado de un aumento del área (de
sección transversa) del lecho vascular uterino.
La integridad de esta circulación es
fundamental para el desarrollo y mantenimiento
de un feto sano. Depende tanto del flujo sanguíneo uterino
como de una función
placentaria normal. La insuficiencia útero-placentaria es
una de las principales causas de CIR, y cuando es grave puede
producir muerte
fetal.
A. FLUJO SANGUÍNEO
UTERINO:
Durante la gestación la placenta se
nutre de la irrigación sanguínea materna y lleva a
cabo funciones nutritivas, respiratorias, renales,
hepáticas, inmunológicas y endocrinas para el
feto.
El aspecto más importante de la
circulación placentaria es su aparente ausencia de
cualquier mecanismo intrínseco autorregulador. Las
arteriolas espirales no tienen terminaciones nerviosas, de manera
que hay una relación simple y directa entre la PA
sanguínea materna y el flujo sanguíneo
intervelloso. En condiciones normales, el flujo sanguíneo
es directamente proporcional a la diferencia entre la PA y venosa
uterinas, e inversamente proporcional a la resistencia vascular
del útero.
En una gestación a término los
flujos sanguíneos materno y fetal son equiparables. El
flujo sanguíneo uterino total al final del embarazo
representa el 10% del GC (500-700 mL/min). El flujo placentario
supone el 80%, y el resto va al miometrio. El flujo umbilical de
un feto a término es de 350-400 mL/min.
Tres factores principales disminuyen el flujo
sanquíneo uterino durante el embarazo:
- Hipotensión sistémica:
·
compresión Ao-Cava,
·
hipovolemia o
·
bloqueo simpático producido por una técnica de
anestesia regional.
- Vasoconstricción uterina:
·
liberación de catecolaminas endógenas frente al
estrés del
trabajo de
parto.
La analgesia epidural efectiva disminuye el estímulo
adrenérgico y es beneficiosa.
·
Fármacos con actividad -adrenérgica
también disminuyen el flujo sanguíneo.
· Los
trastornos hipertensivos (HTA gestacional, preeclampsia…)
paradójicamente, se relacionan con frecuencia con
reducción del flujo sanguíneo por
vasoconstricción generalizada.
Los fármacos vasodilatadores son positivos siempre que
se mantenga la PA materna.
- Contracciones uterinas:
· El
aumento de la frecuencia de las contracciones uterinas
rítmicas al final de la gestación (contracciones de
Braxton Hicks) tiene un efecto beneficioso sobre el flujo
placentario.
·
Contracciones hipertónicas durante el trabajo de
parto, o infusiones de Oxitocina podrían disminuir el
flujo y producir hipoxia fetal.
B. FUNCIÓN
PLACENTARIA:
Durante la gestación, la placenta
actúa como sustituto de muchos órganos. El feto la
requiere para el intercambio de gases
respiratorios, la nutrición y la eliminación de
desechos.
FISIOPATOLOGÍA
ÚTEROPLACENTARIA
Las lesiones vasculares de la placenta que
afectan a los vasos maternos y fetales han sido y siguen
siendo en la actualidad, un tema de amplia discusión y
debate para la
comunidad
obstétrica y neonatal ya que se trata de una entidad
nosológica muy frecuente que pone en riesgo tanto la
salud del feto
como de la madre.
Existen numerosas enfermedades maternas
capaces de provocar alteraciones vasculares que determinan una
mala perfusión placentaria entre ellas la
pre-eclampsia, trombofilias, diabetes
mellitus, hiperlipidemias y diversas coagulopatias que si no son
debidamente controladas durante el embarazo pueden provocar tanto
la muerte del feto como de la madre.
Generalmente estos trastornos, si el producto de la
concepción sobrevive, a menudo se asocian con un
aumento de la incidencia del número de prematuros,
de los recién nacidos con restricción del
crecimiento fetal y de lesiones severas del sistema nervioso
central como la encefalopatía hipóxico-
isquémica y la parálisis cerebral.
Durante la hipoxia fetal se produce una
redistribución del flujo sanguíneo en favor de
cerebro,
miocardio y suprarrenales, a expensas de territorio pulmonar,
renal, esplácnico, muscular y piel
Paralelamente existe un privilegio de circuitos intrafetales
(extra e intracardíacos) de mayor velocidad y
oxigenación, también destinados, y por mecanismos
aún no debidamente dilucidados, a un mayor aporte cerebral
de oxígeno (conducto venoso-foramen oval-conducto
arterioso).
PATOLOGÍAS ESPECÍFICAS
Ø
Síndrome hipertensivo asociado al embarazo
En hipertensión, el estudio de
circulación útero-placentaria ayuda a discriminar
cuadros de diferente severidad.
El síndrome hipertensivo asociado al embarazo puede
ocurrir sin vasculopatía, o sin vasculopatía.
Ø
Retardo de crecimiento intrauterino
El ultrasonido convencional ha sido extensamente usado en la
identificación del feto con RCIU. La circunferencia
abdominal ha demostrado ser el parámetro único
más sensible para este diagnóstico.
Ø Flujo ausente
o reverso durante fin de diástole umbilical
El flujo ausente o reverso en arteria umbilical puede ser un
hallazgo fisiológico durante las primeras etapas del
embarazo.
La evolución natural de esta situación
es usualmente hacia sufrimiento fetal y muerte intrauterina, con
períodos variables de
latencia (1 a 26 días). El período de latencia no
ha demostrado ser un factor pronóstico.
Hay que tomar precauciones ante la posibilidad de
mejoría en la onda de velocidad de flujo, pues no se ha
demostrado cambio
significativo en el pronóstico perinatal para dichos
casos.
Como factores de peor pronóstico dentro de esta
población se han mencionado la
vasodilatacion del territorio cerebral ("brain sparing") y
alteraciones del sistema venoso
reflejando falla cardíaca derecha, especialmente
pulsatilidad de vena umbilical.
FRECUENCIA Y EPIDEMIOLOGÍA:
Existe una gran disparidad en
cuanto a la incidencia de los EHE: En USA se ha informado de una
prevalencia de hipertensión crónica del 1 al 5% y
de preeclampsia en nulíparas de entre el 10 y el 20%. En
España
(Comino, 1986) una frecuencia global de EHE del 2,23%, de los
cuales el 1,1 correspondían a preeclampsia, el 0,4% a
hipertensión crónica, el 0,3% a hipertensión
crónica más preeclampsia sobreañadida y el
0,5% a hipertensión transitoria
La variabilidad observada entre
los diferentes países puede deberse en parte a la
disparidad en la terminología y clasificaciones empleada,
por estadísticas hospitalarias, que no pueden
ser representativas de la población general, así
como a una serie de factores (nutricionales,
genéticos,…), por lo que la epidemiología de
estos procesos no se
puede universalizar, pero en general podríamos dar como
valores:
a)
En países desarrollados: Entre un 5-10% de las gestantes
presentan alguna forma de EHE; entre ellas 4-8% de
hipertensión gestacional, 1-2% de preeclampsia y 2-4% de
hipertensión crónica.
b)
En zonas con déficits nutricionales 10% ó
más de EHE.
La EHE se asocia al 30-40% de
gestaciones complicadas por HTA crónica, diabetes, LES,
etc.
La eclampsia se
presentaría en el 5-6 /10.000 gestaciones de más de
20 semanas.
FACTORES DE RIESGO:
a)
Placentarios: La preeclampsia es un síndrome asociado
exclusivamente al embarazo y para su desarrollo se requiere la
presencia de placenta.
b) Factores
inmunológicos: Ya que la unidad feto-placentaria
tiene, desde el punto de vista inmunológico, las
características de un aloinjerto, cuando los mecanismos
normales de inmunotolerancia entre trofoblasto y tejido materno
fracasan, se inicia una reacción inmunitaria anormal al
ponerse en contacto los antígenos paternos fetales con los
maternos.
En
este sentido, el riesgo de preeclampsia se incrementa:
-En
el primer embarazo, si bien la "protección" de la
gestación tiene caducidad en el tiempo y
así una gestación a los 10 años tiene un
riesgo semejante al de la primigesta.
-Con
una nueva paternidad en embarazos posteriores. En cambio, el
riesgo disminuye con la duración de la actividad sexual
antes del embarazo con la misma pareja, siempre que no se hayan
utilizado métodos de
barrera.
-Con la utilización previa de medios
anticonceptivos de barrera.
-En
embarazos con donación de ovocitos.
c)
Otras causas posibles, no inmunitarias, cuya génesis
estaría en la placenta, son:
-El
aumento de la masa trofoblástica: Excesivo tamaño
de esta última la gestación múltiple,
enfermedad trofoblástica, isoinmunización,
etc…
-Las alteraciones en la microvascularización
placentaria que conducirían a una reducción de la
perfusión. También en este grupo se
incluyen las anomalías en la diferenciación e
invasión del citotrofoblasto y la incorrecta
expresión de proteínas de la matriz
extracelular.
Maternos:
Mujeres con enfermedad subyacente tienen más posibilidad
de desarrollar preeclampsia. Se ha observado que el 20 a 50% de
pacientes con preeclampsia recurren en su siguiente
gestación, también las que desarrollaron un RCIU en
gestación anterior. Enfermedades que implican
alteración microvascular, pueden afectar el proceso de
placentación y las gestantes desarrollar una preeclampsia:
Diabetes, HTA crónica, nefropatías,
trombofilias.
Y
viceversa, varios estudios han mostrado que un porcentaje de
mujeres con preeclampsia presentan un alto riesgo de desarrollar
hipertensión, diabetes y, en general, procesos asociados a
enfermedad cardiovascular. No obstante, el riesgo es variable, lo
que demuestra la heterogeneidad del origen:
Raza:
Afro-americanas, en estudios comparativos incluso corrigiendo los
aspectos socioeconómicos.
Edad > 40 años y adolecentes.
Historia familiar de
preeclampsia.
HTA crónica.
Enfermedad renal crónica.
Síndrome
antifosfolipídico.
Diabetes mellitus.
Gen del angiotensinógeno.
Déficits nutricionales: Ca, Zn,
Se…
ETIOPATOGENIA:
La etiología, que se
desconoce, parece ser multifactorial. Lo único claro hasta
el momento es:
-La preeclampsia es una
enfermedad endotelial sistémica con la presencia de un
vasoespasmo generalizado, siendo la hipertensión una
manifestación más. Por ello sus manifestaciones son
multisistémicas.
-Se considera a la placenta el
foco patogénico de todas las manifestaciones de la
preeclampsia, ya que el parto es el único tratamiento
efectivo para la curación de la enfermedad.
Los conceptos actuales,
interrelacionados, que tratan de explicar su origen
son:
A.- Enfermedad
placentaria: Para que haya preeclampsia se necesita placenta,
aunque no haya feto (enfermedad trofoblástica) ni
útero (embarazo abdominal). Se produciría por
hipoperfusión placentaria directa o a través de una
desproporción entre el tejido trofoblástico (casos
de aumento de masa placentaria) y dicha capacidad de
perfusión.
En la gestación normal,
una vez que se ha realizado la implantación del
blastocisto en la zona de la decidua basal, se produce una
invasión de las arterias deciduales por parte del
trofoblasto, que destruye el endotelio e incluso la capa muscular
y que persiste hasta la 12 semana. Entre la 16 y la 20 se produce
una nueva invasión por el trofoblasto que afecta el tercio
interno de las arterias miometriales. Todo esto implica una baja
resistencia del lecho vascular que favorece la circulación
y recambio nutricional del feto.
En la preeclampsia los vasos
deciduales sufren la invasión pero no así los
miometriales; se conservan los elementos
musculoelásticos y se dificulta la dilatación
vascular, existiendo una mayor reactividad a las sustancias
vasoconstrictoras (fallo en la conversión vascular). El
fallo en la remodelación de las arterias espirales es la
base morfológica de la disminución de la
perfusión placentaria que lleva a una hipoxia precoz.
Podría asociarse también como mecanismo la
incompleta exposición
del tejido trofoblástico, que traería asociadas las
alteraciones inmunológicas.
El tejido trofoblástico
de las preeclámpticas muestra
alteraciones en el equilibrio de
los factores de crecimiento, citoquinas y expresión
alterada de antígenos no detectables en gestaciones
normales.
La isquemia placentaria
conducirá a una disfunción endotelial, a
través de los mediadores y mecanismos que a
continuación estudiaremos.
B.- Alteraciones
plasmáticas:
Sensibilidad
vascular aumentada a los efectos de sustancias presoras:
-Dieckmann
y Michel (1937) demuestran una mayor sensibilidad a la acción
de la vasopresina en gestantes con preeclampsia. Abdul-Kaim y
Assali (1961) demuestran una mayor refractariedad a la
angiotensina II (A II) en las gestantes y Gant (1973) demuestra
que a partir de la segunda mitad del embarazo esta refractariedad
se pierde e incluso se aumenta la sensibilidad a la A II en un
grupo de gestantes que desarrollarán una HIE.
-Este
aumento de sensibilidad parece radicar en la propia muscular de
los vasos, pues no está relacionada con los niveles de A
II como en la no gestante, ni los inhibidores de la A II
solucionan el problema.
-No
hay tampoco gran evidencia de un aumento de los niveles de
catecolaminas en preeclámpticas .
Sensibilidad
vascular alterada por anomalías catiónicas, en su
distribución o disponibilidad:
Sodio:
La infusión de ClNa hipertónico (no
isotónico) puede abolir la refractariedad vascular a la A
II. En diversas formas de HTA la dieta hiposódica tiene un
papel importante. Parece ser que las preeclámpticas
acumulan más y excretan menos Na. Pero la
concentración de Na es igual en gestantes normales que en
pacientes con HIE (el sodio se retiene paralelamente al agua). La
progesterona obliga a un aumento de actividad de la aldosterona
hasta l0 veces para ahorrar sodio, por lo que su reducción
en la ingesta en la gestante, más aún si se asocia
un diurético tiazídico, puede dar una hiponatremia
grave para madre e hijo.
Calcio:
La HTA se ha asociado a un aumento del Ca intracelular. Una
hipótesis en la génesis de la HIE
sería la generación defectuosa de un
proteína transportadora del Ca intracelular. Existen
autores que han hallado menores valores de TA en el tercer
trimestre en gestantes suplementadas con Ca. Otros han hallado
valores disminuidos de Ca en casos de HTA esencial. Por contra
otros no hallan ni hipocalcemia, ni beneficio por la
suplementación de Ca en gestantes con HIE.
Alteración de la cadena de ciclooxigenasa: Las PG
pueden prevenir la reactividad vascular y la inhibición de
su síntesis
con indometacina o altas dosis de aspirina condiciona un aumento
en la sensibilidad a la A II. Alteraciones en la síntesis
de PG podrían ser la causa de la HIE:
-Déficits
nutricios en precursores de PG aumentan la sensibilidad a la A II
en conejos. No se ha demostrado en mujeres.
-En
la HIE se ha visto una disminución de la PGE2, pero no de
la PGF2 : La PGE2 puede por inyección aumentar la
refractariedad a la A II y su síntesis se ve aumentada por
estímulo al aumento de la A II.
-En
la síntesis final de PG se forman paralelamente
prostanoides, entre ellos la prostaciclina (PGI2) es un potente
vasodilatador y el tromboxano-2 (TXA2) vasoconstrictor; en el
embarazo normal se altera la relación PGI2/TXA2, por
déficit en la síntesis de PGI2, pudiendo conducir a
la HTA. La aspirina a dosis bajas puede aumentar el cociente
PGI2/TXA2 y ser, en teoría,
beneficiosa. El dazoxiben disminuye el TXA2 y ha sido usado con
éxito
en casos de HIE grave. La
administración directa de PGI2 por contra ha tenido
efectos catastróficos en el feto y muy indeseables en la
madre. Otras afecciones que cursan con disminución de la
PGI2 asocian trombopenia y microangiopatía como en la
HIE.
Citotóxicos
circulantes: Actuando de manera conjunta (multifactorial)
conducirían a una hiperestimulación del tono
vascular que acabaría agotando el endotelio, dando en
éste alteraciones funcionales e incluso estructurales:
-Altereciones
lipídicas, que conducirían a un estrés
oxidativo aumentado (peroxidación). El estrés
oxidativo puede ser el nexo de unión entre la placenta
hipoperfundida y el síndrome materno. El transporte del
estrés oxidativo de la placenta a la circulación
sistémica estaría vehiculado por neutrofilos y
monocitos activados:
Se ha visto que están
aumentados productos de la peroxidación
lipídica.
También
se han visto aumentados fragmentos oxidados de
sincitotrofoblasto. En la placenta de preeclámpticas se
observan áreas de necrosis del sincitiotrofobasto
vellositario. Así mismo está aumentada la
apoptosis.
Los
niveles de vitaminas antioxidantes
(C y E) están disminuidos en la preeclampsia.
-Citoquinas proinflamatorias
:
-Expresión
anormal o ausencia de integrinas del citotrofoblasto y aumento de
IL-1, TGF y TNF:
IL-1
y TNF: reducen la expresión de la trombomodulina
(anticoagulante).
TNF:
es citotóxico endotelial y aumenta la síntesis de
ácidos
grasos y triglicéridos.
-La
neuroquinina B y VEGF (factor de crecimiento vascular endotelial)
se han visto aumentados en la preeclampsia, este
último también en situaciones de hipoxia.
-Fibronectina,
laminina.
-Factores procoagulantes:
-Factor
de von Willebrand.
-Incremento
de la expresión del inhibidor-activador del
plasminógeno tipo I.
-Disminución
del factor III plasmático.
-Aumento
de los complejos antitrombina III / trombina.
Otros factores:
Se han implicado también, aunque con menor
importancia:
-La
5-dihidroprogesterona restablece la refractariedad a la A
II en gestantes con HIE, pero no en gestantes normales, excepto
en aquéllas a las que se ha aumentado su sensibilidad a la
A II con indometacina.
-Nucleótidos
cíclicos: La teofilina también puede restablecer la
refractariedad a la A II en HIE. Al inhibir la fosfodiesterasa
aumentaría los nucleótidos cíclicos
vasorrelajantes a nivel de la muscular de los vasos.
-Sistema
nervioso simpático.
-Hormonas
calciotropas.
-Metabolismo
del Mg.
-Insulina.
C.- Lesión
endotelial:
El endotelio vascular es la
diana del proceso que implica la preeclampsia. El endotelio
regula la integridad vascular, el tono muscular de la pared y
evita la agregación plaquetaria y con ella la
coagulación microvascular, todo ello alterado en la
preeclampsia. La alteración del endotelio, es responsable
de una respuesta exagerada a sustancias presoras, lo que resulta
en la vasoconstricción que se observa en la
preeclampsia.
El endotelio, hiperactivado o
lesionado por la acción conjunta del estrés
oxidativo (peroxidación), citoquinas y procoagulantes que
hemos estudiado, se agota perdiendo su capacidad de mantener la
integridad vascular, prevenir la adhesión plaquetaria y
produce procoagulantes, vasoconstrictores y mitógenos
:
Se
altera el balance entre el TXA2 (producido en las plaquetas, es
un potente vasoconstricor y estímulo de la
agregación plaquetaria) y la prostaciclina (producida en
el endotelio tiene un efecto contrario).
Aumenta
la producción de endotelina: Marcador de
enfermedad endotelial, es el más potente vasoconstrictor
conocido hasta ahora. Polipéptido de 21 aa. con 3
isómeros, de los cuales la endotelina-1, sintetizada en
vecindad de la membrana basal, pasa a las fibras musculares,
donde actúa sobre su receptor específico (ETa),
provocando la vasoconstricción.
Alteración en la síntesis y funcionalidad del
óxido nítrico: Factor relajante derivado del
endotelio.
Todo lo anterior, lleva a :
-Un aumento de la permeabilidad
capilar.
-Trombosis plaquetaria y
desencadenamiento de la cascada de coagulación.
-Aumento del tono
vascular.
D.- Factores predisponentes:
Ayudaría a explicar el por qué unas mujeres
desarrollan la preeclampsia y otras no. Pueden ser:
Extrínsecos:
-Dieta.
-Duración
de las relaciones
sexuales.
Inmunológicos:
-El
hecho de que la HIE sea l0 veces más frecuente en
primigrávidas se ha pensado asociado a la creación
de anticuerpos maternos contra antígenos fetales, que
inmunizarían a la gestante para futuros embarazos. Pero la
HIE se da también en gestantes con molas, que no tienen
antígenos fetales, el trofoblasto es un antígeno
muy débil y las membranas carecen de antígenos de
histocompatibilidad. De todas formas se ha visto un aumento de
anticuerpos contra antígenos fetales del sistema HLA que
aumenta con la paridad; observándose paralelamente una
menor tasa de estos anticuerpos en pacientes con HIE, así
como una mayor histocompatibilidad con su compañero
sexual. Por otra parte la HIE es más frecuente en
pacientes homozigotas para los antígenos HLA-B.
-La
HIE se asocia la circulación aumentada de inmunocomplejos
(por defecto de anticuerpo o exceso de antígeno),
responsables posiblemente de la vasculitis y alteraciones
glomerulares y de la coagulación que se asocian a formas
severas.
-Hay
autores que abogan por un factor paterno reforzador del riesgo en
la mujer.
-La
trombocitopenia asociada hace también pensar en el factor
inmunológico.
Genética:
-Los
datos de
árboles
genealógicos, sugieren que el genotipo materno es
responsable de ser portador de una susceptibilidad a desarrollar
la preeclampsia, aunque no se ha determinado un gen responsable.
La preeclampsia en familiares de primer grado se asocia a un
aumento de riesgo de 3 a 4 veces. Cuando los dos padres son
producto de un embarazo complicado por preeclampsia, sus hijos
tienen una mayor posibilidad de padecerla a su vez. La mujer que se casa
con un hombre que
tuvo otro hijo en cuya gestación se desarrolló una
preeclampsia tiene un aumento de riesgo de 2.
-Entre
los genes que se han implicado en la preeclampsia se encuentran:
Factor V Leiden, mutaciones de la metilentetrahidrorreductasa,
gen del angiotensinógeno, mutaciones del factor tumoral de
necrosis (TNF).
-Se
ha invocado también un gen recesivo o un dominante con
penetrancia incompleta (dependiente del genotipo fetal).
Enfermedades
preexistentes:
-Enfermedades
autoinmunes con afectación de la microvasculatura.
-Enfermedades
de la regulación vascular y coagulación.
-Hiperlipemias
familiares, que aumentan lípidos
anormales fácilmente oxidables.
-Polimorfismos
génicos que sobrerregulan la síntesis de citoquinas
proinflamatorias y angiotensinógeno.
FISIOPATOLOGÍA Y SU CORRELACIÓN
ANATOMOPATOLÓGICA:
La manifestación de la
preeclampsia se caracteriza por el vasoespasmo, activación
del sistema de la coagulación y alteraciones en sistemas
humorales y autacoides involucrados en el control de la
presión arterial.
La alteración
patológica isquémica se da fundamentalmente a nivel
de la placenta, riñón, hígado y cerebro.
Esto condiciona una
disminución del flujo sanguíneo con
hipoperfusión generalizada de importancia inicialmente en
la placenta ya que disminuye el flujo un 35-50% lo que
condicionará una placenta de menor desarrollo y
función, con mayor tendencia al desprendimiento y, todo
ello, un daño
fetal.
Hallazgos anatomopatológicos clásicos
relacionados con la enfermedad hipertensiva del embarazo:
Vasculopatia
decidual
Anomalías en el
sitio de implantación
Cambios
morfológicos en las vellosidades coriales
Depósitos de
fibrina perivellosa
Infartos maternos
Hematomas (sobre todo
el retrodecidual)
Vasculopatía
decidual: son las lesiones que afectan a las arterias
espiraladas de la decidua materna e incluye las siguientes
entidades:
a)Falta de conversión fisiológica del lecho
vascular: es posible observar la presencia de arteriolas que
conservan su capa muscular intácta y en la vecindad
de las mismas hay presencia de células
del trofoblasto extravelloso que no invade la pared
vascular.
b)Hipertrofia de la capa muscular y fibrosis intimal de las
arterias espiraladas.
c)aterosis aguda: es la forma más común de
vasculopatia decidual . Esta lesión afecta a más
del 50 % de las placentas cuyas madres presentaron eclampsia
durante el embarazo. Esta lesión se caracteriza por la
presencia de histiocitos espumosos subintimales similares a los
observados en la arterioesclerosis
d)Trombosis
e)Necrosis fibrinoide: se caracteriza por la presencia de un
material hialino, acelular en la pared del lecho vascular.
Otros hallazgos frecuentes son la deciduitis crónica
linfocitaria y la necrosis decidual.
La vasculopatia decidual causa una reducción de la
circulación utero-placentaria y trae aparejado consigo un
riesgo incrementado de infarto de
origen materno y restricción del crecimiento fetal.
Anomalías en
el sitio de implantación: la presencia de
abundante trofoblasto extravelloso con numerosas
células gigantes en la decidua sería un
indicador de implantación superficial con poca
invasión vascular y conversión del lecho
Cambios
morfológicos en las vellosidades coriales:
a) Aumento de los nudos sinciciales: es un indicador de
hipoperfusión
b) Aceleración de la maduración: la hipoxia
tisular produce un aumento en la angiogénesis y aumento de
las ramificaciones vellositarias (antiguamente llamada
cambios de Tenney-Parker).
c) Hipoplasia de vellosidades terminales/deficiencia de
vellosidades terminales: estos cambios son observados en estados
de hipoperfusión crónica.
d) Aglutinación vellosa: es otro de los indicadores de
isquemia.
Hallazgos macroscópicos:
Las placentas suelen ser de tamaño pequeño y
peso disminuido para la edad gestacional. Histológicamente
las vellosidades coriales terminales son pocas y elongadas con
escasas ramificaciones y aumento de nudos sinciciales. El espacio
intervelloso se halla expandido. Dichos cambios placentarios se
hallan asociados con restricción del crecimiento y
alteraciones en el doppler.
Depósitos de
fibrina perivellosa: en las placentas de término es
normal encontrar algunos depósitos de fibrina perivellosa,
generalmente de localización subcoriónica. En los
estados de hipoperfusión la magnitud de este tipo de
depósitos aumenta dificultando aún más un
adecuado intercambio materno -fetal.
Infartos
maternos: macroscópicamente, en la superficie de corte
es posible observar áreas intensamente congestivas de
consistencia aumentada (infarto materno temprano) o lesiones
blanquecinas de consistencia firme (infarto materno antiguo).
Histológicamente los infartos maternos tempranos se
caracterizan por presentar vellosidades coriales con marcada
congestión capilar y hemorragia intravellosa con colapso
del espacio intervelloso, a medida que el tiempo transcurre, se
puede observar cariorrexis y picnosis nuclear del
sinciciotrofoblasto seguida de pérdida de la basofilia del
mismo y por último es posible visualizar la presencia de
"vellosidades coriales fantasmas (por
la necrosis coagulativa)" con aumento de la acidofilia y de los
depósitos de fibrina . Ocasionalmente pueden observar
algunos infiltrados de tipo polimorfonuclear.
Desprendimiento de
placenta normoinserta: la mayor parte del los
desprendimientos de placenta normoincerta obedecen a
patología vascular materna. Se caracteriza por la
presencia de un hematoma retrodecidual (se hallan ubicados entre
la decidua y la pared muscular del útero). Pueden ser
recientes o antiguos. Los recientes suelen disgregarse con
facilidad y muchas veces no es posible reconocerlos
macroscópicamente; en esta situación es conveniente
evaluar la presencia de signos
histológicos indirectos de desprendimiento placentario
(reducción del espacio intervelloso e intensa
congestión, edema y hemorragia del estroma velloso). Los
antiguos se hallan organizados y generalmente quedan adheridos a
la cara materna.
DOPPLER EN OBSTETRICIA
Una de las mayores preocupaciones en la
práctica obstétrica es la evaluación
del bienestar fetal o vigilancia antenatal. Análisis de regresión logística sobre factores de riesgo en
parálisis cerebral, sugieren un rol menos importante para
los fenómenos agudos durante el parto y uno muy importante
para los fenómenos de hipoxia ocurridos durante el
embarazo (Nelson, Ellenberg 1986). De esta manera, un objetivo
primordial de la vigilancia antenatal debe ser la
identificación del feto en riesgo de hipoxia-acidosis, a
fin de realizar un adecuado manejo tendiente a disminuir el
riesgo de muerte intrauterina y de secuelas neurológicas a
largo plazo.
La capacidad de estudiar el flujo
sanguíneo del feto y la circulación placentaria en
forma no invasiva, mediante velocimetría Doppler,
constituye el área de mayor avance en medicina
perinatal durante los últimos años.
La introducción de esta tecnología en la
práctica clínica requiere una evaluación
detallada de la información disponible y de los
fenómenos fisiológicos involucrados.
Existe una secuencia racional de
explicación de los fenómenos hemodinámicos e
histológicos que finalmente producen consecuencias
clínicas características. Ella constituye la base
del análisis Doppler.
Fenómenos aún no del todo
dilucidados producen una alteración en el proceso de
transformación de las arterias espirales en vasos
útero placentarios de menor resistencia (Giles W,
1985; McCowan L, 1987; Bracero L, 1989; Fox H, 1986; Khong T,
1986). Estos cambios se reflejarían en ondas de velocidad
de flujo uterino alteradas. Esta situación de hipoxia del
espacio intervelloso se traduciría potencialmente en
cambios hemodinámicos e histológicos placentarios,
como: vascularización anormal de vellosidades terciarias,
áreas de isquemia, infarto, y aterosis. El aumento
consiguiente de los índices umbilico-placentarios y la
hipoxia asociada explican una serie de ajustes cardiovasculares
fetales.
El principal fenómeno a nivel fetal está
relacionado con cambios regionales en la resistencia vascular de
diferentes órganos. Durante la hipoxia fetal se produce
una redistribución del flujo sanguíneo en favor de
cerebro, miocardio y suprarrenales, a expensas de territorio
pulmonar, renal, esplácnico, muscular y piel (Peeters L,
1979; Wladimiroff J, 1986). Paralelamente existe un privilegio de
circuitos intrafetales (extra e intracardíacos) de mayor
velocidad y oxigenación, también destinados, y por
mecanismos aún no debidamente dilucidados, a un mayor
aporte cerebral de oxígeno (conducto venoso-foramen
oval-conducto arterioso).
Una adecuada interpretación clínica de cada uno
de estos fenómenos constituye la base de la
introducción de la velocimetría Doppler en la
práctica obstétrica.
Esquema introducción Doppler en
obstetricia

¿QUé ES DOPPLER?
Efecto Doppler es el cambio en la frecuencia recibida
desde un receptor fijo, en relación a una fuente emisora
en movimiento
(Doppler JC, 1843). Este principio aplicado al ultrasonido
(>20 KHz) nos permite conocer ondas de velocidad de flujo de
un vaso determinado.
Ultrasonido emitido con una frecuencia determinada (Fe), desde un
transductor hacia una columna de partículas
sanguíneas en movimiento, será dispersado y
reflejado con una frecuencia diferente. La diferencia entre la
frecuencia emitida y reflejada se llama frecuencia Doppler (Fd).
Como consecuencia, Fd es proporcional a la velocidad de flujo
sanguíneo y se expresa en la fórmula:
V x cos alfa= velocidad sanguínea
Fd= 2 Fe x V x cos alfa c = velocidad
ultrasonido
c alfa= ángulo de insolación
A recordar de esta fórmula: el
ángulo de insonación debe ser el mínimo
posible en orden a obtener una adecuada onda de velocidad de
flujo. La onda obtenida cae dentro del margen audible (1-20 MHz),
siendo el sonido parte de
su característica.
Doppler color es,
esencialmente, el sistema computacional incorporado a la
máquina de ultrasonido. Este asigna unidades de color,
dependiendo de la velocidad y dirección del flujo
sanguíneo. Por convención, se ha asignado el color
rojo para el flujo hacia el transductor y el azul para aquel que
se aleja.
Evaluación onda de velocidad de
flujo
Se han desarrollado índices
cualitativos descriptivos de esta onda de velocidad de flujo
pulsátil, ángulos independientes.
Indice pulsatilidad: IP =
(A-B)/promedio (Gosling, King, 1974)
Relación S/D: SD = A/B. (Stuart, Drumm, 1980)
Indice de resistencia: IR= (A-B)/A (Planiol, Pourcelot,
1974)
Teniendo en cuenta la evidencia previamente descrita,
podemos asociar dichos índices empíricos con la
variable fisiológica: onda de velocidad de flujo. Ellos
reflejan resistencia o impedancia al flujo producido por el lecho
microvascular distal al sitio de medición. De esta manera obtenemos
índices S/D, IP, e IR mayores, cuanto mayor es la
resistencia al flujo sanguíneo del territorio
irrigado.
Sin existir aún consenso definitivo, se
han usado principalmente relación S/D e IR para descripción de territorio uterino, e IP y
S/D para territorio umbilical y vasos intrafetales. Debe
considerarse, sin embargo, que en casos de ausencia de flujo en
fín de diástole, el IP es el único
utilizable.
Territorios específicos:
Circulación uterina
El estudio Doppler de circulación uterina se puede
realizar vía transabdominal o transvaginal.
Idealmente, el equipo debería consistir en un sistema
de Doppler pulsado color.
Técnica: el transductor debe ser
ubicado en forma para-sagital, a nivel de la unión
cervico-ítsmica, 2-3 cm medial a la espina ilíaca
ántero superior. En esta posición se busca la
ubicación de ambas arterias uterinas a nivel de su
nacimiento desde la división anterior de las respectivas
arterias ilíacas internas. Para ello se ubica a la
paciente en decúbito dorsal y se dispone el transductor de
ultrasonido Doppler color en la pared uterina lateral baja,
buscando medialmente la zona correspondiente.
Características de onda de velocidad de
flujo: a partir del segundo trimestre ocurre un
progresivo descenso de los índices Doppler de territorio
uterino. Se transforma progresivamente en un circuito de baja
resistencia, desapareciendo la escotadura diastólica
temprana ("notch") y disminuyendo progresivamente, además,
la diferencia entre zonas ipsi o contralateral a inserción
placentaria. De esta manera se forma una onda
característica a partir de las 26 semanas de
gestación.
Se han publicado rangos de normalidad para valores de IR y de
relación S/D (Pearce J.,Br J Obstet Gynaecol 1988;
95:244-56; Arduini D, Ultrasound Obstet Gynecol 1991;
1:180-5).
Significado de onda de velocidad de flujo
anormal: a partir de las 26 semanas parece apropiada
la decisión de un solo valor de
corte, > de p 95 ó 2 DS y, eventualmente, la
medición de una sola arteria uterina. Este límite
de normalidad sería de: > 2,6 para S/D y/o la presencia
de escotadura (Fleisher A, 1986).
Aún no existe evidencia concluyente que correlacione
aumentos en impedancia de territorio uterino durante el primer
trimestre y un mal resultado perinatal.
Se han
publicado hallazgos significativos para la correlación
entre índices uterinos alterados obtenidos en segundo
trimestre y la aparición de preeclampsia o retardo de
crecimiento intrauterino (haciendo consideración a
variaciones metodológicas, conceptuales y de
población en estudio). Para estudios realizados entre las
16 y 26 semanas se han encontrado valores de sensibilidad de 25 a
76%, especificidad de 69 a 97%, valores predictivos positivos de
42 a 78% y negativos de aproximadamente 87%, para
aparición posterior de las patologías descritas. El
valor diagnóstico es máximo cuando el examen se
realiza a las 26 semanas (Campbell S, 1986; Schulman H,1989;
Harrington K, 1991; Bewley S,1989).
El screening Doppler uterino para población de bajo
riesgo sigue siendo controversial. La mayoría de los
estudios, sin embargo, demuestran que los embarazos destinados a
resultado perinatal adverso presentaron índices uterinos
elevados durante el segundo trimestre.
Circulación umbilical
La circulación umbilical es un circuito de baja
resistencia, y eso se refleja en la forma de la onda de velocidad
de flujo.
Técnica: en orden a minimizar
errores se deben visualizar correctamente al menos 5 ondas de
velocidad de flujo pulsátil. Medir aquella con el
máximo peak sistólico y mínimo
diastólico obtenidos. El ángulo de
insonación debe ser el mínimo, en orden a evitar la
subestimación de valores (a pesar del uso de
índices ángulo-independientes).
Características de onda de velocidad de
flujo: existe una progresiva disminución de
los índices umbilicales a lo largo del embarazo. Este
fenómeno es en gran parte explicado por el desarrollo de
arterias de pequeño calibre y arteriolas a nivel de las
vellosidades terciarias, disminuyendo, por tanto, la resistencia
global del lecho vascular.
Factores que afectan la variabilidad de esta onda son:
· Edad
gestacional: en las primeras 20 semanas existe gran
variación de los índices, incluyendo ausencia o
flujo reverso diastólico. Su valor, entonces, es muy
limitado durante este período.
·
Frecuencia cardíaca fetal: dentro de rangos normales de
frecuencia, la variación experimentada no es mayor que el
error sistemático de medición.
·
Movimientos respiratorios fetales: cambios bruscos de
presión intratorácica producen gran
irregularidad en el patrón de flujo umbilical. Durante la
"inspiración" se produce aumento del flujo pulmonar, con
disminución consiguiente del flujo umbilical.
· Sitio
de obtención de la señal: evaluación Doppler
en zona próxima a inserción placentaria muestra
índices menores. No se ha demostrado que esta
variación sea significativa.
·
Variabilidad interobservador (10-14%) e intraobservador
(5-9%). Debe ser evaluada para cada centro.
Rangos de normalidad han sido publicados por Thompson R. (Br J
Obstet Gynaecol 1988; 95:589-91), y Arduini D. J Perinat Med
1990; 18(3):165-72)
Significado de onda de velocidad de flujo
anormal: el sustrato histológico placentario
para el aumento de los índices de circulación
umbilical, es una disminución en el número de vasos
de pequeño calibre en vellosidades terciarias. Cambios
obliterativos en dichos vasos también han sido descritos.
Mecanismos vasoactivos locales han sido implicados en la
génesis de estos fenómenos. En consecuencia,
índices elevados umbilicales no indican directamente
condición fetal, sino lesión vascular
placentaria.
Existe actualmente fuerte evidencia que correlaciona
índices umbilicales elevados con situación de
hipoxia-acidosis in utero, así como también con
resultado perinatal adverso, en términos de mayor
incidencia de RCIU y elevada morbimortalidad perinatal.
Valores de anormalidad, según la experiencia publicada,
han sido IP > de 2 DS en relación al promedio, o
relación S/D > percentil 95 para la edad gestacional, o
> 3,0 en valores absolutos.
Siendo un circuito de baja resistencia, la anormalidad extrema
es la ausencia o flujo reverso durante el diástole.
Circulación cerebral
La circulación intracerebral puede ser detectada
mediante Doppler color tan precozmente como 8 semanas de
gestación (Kurjak A, 1993). Existe una diferencia
significativa entre circulación cerebral y la de otros
territorios en etapas tempranas del embarazo. La impedancia
disminuye progresivamente durante el transcurso del embarazo.
Este fenómeno ocurre precozmente a nivel cerebral (flujo
diastólico positivo desde las 11 semanas), en
relación a territorio aórtico o umbilical (flujo
diastólico positivo desde las 15 semanas). Este
interesante mecanismo de autorregulación cerebral que
asegura aporte de oxígeno y glucosa al
cerebro embrionario en sus primeros estadios de desarrollo es, de
hecho, el mecanismo más importante de ajuste posterior
ante situaciones críticas de disminución de
perfusión intracraneana.
Técnica: la ubicación del
transductor debe ser en un plano standard de diámetro
biparietal, incluyendo el tálamo y el cavum del septum
pelucidum. La arteria cerebral media (ACM) puede ser vista
pulsando a nivel de la ínsula. En esta posición se
mueve el transductor hacia la base del cráneo, logrando
una visión de pedúnculos cerebrales. Obteniendo una
imagen Doppler
color adecuada del polígono de Willis, se investiga la ACM
a aproximadamente un centímetro desde su nacimiento, como
la principal rama en dirección ántero-lateral hacia
el borde lateral de la órbita.
Se debe ejercer la mínima presión con el
transductor sobre la calota fetal, en orden a no producir un
aumento transitorio de presión intracraneana y errores de
medición (Vyas 1989).
Características de onda de velocidad de
flujo: es una onda de tipo mediana a alta
resistencia. La evolución de sus índices de
evaluación sigue un curso parabólico durante el
embarazo. Vasodilatación fisiológica entre las 15 a
20 semanas, y hacia el término, refleja el alto grado de
actividad metabólica cerebral en estos períodos.
Rangos de normalidad para IP de arteria cerebral media, han sido
establecidos en un estudio combinado longitudinal y transversal,
realizado por G.Mari (Am J Obstet Gynecol 1992;166:1262-70).
Significado de onda anormal:
probablemente la alteración más significativa, a
este nivel, es un aumento importante en el flujo sanguíneo
cerebral (Arbeille P, Wladimiroff J, 1987). Este fenómeno,
llamado "brain sparing", se genera como mecanismo compensatorio
ante situación de hipoxia fetal. Es así que valores
de IP < de p 5 para la edad gestacional, deben ser
interpretados (dentro de un contexto de sospecha de hipoxia
fetal), como un mecanismo activo de vasodilatación
cerebral. En general, valores absolutos de IP <1,2 deben hacer
sospechar redistribución de flujo. Se ha propuesto el uso
de una relación de índices cerebrales con
umbilicales, siendo la relación cerebro-placentaria <1
la que se correlaciona con mal resultado perinatal (Gramellini D,
1992). Se debe evaluar, además, el impacto clínico
de la vasoconstricción concurrente en territorios
pulmonar, intestinal y renal.
CONCLUSIONES
La integridad de esta circulación es
fundamental para el desarrollo y mantenimiento de un feto sano.
Depende tanto del flujo sanguíneo uterino como de una
función placentaria normal. La insuficiencia
útero-placentaria es una de las principales causas de CIR,
y cuando es grave puede producir muerte
fetal.
La circulación placentaria fetal procede
de dos arterias umbilicales, ramas de la arteria
hipogástrica del feto, llegan a la placenta a
través del cordón umbilical, donde se ramifican en
forma radial para irrigar los cotiledones placentarios
La sangre materna llega a los senos placentarios
a través de las arterias espirales, ramas de las arterias
uterinas.
La circulación útero placentaria y
umbilico placentaria son circuitos de alto flujo y baja
resistencia. Esta característica hace que sus vasos posean
ondas de velocidad de flujo Doppler absolutamente reconocible y
específica. El flujo uterino total es compartido entre
placenta y miometrio.
Existen numerosas enfermedades maternas capaces
de provocar alteraciones vasculares que determinan una mala
perfusión placentaria entre ellas la pre-eclampsia,
trombofilias, diabetes mellitus, hiperlipidemias y diversas
coagulopatias que si no son debidamente controladas durante el
embarazo pueden provocar tanto la muerte del
feto como de la madre.
Doppler nos ofrece la capacidad de
discriminar un nuevo grupo de pacientes,
ya sea dentro de la población general o, con mayor
fuerza, dentro
de una población de alto riesgo. Selecciona a un nuevo
grupo de pacientes, sobre el cual se deben centrar todos los
esfuerzos de vigilancia antenatal convencionales.
Doppler umbilical e intrafetal también es
una importante ayuda en el difícil proceso de toma de
decisiones sobre cuándo interrumpir en el
pretérmino severamente enfermo intrauterino. Es
también un complemento en la decisión de
conducta expectante y no
intervención en patologías maternas estabilizadas o
en el retraso de crecimiento intrauterino de tipo
constitucional.
BIBLIOGRAFÍA
Ackerman J, Gonzalez EF , Gilbert-Barness E. Inmunological
Studies of the Placenta in Maternal Connective Tissue
Disease. Pediatr Develop Pathol 1999; 2;19-24.
Baergen RN, Manual of
Benirschke and Kaufmann`s Pathology of the Human Placenta.
Springer, New York, 2005. Chapter 18. Placental
Malperfusion. Page 332-350.
Dekken GA, Sibai BM. Etiology and Pathogenesis of
Pre-eclampsia: Current Concepts. Am J Obstet Gynecol 1998;
179:1359-1375 (Review)
Khong T.Y. Placental Vascular Development and Neonatal
Outcome. Seminars in Neonatology 2004; 9: 255-263.
Kraus FT, Redline RW, Gersell DJ, Nelson DM, Dicke JM . Atlas
of Nontumor Pathology. Armed Forces Institute of Pathology.
Washington, DC. 2004 Chapter 6: Circulatory Problems:
Thrombi and Other Vascular Lesions . Page 117-157.
Pipkin FB. Risk Factors in Pre-eclampsia. N Engl J Med 2001;
344; 925-926.
Redline RW, Boyd T, Campbell V, Hyde S, Kaplan C, Khong TH,
Prashner H, Waters BL. Placental Underperfusion: Nosology
and Reproducibility of Placental Reaction Patterns. Pediatr
Develop Pathol . 2004. 7:237-249.
Sebire N.J., MD; Backos M., MD; El Gaddal S.,MD; Goldin D.,
MD; Regan L., MD. Placental Pathology, Antiphospholipid
Antibodies, and Pregnancy Outcome in Recurrent Miscarriage
Patients. Obstet Gynecol. 2003; 101:258-63.
Zhang P.,MD, PhD; Schmidt M.,MD, Cook L., MD. Maternal
Vasculopathy and Histology Diagnosis of Preeclampsia: Poor
Correlation of Histologic Changes and Clinical Manifestation.
American Journal of Obstetrics and Gynecology. 2006; 194:
1050-6.
APéNDICES

Autora
Katia Paola Castro Carranza
DEPARTAMENTO DE MORFOLOGÍA HUMANA
MORFOLOGÍA INTEGRADA
universidad nacional de trujillo
FACULTAD DE MEDICINA
ESCUELA
MEDICINA
TRUJILLO – PERU
2008
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
