Con `oxido de etileno:


Es un agente alquilante que se une a compuestos
con hidrógenos lábiles como los que tienen grupos
carboxilos, amino, sulfhidrilos, hidroxilos, etc.Es utilizado en
la esterilización gaseosa, generalmente en la industria
farmacéutica. Destruye todos los microorganismos incluso
virus.
Sirve para esterilizar material termosensible,
como el descartable (goma, plástico,
papel, etc.), equipos electrónicos, bombas
cardiorrespiratorias, metal, tubuladuras, etc. Es muy peligroso
por ser altamente inflamable y explosivo, y además
cancerigeno.
Con aldehídos:
Son agentes alquilantes que actúan sobre
las proteínas,
provocando una modificación irreversible en enzimas e inhiben
la actividad enzimática. Estos compuestos destruyen las
esporas. Glutaraldehído:

Consiste en preparar una solución alcalina
al 2% y sumergir el material a esterilizar de 20 a 30 minutos, y
luego un enjuague de 10 minutos. Este método
tiene la ventaja de ser rápido y ser el único
esterilizante efectivo frío. Puede esterilizar
plástico, goma, vidrio, metal,
etc. Formaldehído:Se utilizan las pastillas de
paraformaldehido, las cuales pueden disponerse en el fondo de una
caja envueltas en gasa o algodón, que después pueden ser
expuesta al calor para una
rápida esterilización (acción
del gas
formaldehído). También pueden ser usadas en Estufas
de Formol, que son cajas de doble fondo, en donde se colocan las
pastillas y se calienta hasta los 60° C y pueden esterilizar
materiales de
látex, goma, plásticos,
etc.Las pastillas de formalina a temperatura
ambiente
esterilizan en 36 hs.
Esterilización por gas-plasma de
Peróxido de Hidrógeno:

Es proceso de
esterilización a baja temperatura la cual consta en la
transmisión de peróxido de hidrógeno en fase
plasma (estado entre
líquido y gas), que ejerce la acción biocida.*
Ventajas: No deja ningún residuo tóxico. Se
convierte en agua y
oxígeno
al final del proceso. El material no precisa aireación. El
ciclo de esterilización dura entre 54 y 75 minutos.
*Desventajas:No se pueden esterilizar objetos que
contengan celulosa,
algodón, líquidos, humedad, madera o
instrumental con lúmenes largos y estrechos. Es el
método de esterilización más caro de entre
los descritos.
Los materiales que se esterilizan son metales,
plásticos, textiles, etc.* Métodos
físicosCalor:La utilización de este método y
su eficacia depende
de dos factores: el tiempo de
exposición y la temperatura.Todos los
microorganismos son susceptibles, en distinto grado, a la
acción del calor. El calor provoca
desnaturalización de proteínas, fusión
y desorganización de las membranas y/o procesos
oxidantes irreversibles en los microorganismos. Calor
Húmedo:El calor húmedo produce
desnaturalización y coagulación de
proteínas. Estos efectos se debe principalmente a dos
razones: *El agua es una
especie química
muy reactiva y muchas estructuras
biológicas son producidas por reacciones que eliminan
agua. *El vapor de agua posee un coeficiente de transferencia de
calor mucho más elevado que el aire.Autoclave

Se realiza la esterilización por el vapor
de agua a presión.
El modelo
más usado es el de Chamberland.Esteriliza a 120º a
una atmósfera de presión (estas condiciones pueden
variar)y se deja el material durante 20 a 30
minutos.Equipo:Consta de una caldera de cobre,
sostenida por una camisa externa metálica, que en la parte
inferior recibe calor por combustión de gas o por una resistencia
eléctrica, esta se cierra en la parte superior por una
tapa de bronce. Esta tapa posee tres orificios, uno para el
manómetro, otro para el escape de vapor en forma de
robinete y el tercero, para una válvula de seguridad que
funciona por contrapeso o a resorte.Funcionamiento:Se coloca agua
en la caldera, procurando que su nivel no alcance a los objetos
que se disponen sobre una rejilla de metal. Se cierra asegurando
la tapa, sin ajustar los bulones y se da calor, dejando abierta
la válvula de escape hasta que todo el aire se desaloje y
comience la salida de vapor en forma de chorro continuo y
abundante.
TyndalizaciónEsterilización por
acción discontinua del vapor de agua, se basa en el
principio de Tyndal. Las bacterias que
resisten una sesión de calefacción, hecha en
determinadas condiciones, pueden ser destruidas cuando la misma
operación se repite con intervalos separados y en varias
sesiones.Se efectúa por medio del autoclave de
Chamberland, dejando abierta la válvula de escape, o sea
funcionando a la presión normal. Puede también
realizarse a temperaturas más bajas, 56º u 80º
ocúpara evitar la descomposición de las sustancias
a esterilizar, por las temperaturas elevadas. *Ventajas del calor
húmedo: Rápido calentamiento y penetración
Destrucción de bacterias y esporas en corto tiempo No deja
residuos tóxicos Hay un bajo deterioro del material
expuesto Económico *Desventajas: No permite esterilizar
soluciones que
formen emulsiones con el agua Es corrosivo sobre ciertos
instrumentos metálicos.
Los materiales que se pueden esterilizar son
textiles y metales.
Calor seco:El calor seco produce
desecación de la célula,
es esto tóxicos por niveles elevados de electrolitos,
fusión de membranas. Estos efectos se deben a la
transferencia de calor desde los materiales a los microorganismos
que están en contacto con éstos.La acción
destructiva del calor sobre proteínas y lípidos
requiere mayor temperatura cuando el material está seco o
la actividad de agua del medio es baja.Estufas


Doble cámara, el aire caliente generado
por una resistencia, circula por la cavidad principal y por el
espacio entre ambas cámaras, a temperatura de 170º C
para el instrumental metálico y a 140º C para el
contenido de los tambores.Se mantiene una temperatura estable
mediante termostatos de metal, que al dilatarse por el calor,
cortan el circuito eléctrico. *Ventajas del calor seco: No
es corrosivo para metales e instrumentos. Permite la
esterilización de sustancias en polvo y no acuosas, y de
sustancias viscosas no volátiles.
*Desventajas: Requiere mayor tiempo de
esterilización, respecto al calor húmedo, debido a
la baja penetración del calor.
Los materiales que se pueden esterilizar son
polvos, sustancias viscosas y metales.
Radiaciones Su acción depende de: El tipo
de radiación
El tiempo de exposición La dosis
Ionizantes:Producen iones y radicales libres que
alteran las bases de los ácidos
nucleicos, estructuras proteicas y lipídicas, y
componentes esenciales para la viabilidad de los microorganismos.
Tienen gran penetrabilidad y se las utiliza para esterilizar
materiales termolábiles (termosensibles) como jeringas
descartables, sondas, etc. Se utilizan a escala industrial
por sus costos. Rayos
Ultravioletas:

Afectan a las moléculas de DNA de los
microorganismos. Son escasamente penetrantes y se utilizan para
superficies, se utilizan para la esterilización en
quirófanos.Rayos Gamma:
Su empleo esta
basado en los conocimientos sobre la energía
atómica. Este tipo de esterilización se aplica a
productos o
materiales termolábiles y de gran importancia en el campo
industrial. Puede esterilizar antibióticos, vacunas,
alimentos,
etc.

FiltraciónSe usan membranas filtrantes con
poros de un tamaño determinado. El tamaño del poro
dependerá del uso al que se va a someter la muestra. Los
filtros que se utilizan no retienen virus ni micoplasmas, estos
últimos están en el límite de
separación según el diámetro de poro que se
utilice. La filtración se utiliza para emulsiones oleosas
o soluciones termolábiles. Su usa para esterilizar
aceites, algunos tipos de pomadas, soluciones oftálmicas,
soluciones intravenosas, drogas
diagnósticas, radiofármacos, medios para
cultivos celulares, y soluciones de antibióticos y
vitaminas.Existen tres tipos básicos de
filtros: Filtros profundos o Filtros de profundidad:Consisten de
un material fibroso o granular prensado, plegado, activado, o
pegado dentro de los canales de flujo. En este tipo de filtros la
retención de las partículas se produce por una
combinación de absorción y de retención
mecánica en la matriz.
Membranas filtrantes: Tienen una estructura
continua, y la retención se debe principalmente al
tamaño de la partícula. Partículas
más pequeñas al tamaño del poro quedan
retenidas en la matriza del filtro debido a efectos
electrostáticos. Filtros de huella de nucleación
(Nucleoporo):Son películas muy delgadas de policarbonato
que son perforadas por un tratamiento conjunto con
radiación y sustancias químicas. Son filtros con
orificios muy regulares que atraviesan la membrana verticalmente.
Funcionan como tamices, evitando el paso de toda partícula
con un tamaño mayor al del poro.
Testigos y controles

Controles de Esterilización:
Son controles que se realizan sobre el método de
esterilización. Monitorean o controlan si el proceso de
esterilización funciona correctamente.
Controles Biológicos:Utiliza indicadores
biológicos como controles del proceso de
esterilización. Estos indicadores son preparaciones
estandarizadas de microorganismos relativamente resistentes al
método de esterilización que se emplea. Los
indicadores se procesan en forma conjunta con el material a
esterilizar y el número de microorganismos presentes en el
indicador es mayor que el que se encuentra en el material.
Una vez concluido el proceso de
esterilización los indicadores son inoculados en medios de
cultivo adecuados e incubados durante un determinado
período de tiempo. Si el proceso de esterilización
fue correctamente empleado y funciona bien no debe observarse
desarrollo del
indicador incubado.

Testigos biológicos:
Es un Indicador Biológico autocontenido para utilizar
en ciclos de esterilización por Óxido de Etileno y
Vapor.
Cada unidad está compuesta por un tubo
plástico, una ampolla de vidrio rompible con medio de
cultivo, y un disco de papel inoculado con esporas. El diseño
de la tapa permite la penetración del agente esterilizante
dentro del testigo y a su vez evita la
contaminación de su contenido luego del proceso
de esterilización. Es un producto apto
para uso hospitalario e industrial.
. Para usar en procesos por Óxido de
Etileno: 600mg/L, 54ºC, 60%RH.. Contiene esporas de Bacilus
atrophaeus 10.6 (ATCC Nº 9372). Incubación en 48
hs.
. Para usar en procesos por Vapor: en ciclos por
gravedad a 121ºC, y ciclos de prevacío entre
121ºC y 135ºC.. Contiene esporas de Geobacilus
stearothermophilus 10.5 y Geobacilus stearothermophilus 10.6..
Incubación en 24 hs.
Indicadores de autocultivo.
§ Son los únicos controles que garantizan
una esterilización efectiva.
§ Contienen microorganismos altamente resistentes a
la esterilización (stearothermophilus) en ampollas con
caldo de cultivo incorporado.
§ Lectura en
incubadoras especiales:
o Negativos = esterilización
correcta.
o Positivos = reesterilizar de nuevo.


Tiras de esporas.
§ Papel inoculado con esporas en sobres.
§ Lectura en servicio de
microbiología.
Estos controles deben realizarse a diario en centrales de
esterilización y a nivel industrial. En autoclaves
pequeños deben realizarse cada cierto tiempo.
ActivaciónDespués que el testigo
biológico se ha enfriado, hay que romper la ampolla de
vidrio del interior apretando los lados del tubo plástico.
La unidad se encontrará correctamente activada una vez que
el medio de cultivo haya sido liberado de la ampolla de vidrio y
haya entrado en contacto con el disco de papel inoculado con
esporas.
EtiquetadoCada unidad cuenta con una etiqueta que detalla:
número de lote, fecha de vencimiento,
fabricante y tipo de proceso de esterilización al que
está destinado su uso. La etiqueta posee espacio para que
el usuario marque la fecha, número de autoclave y
configuración de la carga. La etiqueta incorpora un
indicador de proceso para facilitar la distinción entre
los testigos procesados de los no procesados.
CertificaciónCada lote tiene certificación de
población, especies, valor-D,
valor-z (si fuera aplicable), pureza y vencimiento. Su vida
estante es de 18 meses a partir de la fecha de
fabricación.
Control: el testigo debe conservar su color original
para considerar la carga del ciclo como estéril. Si el
testigo no muestra signos de
crecimiento se debe considerar el test como
inválido.
Test: un ciclo de esterilización fallido se indica
mediante turbidez y/o un cambio de
color hacia el amarillo. Un testigo que permanece con su color
original indica que los parámetros del ciclo de
esterilización han sido alcanzados satisfactoriamente.
Controles fisicoquímicos:
Termocuplas: son métodos directos que
registran la temperatura a la que se desarrolla la
esterilización.Sustancias de punto de fusión
conocido: se utilizan en autoclaves generalmente, son
sustancias con un punto de fusión similar al de la
temperatura de esterilización del proceso. Estas
sustancias están mezcladas con un colorante y al
fundir indican si se alcanzó la temperatura
óptima de esterilización y el tiempo que se
mantuvo.Cinta testigo: cinta de papel crepado
indicadora del proceso de esterilización con vapor. La
impresión cambia de blanco a negro al ser sometida a
condiciones de esterilización de ciclo corto. Se puede
escribir sobre ella. Excelente adhesión al papel,
tela, vidrio, metal y plástico. Está formulada
con un adhesivo no manchante y no se transfiere a los
substratos.Aplicaciones Cinta testigo del proceso de
esterilización en autoclaves de vapor en
clínicas médicas, dentales y hospitales. Muy
útil para sujetar paquetes con una variedad de
instrumentos médicos en el proceso de
esterilización. Esta cinta está diseñada
para utilizarse en el ciclo corto de esterilización
con vapor.

Controles químicos:
Los controles químicos son dispositivos
especiales impregnados de compuestos químicos sensibles al
cumplimiento de los parámetros de esterilización
(tiempo, presión y temperatura).
- Viran de color si
se cumplen los parámetros físicos del
autoclave.
- Deben ubicarse en la
cámara, interior o exterior del paquete de material.
- Validar su "viraje" o
cambio de color antes de usar el material.

Tipos de controles químicos de
esterilización:
§ Test de Bowei and Dick: detección de
bolsas de aire. Debe realizarse al inicio del día o tras
reparaciones o mal funcionamiento.
§ Control
químico externo: en la superficie de cada paquete.
§ Control químico interno: sueltos o
incorporados en los envases.
Controles de Esterilidad :
Permite controlar en forma probabilística
si el material quedó completamente esterilizado pues se
testea un porcentaje representativo de todo el material.
Transferencia Directa a Medios de Cultivo:Se
transfiere una parte de la muestra a medios de cultivos
apropiados que permitan el crecimiento de cualquier
contaminante.
Tioglicolato para anaerobios y aerobios
(37°C)Tripticasa-Soja para aerobios (25°C)
Las muestras representativas se incuban en estos
medios durante un período de 14 días, al cabo del
cual no se debe observar ningún tipo de crecimiento.
Puede ocurrir que la muestra no se encuentre
estéril pero que no se produzca crecimiento durante la
incubación por algún motivo inherente al medio o a
la muestra, por ejemplo presencia de algún inhibidor,
etc.
Test de Promoción del CrecimientoEs un testigo del
control de esterilidad. Son testigos que se utilizan para los
medios de crecimiento del control ya que estos medios tienen
capacidad de promover el crecimiento. Para estos testigos se
utilizan microorganismos con exigencias nutricionales. Los medios
deben ser inoculados con un bajo número de
microorganismos, se incuban durante 7 días, al cabo de los
que se debe observar un abundante crecimiento.
Test de BacteriostasisEs un control que se
realiza para determinar si la muestra supuestamente
estéril no posee propiedades bacteriostáticas. De
esta forma se previenen falsos negativos pues no se produce
crecimiento habiendo en la muestra microorganismos viables. Para
este test se toman los medios de cultivo con microorganismos de
ensayo y se
siembran en las muestras a testear. Se incuban durante 7
días. Si se produce crecimiento esto indica que el
material no contenía inhibidores.
Filtración por Membranas:Se utiliza para
determinar la esterilidad de medios de cultivo, soluciones de
antibióticos, etc.
Se filtran los medios y se procesa el filtro como
en un control de esterilidad para determinar si hay
microorganismos presentes.
Desinfectantes y antisépticos
* Los antisépticos son agentes
químicos que se usan para reducir el número de
microorganismos que se encuentran en la piel y en las
membranas mucosas, sin producirles irritación o daño.
Además de eliminar o matar los microorganismos, es posible
que los antisépticos también impidan el crecimiento
o el desarrollo de algunos tipos de microorganismo.
Se emplean los antisépticos para:
Preparar la piel, la cérvix o la
vagina antes de un procedimiento clínicoLavarse quirúrgicamente
Lavarse las manos en situaciones de alto
riesgo, tal como antes de un procedimiento invasivo o de
contacto con usuarios que tengan alto riesgo de infectarse
(p.ej. los recién nacidos o los usuarios
inmunodeprimidos).
Los antisépticos no se usan para con
materia
inerte, tales como los instrumentos y las superficies.
Los antisépticos están hechos para reducir o
destruir los microorganismos de la piel o de las membranas
mucosas sin hacerles daño a los tejidos.
Normalmente los antisépticos tienen menos potencia que las
sustancias químicas utilizadas para desinfectar los
objetos inanimados. Por eso, nunca se deben usar soluciones
antisépticas para desinfectar materia inerte tales como
instrumentos y guantes reutilizables. Además, nunca se
deben dejar a remojo en soluciones antisépticas tales
objetos como pinzas, tijeras, bisturís y agujas de
sutura.
Antisépticos comunes y cómo usarlos
para preparar a los usuarios
Yodo – Povidona, esta libre de
toxicidad, generalmente el uso continuo, sin enjuague,
provoca irritación en la piel. Debe mantenerse en
recipientes opacos y al abrigo de la luz.Clorhexidina de 4% (p.ej. Hibiclens).
Aplicar, quitar el exceso con gasa esterilizada o
algodón esterilizado. No es recomendable para el
lavado de manos quirurgico.Yodo de 1-3%, seguido de alcohol de 60-90%
(etílico o isopropílico). Aplicar, dejar que se
seque al aire.Clorhexidina con cetrímido (p.ej.
Savlon). Aplicar, quitar el exceso con gasa esterilizada o
algodón esterilizado.Alcohol Iodado, es una combinación de
Yodo con alcohol al 70% , se lo utiliza para la
preparación de la zona operatoria de la piel. Debe
mantenerse en recipientes opacos y tapados para evitar la
evaporación y la alteración de su
concentración inicial.Alcohol, es una alternativa para la
antisepsia de la piel en los pacientes sensibles al Yodo, con
un tiempo no inferior a los 60 segundos.
El alcohol
etílico al 70% (etanol), es el mas frecuente en el
ambiente hospitalario.
El Alcohol isopropílico al 70 o 90%
(isopropanol), es mas potente que el etílico, ambos
alcoholes
resecan la piel, lesionan el epitelio y provocan dolor cuando se
aplican sobre heridas abiertas.
El alcohol al 70% con el agregado de emolientes
en forma de gel, puede utilizarse como lavado antiséptico.
Son inflamables y deben ser guardados en un lugar limpio, fresco
y bien ventilados y herméticamente cerrados.
PERÓXIDO DE HIDROGENO (Agua oxigenada)
Ha sido reconocido como germicida desde hace más de 100
años atrás.
Ha sido empleado durante años para promover la limpieza
y debridamiento de las heridas.
Tiene un débil efecto germicida y fácilmente se
degrada a oxígeno molecular y agua. Es muy importante su
estabilidad, (6-10%), lo que es muy difícil de garantizar
en nuestros mercados en
relación al tiempo de almacenamiento.
Su acción es mecánica, las burbujas de oxígeno
desprenden tejido muerto y las bolsas de bacterias ayudan a
eliminarlas de la herida. Tiene inconvenientes, puede crear
ampollas llenas de aire en los nuevos epitelios,
separándolos del tejido subyacente. Por consiguiente, el
peróxido de hidrógeno no debe utilizarse cuando la
herida está adecuadamente debridada y se está
formando epitelio nuevo. Tras su aplicación, debe
eliminarse de la herida con solución fisiológica.
Tampoco debe emplearse en ciertas heridas profundas ni en la
cavidad peritoneal, pues podría provocar un émbolo
gaseoso en los capilares y vasos linfáticos.
Se ha demostrado que es bactericida, virucida y fungicida. La
inmersión de material limpio en una solución
estabilizada al 6% proporcionaría una desinfección
de alto nivel en treinta minutos.
Su estabilidad no está garantizada en nuestro medio,
por lo que no se la recomienda. Corroe metales como el cobre,
aluminio y
zinc. Debe mantenerse al abrigo de la luz.
EVITE el uso de lo siguiente:
Peróxido de hidrógeno (de
0,3%), disponible en preparaciones antisépticas para
impedir infecciones en cortaduras, quemaduras y raspaduras
menores. Estos productos no son apropiados para el lavado
quirúrgico y la preparación de la piel de
usuarios.Productos que contengan compuestos de amonio
cuaternario, tales como cloruro de benzalconio (p.ej.
Zephiran). Como estos productos son desinfectantes, no se
deben utilizar en lugar de antisépticos. Se contaminan
estos desinfectantes en la presencia de bacterias comunes,
son incompatibles con el jabón y se desactivan
fácilmente si se usan con gasa de algodón.Compuestos que contengan el mercurio (tal
como el laurel mercúrico). No se deben usar porque son
extremadamente tóxicos, producen ampollas y cuando se
aspiran, causan trastornos del sistema nervioso central
(tales como el entumecimiento, la sordera y dificultades del
habla) o la muerte. Además, se pueden absorber a
través de la piel y a las mujeres embarazadas que se
expongan a cantidades reducidas se les puede producir
defectos de nacimiento en el feto.
Cómo evitar que se contaminen las
soluciones:
No deje nunca a remojo en soluciones
antisépticas el algodón, la gasa o las
esponjas. Si se meten las pinzas o los dedos en el recipiente
una y otra vez para agarrar los objetos, se
contaminará tanto la solución como los objetos
mismos.No deje nunca a remojo en soluciones
antisépticas el algodón, la gasa o las
esponjas. Si se meten las pinzas o los dedos en el recipiente
una y otra vez para agarrar los objetos, se
contaminará tanto la solución como los objetos
mismos.
Echar en un recipiente pequeño la
cantidad de antiséptico que se necesite y mojar el
algodón o la gasa allí. Después de
preparar al/a la usuario/a, tire todo el antiséptico
que quede en este recipiente más pequeño. OEchar del recipiente el antiséptico
directamente al algodón o a la gasa. No toque el borde
del recipiente con el algodón o la gasa, para evitar
que el recipiente se contamine.
 Los
Los
antisépticos están hechos para reducir o eliminar
los microorganismos que se encuentran en la piel o en las
membranas mucosas. No utilice nunca los antisépticos para
desinfectar los objetos o instrumentos y jamás deje el
instrumental a remojo en soluciones antisépticas.
* Se denomina desinfectante a un proceso
físico o químico que mata o inactiva agentes
patógenos tales como bacterias, virus y protozoos
inhibiendo el crecimiento de microorganismos patógenos en
fase vegetativa que se encuentren en organismos vivos.
Los desinfectantes reducen los organismos nocivos
a un nivel que no dañan la salud ni la calidad de los
bienes
perecederos.
Los desinfectantes se aplican sobre objetos
inanimados, como instrumentos y superficies, para tratar y
prevenir las infecciones.
Clasificación de los elementos y
niveles de desinfección
Clasificación de los elementos:
De acuerdo al riesgo potencial
de producir una infección durante su uso, los materiales
se dividen en:
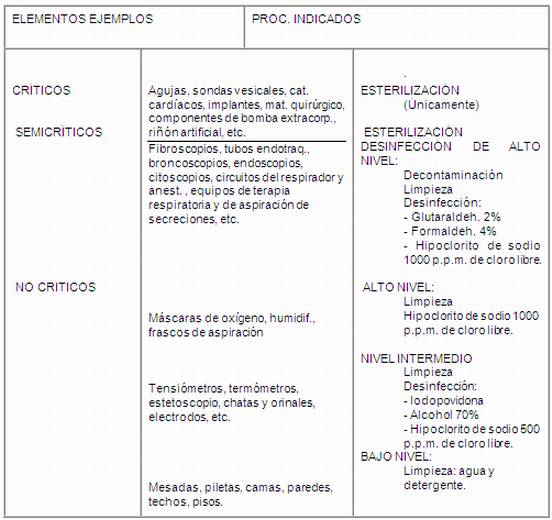
a) Críticos: Constituido por instrumental u objetos que
se introducen directamente dentro del torrente sanguíneo o
dentro de áreas normalmente estériles del cuerpo
(Ej.: instrumental quirúrgico, catéteres
cardíacos, implantes, etc.)
Tienen GRAN RIESGO DE PRODUCIR INFECCIONES
b) Semicríticos: Constituido por elementos que
están en contacto con las membranas mucosas intactas del
paciente o piel lesionada . Generalmente no penetran en cavidades
estériles del cuerpo (Ej.: endoscopios rígidos y
flexibles no invasivos, tubos endotraqueales, citoscopios,
etc.)
Tienen GRAN RIESGO DE PRODUCIR INFECCIONES
c) No críticos: Son aquellos elementos que
habitualmente no tocan al paciente o tocan la piel intacta (Ej.:
muletas, mesa del paciente, tensiómetro, estetoscopio,
etc.)
Tienen POCO RIESGO DE PRODUCIR INFECCIONES
Niveles de desinfección:
a) Alto nivel: Destruye todos los microorganismos con
excepción de un gran número de esporas bacterianas
(bacterias, casi todas las esporas de hongos, bacilo de
TBC, pequeños virus)
b) Nivel intermedio: Inactiva bacterias vegetativas, hongos,
casi a todos los virus, pero no a endosporos bacterianos.
c) Bajo nivel: Destruyen a la mayoría de las bacterias,
algunos virus, algunos hongos, pero no afectan organismos
más resistentes como bacilo de TBC o endosporos
bacterianos.
CLASIFICACIÓN DE ELEMENTOS
NIVELES DE DESINFECCIÓN
DESINFECTANTES DE USO COMÚN EN HOSPITALES Y/O CENTROS
ASISTENCIALES
AMONIOS CUATERNARIOS (Cl. de Benzalconio: Tersotyl M.R.) (DG6
M.R.)
Estos compuestos tuvieron amplio uso desde su inicio como
germicida en el año 1935.
Son buenos agentes de limpieza, pero actualmente no se
recomiendan como antisépticos de piel y tejidos, ya que
diversos estudios han documentado que en ellos sobreviven y
desarrollan bacterias Gram (-), que han podido relacionarse con
brotes de infecciones hospitalarias. Materiales como el
algodón y las gasas disminuyen su actividad, porque
absorben los ingredientes activos.
No se los debe utilizar para la desinfección de
elementos críticos o semicríticos. Solamente para
el tratamiento de materiales no críticos.
No eliminan esporas ni determinados virus, como por ejemplo el
de la Hepatitis B.
Debe usarse con cuidado, ya que se ha visto que algunas
soluciones permiten el crecimiento de Pseudonomas.
COMPUESTOS MERCURIALES (Merthiolate M.R.)
Son antisépticos que inactivan rápidamente en
presencia de proteínas. Se requieren altas concentraciones
de mercuriales para alcanzar un efecto bactericida: son
desinfectantes de bajo nivel y prácticamente no cumplen
ningún rol en las estrategias
modernas de desinfección.
Usado sobre materiales o superficies debe recordarse que
corroe los metales.
FORMALDEHÍDO
Inactiva microorganismos a través de la
alcalinización de las proteínas.
Se presenta en concentraciones del 40%. La solución
acuosa es bactericida, tuberculicida, fungicida, esporicida y
virucida.
Según su dilución actuará como
esterilizante, luego de un tiempo prolongado o como desinfectante
de alto nivel.
Se lo utiliza para la inactivación de bacterias en los
sistemas de
distribución de agua tratada de los
servicios de
Hemodiálisis.
Si se lo emplea en la reutilización de membranas su
concentración será del 4%, con un tiempo de
contacto de 24 Hs. como mínimo. Debe tenerse presente que
los filtros deben ser enjuagados cuidadosamente antes de usarse.
Resultan convenientes monitoreos periódicos de
formaldehído residual.
Los vapores de formaldehído tienen efectos
tóxicos e irritantes, por lo que es necesaria la
utilización de elementos protectores durante su
manipulación. (Máscaras respiratorias, protectores
oculares, guantes resistentes y delantales impermeables). El
ambiente de trabajo debe
contar con un adecuado sistema de
recambio de aire. Concentraciones ambientales de 2 p.p.m. han
ocasionado efectos tóxicos.
Las pastillas de formalina no deben utilizarse en cajas de
instrumental, guantes, etc. Su acción germicida solo se
produce en la vaporización por calor. Actualmente se
desaconseja su uso en quirófanos o habitaciones de
pacientes, por ser no solo un procedimiento
riesgoso (efecto carcinogénico) sino también
ineficaz.
Por las razones expuestas, su uso queda limitado a los
servicios de Hemodiálisis.
GLUTARALDEHÍDO AL 2%
Es una solución estable, bactericida de amplio
espectro, eficaz contra virus, de efectiva acción
esporicida. Resulta activo ante presencia de materia
orgánica. Algunas publicaciones indican que no es
corrosivo para los metales, gomas y lentes, mientras que otras
indican presencia de corrosión a largo plazo. No tiene efectos
deletéreos sobre cementos y lentes de endoscopios. Se debe
evitar la corrosión por contacto, debida a la presencia de
dos metales diferentes en presencia de un electrolito conductor:
agua. (Ej.: No mezclar acero inoxidable
con instrumental de níquel).
Actúa afectando las lipoproteínas de la membrana
celular y el citoplasma de las formas bacterianas vegetativas,
altera el sistema enzimático y el daño en la
membrana permite la salida de sustancias y componentes
intracelulares y facilita la entrada directa del desinfectante al
citoplasma.
Entre los factores que influencian su actividad, se debe tener
en cuenta: (Ver factores que influyen en los procedimientos de
desinfección)
– Ph:
Solución alcalina. 7.9
– Concentración: al 2%
– Temperatura: ambiente
– Materia orgánica: Tratar de disminuir su presencia en
los materiales a desinfectar. Uno de los factores más
importantes es la limpieza previa del material, requisito sin el
cual el proceso de desinfección fracasaría. El
glutaraldehído es incrustante de la sangre.
Recientes estudios han podido demostrar que concentraciones de
glutaraldehido disminuyen del 2,1% (Ph 8.5) al 1,3% (Ph 7.4) a lo
largo de un período de 28 días a temperatura
ambiente.
El glutaraldehido tiene una vida media entre 14 y 28
días. Los preparados comerciales tienen una
solución "activadora", un inhibidor de corrosión y
glutaraldehido al 2%. La solución "activadora" se coloca
en el momento de preparar el producto para usar por primera vez.
Debe tenerse la precaución de mezclar muy bien la
preparación, para evitar obtener una solución
parcialmente activada.
MATERIALES QUE SE PUEDEN DECONTAMINAR, DESINFECTAR Y
ESTERILIZAR CON GLUTARALDEHIDO AL 2%.
Aluminio, zinc, acero de carbono,
carburo de tungsteno, acero inoxidable, acero cromado, cloruro de
polivinílico, policarbonato, polietileno, poli propileno,
sondas de neopreno, silicón, tubos de látex, tubos
de Krotón, y nylon rígido.
Resulta de utilidad para
materiales especiales, como LARINGOSCOPIOS, ELECTROBISTURIES,
ENDOSCOPIOS, LUCES ÓPTICAS, etc., que por su calidad no
pueden ser sometidos a procedimientos de decontaminación
habituales o por calor, como por ej. el autoclavado y a los que
el Hipoclorito de sodio ya sea al 1 o al 10% les produce con el
tiempo un importante deterioro.
Se debe controlar diariamente, hasta que se establezca un
promedio para el uso y duración del glutaraldehido
"activado", con tiras medidoras de Ph. y con tiras medidoras del
porcentaje de concentración, que debe mantenerse siempre
al 2%. La capacidad germicida de la solución varía
según el uso del producto activado. A mayor uso diario, se
produce una disminución de la vida media del mismo. Se
recomienda su medición y no el uso estandarizado durante
14 ( endoscopios, por ej., por posibilidad de bacilo de Koch ) o
28 días. Algunas marcas
comerciales de este producto ofrecen tiras reactivas destinadas a
medir la concentración del mismo, Es por ello que conviene
tener en cuenta las especificaciones del fabricante. Hay varias
marcas comerciales disponibles en el mercado.
La contaminación de la solución con
materia orgánica influenciará en la pérdida
de la actividad. Materias orgánicas como sangre o pus,
podrían actuar protegiendo especies microbianas o
compitiendo con la molécula desinfectante, reduciendo su
actividad.
Se ha comprobado disminución en la actividad del
glutaraldehido cuando se diluye con agua.
Cuando se lo utiliza como DESINFECTANTE DE ALTO NIVEL en
instrumentos sometidos a limpieza previa, la mayoría de
los estudios sugieren un tiempo de contacto no menor a 10
minutos. Cuando la finalidad es la DECONTAMINACIÓN el
tiempo se extenderá a 30 minutos y cuando el objetivo es la
ESTERILIZACIÓN: 10 HORAS o más.
Los objetos sometidos a desinfección con glutaraldehido
se someterán a previa limpieza manual.
(Realizada con guantes y protección ocular).
La limpieza manual se realiza cepillando la superficie de los
instrumentos con cepillos duros (no de metal). Ej. cepillo de
dientes o de uñas, bajo chorro de agua fría.
No se debe usar agua a más de 45 grados
centígrados, pues coagula la albúmina y hace
más difícil la limpieza.
Las superficies no deben frotarse con polvos limpiadores
domésticos, abrasivos, lana de acero, esponjas de metal,
cepillo de alambre, porque estos rayan los metales, aumentando
las posibilidades de corrosión.
Los cepillos de limpieza, una vez usados, deben ser lavados,
desinfectados (Hipoclorito al 1%) y secados para evitar que se
contaminen.
Los detergentes empleados en la limpieza, no deben ser
abrasivos ni cáusticos ni precipitar en aguas duras.
Instrumentos acanalados, huecos o con cualquier tipo de luz,
deben ser lavados en su interior mediante presión por
medio de una jeringa o similar.
Este procedimiento también es válido cuando se
sumerge el elemento en el glutaraldehido, a efectos de que el
desinfectante contacte con todas las partes del instrumental a
desinfectar.
Después de la limpieza manual, el enjuague es muy
importante, ya que se debe retirar todo resto de detergente antes
de sumergir el instrumental en la solución desinfectante.
(No menos de dos minutos).
Resulta por lo expuesto relativamente fácil el uso de
glutaraldehido, pero si bien es de baja irritabilidad y
toxicidad, puede tener algunos efectos tóxicos para el
personal que
lo manipula, ya sea en procesos de desinfección,
decontaminación o esterilización.
Del mismo modo, puede resultar tóxico para el paciente
expuesto al instrumental tratado, que en algunos casos puede
involucrar el contacto con la sangre.
Algunas investigaciones
mostraron que los plásticos y las gomas absorben el 10%
del glutaraldehido y lo liberan después de 24 Hs.
La absorción de glutaraldehido depende del tiempo de
contacto entre el enjuague del material. Esta investigación sugiere la inmersión
del material en agua estéril en tres baños
diferentes, agitando frecuentemente el material (2 minutos en
total ). Tener en cuenta el enjuague a presión con jeringa
en instrumental con luz interior.
El glutaraldehido es levemente irritante de la piel,
severamente irritante de los ojos y membranas mucosas. Se han
documentado dermatitis de
contacto en asistentes dentales y enfermeras del quirófano
por no adoptar medidas de bioseguridad. La inhalación de
aldehídos también resulta tóxica.
Debe utilizarse en un ambiente exclusivo, con buena
aireación.
El Personal que lo utilizará debe estar entrenado en su
correcto manejo y debe conocer las medidas de bioseguridad que
debe emplear para su manipuleo.
La vestimenta de los operadores consistirá en:
Barbijo, Protección ocular (Antiparras o gafas, para
evitar riesgo de salpicaduras en los ojos) y guantes resistentes.
Dado que no se puede medir la cantidad de partículas por
millón que se encuentran presentes en la atmósfera
del lugar donde se utiliza el producto, se recomienda que los
operadores no trabajen en dicho lugar durante más de
quince o veinte minutos continuos.
Si el ambiente cuenta con extractor de aire, a la altura de
las mesadas de trabajo, el riesgo de toxicidad para los
operadores disminuye. Se recomienda mantener los contenedores de
glutaraldehido activado correctamente tapados, salvo en el
momento en que se realizan los procedimientos.
HIPOCLORITO DE SODIO
Conocido popularmente como agua lavandina, cloro,
lejía, agua de Javel o agua Jane es un compuesto
químico, además de un fuerte oxidante
químico cuya fórmula es NaClO.
Contiene el cloro en estado de oxidación +1 y por lo
tanto es un oxidante fuerte y económico. Debido a esta
característica se aprovechan sus propiedades de
desinfectantes.
En disolución acuosa sólo es estable a pH
básico. Al acidular en presencia de cloruro libera cloro
elemental. Por esto debe almacenarse alejado de cualquier
ácido.
Se utiliza como desinfectante en el ambiente hospitalario, ya
sea por aplicación directa en mesadas desinfectando los
lavabos gracias a su poder
fungicida y bactericida, o elementos no críticos como
chatas y orinales, se recomienda el uso diluido con agua (12,5
ml. de Hipoclorito por cada 100 ml. de Agua.
En parasitología puede ser utilizado para la
esporulación invitro de Ooquistes de protozoos del phylum
apicomplexa en el método denominado de Cawthorn.
Manejo del
material estéril
El campo estéril siempre debe estar lo mas
lejos posible del personal de salud que lo va a manipular, al
depositar el material en el campo estéril debe haber mucha
precaución, como por ejemplo, separar las manos del
cuerpo, abrir el paquete y tirar el material en el campo
estéril, se considera que los 2 cm. que rodean al campo
estéril esta contaminado. Si se nos cayera el paquete
tocado en el campo estéril se debe volver a preparar el
campo estéril y utilizar todo como material limpio o
volverlo a esterilizar.
METODO PARA LA ESTERILIZACION DE MATERIAL
– Una limpieza exhaustiva del material
utilizado
– El empaquetado ha de ser de tela o papel +
plástico
– Medios de esterilización, autoclave
(calor húmedo), poupinel (calor seco)
– Controles de esterilización,
químicos, físicos (autoclave), tiras reactivas que
viran de color a una determinada temperatura, biológico
(esporas).
– Almacenaje, no ha de variar la Tª, que
este protegido de la contaminación del aire, poner ultravioletas
para proteger el mal esterilizado.
– Ante la sospecha de que no este bien
esterilizado utilizar como limpio.


Conclusión
Esterilización
La esterilización es una técnica de saneamiento
preventivo para conseguir la asepsia, o sea, la
destrucción de todos los microorganismos y sus formas de
resistencia que puedan existir en la superficie o en el espesor
de un objeto cualquiera. Obtiene como resultado la ausencia de
todo germen vivo consiguiendo material estéril. Se debe
considerar como inadecuados los siguientes términos por
ser falsos: esterilización por ebullición
(sólo se trata de desinfección);
esterilización por antisépticos (en la piel y
mucosas no se puede conseguir esterilización por ellos y
en cuanto a los procedimientos de inmersión en
desinfectantes son muy escasos y requieren tiempo y pH
adecuados), y esterilización del intestino (sólo
podemos ejercer con antibióticos y quimioterápicos
un efecto bacteriostático o bactericida de algunos de los
gérmenes en él contenidos, pero no de toda su flora
bacteriana). La esterilización se puede conseguir por
procedimientos físicos y químicos, siendo
más usados los primeros, aunque en los últimos
años se están desarrollando los
químicos.
Se denomina desinfección a una técnica de
saneamiento que tiene por objeto destruir los microorganismos
patógenos, productores de enfermedades transmisibles,
actuando sobre personas, animales,
ambiente y superficies de locales, objetos y excretas que son
portadores de aquéllos, evitando así su
propagación; esta acción germicida puede ser
bactericida, viricida, fungicida o esporicida. Se dice que un
objeto es infectante cuando en su superficie o en su masa lleva
gérmenes de alguna enfermedad transmisible; para que deje
de serlo se emplea la desinfección o la
esterilización, siendo la primera la
técnica de saneamiento, que utiliza la medicina
preventiva, para destruir los gérmenes patógenos,
mientras que utiliza la esterilización cuando no solamente
se destruyen los gérmenes patógenos, sino cualquier
forma elemental de vida patógeno o saprofita e incluso las
formas de resistencia. Un objeto puede estar desinfectado, pero
no esterilizado, mientras que todo objeto estéril
está desinfectado. Si se actúa con material que no
posee germen vivo alguno, ni siquiera en sus formas de
resistencia, se dice que dicho material es aséptico y que
se trabaja con asepsia. Si se actúa en personas,
heridas infectadas, mediante productos bacteriostáticos o
germicidas (antisépticos), se realiza
antisepsia.
Bibliografía
MANUAL DE ENFERMERIA DE LA UNIVERSIDAD DE
ROSARIO / 2ª EDICION, ESTERILIZACION.APUNTES DE LA FACULTAD DE CIENCIAS EXACTAS (
UNLP)www.microbiologia.com.ar
www.wikipedia.org
www.ramosmejia.org
www.higiene.edu.uy
www.saludymedicinas.com
Autor:
Paola Aquino
Kateryn Vidaurre Roca
Docentes: Lic. Marta Druguer, Lic. Beatriz
Núñez
Escuela de Enfermería
del Hospital Israelita
Enfermería Profesional / 2º
cuatrimestre
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
