¿Cómo documentar en un Laboratorio de Terapia con un sistema de gestión de calidad? (página 2)
q) Control de calidad,incluidas las
comparaciones interlaboratorios.
r) Sistema de información de
laboratorio.
s) Informes de los resultados.
t) Acciones correctivas y gestión de
las reclamaciones.
u) Comunicación y otras relaciones
con los pacientes,profesionales de la salud,otros
laboratorios y proveedores.
v) Auditorías internas.
y) Ética.
Manual de
procedimientos
Un procedimiento es una secuencia de pasos
para ejecutar una tarea de rutina.Se prescribe como
se procedería en ciertas circunstancias para producir un
resultado deseado(1).
-SE DEBEN CUMPLIR LOS SIGUIENTES
PRINCIPIOS:
A) Definir las actividades y
funciones del laboratorio.
B) A partir de lo anterior,concretar los
procesos y sus relaciones de la manera más eficaz
y eficiente estableciendo un primer
mapa de procesos.
C) Implicar a todo el personal del
laboratorio.
D) Definir y listar los
procedimientos(procesos)que se van a desarrollar,comenzando
por documentar los más sencillos e
importantes,que son los que están relacionados
con
usuarios o clientes("procedimientos
clave").
E) No escribir nada que ya esté
escrito y podamos asumirlo como documento
propio,anexar o hacer referencia;p.e. procedimientos
analíticos y de mantenimiento de equipos
facilitados en muchos casos por los fabricantes o
sus agentes,etc.
F) Para cada procedimiento,comenzar
haciendo un diagrama con las tareas que
comprende el proceso y un esquema de los
puntos que debe incluir y su contenido.
G) Cuando se escriba un
párrafo,volver a leerlo detenidamente y pensar para
volver a escribirlo de la forma más corta
y simple.¡Ni una sola palabra que no sea
imprescindible!.
H) Utilizar diagramas siempre que se
pueda para simplificar el texto.
I) No escribir nada que no sea
estrictamente necesario,entendiendo por tal que lo escrito
sea lo mínimo y suficiente para
que:
– Los que ejecuten el procedimiento lo
lleven satisfactoriamente a la práctica.
– Cualquier colega ajeno o nuevo en el
laboratorio,después de consultar la
documentación del SGC pudiera conocer
de manera fácil y precisa todo el funcionamiento del
laboratorio.
– Un auditor del laboratorio pueda apreciar
que el SGC se ha implantado de acuerdo con la
norma tomada como referencia.
Distinguiremos dos tipos de
procedimientos:
-PROCEDIMIENTOS GENERALES,que los
denominaremos"PROCEDIMIENTOS
OPERATIVOS DE LA CALIDAD(POC)",
corresponden a los procesos estratégicos de
Gestión de la calidad y a los procesos de
apoyo para dicha gestión.
-POE son los procedimientos
operativos de los procesos clave,o sea para la
realización de los servicios en sus fases
preanalítica, analítica y
postanalítica.
En la siguiente figura se diferencia entre
el MC y el manual de procedimientos(4):

Procedimientos
operativos específicos
Los POE son instrucciones escritas para
diversas operaciones particulares o generales y aplicables a
diferentes productos o insumos La realización de POE es
requerida por las BPL y por la regulación bajo normas ISO
9000.
Se requiere que estos estén escritos
y que sean seguidos fielmente por toda persona envuelta en la
operación correspondiente.Su propósito principal es
garantizar la uniformidad, reproducibilidad y consistencia de las
características del producto lote tras lote,empleado a
empleado y turno a turno.
Los POE deben cumplir con ciertas
características:
– Ser escritos en un idioma que los que lo
van a ejecutar entiendan.
– Describir los pasos para realizar cada
tarea en orden cronológico.
– Enumerar todos los materiales a
utilizar.
– Evitar usar palabras ambiguas tales
como:aproximadamente,varias,caliente o
frío,etc..
– Especificar
temperatura,concentraciones.
– Cumplir con todas las
reglamentaciones(BPL,ISO,etc).
– Describir claramente el uso de puntos
decimales y reglas de redondeo.
– Evitar el uso de sinónimos y de la
palabra etcétera.
– Escribir el POE usando oraciones cortas y
con verbos en modo activo.
La siguiente figura muestra en diagrama de
flujo para la elaboración de un POE(1):

En la próxima figura se describe el
formato de un POE(8):

Beneficios de los POE:
-Los procedimientos son la primera
herramienta en el entrenamiento del nuevo personal.
-Garantizan la realización de las
tareas siempre de la misma forma.
-Sirven para evaluar al personal y conocer
su desempeño.
-Al ser de revisión
periódica, sirven para verificar su actualidad y como
reentrenamiento del personal con
experiencia.
-Promueven la comunicación entre los
distintos sectores de la empresa.
-Son útiles para el desarrollo de
auditorias internas y externas.
Requisitos para el manejo de los
POE:
-La distribución de POEs debe
funcionar correctamente.
-Estar registrados
adecuadamente.
-Guardar un juego completo de las versiones
vigentes.
-Los POE nuevos deben ser distribuidos tan
rápido como sea posible,igual que aquellos que
sean nuevas versiones de otra ya existente.
-Tener disponibles suficientes manuales en
las áreas de trabajo.
-Retirar las versiones anteriores de los
POE.
-Los POE deben ser incluidos como parte del
entrenamiento de normas GMP(Good –
Manufacture Practice).
-Validar su ejecución.
–Organización por
áreas.
-No incluir varios temas diferentes en el
mismo POE(1).
Los instructivos
de trabajo
Por cada procedimiento se debe identificar
si se requiere IT.La instrucción de trabajo es
"información que explica en detalle el como se
efectúa una operación concreta". Las modalidades
comúnmente utilizadas son: listas de verificación,
flujogramas, tablas de decisión y ayudas visuales.Los IT
están en el tercer nivel, bajo el título de
documentos de calidad,estas cuando se requieran pueden referirse
a los procedimientos e incluirse como anexo.
Las instrucciones deben redactarse en un
lenguaje fácilmente comprensible para los operadores del
nivel mas bajo.
Una instrucción trasmite
conocimientos,información o direcciones para el
propósito de realizar el trabajo.Los procedimientos
también transmiten conocimiento,información y
direcciones,pero exponen como se realizan ciertas tareas y
especifican quien es el que la realiza,esta es la principal
diferencia entre estos tipos de documentos(1).
Las instrucciones técnicas se pueden
documentar mediante flujogramas en los casos de:
1) Procesos sencillos,como único
medio de documentación.
2) Procesos complejos,como ayuda para los
que lo ejecutan a diario el proceso,pero siempre como respaldado
por el procedimiento original en el que dicho diagrama de flujo
figura como anexo.
La metodología de elaboración
de un diagrama de flujo:
A) El principio y el fin del proceso se
introducen en un marco ovalado.
B) Las etapas intermedias sin
elección en un marco rectangular.
C) Las etapas intermedias con posibilidad
de opciones por un rombo.
D) El encadenamiento de las etapas se marca
con una flecha(9).
En la siguiente figura se muestra la
simbología utilizada en un procedimiento de diagrama de
flujo(4):

Registros
A) Demuestran que el SGC está
implantado,controlado e informa del nivel de calidad
alcanzado.
B) Permiten que todas las acciones sean
trazables y por tanto investigar las causas de las
posibles desviaciones.
C) Son la base de las revisiones por la
dirección y de las auditorías internas para la
búsqueda de posibilidades de
mejora.
D) Son la base de las auditorías
externas con el fin de obtener el reconocimiento
externo"por un tercero"(entidad de
habilitación,certificación,acreditación,etc.).
Los registros a recoger y mantener deben
ser al menos los siguientes,según ISO 15189(7):
a) Hojas de petición(incluyendo la
historia clínica,solamente si se utiliza como hoja de
petición).
b) Resultados del análisis e
informes de laboratorio.
c) Resultados editados por los
instrumentos(salidas de impresora).
d) Procedimientos
analíticos.
e) Cuadernos de trabajo o de recogida de
datos del laboratorio.
f) Registros de los accesos.
g) Funciones de calibración y
factores de conversión.
h) Registros de control de la
calidad.
i) Reclamaciones y acciones
tomadas.
j) Registros de auditorías internas
y externas.
k) Registros de evaluaciones externas de la
calidad y las comparaciones interlaboratorios.
l) Registros de la mejora de la
calidad.
m) Registros de mantenimiento de los
instrumentos,incluyendo los registros de la
calibración interna y externa.
n) Documentación sobre el
lote,certificados de suministros,folletos de instrucciones de
uso.
o) Registros de incidentes o accidentes y
las acciones tomadas.
p) Registros relativos a la
formación y competencia del personal.
Control de registros
Los registros deben incluir la identidad
del personal responsable del muestreo,de la realización de
cada ensayo o calibración y de la verificación de
los resultados.
Las observaciones,los datos y los
cálculos se deben registrar en el momento de hacerlos y
deben poder ser relacionados con la operación en
cuestión.Cuando ocurran errores en los registros,cada
error debe ser tachado,no debe ser borrado,hecho ilegible ni
eliminado,y el valor correcto debe ser escrito al margen.Todas
estas alteraciones a los registros deben ser firmadas o visadas
por la persona que hace la corrección(1).
Un resumen del contenido de los documentos
de calidad se detallan en la siguiente figura(9):

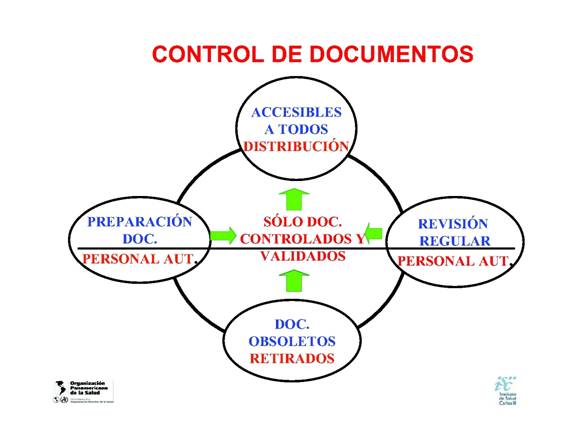
Control de
documentos
Las ediciones autorizadas de los documentos
se deben encontrar disponibles en todos los lugares en donde se
desempeñen operaciones esenciales para el funcionamiento
efectivo del laboratorio,estos documentos deben ser revisados
periódicamente y en caso de ser necesario
actualizados a fin de asegurar la continua adaptabilidad y
cumplimiento con los requisitos aplicables,a su vez los
documentos sin validez u obsoletos deben ser retirados
prontamente de los puntos de uso.
Todos los documentos distribuidos entre el
personal del laboratorio como parte de un sistema de
gestión deben ser revisados y aprobados,para su uso,por el
personal autorizado antes de su emisión.Se debe establecer
una lista maestra o un procedimiento equivalente de control de la
documentación,identificando el estado de revisión
vigente y la distribución de los documentos del sistema de
gestión,la cual debe ser fácilmente accesible con
el fin de evitar el uso de documentos no válidos u
obsoletos.
Si el sistema del control de la
documentación del laboratorio permite la enmienda de
documentos en forma manual hasta la nueva expedición de
los documentos,se deben definir los procedimientos y autoridades
para tales enmiendas.Las enmiendas deben ser claramente
marcadas,firmadas y fechadas.Tan pronto como sea práctico
debe reemitirse formalmente un documento actualizado.
ISO 9001 determina que una
organización que implante un sistema de calidad debe
"establecer y mantener al día procedimientos para
controlar todos los documentos y datos" relevantes para el
sistema.Los documentos del sistema de gestión generados
por el laboratorio deben ser identificados
unívocamente.Dicha identificación debe incluir la
fecha de emisión o una identificación de la
revisión,la numeración de las páginas,el
número total de páginas o una marca que indique el
final del documento,y la o las personas autorizadas de
emitirlo).
El objetivo del control de la
documentación es asegurar que todos los que realizan
tareas conocen la existencia y disponibilidad de los documentos
que regulan dichas tareas.
Debe establecerse un procedimiento
documentado que defina los controles necesarios para:
-Aprobar los documentos en cuanto su
adecuación antes de su emisión.
-Revisar y actualizar los documentos cuando
sea necesario y aprobarlos nuevamente.
-Asegurarse de que se identifican los
cambios y el estado de revisión actual de los
documentos.
-Asegurarse de que las versiones
pertinentes de los documentos aplicables se encuentran
disponibles en los puntos de uso.
-Asegurarse de que los documentos
permanecen legibles y fácilmente
identificables.
-Asegurarse de que se identifican los
documentos de origen externo y se controla su
distribución.
-Prevenir el uso no intencionado de
documentos obsoletos,y aplicarles una
identificación adecuada en el caso de que se
mantengan por cualquier razón.
El control de documentos debe iniciarse al
tiempo de su redacción y se mantendrá hasta que
sean descartados.Los documentos que deben controlarse no se
limitan a las especificaciones que genera el departamento de
diseño.Todos los documentos que definen el producto,o que
sean necesarios para el funcionamiento eficaz del sistema de la
calidad,deben incluirse dentro del sistema de
control(1)
La siguente figura muestra el índice
maestro(8):

Las figuras siguientes muestran la manera
de identificar los documentos(8):


Por último,un resumen del control de
documentos(8):
Bibliografía
1. Alonso Guerra MM,Campos Castro
LM.Elaboración del manual de bioseguridad y
documentación de los Procedimientos Operativos
Estándar POES e instructivos del laboratorio de
bacteriología especializada de la Facultad de Ciencias
de la Pontificia Universidad
Javeriana.Bogotá,D.C.Enero 2008.2. Lázaro Rodríguez
J.Documentación de Laboratorio y su Ordenación
y Presentación: Índice de la
Documentación.SEDIGLAC(Sociedad Española de
Dirección y Gestión de los Laboratorios
Clínicos).3. Dybkaer R.La
acreditación de los laboratorios clínicos
mediante la norma ISO
15189:2003.http://www.ifcc.org/ria/div/norm1.htm.4. Zirpoll MM.Sistema de
Gestión de Calidad,En:2º Simposio de
Actualización en Bioquímica
Clínica,Tucumán;2008.5. Burnett D.Una guía
práctica para la Acreditación del Laboratorio
Clínico.Barcelona: SEQC;2002.6. Asociación
Española de Normalización y
Certificación.Guía para la redacción de
un manual de la calidad.UNE
66908.Madrid:AENOR;1998.7. Asociación
Española de Normalización y
Certificación.Laboratorios clínicos.Requisitos
particulares para la calidad y la competencia UNE-EN ISO
15189:2003.Madrid: AENOR;2003.8. Ramirez E.Documentación
del Sistema de Calidad.Curso OPS"Gestión de Calidad
para Laboratorios".Antigua,Guatemala,10-15 de octubre de
2005.9. Fernández C,Mazziotta
D.Gestión de la Calidad en el Laboratorio
Clínico.Madrid: Editorial médica
panamericana;2005.
Autor:
Benjamín Jorge
Shmuklerman
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
