OBJETIVO:
Determinar la isoterma de adsorción para el
sistema carbón vegetal- acido acético a partir de
datos de laboratorio, a 25°C.
MATERIAL Y
EQUIPO:
3 pipeta(10ml)
2 pipetas volumétricas (10ml)
2 soportes
10 matraz erlenmeyer 250ml
3 aros
3 buretas
papel filtro
2 pinzas para bureta
1 matraz aforado (50ml)
4 vasos de precipitado (100ml)
3 embudos de vidrio
Balanza analítica
SUSTANCIAS:
Agua destilada
Acido acético 0.4M
Hidróxido de sodio 0.1 N
Fenolftaleína
INTRODUCCIÓN:
El concepto de adsorción, se refiere a la
unión de los átomos, iones o moléculas de un
gas o de un líquido (adsorbato) a la superficie de un
sólido o líquido (adsorbente). En los
sólidos porosos o finamente divididos la adsorción
es mayor debido al aumento de la superficie expuesta. De forma
similar, la superficie adsorbente de una cantidad de
líquido se incrementa si el líquido está
dividido en gotas finas. En algunos casos, los átomos del
adsorbato comparten electrones con los átomos de la
superficie adsorbente, formando una capa fina de compuesto
químico. La adsorción es también una parte
importante de la catálisis y otros procesos
químicos. En la absorción, las moléculas de
la sustancia adsorbida penetran en todo el volumen del
sólido o líquido adsorbente.
TIPOS DE ISOTERMA DE
ADSORCIÓN
Brunauer clasificó las isotermas de
adsorción de gases sobre sólidos en cinco tipos: I,
II, III, IV y V. Cada una de ellas corresponde a un
comportamiento de adsorción bien definido.
TIPO I: El adsorbato cubre al adsorbente,
el cual tiene una superficie uniforme, hasta que se forma una
monocapa y entonces el proceso se detiene. La gran mayoría
de los procesos de quimisorción muestran este tipo de
isoterma.
 Este tipo
Este tipo
de isoterma se ajusta a la isoterma descrita por Langmuir,
enunciada en la siguiente ecuación:
? = (KPA/(1 + KPA))
Esta ecuación se basa en las siguientes
suposiciones:
Todos los sitios de adsorción son
equivalentes.La adsorción no depende del
recubrimiento.Se alcanza el equilibrio descrito por la siguiente
ecuación:
A(g) + M(surf) <===> AM
Donde la adsorción procede con una constante de
velocidad ka y la desorción procede con una constante de
velocidad kd
La isoterma de Langmuir se usa mucho en casos de
quimisorción o de adsorción de gases en
sólidos no porosos. Esto no significa que haga un buen
trabajo en los casos de quimisorción. En un gran
número de casos es necesario utilizar isotermas "de
Langmuir" modificadas, tales como las propuestas por Freundlich o
por Temkin.
TIPO II: El adsorbato cubre al adsorbente
hasta que se forma una monocapa y el proceso continúa con
adsorción en multicapas. Es un perfil frecuente en
procesos de adsorción física en los cuales las
interacciones son poco específicas. Para que se produzca
este tipo de comportamiento es necesario que la afinidad del
adsorbato por el adsorbente sea algo mayor que la afinidad del
adsorbato por sí mismo.

Este tipo de isoterma se puede ajustar a la
ecuación llamada BET, desarrollada por Brunauer,
Emmett y Teller. La forma de la ecuación es como
sigue:

donde: Po es la presión de vapor de
saturación Vm es la capacidad de monocapa C aprox. igual a
exp[-(?Hads – ?Hliq)/RT]
La isoterma BET es una extensión del argumento de
Langmuir:
La primera capa obedece a un calor de
adsorción ?HadsLas capas posteriores a la primera tienen un calor
de adsorción igual al calor de licuefacción,
?Hliq
La ecuación BET reproduce bastante bien capas
adsorbidas físicamente.
TIPO III: El adsorbato tiene
aproximadamente la misma afinidad por el adsorbente y por
sí mismo, o es ligeramente más afín a
sí mismo que al adsorbente, por lo cual es una vez que se
ha adsorbido una molécula ésta actúa
también como sitio libre para que otra molécula se
adsorba. Esto conduce a un recubrimiento desigual, con partes
limpias, partes cubiertas con monocapa y partes cubiertas con
multicapa.
 Las
Las
isotermas tipo III pueden ajustarse bastante bien a la
BET.
TIPO IV: En este caso el comportamiento
inicial consiste en formar una monocapa, para luego mostrar
comportamiento de formación de multicapas hasta alcanzar
un ?espesor de multicapa? máximo a una presión
máxima Po. Este comportamiento se justifica postulando un
adsorbente rugoso en el cual la monocapa inicial deja muchos
huecos, que terminan por saturarse de adsorbato al alcanzar la
presión Po (condensación capilar).

TIPO V: En este caso el comportamiento
inicial consiste en formar una multicapa hasta alcanzar un
"espesor de multicapa" máximo. Este comportamiento se
justifica postulando un adsorbente rugoso, como en el caso IV, y
un adsorbato que interactúa débilmente con el
adsorbente.

¿Cuál es la diferencia entre
adsorción y absorción?
Cuando una sustancia se adhiere a una superficie se
habla de adsorción, es este caso, la sustancia se adhiere
a la superficie interna del carbón activo. Cuando la
sustancia es absorbida en un medio diferente esto es llamado
absorción. Cuando un gas es atraído dentro de una
solución se habla de absorción.
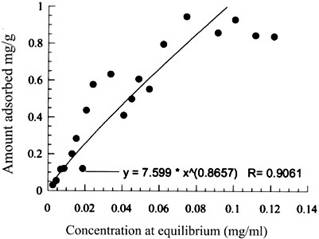
Figura 1: se ve la adsorción isotérmica
específica para el carbón activo. En el eje
horizontal se encuentra la concentración, y en el
eje vertical la cantidad necesaria de carbón. Usted puede
utilizar este tipo de gráficos para optimizar su
columna.

Figura 2: nos muestra el agotamiento durante el uso de
su columna. En el punto C3 la columna empieza a romper en el
punto mas bajo y cerca del punto C4 su columna ya no purifica.
Entre el punto C3 y C4 usted necesita regenerar la
columna.
DESARROLLO DE LA
PRÁCTICA:

CALCULOS Y
RESULTADOS:
Equipos 1 y 2:
MUESTRA | GR. DE CARBÓN VEGETAL | GASTO DE NaOH. (0.1N) |
1 | 1.0028 gr. | 30.60 ml |
2 | 2.0086 gr. | 25.00 ml |
3 | 3.0046 gr. | ———- |
4 | 4.0196 gr. | 19.80 ml |
5 | 5.0065 gr. | 18.8 ml |
6 | 6.0205 gr. | 14.50 ml |
Equipos 3 y 4:
MUESTRA | GR. DE CARBÓN | GASTO DE NaOH |
1 | 1.0212 gr. | 32.50 ml |
2 | 2.0698 gr. | 29.00 ml |
3 | 3.0090 gr. | 24.oo ml |
4 | 4.0023 gr. | ———– |
5 | 4.9998 gr. | 17.35 ml |
6 | 5.9926 gr. | 14.10 ml |
DISCUCIÓN DE
RESULTADOS:
Los resultados presentaron valores congruentes, ya que a
medida que aumenta la concentración del ácido
acético (adsorbato) aumenta la relación entre la
cantidad adsorbida por gramo de carbono y eso fue lo que
sucedió.
La relación entre la cantidad de sustancia
adsorbida por un adsorbente y la presión o
concentración de equilibrio a una temperatura constante se
denomina isoterma de adsorción.
Por lo tanto para que el ácido acético
haya sido adsorbido por el carbón activado sus
moléculas debieron de penetrar los poros del mismo, en
consecuencia, los poros del carbón deben de tener un
diámetro mayor que las moléculas de impurezas, y en
este caso se da.
OBSERVACIONES:
Durante esta práctica el objetivo simplemente
es determinarla isoterma de absorción siendo
así se determino el peso molecular M2 en
función de la constante de crioscopia del solvente,
también en función del punto de
congelación.Aunque el tamaño de las partículas del
carbón no influyen directamente en la
adsorción, resulta provechoso el empleo de
carbón pulverizado para disminuir el tiempo de
contacto necesario para que ocurra la adsorción de
manera apreciable.Cuando se emplea carbón activado pulverizado
en los procesos de adsorción es recomendable el empleo
de filtros especiales para obtener una filtración
más eficiente.
CONCLUSIONES:
En esta práctica solo se analizaron los
valores de la temperatura a la cual la solución de
congelaba, siendo así que la temperatura de
congelación esté en función da las
concentraciones utilizadas.A medida que aumenta la concentración del
ácido acético (adsorbato) aumenta la
relación entre la cantidad adsorbida por gramo de
carbono.El carbón activado pulverizado proporciona
datos de adsorción de manera eficiente y en un corto
tiempo, debido a la velocidad por llegar al
equilibrio.
BIBLIOGRAFÍA:
Microsoft ® Encarta ® 2008. © 1993-2007
Microsoft Corporation. Reservados todos los
derechos.http://www.geocities.com/quimico69/fqav/isoterms.ht
Autor:
Asneydi Madrigal Castro

SEP SES DGEST
INSTITUTO TECNOLOGICO DE
JIQUILPAN
PRACTICA Nº6 DE
FISICOQUIMICA
MIREYA
ING. x
17 DE OCTUBRE DEL 2008
1 DE DICIEMBRE DEL 2008
