- Introducción
- Identificación y características
del gen implicado - Un
poco de historia - Mutaciones y estructura de la
proteína - Terapia génica
- Diagnostico, tratamiento y
pronostico
Introducción
La fenilcetonuria es un trastorno caracterizado por la
conversión defectuosa de fenilalanina en tirosina, debido
a la carencia de la enzima fenilalanina hidroxilasa, por lo que
la fenilalanina no puede ser convertida en tirosina, que es un
aminoácido fundamental para el metabolismo del organismo.
[1]Cuando la hidroxilasa es deficiente, se usan
vías alternativas para metabolizar la fenilalanina, esta
es convertida por transmutación en acido fenilpiruvio, que
es reducido a acido fenilactico, o en forma, por
descarboxilacion, acido fenilacteico que, por conjugación,
origina la fenilcetilglutamina. Finalmente, la fenilalanina y
estos productos metabólicos se acumulan en líquidos
del organismo. Estos compuestos no son metabólicos
anormales, sino metabólicos normales, aunque en cantidades
anormales [2]Como resultado, este
aminoácido puede acumularse a niveles tóxicos en la
sangre y otros tejidos, dado que las células nerviosas en
el cerebro son especialmente sensibles a los niveles de
fenilalanina, cantidades excesivas de esta sustancia puede causar
daño cerebral, por lo que es una enfermedad progresiva
severa que puede producir retraso mental si no se trata con una
dieta libre de alimentos que contengan este aminoácido a
tiempo.
La incidencia de la enfermedad es de 1:10000 a 20000
personas. Se manifiesta por igual en ambos sexos. Los estudios de
la genética de la población revelan claramente una
herencia autonómica recesiva. La salud de los portadores
no sufre efecto alguno por la presencia de este
gen.[3]
Identificación y
Características del gen implicado
Como se menciono anteriormente, todos los defectos se
heredan con carácter autosómico recesivo. Hasta el
momento se ha encontrado un gen asociado a este trastorno,
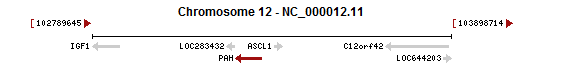
conocido como el gen PAH. Este gen se encuentra en el brazo largo
del cromosoma 12, entre las posiciones 22 y 24.2,
abarca 90 kb y contiene 13 exones.
Actualmente se han descrito más de 500 mutaciones en su
cDNA, que en diferentes combinaciones, pueden dar cuenta de la
gran variedad clínica y bioquímica que presentan
los pacientes con deficiencia en PAH. El cromosoma 12 contiene
103.232.103 pares de bases a 103.311.380 y el gen se encuentra de
los pb 103.232.103 a 103.311.380.[4]

En cuanto a la identificación de este gen en 1984
Lidsky et al., demostraron que el gen PAH se encuentra en el
cromosoma 12 y presumiblemente en la parte distal de 12q, por
medio del uso de una sonda de DNAc de PAH humano para analizar el
ratón hibrido de células humanas por
hibridación de Southern, la hipótesis planteada se
confirmo porque en los híbridos que contienen el cromosoma
translocado 12, estaban separados con PEPB (12q21) y no con TPI
(12p13). [5]También en 1984 Woo et al.
Asigna el gen en el cromosoma 12q21 HAP-qter mediante
análisis de restricción de ADN de hámster
híbridos de células somáticas
humanas. Por hibridación in situ, la
asignación del gen PAH se redujo a 12q22-q24.1
cromosoma[6]Por ultimo en 1985 O´Conell et
al. de RFLP, confirmó la asignación del gen PAH a
12q terminal.[7]
También es importante mencionar que mediante el
análisis de Nothern blot, Lichter-Konecki et al en 1999
detecto más alta expresión de un kb HAP de
transcripción-2.5 en el hígado humano, seguido de
riñón, páncreas y cerebro. Una
transcripción de 4,6 kb se detectó también
en el hígado, los riñones y el páncreas, los
ensayos de RNasa confirmó HAP la expresión en el
hígado y el riñón. El ARN de
hibridación in situ reveló expresión de PAH
en los túbulos proximales de los adultos y la corteza
renal fetal y en la corteza cerebral del cerebro del
feto. El análisis inmunohistoquímico
confirmó expresión de la proteína PAH en
túbulos renales proximales
complicado.[8]
Un poco de
Historia
En cuanto a la historia de la fenilcetonuria, fue en
1934 cuando Fölling realizo la descripción de una
enfermedad que causaba un grave daño cerebral, en la que
estaba implicada una sustancia originaria de las proteínas
denominada fenilalanina; la denominó "imbecillitas
phenylpyuruvica" oligofrenia fenilpirúvica, también
conocida como enfermedad de Fölling[9]Tres
años más tarde, Penrose y Quastel sugieren que se
denomine a esta enfermedad fenilcetonuria nombre con el que se
conoce hoy en día. En 1947 Jervis observó que
cuando se daba fenilalanina a individuos sanos, en éstos
se producía un aumento de otra sustancia llamada Tirosina.
Pero cuando suministraba fenilalanina a individuos
fenilcetonúricos no presentaban tal elevación. Tras
varios años de investigación Jervis concluyó
finalmente que en la enfermedad conocida como fenilcetonuria se
produce un fallo en la transformación de la fenilalanina
en tirosina y que dicha transformación en los individuos
sanos tiene lugar en el hígado. [10]Los
avances en el tratamiento de la enfermedad no se iniciaron hasta
1953 cuando Bickel publica sus primeros trabajos en los que
demuestra la efectividad de una dieta especial restringida en
fenilalanina para el tratamiento de la fenilcetonuria, especulo
que podría haber una relación causal entre el
exceso de fenilalanina en los líquidos biológicos y
una niña de daño cerebral y por lo cual planteo que
sería posible mejorar su condición mediante la
reducción de la ingesta de fenilalanina. El uso de un
hidrolizado de caseína restringida en fenilalanina como la
principal fuente de proteínas de la dieta se
consideró.[11]
Mutaciones y
estructura de la proteína
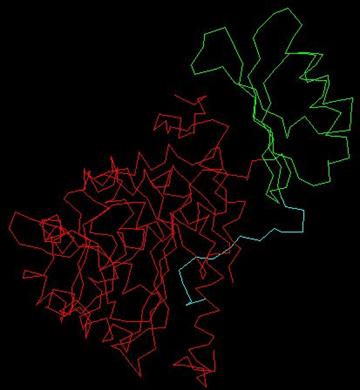
La proteína fenilalanina hidroxilasa tiene
C-terminal del monómero PheOH que se caracteriza por el
dominio catalítico, y es también responsable de
tetramerización. El sitio activo PheOH se encuentra
en un bolsillo profundo de las paredes helicoidal en el
C-terminal. El N-terminal es el dominio de
reglamentación y se extiende a través del sitio
activo del dominio catalítico y es estructuralmente
similar a la del dominio regulador de fosfoglicerato
deshidrogenasa, una enzima implicada en la biosíntesis de
serina, y PCD / DCOH, involucrados en la regeneración de
BH4 y la activación de NHF1 que a su vez activa la
transcripción de PAH. La siguiente figura es un
monómero de PheOH, el rojo indica que el término
dominio catalítico-C, el verde indica que el núcleo
del ámbito regulatorio, y el azul la terminal de
autorregulación de dominio-N.
Las mutaciones en el gen PAH y sus
consiguientes cambios estructurales en la enzima, dan lugar a la
función PheOH reducida y la fenilcetonuria. Muchas
mutaciones en el sitio activo PheOH tienen evidentes
implicaciones estructurales. Sin embargo, las mutaciones en
el dominio catalítico y la región N-terminal
también se han identificado. Kobe et al. En
anteriores postulados dicen que el N-terminal y la función
reguladora de la bisagra puede ayudar a explicar la
disminución de la actividad de los mutantes de PAH en las
zonas que no sea el sitio activo.
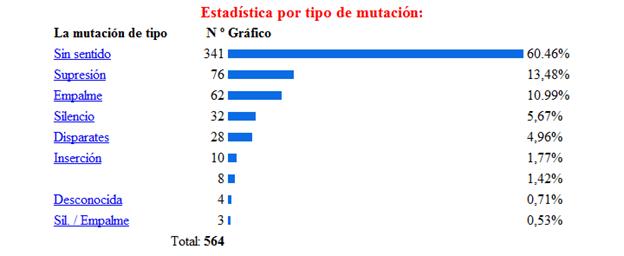
La base de la fenilcetonuria son las mutaciones
producidas en el gen PAH, hasta la actualidad se han identificado
564 mutaciones en el gen PAH, según la base de datos
internacional de este gen[12]Algunos estudios han
establecido relaciones entre el genotipo y el fenotipo
metabólico, permitiendo determinar el grado de severidad
de acuerdo con la actividad de la enzima mutada, y de esta forma
indirectamente también se puede afectar el desarrollo
cognitivo.[13] Los tipos de mutaciones vinculados
a la PKU son la sustitución de un aminoácido por
otro, deleciones, inserciones, mutaciones que alteran el
procesamiento del RNA heteronuclear y las mutaciones sin sentido
(etc.) En la siguiente imagen se muestra la estadística de
las mutaciones más comunes del gen, estos datos fueron
obtenidos de la base de datos internacional del gen
PAH.[14]
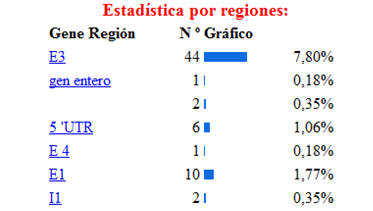
De las diferentes estructuras de este gen la más
afectada por las mutaciones es el exón 7 como se puede
observar en la siguiente imagen donde se muestra la incidencia de
las diferentes mutaciones del gen según la región
apareciendo como la región más afectada el
exón 7, luego el 11,10 (etc.) Lo cual se explica porque la
región codificante contiene 22 sitios CPG (ricos en pares
citosina-guanina), 5 de los cuales están ubicados en el
exón numero siete de este gen. En el exón 7, se
encuentran la mayoría de las manifestaciones que
están relacionadas con hiperfenilalninemia. La
hipótesis más aceptada es que esta región
altamente conservada, confiere funciones esenciales para la
hidroxilacion de la PAH, cualquier variación en el dominio
codificado por este exón, altera la función de la
enzima produciéndose la elevación de la
fenilalanina. Diversas son las mutaciones que se han relaciona
con la deficiencia de PAH, donde la sustitución de un
aminoácido por otro es de la mas frecuéntenme
encontradas.
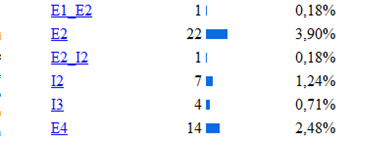
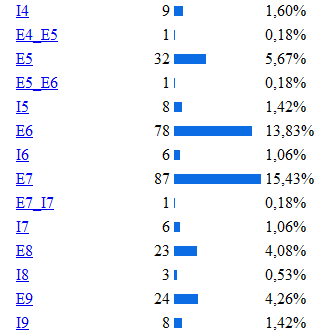
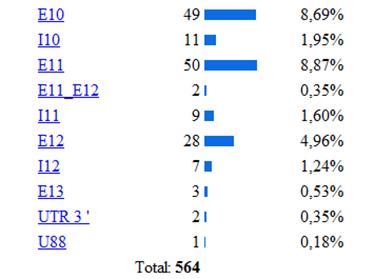
Se han clasificado 28 mutaciones como graves, como es el
caso de una de las más frecuentes, la mutaciones
IVS10nt-11, que en homocigosis confiere un fenotipo grave. Otro
grupo de 16 mutaciones se relacionan con una actividad PAH
residual con un fenotipo suave, entre las que se incluyen la 165T
la V388M.
Además se han caracterizado 13 mutaciones
causantes de hiperfenilalninemia benigna, como la A403V, muy
frecuente en nuestra población. Se ha establecido un
sistema de búsqueda sistemática de mutaciones en el
gen PAH, mediante la técnica de DGGE, que permite la
identificación del genotipo de los casos de PKU
diagnosticados cada año en el programa de detección
precoz de metabolopatias. El conocimiento del genotipo aporta al
clínico una información esencial en la
predicción de la evolución fenotípica de
cada recién nacido PKU permite la aplicación de la
aplicación de la dieta optima individualizada para cada
paciente[15]Algunos estudios han establecido
relaciones entre el genotipo y el fenotipo metabólico,
permitiendo determinar el grado de severidad de acuerdo con la
actividad de la enzima mutada, y de esta forma indirectamente
también se puede afectar el desarrollo
cognitivo.[16]
A continuación se muestra una imagen con las
mutaciones más frecuentes del gen, y después una
descripción de las más importantes.
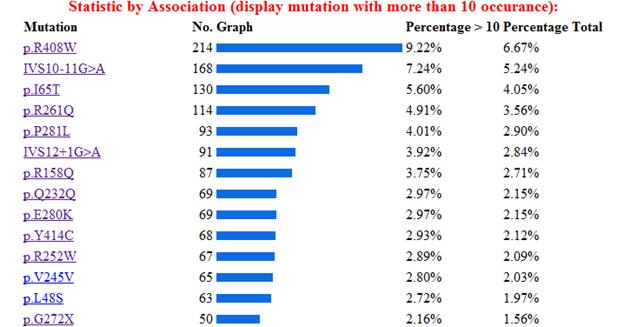
ARG408TRP
Este defecto es causado por una transición CGG/TGG en
el exón 12, en la secuencia 1222.000 dando lugar a una
sustitución de aminoácidos (arg-a-trp) en el
residuo 408 (R408W) de PAH, se considera una mutación de
tipo sin sentido que se produce en el dominio catalítico
de la HAP.
Por medio del uso de hibridación de análisis
directo de la mutación puntual usando una sonda de
oligonucleótidos específicos fue demostrado que
esta mutación está en desequilibrio de ligamiento
con RFLP haplotipo-2 alelos que componen alrededor del 20% de los
genes mutantes PAH. En 1993 Ivanschenko y Baranov
describió una rápida y eficiente prueba de de PCR/
prueba StyI para identificar la mutación
IVS12DS, GA, +1
Consiste en el cambio de base individual (G/A) en el
empalme de la zona donante de 5´ del intron
12[17]
En 1986 Marvit et al., encontró que el GT-a
AT-sustitución en el empalme de 5´del intrón
12 dio lugar a la omisión del exón precedente,
durante el empalme de ARN Se demostró que había una
eliminación de 116 pares de bases internas correspondan
exactamente a exón 12 y que conduce a la síntesis
de la proteína truncada que carecen de la C-terminal de 52
aminoácidos, la supresión suprimió la
actividad de PAH en la célula como consecuencia de la
inestabilidad de las proteínas, de hecho una
sustitución de un solo nucleótido en lugar de la
supresión de una base fue la base del producto del gen
anormal.[18]
GLU280LYS
La mutación consiste en un cambio de GAA/AAA en
el exón 7, en la secuencia 838, esta mutación es
considerada del tipo sin sentido y se encontró un cambio
de glu280 a lis, identificado en un niño con una variante
de fenilcetonuria. La enzima mostro actividad residual parcial,
esta mutación se relacionaba con haplotipos en el sur de
Europa y Norte de África. [19]
A partir del análisis de la base de datos de
mutación de PAH, Byck et al en 1997 demostraron que el
alelo E280K, el 1,5% de los cromosomas PKU en todo el mundo. S e
presenta el 4 e haplotipos diferentes en los europeos y en
haplotipos 1 y 2 en Quebec.[20]
ARG261GLN
Mutación de tipo sin sentido
CGA/CAA en el exón 7, en el nucleótido 782, en el
codón 261 se produce un cambio de arg a gln (R261Q).
[21]Para esta mutación especifica es
interesante mencionar el caso que fue observado por Zurich,
Superti-Furga et al en 1992 donde observo retraso intrauterino,
microcefalia, microcefalia y retraso en el desarrollo de dos
primos hermanos de madres de 23 y 24 años, se
encontró que había fenilalanina en concentraciones
aprox de 1.2mmol/l, pero nunca había sido tratada y no
presentaban retraso mental. Ambas madres demostraron ser
homocigotas para mutación arg261, esto nos indica que el
estado homocigoto de esta mutación se acompaña de
manifestaciones clínicas leves, pero suficiente
elevación de fenilalanina en la sangrepuede causar el
síndrome de fenilcetonuria materna en la
descendencia[22]
ARG252TRP
Hay un cambio de C-T para la transposición de la
primera base en el codón 252, que da lugar a la
sustitución arg252 a trp, es una mutación sin
sentido descubierta por Abadie et al en
1991[23]
Se han realizado análisis de los vectores de
expresión que contiene el cDNA mutantes y en los
mamíferos reveló células transfectadas con
insignificante actividad de la enzima, en estudios
genéticos de la población italiana se mostro un
marcado desequilibrio los a-trp mutación arg252 y
haplotipos RFLP 1. El arg252 a trp es una mutación que se
encontró en el 10% de un hapotipo de cromosomas
mutantes[24]
ARG158GLN
En 1989 Dworniczak et al identifico una
transición G a A (CGG/CAG) en el nucleótido 695 en
el exón 5. La sustitución de base prevé un
arg158 a gln (R158Q). Veinticuatro por ciento de los alelos PKU
se encontraban en un contexto de haplotipo 4, todos los 7 de la
a-Una transición G estaban en el haplotipo 4 de
fondo. [25]
ARG243TER
Se trata de una mutación
sinsentido en el exón 7 donde se produce cambio CGA/TGA en
el nucleótido727 esto causa un cambio de arg243 a un
codón de parada. Alelo mutante se asoció con el
haplotipo 4. La mutación estaba presente en 2 de 9
haplotipo 4 alelos mutantes entre los europeos del este, pero no
se encuentran entre los europeos occidentales y los
asiáticos.[26]
PRO281LEU
Consiste en una mutación sin sentido donde se
produce cambio de CCT/CTT, en el exón 7 en el
nucleótido 842. El análisis de
expresión revelo la actividad enzimática
insignificante y los niveles no detectables de proteínas
inmunorreactivas HAP. El pro281 a leu mutación se
encontró en el 20% de un haplotipo cromosomas mutantes en
la población italiana [27]
En 1994 Baric et al. Señalo que los datos que
indican la mayor frecuencia de la mutación esta en
Croacia, donde se detecto 55% de los alelos de un haplotipo, que
corresponde al 12% de todos los alelos de PKU. Ellos
interpretaron este resultado como una indicación de que la
mutación se origino en el suerete de
Europa[28]
TYR414CYS
Consiste en el cambio de TAC/TGC en el exón 12 en
el nucleótido 1241, causando el cambio de tyr414 a CYS).
La transición de Aa G en la segunda base del codón
414 fue la responsable Los estudios in vitro mostraron que
la expresión-a-cis mutación tyr414 producía
una proteína con una cantidad significativa de los HAP
actividad de la enzima, es decir, aproximadamente el 50% del
estado de equilibrio los niveles
normales.[29]
En 2008 Gersting et al declaró que la
mutación se produce en el Y414C produciendo
dimerización del dominio de oligomerización HAP,
que interactúa con el dominio catalítico de la
subunidad HAP mismo. Encontraron que la tetramerización de
HAP recombinante con la mutación Y414C parecía a la
de la proteína de tipo salvaje. La reducción
en la actividad resultante de la mutación Y414C
parecía deberse a un cambio conformacional global en la
proteína que reduce
alosterismo.[30]
GLY272TER
Es una mutación de tipo sin
sentido que causa un cambio GGA/TGA en el nucleótido 814
del exón 7 , que resulta en cambio de una gly272 a ter
(G272X) de sustitución, y la deleción del
codón leucina CTT 364
( 612349.0021 ).
En 1993 Alpod et al encontró datos recopilados en
la frecuencia de la mutación G272X en las poblaciones
europeas. La mutación se produce al norte de los
Alpes y tiene una alta frecuencia en particular en el Fiordo de
La Región de Oslo de Noruega con la Bohuslän
región adyacente de Suecia. Una frecuencia intermedia
se observó en la parte oriental de Alemania con la parte
adyacente del oeste de Checoslovaquia.Los hallazgos sugieren un
origen único para esta mutación, por lo menos una
población fundadora en el sureste de Noruega/Suecia
adyacentes [31]
IVS10AS, GA, -11
Se produce una mutación de tipo
empalme de G/A en intron 10, hay una transición en
la posición 546, 11pb arriba del límite con el
exón 10. La mutación se produce en un sitio de
empalme crítica y da lugar a un marco de inserción,
de 9 de nucleótidos entre los exones 10 y 11 del ARNm
procesado. Cantidades normales de proteína en el
hígado PAH estaban presentes en la PKU homocigotos de los
pacientes, pero no la actividad catalítica. Esta
pérdida de actividad de la enzima fue causado
probablemente por cambios conformacionales que resultan de la
inserción de 3 aminoácidos adicionales
(Gly-Leu-Gln) entre las secuencias normales codificada por exones
10 y 11. La mutación se encuentra en estrecha
asociación con los haplotipos cromosomas 6, 10 y
36. [32]Debido a la alta frecuencia de estos
haplotipos en particular en Bulgaria, Italia y
Turquía, Dworniczak et
al. (1991) sospecha que esta mutación puede
ser uno de los defectos más frecuentes en el gen que causa
la PKU clásica HAP en el sur de Europa. Perez et
al.(1992) también encontró esta
mutación en España. Por otra
parte, Pérez et
al. (1993) encontraron que esta mutación es
la lesión molecular predominante que causan la
fenilcetonuria en Chile, Argentina y México.
Terapia
Génica
El tratamiento para esta enfermedad se ha basado
principalmente en el control de la dieta del paciente, pero en la
actualidad se ha planteado una nueva alternativa que consiste en
la terapia génica, ya había sido revelado que el
método había curado fenilcetonuria (PKU) en
ratones.
La noticia de que esta técnica tiene
efectivamente curar una enfermedad grave, aunque en ratones, ha
elevado las posibilidades y las expectativas.
Además de la PKU, esta técnica
podría ser usada para curar otras enfermedades
genéticas causadas por falta de enzimas hepáticas
como la hemofilia y las deficiencias de la enzima ciclo de la
urea, así como la limpieza de colesterol de la sangre y
otros.
La técnica consiste en insertar genes en regiones
no codificantes del genoma lo que no hay peligro de interferencia
con el funcionamiento de otros genes. Una vez insertado, el
gen sigue siendo una parte permanente del genoma de la
célula.
El Dr. Woo y su colega Li Chen utiliza un gen de
un bacteriófago , que reconoce una secuencia
específica de ADN. Esta secuencia sólo se produce
varias veces en el genoma del ratón entero y siempre se
encuentra en la región no codificante entre los
genes.
Woo y Chen fueron capaces de curar la PKU en ratones con
sólo tres inyecciones por vía intravenosa. Los
niveles de fenilalanina en los ratones tratados se redujo a
valores normales y se mantuvo estable a partir de
entonces.
Su color de piel también cambió de gris a
negro, indicando que estaban produciendo los niveles normales de
melanina, un pigmento, que está siendo producida en
ratones y seres humanos con PKU.
"Debido a que los genes se insertan de forma
permanente, algunas aplicaciones sería suficiente para
corregir de forma permanente una enfermedad", dijo
Woo.
"El reto actual es identificar un medio adecuado
para la introducción de ADN en las células del
hígado. Una vez que la tecnología se desarrolla,
esta nueva técnica proporcionará un método
seguro y eficaz de integrar el ADN en el genoma de la
célula."[33]
Diagnostico,
tratamiento y Pronostico
En relación a este trastorno es importante
mencionar los métodos utilizados para el diagnostico, como
la prueba del cloruro férrico en la orina. Existen casos
raros en los que no se encuentra el ácido
fenilpirúvico en la orina siempre, sólo cuando se
ha expuesto al niño a una sobrecarga dietética o
cuando tiene fiebre este aparece estos casos se consideran como
defectos parciales.
En cuanto al tratamiento habitual comprende una dieta
extremadamente baja en fenilalanina, especialmente cuando el
niño está creciendo. Aquellos pacientes que
continúen con la dieta hasta la vida adulta tendrán
una mejor salud física y mental. La fenilalanina se
encuentra en cantidades significativas en alimentos como la
leche, los huevos y otros alimentos comunes. Además, se
encuentra en el edulcorante artificial Nutrasweet (aspartamo),
razón por la cual cualquier producto que contenga
aspartamo se debe evitar.
Lofenalac es una leche en polvo infantil especial para
bebés con fenilcetonuria que se puede usar durante toda la
vida como fuente de proteína, con un contenido
extremadamente bajo en fenilalanina y balanceada con respecto a
los aminoácidos esenciales restantes.
El hecho de tomar suplementos, como el aceite de
pescado, para reemplazar los ácidos grasos de cadena larga
faltantes de una dieta estándar libre de fenilalanina
puede ayudar a mejorar el desarrollo neurológico,
incluyendo la coordinación motriz fina. Asimismo, se
pueden necesitar otros suplementos específicos, como el
hierro o la carnitina.
Se espera que el desenlace clínico sea muy
alentador si la dieta se sigue estrictamente, comenzando poco
después del nacimiento del niño; pero si el
tratamiento se retrasa o el trastorno permanece sin tratamiento,
se presentará daño cerebral. El desempeño
escolar se puede deteriorar levemente.
Si no se evitan las proteínas que contengan
fenilalanina, la fenilcetonuria puede conducir a retardo mental
hacia el final del primer año de vida.
Autor:
Lina Merchancano
Universidad ICESI
16 de Mayo del 2011
[1] Scriver, Cr Kaufman, S, Eisensmith, RC, y
Woo, (1995). In the Metabolic Basis of Inherited Diseas I,
Seventh edition. Scriver, CR, Beaudet, AL, Sly WS, Valle, D.
(Eds.) McGraw-Hill, 1015
[2] Van Sprosen, FJ, Van Dijk, T Smit, GPA
et. Al. Large daily fluctuations in tyrosine intreated patients
with phenylketonuria (PKU). Am J clin Nuir 1996; 64:
916-921
[3] Waisbren, SE,Chang, PL Leavy, HL et al
Neonatal neurological assessment of offspring in maternam
phenylketonuria. J Metab Dis 1998; 21:39-48
[4] Genetics Home Referencs. PAH, Published:
May 8, 2011
[5] Lidsky, A. S., Robson, K. J. H.,
Thirumalachary, C., Barker, P. E., Ruddle, F. H., Woo, S. L.
C. The PKU locus in man is on chromosome 12. Am. J.
Hum. Genet. 36: 527-533, 1984. [PubMed: 6547271]
[6] Woo, S. L. C., Lidsky, A., Law, M., Kao,
F. T. Regional mapping of the human phenylalanine
hydroxylase gene and PKU locus to 12q21-qter. Am. J. Hum.
Genet. 36: 210S-only, 1984. (Not available in PubMed)
[7] O'Connell, P., Leppert, M., Hoff, M.,
Kumlin, E., Thomas, W., Cai, G., Law, M., White, R. A
linkage map for human chromosome 12. Am. J. Hum.
Genet. 37: A169-only, 1985. (Not available in PubMed)
[8] Lichter-Konecki, U., Hipke, C. M.,
Konecki, D. S. Human phenylalanine hydroxylase gene
expression in kidney and other nonhepatic tissues. Molec.
Genet. Metab. 67: 308-316, 1999. [PubMed: 10444341]
[9] Folling, R. Ueber Ausscheidung
Phenylbrenztraubensaeure en Harn von den als
Stoffwechselanomalie en Verbindung Imbezillitaet
MIT. Ztschr. Physiol. Chem. 227: 169-176,
1934.
[10] Jervis, G. A. Phenylpyruvic
oligophrenia deficiency of phenylalanine-oxidizing
system. Proc. Soc. Exper. Biol. Med. 82: 514-515,
1953. [PubMed: 13047448]
[11] Bickel, H., Gerrard, J., Hickmans, E.
M. Influence of phenylalanine intake on
phenylketonuria. Lancet 262: 812-813, 1953. (Note:
Originally Volume 2.) [PubMed: 13098090
[12]
http://www.pahdb.mcgill.ca/?Topic=Search&Section=Main&Page=0
[13] Pérez B., Desviat L.R.,
Dié M., Cornejo V., Chamoles NA., Nicolini H. y Ugarte
M. Presence of the mediterranean PKU mutation IV10 in Latin
América. Human Molecular Genétics. 1993, 2.8 pp.
1.289-1.290.
[14]
http://www.pahdb.mcgill.ca/cgi-bin/pahdb/mutation_statistics-1.cgi
[15] Farreras Rozman. Medicina Interna 14ta
edicion [CD-ROM]. Madrid, España: Ediciones
Harcout;2000
[16] Pérez B., Desviat L.R.,
Dié M., Cornejo V., Chamoles NA., Nicolini H. y Ugarte
M. Presence of the medite- rranean PKU mutation IV10 in Latin
América. Human Molecular Genétics. 1993, 2.8 pp.
1.289-1.290.
[17] DiLella, AG, Kwok, SCM, Ledley, DF,
Marvit, J., Woo, SLC estructura molecular y el mapa
polimórficas del gen de la fenilalanina hidroxilasa
humana. Bioquímica 25: 743-749,
1986. [PubMed: 3008810]
[18] Marvit, J., DiLella, A. G., Brayton, K.,
Ledley, F. D., Robson, K. J. H., Woo, S. L. C. GT to AT
transition at a splice donor site causes skipping of the
preceding exon in phenylketonuria. Nucleic Acids
Res. 15: 5613-5628, 1987. [PubMed: 3615198]
[19] Lyonnet, S., Caillaud, C., Rey, F.,
Berthelon, M., Frezal, J., Rey, J., Munnich, A. Molecular
genetics of phenylketonuria in Mediterranean countries: a
mutation associated with partial phenylalanine hydroxylase
deficiency. Am. J. Hum. Genet. 44: 511-517, 1989.
[PubMed: 2564729]
[20] Byck, S., Tyfield, L., Carter, K.,
Scriver, C. R. Prediction of multiple hypermutable codons
in the human PAH gene: codon 280 contains recurrent mutations
in Quebec and other populations. Hum. Mutat. 9:
316-321, 1997. [PubMed: 9101291]
[21] BasededatosdelgenPAH.
http://www.pahdb.mcgill.ca/PahdbSearch.php?SearchValue=p.R261Q&SearchField=mut_name&SearchOrderedField=id_mut&SearchAscDesc=ASC&Submit=Submit&MenuSelection=Mutation
[22] Zuperti-Furga, A., Steinmann, B., Duc,
G., Gitzelmann, R. Maternal phenylketonuria syndrome in
cousins caused by mild, unrecognized phenylketonuria in their
mothers homozygous for the phenylalanine hydroxylase
arg261-to-gln mutation. Europ. J. Pediat. 150:
493-497, 1991. [PubMed: 1915502]
[23] Abadie, V., Lyonnet, S., Maurin, N.,
Berthelon, M., Caillaud, C., Giraud, F., Mattei, J.-F., Rey,
J., Rey, F., Munnich, A. CpG dinucleotides are mutation
hot spots in phenylketonuria. Am. J. Hum. Genet. 45
(suppl.): A169-only, 1989. [PubMed: 2574153]
[24] Okano, Y., Eisensmith, R. C., Dasovich,
M., Wang, T., Guttler, F., Woo, S. L. C. A prevalent
missense mutation in Northern Europe associated with
hyperphenylalaninaemia. Europ. J. Pediat. 150:
347-352, 1991. [PubMed: 2044609]
[25] Dworniczak, B., Aulehla-Scholz, C.,
Horst, J. Phenylketonuria: detection of a frequent
haplotype 4 allele mutation. Hum. Genet. 84: 95-96,
1989. [PubMed: 2606484]
[26] Wang, T., Okano, Y., Eisensmith, R. C.,
Fekete, G., Schuler, D., Berencsi, G., Nasz, I., Woo, S. L.
C.Molecular genetics of PKU in Eastern Europe: a nonsense
mutation associated with haplotype 4 of the phenylalanine
hydroxylase gene. Somat. Cell Molec. Genet. 16:
85-89, 1990. [PubMed: 2309142]
[27] Okano, Y., Eisensmith, R. C., Dasovich,
M., Wang, T., Guttler, F., Woo, S. L. C. A prevalent
missense mutation in Northern Europe associated with
hyperphenylalaninaemia. Europ. J. Pediat. 150:
347-352, 1991. [PubMed: 2044609]
[28] Baric, I., Mardesic, D., Sarnavoka, V.,
Lichter-Konecki, U., Konecki, D. S., Trefz, F.
K. Geographical distribution of the P281L mutation at the
phenylalanine hydroxylase locus: possible origin in
southeastern Europe. J. Inherit. Metab. Dis. 17:
376-377, 1994. [PubMed: 7807961]
[29] Okano, Y., Eisensmith, R. C., Dasovich,
M., Wang, T., Guttler, F., Woo, S. L. C. A prevalent
missense mutation in Northern Europe associated with
hyperphenylalaninaemia. Europ. J. Pediat. 150:
347-352, 1991. [PubMed: 2044609]
[30] Gersting, S. W., Kemter, K. F.,
Staudigl, M., Messing, D. D., Danecka, M. K., Lagler, F. B.,
Sommerhoff, C. P., Roscher, A. A., Muntau, A. C. Loss of
function in phenylketonuria is caused by impaired molecular
motions and conformational instability. Am. J. Hum.
Genet. 83: 5-17, 2008. [PubMed: 18538294]
[31] Apold, J., Eiken, H. G., Svensson, E.,
Kunert, E., Kozak, L., Cechak, P., Guttler, F., Giltay, J.,
Lichter-Konecki, U., Melle, D., Jaruzelska, J. M. The
phenylketonuria G272X haplotype 7 mutation in European
populations. Hum. Genet. 92: 107-109, 1993. [PubMed:
8370573]
[32] Dworniczak, B., Aulehla-Scholz, C.,
Kalaydjieva, L., Bartholome, K., Grudda, K., Horst,
J. Aberrant splicing of phenylalanine hydroxylase mRNA:
the major cause for phenylketonuria in parts of southern
Europe.Genomics 11: 242-246, 1991. [PubMed: 1769645]
[33] New gene therapy technique cures PKU-
Chu Wai Lang, 11-Oct-2005
