- Introducción
- Delimitación del tema
- Sistema endocrino difuso origen de los TNE
G-I - Historia evolución y nomenclatura actual
de los tumores neuroendocrinos - Epidemiologia
- Perfil
celular y metabólico. Descripción
histopatológica - Genética y biología
molecular - Estudio de una neoplasia neuroendocrina
gastrointestinal. Marcadores
bioquímicos - Tumores carcinoides gastrointestinales.
Carcinoide gástrico - Tratamiento de las metástasis
hepáticas - Conclusiones
- Abreviaturas
- Bibliografía

INTRODUCCION
Los tumores neuroendocrinos gastrointestinales (TNE G-I)
son un grupo de neoplasias originadas de las células
neuroendocrinas intestinales. Constituyendo solo el 1 a 2 % del
epitelio intestinal, estas células conforman en conjunto
el mayor órgano neuroendocrino del organismo, el
denominado sistema endocrino difuso (SED) del tracto
gastrointestinal.1 Si bien los TNE G-I comparten aspectos
fenotípicos comunes y producen sustancias bioactivas y
factores de crecimiento, se caracterizan por su marcada
heterogeneidad en términos de estirpe celular,
localización anatómica, marcadores
biológicos y potencial asociación con
síndromes de hipersecreción lo que con frecuencia
se traduce en un desafío diagnóstico y
terapéutico.2
El tumor carcinoide (TCa) es el más frecuente de
los TNE G-I y se origina de las células enterocromafines.
Su conocimiento por parte del cirujano reviste particular
importancia ya que en el tracto gastrointestinal se originan el
70% de todos los TCa.3 Si bien su prevalencia es baja,
correspondiendo a un 2% de los tumores gastrointestinales, los
TCa constituyen un tercio de los tumores del intestino delgado y
la mitad de las neoplasias apendiculares.4 Además, es
notorio el aumento en su diagnostico en las últimas
décadas, hecho seguramente influido no solo por los
avances endoscópicos sino también por la creciente
tendencia a la publicación de reportes de casos. Este
último aspecto resulta particularmente interesante cuando
se realiza una revisión del tema. Si bien es abundante y
de fácil acceso, la literatura puede resultar confusa ya
que suelen utilizarse en forma indistinta términos como
TNE G-I, APUDomas, tumores endocrinos intestinales, tumores de
células argentafines o TCa.
DELIMITACION DEL
TEMA
La presente revisión inicia mencionando aspectos
generales referidos al origen, historia, epidemiologia,
fisiopatología, clasificación y diagnostico de los
tumores neuroendocrinos de origen gastrointestinal.
Posteriormente revisaremos aspectos específicos de los
tumores carcinoides gástricos, del intestino delgado,
apéndice colon y recto, haciendo especial énfasis
en sus aspectos diagnósticos y tratamiento actual.
Finalmente analizaremos el tratamiento de las metástasis
hepáticas en los TNE G-I
SISTEMA ENDOCRINO
DIFUSO ORIGEN DE LOS TNE G-I
Las células neuroendocrinas derivan de la cresta
neural y endodermo. Comparten características de las
células neuronales aunque carecen de axones y sinapsis.
Producen neuropéptidos, neuromoduladores y
neurotransmisores los cuales están presentes en sus
gránulos de secreción.5 Estas células pueden
organizarse formando glándulas (hipófisis,
paratiroides, médula adrenal y paraganglios) o disponerse
en forma difusa como en el páncreas, tracto intestinal y
respiratorio, vía biliar, tracto urogenital, timo,
tiroides (células C) y piel. En el tracto gastrointestinal
estas células conforman el mayor órgano
neuroendocrino del organismo el cual se denomina SED.5 Existen al
menos 15 péptidos secretados por los distintos tipos de
células neuroendocrinas del páncreas y del tracto
gastrointestinal: insulina, glucagón, somatostatina,
polipéptido pancreático, ghrelina, GIP
(péptido gastrointestinal), gastrina, secretina,
Péptido YY, GLP-1 ("glucagón péptido
like" tipo 1), GLP-2, neurotensina, serotonina, histamina,
motilina, substancia P, CCK (colecistokinina). Estos
neuropéptidos regulan la homeostasis de la glucosa, la
secreción pancreática exocrina, la motilidad y el
vaciamiento gástrico, el crecimiento y la
proliferación intestinal, entre otras funciones.5 El
concepto clásico de Pearsen, que asumía que las
células neuroendocrinas derivaban de la cresta neural y
migraban luego al epitelio intestinal ha sido desplazado por los
conocimientos actuales que demuestran que dichas células
se originan en el endodermo a través de complejos
programas de diferenciación de células madre.5 6
Este concepto cobra relevancia para entender el origen de los TNE
G-I. Si podemos conocer los factores moleculares que intervienen
tanto en el desarrollo, como en el mantenimiento de la
función madura de las células neuroendocrinas ello
nos puede llevar a comprender qué mecanismos hacen que
estos tumores tengan distintos grados de diferenciación y
agresividad.3
Tanto en el páncreas como en las criptas
intestinales intervienen diversos factores de
transcripción que facilitan o impiden la
diferenciación neuroendocrina de los cuales la Neurogenina
3 (Ng3) es el principal.5 7 En el intestino el proceso de
diferenciación se inicia en las células
pluripotenciales localizadas en las criptas intestinales las
cuales derivarían en enterocitos, células de
Paneth, células caliciformes y células
neuroendocrinas. Este proceso se inicia a través de Math1,
un factor de transcripción de la familia bHLH ("basic
helix-loop-helix"). Posteriormente Ng3 inicia la
diferenciación en los distintos tipos celulares
neuroendocrinos: células D (somatostatina), D1 (VIP), I
(CCK), K (GIP), M (motilina), N (neurotensina), L (PYY y GLP-1),
S (secretina), EC (serotonina) y P/D1 (Ghrelina). En el
estómago el desarrollo de células productoras de
glucagón, gastrina y somatostatina es dependiente
también de Ng3, sin embargo solo una parte de
células ECL ("enterocromafin like"), EC y
células productoras de Ghrelina se diferencian a
través de este mecanismo.5
Algunos TNE G-I pueden conservar e incluso amplificar la
producción de las células de origen. El producto
clásico es la 5-hidroxitriptamina o serotonina (5-HT). La
producción en exceso de esta amina es la responsable del
síndrome carcinoide.3
HISTORIA
EVOLUCION Y NOMENCLATURA ACTUAL DE LOS TUMORES
NEUROENDOCRINOS
Definidos conceptualmente por primera vez por Lubarsch
en 1888 el término "Karznoid" (similar al carcinoma) fue
acuñado por Oberndorfer en 1907 para describir a una serie
de tumores gastrointestinales que tenían un comportamiento
menos agresivo que los adenocarcinomas intestinales.3 6
Posteriormente el propio Oberndorfer fue reconociendo el
potencial carácter maligno de estos tumores y modifico sus
planteamientos iniciales referidos a la naturaleza "benigna" de
los mismos.3 Varios años antes, en 1890, Ransom
había informado de la existencia de 2 tumores en el
íleon con similares características
histológicas los cuales se asociaban con diarrea y
sibilancias. En aquella época no se había apreciado
aun la secreción de hormonas por parte de estos tumores.6
En 1914 Gosset y Masson plantearon que los TCa se originaban de
las células EC gastrointestinales al identificar estas
células en TCa lo que les confirió por primera vez
el carácter de tumores endocrinos. En 1951 Scholte realiza
la primera descripción del síndrome carcinoide y en
1953 Lembeck pudo extraer 5-HT de un TCa. En 1955
Page demostró la presencia de acido
5-hidroxiindolacético (5-HIA) a nivel urinario en
pacientes con síndrome carcinoide.3 6
En nuestro medio diversos autores se han referido a este
tema. En 1959 Acosta-Ferreira
y Franco-Raffo 8 publicaron acerca de la
citofisiología e histoquímica de las células
argentafines. Lorenzo, Losada y cols. 9 publicaron en 1960 el
primer caso de tumor carcinoide con síndrome carcinoide de
nuestro medio. En 1961 Sanguinetti y cols. 10 hacen referencia a
la serotonina, tumor carcinoide y síndrome carcinoide.
Filgueiras y Facal 11 en 1968 publican su trabajo sobre tumores
primitivos del yeyunoíleon. Cassinelli y Estefan en 1970
publican un caso clínico acerca de un tumor carcinoide del
íleon con síndrome carcinoide. 12 En 1973 Estrugo
presenta su tesis de doctorado, acerca de los tumores carcinoides
del aparato digestivo. 13 En agosto de 1975 se efectuó una
mesa redonda en la Sociedad de Cirugía del Uruguay sobre
tumores carcinoides del aparato digestivo. En esta mesa los
tumores carcinoides son referidos como tumores de origen
neuroectodérmico, ubicados en el tracto gastrointestinal,
genitourinario, y bronquial, con una biología particular
de crecimiento lento, secretores de aminas biogénicas, con
características macro y microscópicas propias que
permiten individualizarlos y distinguirlos de otros tumores. 14
Más recientemente Krygier y Espasandín publican un
caso clínico acerca de manifestaciones poco frecuentes del
síndrome carcinoide. 15 En el congreso uruguayo de
cirugía del año 2003 se presentaron como temas
libres 2 revisiones acerca de tumores carcinoides apendiculares y
del recto.16 En el año 2009 se presentó en el
congreso argentino de Buenos Aires un trabajo retrospectivo
epidemiológico realizado en el Hospital Maciel acerca de
carcinoides apendiculares.17
La primera clasificación de este grupo de
neoplasias la realizaron Williams y Sandler en 1963 y las
dividieron según el origen embriológico en
carcinoides del intestino anterior (broncopulmonares, timo,
estómago, duodeno y páncreas), carcinoides del
intestino medio (intestino delgado, apéndice y colon
derecho, ovarios y testículos) y carcinoides del intestino
posterior (colon transverso, descendente, sigmoides y recto).2 4
Esta clasificación no tuvo una aceptación universal
dado que en el mismo grupo hay lesiones de comportamiento
biológico muy dispar. Sin embargo, sus investigaciones
pusieron de manifiesto que los tumores desarrollados a partir de
los diferentes sectores del intestino embrionario variaban en
cuanto a características histológicas
inmonohistoquímicas y producción hormonal.3 18 Los
TCa del intestino anterior suelen ser argentafínico
negativos, presentan bajos niveles de 5-HT y a menudo secretan 5-
hidroxitriptófano (5- HTP) e histamina. Los TCa del
intestino medio son argentafínico positivos y presentan un
elevado contenido de 5-HT, secretan taquininas, prostaglandinas y
bradiquininas a la circulación. Los TCa del intestino
posterior son argentafínico negativos, rara vez contienen
5-HT o secretan 5-HTP.3 19 Aunque esta clasificación es
útil y destaca las diferencias clínico
patológicas entre los distintos TNE G-I es imprecisa para
predecir el comportamiento biológico de cada tumor, sobre
todo para los tumores derivados del intestino
anterior.3
En 1980 la OMS clasificó como carcinoides a la
mayor parte de los tumores endocrinos. Se distinguieron los
tumores pancreáticos y de otras localizaciones
extragastrointestinales. Los carcinoides a su vez se
subdividieron en los originados de células EC, de
células G o no especificados. Esta clasificación
resultó confusa porqué los patólogos
denominaron carcinoide a todos los tumores con
diferenciación neuroendocrina, aplicando este
término a tumores con morfología clásica y a
neoplasias atípicas, mientras que los oncólogos
entendían como tal a aquellas neoplasias productoras de
serotonina y de síndrome carcinoide.3 Una dificultad
añadida en esta clasificación es el hecho de que
los carcinoides diferían en su comportamiento según
la localización.2 Esto condujo a la elaboración de
una nueva clasificación que fue establecida por la OMS en
el año 2000 la cual consta de un esquema general aplicable
a todas las neoplasias endócrinas
gastroenteropancreáticas, independientemente de su
localización anatómica.
Consta de cinco categorías principales que
distinguen a las neoplasias con fenotipo endócrino puro de
las neoplasias mixtas exocrino-endócrinas (con fenotipo
divergente) y las lesiones pseudotumorales:
1. Tumor neuroendocrino (TNE) bien diferenciado
(de comportamiento benigno/incierto).
2. Carcinoma neuroendocrino (CaNE) bien
diferenciado (bajo grado de malignidad).
3. Carcinoma neuroendocrino pobremente
diferenciado (small cell), (alto grado de malignidad).
4. Carcinoma mixto neuroendocrino-exocrino (el
más agresivo dicta el pronóstico).
5. Lesiones tumor – like.
Entre las neoplasias neuroendocrinas con fenotipo
endócrino puro la distinción entre neoplasias
endócrinas bien y pobremente diferenciadas se realiza en
base al tamaño tumoral, su índice mitótico y
rango de proliferación, invasión local y/o
linfovascular y presencia de metástasis.2
El término de tumor neuroendocrino bien
diferenciado se aplica a aquellas neoplasias con estructura
monomorfa trabecular y microlobulillar, a veces con áreas
más sólidas, atipía celular leve, bajo
índice mitótico (1-2 mitosis/10 CGA) y bajo
índice proliferativo valorado con el índice Ki67
(<2%).2 3
El término de carcinoma neuroendocrino bien
diferenciado se aplica a neoplasias que muestran predominio de
nidos sólidos, con necrosis escasa, atipía
más evidente y actividad mitótica importante (2-20
mitosis/10 CGA) a veces mitosis atípicas y un
índice proliferativo valorado con Ki67 >2% y <20%.2
3
El término de carcinoma neuroendocrino poco
diferenciado se aplica a neoplasias muy agresivas
histológica y citológicamente, con atipía
marcada, elevado índice mitótico (>20 mitosis/10
CGA), mitosis atípicas y abundante necrosis. Es frecuente
observar invasión vascular y perineural. El índice
proliferativo Ki67 es >20%.2 3
En base a los criterios histopatológicos de la
vigente clasificación, los TCa corresponden a la
categoría de TNE bien diferenciados, sin embargo el
término "carcinoide" persiste en el arraigo medico
utilizándose en forma indistinta lo que genera
complicaciones interpretativas a la hora de analizar estas
neoplasias. Habitualmente se designa con el término de
"carcinoides" a los tumores del tubo digestivo que producen 5-HT
o que inducen un síndrome carcinoide. Ello hace que el
término se aplique esencialmente para los carcinoides de
apéndice y de intestino delgado mientras que los restantes
"tumores carcinoides" suelen designarse como TNE, con
indicación posterior de su origen y de si se correlacionan
o no con una endocrinopatía.3
En la presente revisión el término TCa
será utilizado como sinónimo de TNE bien
diferenciado con independencia de si produce 5-HT o no y de la
inducción de un síndrome carcinoide.
EPIDEMIOLOGIA
La incidencia global de los tumores carcinoides
gastrointestinales es de 2.5 a 5 por
100000 personas aunque probablemente estemos ante una
subestimación de la misma dado que habitualmente son
tumores asintomáticos.6 La incidencia y prevalencia de
estos tumores ha aumentado significativamente a lo largo de las
últimas décadas.20
Según un análisis de 13715 casos de TCa,
el 68% se originan en el tubo digestivo y el
25% lo hacen en las vías broncopulmonares. Los
carcinoides del intestino delgado son los más frecuentes
45%, le siguen los rectales 20%, apéndice 16%, colon 11% y
luego los del estomago con un 7%. 21 La edad de los pacientes al
momento del diagnostico varia en relación a la
topografía pero promedialmente es de 50 años. Los
TCa son más frecuentes entre los hombres afro-americanos
(aproximadamente 4,5 por 100.000 personas) que entre los varones
de raza blanca (2,5 por cada 100.000 personas) siendo la
incidencia por sexos similar o ligeramente más elevada en
hombres.20 21 La incidencia ajustada por edad de los carcinoides
del intestino delgado ha aumentando un 460% en los últimos
30 años. La prevalencia durante este mismo periodo aumento
un 274 % en personas de raza blanca y un 500% en personas de raza
negra, incremento que puede obedecer en parte al aumento de las
comunicaciones de casos y a la mayor tasa de detección
propiciada por los avances endoscópicos. 3
PERFIL CELULAR Y
METABOLICO Descripción
histopatológica
Los TCa gastrointestinales suelen aparecer como lesiones
nodulares sólidas, únicas o múltiples, raras
veces ulceradas. Estos tumores están habitualmente
formados por capas monótonas de células
pequeñas, uniformemente redondas, sin apenas atipias
nucleares y escasas mitosis, que adoptan diversos patrones de
crecimiento: insular (en nódulos sólidos),
trabecular (en cintas entrelazadas), raras veces con
disposición glandular o con aspecto indiferenciado y
frecuentemente con un patrón mixto.22 (Fig. 1 y 2). Dos
hechos histológicos, además de los descritos,
destacan en estos tumores: por una parte, su acusada
vascularización y, por otra, la intensa reacción
desmoplásica que originan, en forma de fibrosis
peritumoral.3 A pesar del patrón histológico de
neoplasia indolente que coincide con su comportamiento
clínico y que mereció hace un siglo el calificativo
de "carcinoide" hoy sabemos que en una pequeña
fracción de los TNE-GI (menos del
20%) se aprecian signos histológicos de
agresividad (displasia celular, índices proliferativos
elevados, imágenes de angioinvasión y necrosis
tumoral), que no siempre implican un comportamiento
biológico más agresivo.3 6 El hallazgo
ultraestructural en el citoplasma de las células
carcinoides, de vesículas grandes (de más de 80 nm
de diámetro), con un grueso gránulo electrodenso,
donde se albergan los productos de secreción de
aquéllas (aminas bioactivas y péptidos hormonales),
junto con otras vesículas pequeñas (de 40-80 nm de
diámetro), que corresponden a estructuras
sinápticas neuronales, son 2 imágenes que avalan
morfológicamente la naturaleza neuroendocrina de dichas
células.22
Inmunohistoquímica
La tinción de una parte de las células de
los TCa-GI con cromato potásico justifica su
definición como células
"enterocromafin-símiles", (EC-l), por sus siglas en
inglés (enterochromaffin-Iike). Por otra parte,
el contenido granular de las células carcinoides reacciona
de manera diferente frente a las sales de plata. En una parte de
dichas células este contenido reduce directamente las
sales de plata (reacción argentafin, de ahí la
denominación de tumores de células argentafines),
mientras que en otras, para que se produzca esta reducción
hasta plata metálica es necesaria la intervención
de un agente reductor exógeno (reacción
argirófila).6 22 Finalmente, con el tiempo se ha ido
identificando una serie de proteínas ligadas a estructuras
citoplasmáticas carcinoides que parecen comportarse como
«marcadores paneuroendócrinos », más o
menos específicos, entre los que se encuentran la enolasa
específica de neuronas, la
sinaptofisina y, sobre todo, las cromograninas A, B y
C.3 6 22 (Fig. 3 4 y 5)

Fig. 1 y 2 Tumor carcinoide del
intestino delgado
Patrón de crecimiento en nidos
Inmunohistoquímica

Fig. 3 Enolasa especifica
neuronal

Fig. 4 Sinaptofisina

Fig. 5 Cromogranina A
Perfil metabólico
Poco sabemos sobre las alteraciones metabólicas
que presentan las células de los
TCa-GI con excepción de la distorsión del
metabolismo del triptófano. (Fig. 6).
El 99% del aporte del triptófano alimentario, se
metaboliza, en condiciones fisiológicas, gracias a la
acción de una oxidasa que lo transforma en ácido
nicotínico, este es necesario fundamentalmente para el
metabolismo cerebral pero también de otros tejidos.22
Sólo un 1% del triptófano sufre su
transformación a 5-hidroxitriptófano (5- HTF)
gracias a la acción de una hidroxilasa. Este modelo
metabólico se rompe por completo, en sujetos afectados de
un TCa-GI, ya que las células de estos tumores "reclaman"
para sí hasta el 60% del triptófano
dietético el cual es desviado hacia una
hidroxilación que de este modo lo transforma masivamente
en 5-HTF.6 Este último metabólico, bajo la
acción de una decarboxilasa de aminoácidos
aromáticos, se transforma en 5-hidroxi-triptamina o
serotonina (5-HT), a su vez, se degrada a ácido
5-hidroxi-indol-acético (5-HIA). Este
último paso metabólico se realiza fundamentalmente
en el hígado gracias a la acción de la
monoaminoxidasa y, en menor cuantía, en el
riñón, gracias a la aldehído-deshidrogenasa.
Por último, el ácido 5-HIA se elimina en la orina
como producto metabólico terminal. Esta distorsión
del metabolismo del triptófano explica el anormal
almacenamiento de 5-HT y 5-HTF, en los gránulos
electrodensos de las células de muchos de estos tumores.3
6 Con el paso del tiempo se ha ido descubriendo que,
además de la 5-HT y del 5-HTF, las células de los
TCa son capaces de sintetizar, almacenar y, a veces, segregar
unos 40 productos pertenecientes a diversas familias moleculares.
Entre éstas destacan las siguientes: aminas bioactivas
(5-HT, 5-HTF, histamina, etc.); péptidos hormonales,
hormona del crecimiento (ACTH) gastrina, glucagón,
somatostatina, gonadotropina coriónica, calcitonina,
etc.); taquininas (sustancia P, neuropéptido K,
kalicreína, etc.) y algunas prostaglandinas (PG-E). La
acción combinada de varias de estas sustancias, cuando
llegan a la circulación general, conduce al desarrollo del
denominado "síndrome carcinoide" 3 6 23.

Fig. 6. Distorsión del normal
metabolismo del triptófano en los tumores
carcinoides.
GENETICA Y
BIOLOGIA MOLECULAR
Los TCa se han asociado con una variedad de alteraciones
genéticas. El síndrome de neoplasia endocrina
múltiple tipo 1 (NEM 1) es un trastorno autosómico
dominante asociada con la pérdida del gen supresor tumoral
en el cromosoma 11q13.6
Se caracteriza típicamente por la presencia de
tumores de paratiroides e hipófisis, tumores endocrinos
del páncreas y TCa los cuales tienen una incidencia de10%
en las personas afectadas por este síndrome.24
Particularmente los TCa gástricos.24
También se ha descubierto que el gen del
síndrome de NEM 1 puede estar implicado en la
tumorigénesis de los carcinoides esporádicos,
incluso en ausencia de otras manifestaciones del síndrome
NEM 1. En un estudio, la pérdida de heterocigosidad en el
cromosoma 11q13 se identificó en el 78% de 46 pacientes
con TCa esporádicos.25
Para los carcinoides del intestino medio, las
áreas principales de la pérdida cromosómica
son 18q (54%), 9p (15%), 11q (13%), y 16q (12%).26 27 Mutaciones
del gen NEM 1 se han detectado sólo ocasionalmente en TCa
del intestino medio.28 Un estudio reciente asigna la
pérdida de heterocigosidad en el gen NEM 1 en sólo
1 de 9
TNE del intestino medio mientras que 3 de los 9
tenían pérdida de heterocigosidad en 11q23.29 Las
mutaciones del gen supresor tumoral p53 han sido implicadas en el
proceso de tumorigénesis aunque la inactivación de
este gen sólo se ha demostrado en TCa atípicos
broncopulmonares y no parece desempeñar ningún
papel importante en los TCa G-I .También los genes Bcl 2 y
Bax que intervienen en la regulación de la apoptosis
celular han sido implicados.6 La apoptosis celular está
influenciada por las diferencias en la expresión de las
proteínas codificadas por estos genes, actuando algunas
como promotoras y otras como inhibidoras de las señales de
apoptosis. El heterodímero Bcl 2-Bax tiene efecto
inhibitorio de la apoptosis en cambio la formación de
homodímeros Bax-Bax la favorece. Se ha demostrado
sobreexpresión de Bcl 2 las lesiones metastásicas
en comparación con el tumor primario.6
La expresión de factores de crecimiento como el
factor básico de crecimiento de fibroblastos (bFGF),
factor de crecimiento vascular endotelial (VEGF), factor de
crecimiento transformante alfa y beta (TGF a el TGF ß),
factor de crecimiento derivado de plaquetas (PDGF), factores de
crecimiento similares a la insulina I y II (IGF-I y II), factor
de crecimiento epidérmico (EGF) se ha demostrado en TNE
G-I y pulmonares.3 6
Otra característica del perfil biológico
de las células de los TCa es la de expresar, en sus
membranas, receptores para ciertas hormonas, como la
somatostatina (SST-r), y varios de los factores de crecimiento
mencionados, como el fibroblástico (FGF-r) el derivado de
las plaquetas (PDGF-r), etc. Estos receptores parecen
desempeñar algún papel en la patogenia de estos
tumores y como veremos, en sus posibilidades diagnósticas
y terapéuticas.3 6
ESTUDIO DE UNA
NEOPLASIA NEUROENDOCRINA GASTROINTESTINAL Marcadores
bioquímicos
Los TCa pueden manifestarse por síntomas poco
ostensibles y comunes a otras afecciones del tracto
gastrointestinal incluso ser asintomáticos, es por ello
que generalmente se requiere de un alto nivel de sospecha y
numerosas investigaciones para establecer su diagnostico. Frente
a la sospecha de un TCa debe solicitarse marcadores
bioquímicos.30 La medición de los niveles urinarios
del metabolito principal de la 5-HT, el 5-HIA en una muestra de
orina de 24 horas (rango normal de 2.8 mg/24 horas) es positiva
en aproximadamente un 50% de los pacientes con TCa tengan o no
síndrome carcinoide.3 6 30 Un nivel elevado de 5-HIA
urinario tiene una sensibilidad diagnóstica del 70% y una
especificidad de 88% al 100%. Los niveles se correlacionan con la
carga tumoral. Sin embargo, las frutas y hortalizas, como banana,
kiwi, ananá, ciruela, tomate y una variedad de frutos
secos, incluyendo maní y nueces pueden aumentar los
niveles urinarios de 5-HIA y deben evitarse antes del examen. Los
fármacos con guaifenesina, paracetamol, salicilatos y la
L-dopa también afectan los niveles urinarios de 5-HIA.3
30
Se ha informado que la medición de los niveles
plasmáticos de 5-HT es más sensible que la de su
metabolito en orina el 5-HIA para la detección de los TCa.
Esto fue particularmente cierto en pacientes con tumores
productores de bajos niveles de 5-HT. Además, los niveles
de 5-HT no se vieron afectadas por la dieta.3 6
Otro marcador tumoral es la cromogranina A (CgA). Esta
proteína de 49 kd esta presenta en las vesículas
neurosecretoras de las células de los TNE y es detectable
en el plasma de los pacientes con TCa con independencia de la
producción de 5-HT por lo cual es considerado como el gold
standard en muchas instituciones.3 6 30 Debe saberse que niveles
de CgA también pueden estar elevados en otras enfermedades
endocrinas y no endocrinas. Es bien sabido que las drogas que
suprimen la secreción de ácido gástrico, los
inhibidores de la bomba de protones (IBP), pueden aumentar los
niveles de gastrina.6 Los IBP, tan ampliamente utilizados, pueden
causar, utilizados por tiempo prolongado, una hiperplasia de
células EC-l con hipergastrinemia secundaria,
condición esta que puede elevar los niveles de CgA. Los
valores de CgA pueden permanecer elevados durante meses luego de
la suspensión de los IBP.31 Algunos resultados falsos
positivos se producen en presencia de insuficiencia renal,
tratamiento con corticoides, hipergastrinemia y el uso de IBP.6
La CgA tiene un ritmo circadiano no vinculados a las
catecolaminas en plasma, por lo tanto, la recolección de
sangre para la medición de sus niveles debe hacerse
aproximadamente a la misma hora del día.3 6
El nivel de CgA para el diagnóstico y seguimiento
de TNE tiene una sensibilidad del 62,9% y una especificidad del
98,4%. Los niveles son más elevados en tumores secretantes
frente a los no secretantes y se relacionan con el grado de
metástasis.3 6 30
Niveles mayores de 5000ug/L se asocian con peor
pronóstico. Las mediciones seriadas cada 3 o 6 meses son
un marcador confiable para el seguimiento después del
tratamiento.3 6 30
Perfil endoscópico imagenológico y
utilidad de los radiomarcadores
La mayor disponibilidad de la endoscopia ha desplazado a
la radiología simple o con bario y por lo tanto
habitualmente TCa G-I, sobre todo los gástricos y
colorectales son visualizados por endoscopia en pacientes que se
encuentran en evaluación por anemia o dolor abdominal
inespecífico.3 6
La tomografía (TAC) y la resonancia nuclear
magnética (RNM) de abdomen tienen una sensibilidad del 80
al 90% para detectar secundarismo hepático (Fig. 7).
También puede identificar el tumor primario y el
compromiso ganglionar con una sensibilidad del 50 al 80% para
tumores mayores al cm.3 6 30 El clásico signo indirecto de
sospecha es la presencia de la "imagen radiada" o en el signo de
la "rueda de carro" que traduce la fibrosis mesentérica
por el crecimiento de tipo desmoplásico de los TCa del
intestino delgado (Fig. 8). 3 La gammagrafía con
análogos de la somatostatina (Fig. 9 y 10) es la
técnica gold standard para evaluar la extensión
lesional en los pacientes con TCa G-I.3 6 30 La mayoría de
los TNE y en especial los TCa expresan receptores de membrana
para el péptido somatostatina. En alrededor del 90% de los
casos estos receptores se expresan tanto en los tumores primarios
como en las metástasis. Actualmente se han descrito 5
subtipos de receptores de somatostatina que han sido enumerados
del SST-1 al SST-5.3 Múltiples investigaciones han
demostrado que alrededor de 90% de los TCa expresan el subtipo
SST-2 y 50% el subtipo SST-5. Por esta razón el
111In-DTPA-D-Phe1 octreotide (OctreoScan®), que
tiene afinidad por ambos subtipos de receptores, ha demostrado un
elevado rendimiento para el diagnóstico, la
estadificación y el seguimiento de los TNE y en particular
de los
Tumores Carcinoides.32
La utilización de tomografía por
emisión de positrones (PET scan) se basa en el hecho que
habitualmente las células neoplásicas tienen una
mayor tasa replicativa y por lo tanto glucolítica que las
células normales. El marcador 18fluoro-2-desoxi-D-glucosa
(FDG) es el más comúnmente utilizado para
identificar aumento de la captación por los tumores. Dado
que la mayoría de los TCa son de replicación lenta
la sensibilidad de este estudio es notoriamente inferior al del
OctreoScan.32 Un estudio publicó 89% vs. 58%
respectivamente.32 Se están desarrollando investigaciones
de la utilidad del PET scan con otros radiomarcadores. El cambio
se basa en las alteraciones del metabolismo del triptófano
que se produce en pacientes con TCa utilizando el 5-HTP marcado
con 11C. 3

Fig. 7. Secundarismo
Hepático.

Fig. 8. Signo de la rueda de
carro

Fig.9. OctreoScan. Exploración
normal

Fig. 10. OctreoScan. Metástasis
hepáticas y peritoneales
TUMORES
CARCINOIDES GASTROINTESTINALES CARCINOIDE
GASTRICO
En el estómago las dos principales células
endocrinas son las G, ubicadas en el antro y productoras de
gastrina y las células EC-l localizadas en el cuerpo y
fondo, productoras principalmente de histamina. Desde el punto de
vista de la célula de origen se han caracterizado 2 tipos
principales de TNE, el originado de las células G llamado
gastrinoma y las neoplasias de células EC-l o TCa. Estas
últimas constituyen la gran mayoría de las
neoplasias neuroendocrinas de estomago; los gastrinomas son
extremadamente infrecuentes.31 Los TCa gástricos
constituyen el 4% del total de los TCa G-I y el 1% de las
neoplasias gástricas, se clasifican en 4 tipos. Los 3
primeros se originan en las EC-l, siendo los de tipo 1 y 2
tumores dependientes de la gastrina.3 Se ha demostrado que el
porcentaje de carcinoides gástricos va en aumento. Los
primeros datos recopilados en los años 70 registran una
incidencia del 2.5% mientras que los más recientes hacen
referencia a una incidencia del 6%. También se ha
observado que el porcentaje de carcinoides gástricos en
relación al conjunto de las neoplasias de estomago ha
crecido de un 0.4% a un 1,8%. No se sabe con precisión si
estos datos corresponden a una pauta de crecimiento real o se
deben a la mejora de los métodos diagnósticos y al
mayor número de comunicaciones de casos.3 31
CARCINOIDE GASTRICO DE TIPO 1
Los carcinoides gástricos de tipo 1 constituyen
el 70 a 80% de los carcinoides del estomago y se desarrollan como
consecuencia del efecto trófico de la gastrina sobre las
EC-l.3 6 31 Estos tumores se asocian con gastritis
atrófica crónica autoinmune en el 50% de los casos.
La gastritis atrófica puede estar condicionada por anemia
perniciosa o por infección por HeIicobacter pylori (H
pylori); en el primer caso, los anticuerpos
anticélulas parietales producen atrofia de la mucosa
oxíntica y en el segundo, la gastritis asociada con H
pyIori puede llevar a atrofia gástrica; la
hipoclorhidria resultante, con disminución del pH del
contenido gástrico es un estímulo para que las
células G del antro aumenten la secreción de
gastrina; esta última, además de estimular a las
células parietales para que incrementen la
producción de ácido, tiene un efecto trófico
sobre las células EC-l del cuerpo y fondo. Si el
estímulo persiste por tiempo prolongado, se produce
hiperplasia de células G, hipergastrinemia e hiperplasia
de células EC-l, lo que puede conducir, después de
un tiempo prolongado a tumores de células EC-l denominados
TCa gástricos.31 Es características de estos
tumores el hecho de ser múltiples y pequeños
(<2cm). Se topografían con mayor frecuencia en el
fundus o cuerpo y dada que generalmente se asocian a
malabsorción de vitamina b12 y anemia perniciosa su
incidencia es mayor en mujeres a partir de los 50 años.3 6
31
El diagnostico suele establecerse en forma accidental
durante la realización de una fibrogastroscopía
(Fig. 11) ya que estos pacientes son generalmente
asintomáticos. Aunque también se han reportado
casos sintomáticos caracterizados por dolor abdominal y
episodios de sangrado.30 La mayoría de estos tumores son
de comportamiento benigno y desde el punto de vista
histológico la mayoría clasifican como tumor
neuroendocrino bien diferenciados.3 Se han comunicado
metástasis hasta en 3 a 5% de los casos que deben ser
evaluadas mediante estudios de imagen como TAC (Fig. 12) o RNM.
En cuanto al tratamiento quirúrgico, las lesiones
polipoides menores de 1 cm, en escaso número (5 o menos)
pueden ser tratadas con éxito mediante escisión
endoscópica. Posteriormente se deben realizar controles
endoscópicos con toma de biopsias cada 6 meses con el fin
de detectar recurrencias, que de presentarse condicionan un
tratamiento quirúrgico mediante escisión local de
la lesión y antrectomía, ya que en diversos
estudios se ha comunicado la desaparición de TCa asociados
a hipergastrinemia mediante antrectomía, la cual lleva a
la normalización de los valores de gastrina.3 6 31 33
Cuando existen más de 5 lesiones o el tamaño es
mayor de 1 cm, el tratamiento recomendado es la
antrectomía junto con escisión local de las
lesiones mayores de 1 cm. Si en el seguimiento se objetiva
recurrencia, se debe realizar gastrectomía. Si en el
momento del diagnóstico existe crecimiento invasivo o
afección de ganglios linfáticos también se
aconseja practicar gastrectomía total. 3 6 31 33
También se han empleado análogos de la
somatostatina para reducir los niveles de gastrina y ello ha
puesto de manifiesto cierta disminución de las recidivas
aunque no existen protocolos claros en cuanto a su
indicación.3 La tasa de supervivencia a 5 años para
estos tumores es próxima al 98% lo cual refleja el
carácter benigno de este tipo de
tumores.3 31
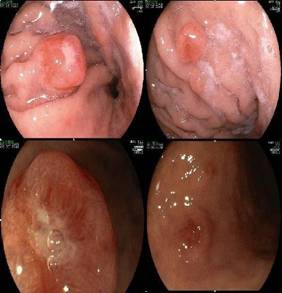
Fig. 11 Aspecto endoscópico
carcinoide gástrico
CARCINOIDES GASTRICOS DE TIPO 2

Fig. 12 TAC carcinoide
gástrico

Fig. 11 Aspecto endoscópico
carcinoide gástrico
Fig. 12 TAC carcinoide
gástrico
CARCINOIDE GASTRICO DE TIPO 2
Estos tumores al igual que los de tipo 1 son gastrina
dependiente y a menudo multifocales. Se desarrollan en pacientes
con síndrome de Zollinger-Ellison (SZE) y se producen casi
invariablemente en pacientes con síndrome NEM 1.3 6 31 En
estos pacientes la hiperplasia de las células ECL es
habitual siendo posible que hasta un 15 a
30% de estos pacientes desarrollen carcinoides en el
cuerpo y fundus del estomago. A diferencia de los de tipo 1 estos
pacientes registran niveles elevados de acido gástrico y
presentan las manifestaciones típicas del SZE.3
Además de la hipergastrinemia parece existir otro factor
causal de tipo genético (gen de la NEM 1).31 Los TCa
gástricos de tipo 2 representan el 5% de los carcinoides
gástricos y presentan igual distribución por sexos.
Histológicamente son similares a los de tipo 1 aunque su
potencial maligno es mayor. Se ha comunicado afectación de
ganglios linfáticos en un 30% de los casos y
metástasis regionales en un 10%.21 En consecuencia la
mayoría de los "carcinoides gástricos" de tipo 2
son considerados desde el punto de vista histológicos
carcinomas neuroendocrinos bien diferenciados.3 El tratamiento
quirúrgico se centra en la eliminación del tumor
primario y de la fuente de hipergastrinemia, resecando el
gastrinoma y sus metástasis en los ganglionares. El
tratamiento del TCa gástrico es similar al del tipo 1, con
mucosectomía endoscópica de tumores <1 cm.
Resección quirúrgica y vaciamiento ganglionar
regional en los tumores más grandes y multifocales con
angioinvasión o invasión de la pared. 3 33
Más recientemente se ha comunicado la regresión de
tumores carcinoides múltiples en pacientes con SZE
asociados a NEM 1 mediante tratamiento con lanreótido y
acetato de octreótido.3 6 En estos pacientes se
observó una disminución progresiva de los valores
de gastrina y una reducción del número y
tamaño de los tumores, que se atribuyó a la
disminución de la gastrinemia. La supervivencia a 5
años es de 90%.3
CARCINOIDE GASTRICO DE TIPO 3
Los tumores de tipo 3 o esporádicos son
responsables del 20% de los "carcinoides gástricos". A
diferencia de los de tipo 1 o 2 no se asocian a niveles elevados
de gastrina y suelen ser únicos y grandes siendo
más frecuente en hombres mayores de 50 años.3
31
Histológicamente pueden considerarse tumores
neuroendocrinos bien diferenciados no
obstante las lesiones grandes tienden a presentar
histología atípica con pleomorfismo , alta tasa de
mitosis y frecuentemente Ki 67 elevado en consecuencia muchos de
ellos corresponden a carcinomas neuroendocrinos mal
diferenciados.3 La afectación de ganglios regionales se
registra en un 50% de los casos aproximadamente y las
metástasis hepáticas se dan dos tercios de los
pacientes.6 21 Un síndrome carcinoide atípico puede
desarrollarse en el 5 al 10% de los pacientes con carcinoide de
tipo 3.31
Dicho síndrome es consecuencia de la
liberación de histamina y se caracteriza por
enrojecimiento parcheado de la piel, edema cutáneo,
inflamación de las glándulas salivales y lagrimeo
excesivo. Las dosificación plasmática de histamina
y urinaria de su metabolito, methylimidazoleacetic ácido
(MelmAA) sirve como marcador tumoral.6 31
El TCa gástrico esporádico se trata de
forma similar al adenocarcinoma de estomago realizando
resección en bloque de los niveles ganglionares 1 y 2
según su topografía. 3
A diferencia de los carcinoides de tipo 1 y 2 la
sobrevida a 5 años para los carcinoides de tipo 3 es de
solo un 50% cayendo al 10% si presentan metástasis al
momento del diagnostico.3
CARCIONOIDE GASTRICO DE TIPO 4
Corresponden a carcinomas endocrinos mal diferenciados y
carcinomas mixtos exocrinos-endocrinos. La gastritis
atrófica está presente en un 50% de los casos. Son
generalmente tumores únicos ulceroinfiltrantes y avanzados
con lo cual el porcentaje de
resecabilidad es bajo. Su pron6stico es malo con una
mediana de sobrevida publicada de apenas 8 meses. Dado los malos
resultados terapeuticos se ensayan en este tipo de tumores planes
quimiotenipicos3
CARCINOIDE DEL INTESTINO MEDIO
Son los tumores carcinoides más frecuentes
constituyendo el 25% de los tumores neuroendocrinos abdominales.
Se originan con mayor frecuencia en el íleon terminal
siendo las localizaciones siguientes más frecuentes el
apéndice y el colon derecho.21
Aunque estos tumores comparten el mismo desarrollo
embriológico parecen ser
Página siguiente  |
