Biodisponibilidad comparativa entre dos formulaciones de gabapentina cápsulas de 300 mg en voluntarios sanos colombianos (página 2)
MÉTODOS
Materiales comunes
· Producto de
prueba (P): Gabantex®/Gabapentin MK, cápsulas de 300
mg, lote EX2E19E, con fecha de vencimiento febrero de 2005,
producido y suministrado por Tecnoquímicas S.A.
· Producto de referencia (R): Neurontin®,
cápsulas de 300 mg, lote 084042, con fecha de vencimiento
abril de 2004, elaborado para Parke-Davis & Company bajo su
dirección y control por
Warner-Lambert LLC.
· Estándar de referencia USP de
Gabapentina, lote F.
Equipos y materiales
para la equivalencia farmacéutica. Disolutor Hanson
Research, cromatógrafo líquido Perkin Elmer, Series
200, con identificador ultravioleta con arreglo de diodos, columna
cromatográfica C18 Hewlett Packard®, controlado con el
software
TurboChrom®.
Reactivos grado HPLC. Agua obtenida
en un equipo Milli Q Plus®, acetonitrilo y metanol
Merck.
Reactivos grado analítico marca JT Baker.
Fosfato de sodio, fosfato de potasio, ácido
fosfórico, fosfato de amonio, ácido
clorhídrico, hidróxido de sodio, sal sódica
del ácido decanosulfónico y
trietilamina.
Equipos y materiales para determinar gabapentina en
plasma. Cromatógrafo líquido Hewlett Packard,
modelo 1100,
con detector de fluorescencia, columna cromatográfica C18
LiChosorb RP-select B Merck®, controlado con el programa
ChemStation®, con el cual se realizó la integración y la cuantificación del
fármaco administrado.
Reactivos grado HPLC. Metanol, acetonitrilo y
agua.
Reactivos grado analítico. Acido
perclórico, ácido
o-phtaldehído-3-mercaptopropiónico y
EDTA.
Método para la equivalencia farmacéutica.
Los dos productos
fueron evaluados in vitro, con el fin de verificar el
cumplimiento de las especificaciones establecida por la
Farmacopea Americana USP 26-NF 21 para
cápsulas9, utilizando los métodos de
cuantificación de gabapentina establecidos por
Tecnoquímicas S.A., para las pruebas de
uniformidad de dosis, disolución y valoración
(contenido de gabapentina por cápsula).
Criterio de aceptación. En la valoración,
el producto de prueba no debe diferir en más de 5% con
respecto al producto de referencia.
Método para el estudio de bioequivalencia.
Diseño
del estudio in vivo. El estudio de bioequivalencia se
realizó en 14 voluntarios sanos, 7 hombres y 7 mujeres,
bajo un diseño aleatorio, cruzado, con dosis única,
en dos períodos, con dos tratamientos, dos secuencias y un
tiempo de
lavado de una semana. Previo a la selección
de los voluntarios, se presentó el protocolo del
estudio al Comité de Ética de la Facultad de
Medicina de la
Universidad de
Antioquia y al Comité de Ética del Hospital
Universitario San Vicente de Paúl (HSVP) de
Medellín para su aprobación.
Todas las etapas del estudio in vivo se desarrollaron
cumpliendo con las BPC10, los principios
éticos de la Declaración de Helsinki11
actualizada en octubre de 2000 y la Resolución Nº
008430/93 del Ministerio de Salud de la República
de Colombia12.
Los sujetos incluidos en el estudio tuvieron edades
comprendidas entre 17 y 28 años de edad, peso corporal
entre 50.1 y 72.9 kg y la estatura varió en un rango de
1.55 a 1.84 metros. Todos cumplieron con las
características de talla y peso establecidas por la
Metropolitan Life.
Estos voluntarios se sometieron a evaluación
médica y exámenes paraclínicos, incluyendo
VIH, hepatitis B y
embarazo en
las mujeres. Recibieron toda la información concerniente al estudio, los
riesgos y los
beneficios y las condiciones a cumplir durante el mismo. Todos
firmaron el consentimiento informado antes de iniciar el
estudio.
El primer día de cada período, los sujetos
fueron confinados en el HSVP por un día, previo ayuno de
12 horas. Antes de la
administración del medicamento se tomaron muestras de
orina para verificar ausencia de drogas de
abuso (alcohol
etílico, cocaína,
marihuana,
morfina, benzodiazepinas y anfetaminas);
se tomaron los signos vitales
y la muestra de
sangre
correspondiente al tiempo cero (0:0 hora). Acto seguido se les
administraron 2 cápsulas (600 mg de gabapentina) del
producto de prueba o del producto de referencia, de acuerdo con
la tabla de asignación al azar, con 240 ml de agua. Se
tomaron muestras de sangre en tubos heparinizados, a las 0.5,
1.0, 1.5, 2.0, 2.5, 3.0, 4.0, 5.0, 6.0, 12.0, 24.0 y 36.0
horas.
La alimentación suministrada fue
estándar: desayuno, refrigerio, almuerzo, refrigerio y
cena, a las 2.0, 3.5, 5.0, 8.0 y 11.0 horas respectivamente
después de administrado el medicamento.
Las muestras sanguíneas fueron sometidas a
centrifugación para separar el plasma y dejarlo en
congelación a -20ºC, hasta el momento del análisis.
Análisis para los niveles plasmáticos de
gabapentina. Los niveles plasmáticos de gabapentina fueron
analizados usando el método de
cromatografía líquida informado por
Forrest et al.13. Este método fue previamente
validado en un rango entre 0.0781 mg/ml y 5.0 mg/ml, con los
siguientes resultados: el porcentaje promedio de
recuperación fue 87.1%, mientras que el coeficiente de
variación (CV) de las pendientes de las curvas de
calibración fue de 4.6% para la validación
intradía y 8.8% para la validación interdía;
para una concentración de 0.3125 mg/ml, la
precisión tuvo un CV de 11.8% y para la
concentración de 5 mg/ml, el CV fue de 7.5%.
Las muestras se trataron con ácido
perclórico 2 M, centrifugadas y luego derivatizadas con el
ácido o-phtaldehído-3-mercaptopropionico. La
separación se efectuó en una columna C18,
utilizando como fase móvil buffer de acetato pH
3.7-metanol-acetonitrilo (40:30:30), empleando un detector de
fluorescencia programado con longitudes de onda de
excitación y emisión de 330 y 440 nm
respectivamente.
Análisis farmacocinético. Para cada
voluntario se construyeron los perfiles plasmáticos y se
calcularon los siguientes parámetros
farmacocinéticos:
· Concentración máxima
(Cmax), obtenida de los datos de
concentración plasmática, establece la
concentración más alta de principio activo que es
absorbida.
· Tiempo máximo (Tmax),
obtenido directamente de los datos de la concentración
plasmática, el cual corresponde al tiempo requerido para
alcanzar la concentración máxima.
· Área total bajo la curva de
concentración plasmática vs. tiempo
(ABC0ºº) está relacionado
con la extensión de la absorción del principio
activo, obtenida sumando el ABC0t por medio
de la fórmula trapezoidal más el
ABCtºº calculado como el cociente
entre la última concentración plasmática
cuantificable sobre la constante de eliminación (ke). ke
se calculó de la pendiente obtenida de la parte final de
la curva, transformando a logaritmo los valores de
la concentración y aplicando regresión
lineal14.
· Exposición
temprana (ABC0Tmax), que se expresa como el
área bajo la curva de la concentración
plasmática vs. tiempo, hasta el Tmax del
producto de referencia. Este se calculó como el
área parcial hasta un valor t,
siendo t la mediana de los valores del
Tmax de la población para la formulación de
referencia. Esta medida permite un mejor control del principio
activo en la circulación sistémica, que debe
reflejar velocidades y medidas de absorción comparables
que van dirigidas a asegurar efectos terapéuticos
comparables con medicamentos administrados vía oral y que
son de liberación convencional15.
Análisis estadístico. Para el
propósito de declarar bioequivalencia las principales
variables
analizadas fueron: ABC0ºº,
Cmax, Tmax y
ABC0Tmax. Los valores obtenidos de estas
variables para los dos productos, se analizaron
estadísticamente por medio del análisis de varianza
(ANOVA), para determinar si se presentan diferencias
significativas en los valores de las variables estudiadas,
debidas a cada una de las fuentes de
variación: productos, sujetos, períodos y
secuencias de administración. Los valores de
ABC0ºº, Cmax y
ABC0Tmax se transformaron a logaritmo
natural. El Tmax se analizó sin
transformar16.
Para determinar la bioequivalencia entre las
formulaciones estudiadas se aplicó el método
sugerido por Schuirmann17 y aceptado por la FDA,
conocido como el "Método de dos pruebas unilaterales",
teniendo en cuenta el valor estándar del ANOVA calculado
para cada parámetro. El nivel de significancia
(a) para las
pruebas o probabilidad de
error fue 0.05 y se construyeron intervalos de confianza de 90%
para el cociente entre las medias del producto de prueba y del
producto de referencia.
Criterio de aceptación. El producto de prueba se
declaró bioequivalente con respecto al producto de
referencia si, y sólo si los intervalos de confianza de
90% para el cociente de medias de los datos tanto del
ABC0ºº como del Cmax
transformados a logaritmos naturales están incluidos en el
intervalo de 80% a 125% y el Tmax sin transformar
está incluido en el intervalo de 80% a 120%.
Los datos también fueron analizados en
relación con los supuestos del modelo cruzado, dos
períodos, dos secuencias, dos formulaciones para
evaluar:
· El efecto de arrastre (carry over) en las dos
formulaciones.
· El efecto de período y de
productos.
· Variabilidad intersujeto.
· Variabilidad intrasujeto, por medio de la
prueba F ajustada de Pitman-Morgan.
· Normalidad de los residuos intersujetos e
intrasujetos, aplicando la prueba de normalidad de
Shapiro-Wilk.
· Independencia
de los residuos {Sik} y {eijk}, usando el
coeficiente de correlación de Pearson.
· Datos fuera de lo normal (outliers) para las
variables p-r, p/r y ln p/r, de los datos sin transformar,
empleando las cajas esquemáticas del análisis
exploratorio de datos, siendo p el producto de prueba y r el
producto de referencia.
La diferencia se consideró
estadísticamente significativa cuando el valor
p<0.05.
RESULTADOS
Estudio de equivalencia farmacéutica. Las pruebas
de contenido de gabapentina por cápsula y
disolución permitieron concluir que los dos productos son
equivalentes farmacéuticos (Cuadro 1).

Estudio de bioequivalencia. Con ambos productos se
presentaron reacciones adversas (Cuadro 2). No hubo deserciones
ni retiros durante el estudio. Algunos voluntarios presentaron
hasta tres reacciones adversas simultáneamente.

Las concentraciones plasmáticas
medias en mg/ml en cada tiempo de muestreo dieron
origen a los perfiles plasmáticos medios para
cada formulación los cuales se presentan en la
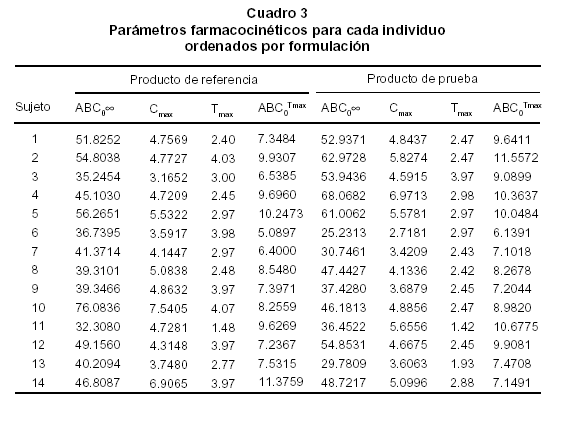
Gráfica 1 y los parámetros farmacocinéticos
para cada formulación y cada sujeto están
consignados en el Cuadro 3. Los resultados del ANOVA, realizado a
los parámetros farmacocinéticos
ABC0ºº, Cmax y
ABC0Tmax transformados a logaritmo natural
y el Tmax original, se informan en el Cuadro
4.


Los resultados obtenidos con respecto a los intervalos
de confianza de 90%, expresados en porcentaje para el
ABC0ºº, Cmax y
ABC0Tmax para el producto de prueba, son en
su orden: 87.5%-114.5%, 85.0%-109.7% y 97.9%-118.8%, los tres
contenidos en el intervalo de confianza de 80% a 125% de la
formulación de referencia. El intervalo de confianza para
el Tmax del producto de prueba es de 68.4%-94.6% que
no está contenido en el intervalo de confianza de 80% a
120% del producto de referencia. De acuerdo con las directrices
de la FDA los dos productos son bioequivalentes con respecto
ABC0ºº, Cmax y
ABC0Tmax y no bioequivalente con respecto
al Tmax.
En la comprobación de los supuestos para el
modelo ANOVA en el diseño cruzado, se obtuvieron los
siguientes resultados:
· No hay efecto de arrastre para los productos de
referencia y prueba.
· No hubo resultados significativos para efectos
de período y de productos, excepto en el Tmax
para productos donde se obtuvo un valor p=0.03.
· En la variabilidad intersujeto no se
presentó significancia estadística para las variables
Cmax y Tmax, pero sí significancia
para el ABC0ºº y el
ABC0Tmax obteniéndose valores de
p=0.040 y 0.022 respectivamente.
· La variabilidad intrasujeto no fue
significativa.
· Los residuos inter e intrasujetos presentan
distribución normal para variables
ABC0ºº, Cmax y
ABC0Tmax.
· Hay independencia entre los residuos inter e
intrasujetos para cada uno de los parámetros
ABC0ºº, Cmax y
ABC0Tmax.
· No se presentaron valores extremos para las
distribuciones de p-r, p/r y ln p/r para las variables
ABC0ºº y Cmax. Con
respecto al parámetro ABC0Tmax, se
presenta un dato posiblemente extremo, correspondiente al
voluntario 14, que no se retiró por no considerar esta
variable como decisoria para declarar la bioequivalencia entre
los productos evaluados.
DISCUSIÓN
Los dos productos fueron equivalentes
farmacéuticos, es decir que las pruebas
fisicoquímicas y farmacotécnicas permitieron
demostrar que los dos productos eran similares en cuanto a las
especificaciones establecidas para esta forma
farmacéutica, pero se comprobó que a pesar de ello,
no se puede garantizar que su comportamiento
en el organismo sea idéntico, porque el parámetro
farmacocinético de mayor diferencia en este estudio fue el
Tmax, para alcanzar la Cmax; la
Tmax media del producto de referencia fue 3.18 horas y
para el producto de prueba 2.59 horas. Esta diferencia
significativa se puede explicar por la existencia de factores
tales como el origen del principio activo, los excipientes
utilizados, la tecnología empleada
en la elaboración de la forma farmacéutica, que
hacen que se demore en alcanzar la concentración
plasmática máxima.
Sin embargo, las variables ABC que permite medir la
extensión de la absorción y la Cmax que
representa el nivel de principio activo máximo que puede
afectar la respuesta terapéutica del fármaco, se
encuentran cercanos entre los dos productos, es decir que
presentan una media y una desviación estándar que
no difiere significativamente.
Los resultados obtenidos al analizar el efecto de
arrastre, período y formulación, permitieron
considerar la bioequivalencia de las dos formulaciones aplicando
los delineamientos sugeridos por la FDA con el ANOVA.
La variabilidad intersujeto, interpretada como la
respuesta de varios sujetos a la misma formulación,
presentó en el ABC o sea en la extensión de la
absorción, lo cual pudo ocurrir debido a factores
fisiológicos del tracto gastrointestinal propios de
algunos individuos. Estos hallazgos están en concordancia
con los presentados por Gidal et al.4, en el que
demostraron en dos estudios que la variabilidad intersujetos fue
sustancialmente mayor que la intrasujetos para el ABC.
Para que dos medicamentos sean declarados
bioequivalentes, la FDA ha establecido que deben ser
bioequivalentes en las variables farmacocinéticas
ABC0ºº, Cmax y
Tmax, sin considerar la duración del
tratamiento en el que será utilizado, la frecuencia de
administración y la respuesta esperada. En
el caso de la gabapentina si se utiliza en un tratamiento de uso
crónico la equivalencia con respecto al ABC y al
Cmax garantizan que se mantendrá la
extensión de la absorción y que se llegará a
la concentración máxima que asegura la respuesta
terapéutica esperada.
CONCLUSIONES
· La comparación estadística de
parámetros farmacocinéticos
ABC0ºº,
ABC0Tmax y Cmax indican que no
existen diferencias significativas entre los productos
Gabantex®/Gabapentin MK, cápsulas de 300 mg, producido
y suministrado por Tecnoquímicas S.A. y el producto
Neurontin®, cápsulas de 300 mg elaborado para
Parke-Davis & Company bajo su dirección y control por
Warner-Lambert LLC. Los intervalos de confianza de 90% para el
cociente entre las medias de las dos formulaciones, de las
variables farmacocinéticas
ABC0ºº,
ABC0Tmax y Cmax transformadas a
logaritmo natural, están contenidos en el rango del
80%-125%, criterio de aceptación establecido por la FDA
para indicar que el producto Gabantex®/Gabapentin MK es
bioequivalente al producto Neurontin® con respecto a los
parámetros ABC0ºº,
ABC0Tmax y Cmax.
· Con respecto al Tmax, se presentaron
diferencias significativas entre los dos productos y el intervalo
de confianza de 90%, calculado para el producto de prueba de
68.4%-94.6% que no está contenido en el intervalo de
confianza de 80% a 120% del producto de referencia. Este
resultado indica que el producto Gabantex®/Gabapentin MK no
es bioequivalente con el producto Neurontin® con respecto al
Tmax.
· Este estudio de bioequivalencia permite
garantizar que al utilizar el producto Gabantex®/Gabapentin
MK se tendrá una respuesta terapéutica similar a la
del producto Neurontin®.
AGRADECIMIENTOS
Al profesor Abel
Díaz sus aportes en el análisis estadístico
del presente estudio. La financiación por
Tecnoquímicas S.A., contrato 8716/01
de 2002, entre la Universidad de Antioquia y Tecnoquímicas
S.A. Los autores aclaran que ninguno de ellos tiene ni ha tenido
vínculos laborales o intereses personales con los
laboratorios farmacéuticos Tecnoquímicas S.A. o
Parke Davis que puedan derivar en conflicto de
intereses.
REFERENCIAS
1. Haig GM, Bockbrader HN, Wesche DL, et al. Single-dose
gabapentin pharmacokinetics and safety in healthy infants and
children. J Clin Pharmacol 2001; 41: 507-514.
2. Mc Lean MJ. Clinical pharmacokinetics of gabapentin.
Neurology 1994; 44: 517-521.
3. Ifa DR, Falci M, Moraes ME, Becerra FA, Moraes MO, De
Nucci G. Gabapentin quantification in human plasma by
high-performance liquid chromatography couple to electrospray
tandem mass spectrometry. Application to bioequivalence study. J
Mass Spectrom 2001; 36: 188-194.
4. Gidal BE, Radulovic LL, Kruger S, Rutecki P, Pitterle
M, Bockbrader HN. Inter and intra-subject variability in
gabapentin absorption and absolute bioavailability. Epilepsy Res
2000; 40: 123-127.
5. Bruce LR. The role of GABA in anxiety disorders. J
Clin Psychiatry 2003; 64 (Suppl 3): 21-27.
6. Tremont-Lukats IW, Megeff C, Backonja M.
Anticonvulsivants for neuropathic pain syndromes. Drugs 2000; 60:
1029-1052.
7. Ministerio de Salud de Colombia. Decreto
677 de 1995. Bogotá: Ministerio de Salud de Colombia;
1995.
8. Ministerio de Salud de Colombia. Resolución
1400 de 2001. Bogotá: Ministerio de Salud de Colombia;
2001.
9. US Pharmacopeia-National Formulary. The official
compendia of Standards (USP26-NF21). Rockville: United States
Pharmacopeial Convention Inc; 2003. p. 2334-2342.
10. Organización Panamericana de la
Salud-Organización Mundial de la Salud (OPS/OMS). Normas
éticas internacionales para las investigaciones
biomédicas con sujetos humanos. Geneva: OPS/OMS;
1996.
11. World Medical Association (WMA). Declaration of
Helsinki. Edinburgh: Ethical principles for medical research
involving human subjects; October 2000.
12. Ministerio de Salud de Colombia. Resolución
008430 de 1993. Ministerio de Salud de Colombia, 1993.
13. Forrest G, Sills GJ, Leach JP, Brodie MJ.
Determination of gabapentin in plasma by high-performance liquid
chromatography. J Chromatogr B Biomed Sci Appl 1996; 681:
421-425.
14. Su Souich P. Farmacocinética clínica:
Absorción de medicamentos. En Métodos en
farmacología clínica. Washington:
Organización Panamericana de la Salud (OPS); 1992. p.
84-115.
15. Food and Drug Administration. Guidance for industry.
Bioavailability and bioequivalence studies for orally
administered drug products-general considerations. 2003 [fecha de
acceso 15 de mayo de 2003]. Disponible en:
16. Food and Drug Administration. Guidance for industry.
Statistical approaches to establishing bioequivalence. 2001
[fecha de acceso 20 de junio de 2001]. Disponible en:
http://www.fda.gov/cder/guidance/index.htm
17. Schuirmann DJ. A comparison of the two-one side
test procedures
and the power approach for assessing the equivalence of average
bioavailability. J Pharmacokinet Biopharm 1987; 15:
657-681.
Sergio Parra, M.D., M.Sc.2, Fanny Cuesta,
Ing. Q. Esp.2, Margarita Restrepo, Q.F.,
M.Sc.3, Rosendo Archbold, Q.F., M.Sc.3,
Blanca Montoya, Bact.4, Gloria Holguín, Q.F.
Esp.3, Juan Carlos Ríos,
M.D.5
1. Los autores son integrantes del Grupo de
Estudio e Investigaciones Biofarmacéuticas, Universidad de
Antioquia, Medellín.
2. Profesor, Departamento de Farmacología, Facultad de
Medicina, Universidad de Antioquia, Medellín.
3. Profesor, Departamento de Farmacia, Facultad de Química
Farmacéutica, Universidad de Antioquia,
Medellín.
4. Bacterióloga, Laboratorio de
Toxicología, Facultad de Medicina,
Universidad de Antioquia, Medellín.
5. Estudiante, Maestría en Ciencias
Básicas Biomédicas, Universidad de Antioquia,
Medellín.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
