Tabla 5. Representación del tratamiento
según el protocolo cubano del Programa Nacional de
Prevención del VIH/SIDA en hijos de madres seropositivas
al VIH/SIDA en La Habana
Parto | |||||||
No. Caso | Tto. durante el embarazo de la | Tto. durante el trabajo de | Eutocico | Cesárea | Tto. al RN. | Lactancia materna | |
1 | NO | NO | x | NO | SÍ | ||
2 | NO | NO | x | NO | SÍ | ||
3 | NO | NO | x | NO | SÍ | ||
4 | NO | NO | x | SÍ | SÍ | ||
5 | NO | NO | x | SÍ | NO | ||
6 | SÍ | SÍ | x | SÍ | NO | ||
7 | SÍ | SÍ | x | SÍ | NO | ||
8 | SÍ | SÍ | x | SÍ | NO | ||
9 | SÍ | SÍ | x | SÍ | NO | ||
10 | SÍ | SÍ | x | SÍ | NO | ||
11 | SÍ | SÍ | x | SÍ | NO | ||
Fuente: Dpto. de Admisión, Archivo y
Estadísticas, IPK.
En el estudio de nuestra provincia solo un niño
marco SIDA y el tratamiento que tiene, está acorde con la
bibliografía estudiada donde se plantea que este debe ser
con triterapia y no con mono terapia como se hacía al
inicio de la epidemia.En noviembre de 1989 la FDA autorizó
su uso en los niños y en julio del 2002 se
incorporó la triterapia después de la conferencia
internacional de SIDA celebrada en Barcelona,
España.
Después del año 1996 todos los
niños hijos de madres seropositivas al VIH son captados
antes de los 2 años de vida. Después del 2001 las
captaciones se realizan antes de arribar a los 12
meses.
A partir de 2002, la última fecha en que la
información género específica se
encontró disponible 19,2 millones de mujeres y 17,4
millones de hombres estaban viviendo con el virus (68). Esto
marcó la primera vez desde el principio de la epidemia que
el número de mujeres con la infección de VIH
sobrepasó al de hombres.
El SIDA es la causa principal de muerte en África
y la cuarta causa de muerte mundial. Las más altas
proporciones de infección de VIH se observan en
África subsahariana, sobre todo en Botswana, África
Sur, y Zimbabwe dónde el 30 al 40 % de la población
está infectada (68). Fuera de África, el porcentaje
más alto de personas infectadas (la seroprevalencia)
está en la República Dominicana (entre 3,5 y
7%).
Una baja seroprevalencia puede aún representar
una carga grande de enfermedad en los países con las
poblaciones grandes, y puede no anticipar un aumento explosivo en
la extensión del VIH, como ha ocurrido entre los usuarios
de droga en Europa Oriental.
Sin la intervención de un programa de
prevención y control, en India y China dónde la
infección de VIH está empezando a extenderse
rápidamente, puede experimentarse un aumento similarmente
rápido que involucra muchas más
personas.
El primer ensayo clínico aleatorizado (ECA) que
demostró eficacia de un ARV en la disminución de la
TV del VIH se publicó en 1994 (46). Este ensayo denominado
ACTG 076, fue llevado a cabo en EE.UU. y Francia en gestantes
VIH+ sin exposición previa a ARV en ausencia de lactancia
materna posterior. Consistió en la administración
oral de AZT 500mg diarios entre las 14 y 34 semanas de
gestación, AZT (por vía endovenosa) en el parto y
AZT en jarabe al niño durante seis semanas. La TV fue de
un 8,3% frente a un 25,5% en el grupo placebo con una eficacia
relativa (disminución de la TV) de un 68% A raíz de
este ECA, en el mundo occidental se inició la
utilización de esta pauta, con lo que la incidencia de
infección por el VIH en pediatría disminuyó
en los EE.UU. y otros países de Europa.
El problema fundamental para la generalización de
la utilización de AZT en todo el mundo ha sido su precio,
imposible de sufragar por países subdesarrollados y
además la premisa de captar precozmente la embarazada y
llevar un buen control de la misma, observando si aparecen
efectos adversos al medicamento y una buena adherencia al mismo.
Posteriormente en un subanálisis de los datos del
protocolo ACTG 076 se demostró que solo parte de la
eficacia del AZT en disminuir la TV se correlacionaba con una
disminución de la CV materna, estableciéndose la
hipótesis de que la mayor parte del efecto podría
ser atribuible a un efecto profiláctico (69 ).
En este sentido en 1999 se publicaron tres ECA con
pautas más cortas de AZT e incluso con otros
fármacos aplicables en la práctica clínica
diaria en países subdesarrollados en que no existe un buen
control sanitario de la población (Protocolos
Thailandés, Petra, HIVNET 012, BMS 094, y el ACTG 316).
(70-72). Aunque con estos protocolos se logró disminuir la
TV, el protocolo ACTG 076 demostró ser el mas eficaz con
respecto a la disminución de la TV. (73)
En Cuba, el mayor por ciento de las embarazadas son
captadas antes de las 13.6 semanas de embarazo (captación
precoz) y se incluye entre los complementarios del primer
trimestre la detección de anticuerpos contra el VIH. Esto
posibilita el uso de AZT en toda gestante virgen de tratamiento
como establece el protocolo ACTG 076. En nuestro medio ha sido
modificado por no contar con AZT endovenoso. La eficacia en la TV
forma parte de los resultados de esta tesis, sin que se recojan
estudios previos donde se aborde esta temática. En una
sola gestante de las historias clínicas revisadas se
aplico dosis única de Nevirapina intraparto asociado a la
aparición de eventos adversos (anemia), después de
seis semanas de tratamiento con AZT.
No se tienen experiencia con el uso de la Nevirapina en
dosis única intraparto pero según un estudio
publicado en la revista Nature Medicine del 2005, (74) aunque no
es concluyente, se informa que el uso de este medicamento aun en
dosis única produce resistencia a los otros INNTR de por
vida. Nuevos estudios se requerirán entonces, para
explorar la razón costo/ beneficio de esta
terapéutica.
A diferencia de nuestro país, donde la cobertura
del tratamiento ARV de la embarazada VIH+ es del 100%, en la
mayor parte del mundo subdesarrollado los progresos en la
ampliación del acceso a tratamientos de prevención
ARV han sido muy lentos, de modo que solo el 10% de las mujeres
embarazadas dispone de este servicio (75). En Burkina Fasso,
Etiopía, Malawi, Nigeria y Sudáfrica, menos del 1%
de las mujeres infectadas por el VIH que dieron a luz en el 2003
tuvieron acceso al tratamiento para prevenir la TV. En Camboya,
Myanmar y Viet Nam la cobertura es inferior al 3%
(76).
Para detener los efectos de esta problemática
desde 1999 la UNICEF (77) ha liderado a nivel internacional la
creación de proyectos para reducir la TV en los
países de ingresos bajos y medianos. Entre Abril de 1999 y
Julio del 2002, los proyectos respaldados por la UNICEF y otras
organizaciones asociadas beneficiaron casi 600,000 mujeres
embarazadas en centros de asistencia prenatal, y proporcionaron
tratamiento ARV a 12 000 mujeres seropositivas después del
asesoramiento y pruebas del VIH.
En los países de ingresos bajos y medianos, la
probabilidad de que una madre VIH+ que amamante transmita el
virus a su hijo RN es como mínimo el 30% (76). En cambio
en los países industrializados, la transmisión del
VIH a los lactantes es excepcional gracias a la profilaxis ARV,
el parto por cesárea y las alternativas de
alimentación materna (77-79).
En la casuística cubana se pesquisaron 131
historias clínicas de niños nacidos de padres VIH+,
de las cuales 11 son de provincia La Habana. Esta cifra incluye
todos los niños nacidos de mujeres VIH+ con y sin
tratamiento ARV profiláctico.
De ellos 1 niño fue VIH+ y desarrollo SIDA, 10
niños resultaron NO INFECTADOS por el VIH: (6 niñas
y 4 niños). Estos resultados se han alcanzado gracias a la
aplicación del programa de prevención y control del
VIH/SIDA (27) que incluye las medidas de la proscripción
de la lactancia materna desde 1986, cesárea desde 1989 y
profilaxis con AZT desde 1997.
De los 11 niños estudiados, solo 1 es VIH+. Sin
embargo, desde que se aprobó el uso de ARV por la FDA en
niños se ha alterado espectacularmente el curso de la
infección por el VIH, al reducir la replicación
viral y prolongarles la vida (22).
En la literatura se describe de que al menos una cuarta
parte de los neonatos infectados por el VIH que fallecen, lo
hacen antes de cumplir el primer año de vida, y hasta el
60%, antes de llegar al segundo aniversario. En general, la
mayoría fallece antes de los cinco años de edad
(78). En nuestra casuística, sin embargo el 100% de los
niños continúan viviendo ya que 10 son sanos y solo
1 que es caso SIDA continua con vida después de haber
cumplido sus 16 años. Las estadísticas mundiales
sobre la mortalidad por el VIH/SIDA en niños son
alarmantes.
En el año 2002 se reportaron 800, 000
niños menores de 15 años infectados y de esta cifra
610, 000 fallecieron según reportes de la UNICEF
–VIH/SIDA del año 2003 (80).
En 1999, en Botswana, el SIDA fue el causante del 40% de
todas las defunciones de niños menores de cinco
años. Otras cifras comparables en el mismo grupo de edad
son el 35% en Zimbabwe; 25% en Namibia y Swazilandia, y mas del
20% en Kenya, Sudáfrica y Zambia (81).
Así mismo estudios prospectivos han demostrado
que la mediana de supervivencia es hasta los 96 meses de edad
(4-7), observándose un deterioro inmunológico
precoz (82-84). Después de la aplicación del TARGA
en Cuba, desde Julio del 2002 la problemática de la
supervivencia ha cambiado para los niños infectados con el
VIH/SIDA Debe realizarse el diagnostico de VIH lo antes posible a
todo RN hijo de madre VIH+ y comenzar tratamiento precozmente con
el objetivo de evitar la replicación viral y el deterioro
inmunológico (60).
Con el éxito del TARGA y las noticias difundidas
por los medios de comunicación masivos de los diferentes
métodos (tratamiento ARV, cesárea, tratamiento al
RN etc) para disminuir la TV se ha despertado el interés
para la procreación entre los propios infectados por el
VIH, tanto en parejas en que ambos miembros están
infectados como en parejas serodiscordantes (85).
En Cuba, al comienzo de la epidemia nacían de uno
a tres niños hijos de madres VIH+ por año. A partir
de 1993 se fue incrementando el número de nacimientos
debido al aumento del número de mujeres infectadas en edad
fértil. En 1997 cuando se le incluyó al Programa de
Prevención y Control del SIDA el uso del AZT a las
embarazadas VIH+, los partos disminuyeron e incluso en el
año 1998 solo nacieron tres niños. A pesar de la
educación y el tratamiento profiláctico para
disminuir la TV, muchas embarazadas VIH+ se negaban a tomarlo e
incluso muchas prefirieron realizarse voluntariamente la
interrupción del embarazo. Ya en 1999 se produjo un cambio
en la percepción del problema por los resultados
beneficiosos reportados con las medidas del programa nacional y
el número de partos se fue incrementando a razón de
11 y 20 nacimientos por año. Este incremento
también estuvo influenciado por el aumento de la
incidencia de embarazos que llegan a término con
tratamiento de AZT en mujeres en edad reproductiva que desean
procrear y últimamente por la utilización del TARGA
en gestantes SIDA en la prevención de la TV. En
relación con la probabilidad de los niños
infectarse por TV se observó, que antes de la
introducción del uso del AZT, nacían niños
infectados por el VIH (1985-1996). En 1997 solo se reportó
un niño VIH+, cuya madre se captó
tardíamente y el niño contaba con un año de
edad, el cual incluso estaba siendo amamantado; por lo tanto a
ninguno de los dos se les administró el AZT programado.
Sin embargo, el resto de todas las embarazadas VIH+ captadas
precozmente desde esa fecha y que recibieron AZT hasta el
año 2000 NO tuvieron ningún niño infectado.
En el año 2001, se detectaron tres niños infectados
por el VIH, uno de los cuales se encuentra asintomático y
los otros dos desarrollaron el SIDA en etapa de lactante, e
incluso uno ya falleció.
En el año 2002 se reportaron cuatro niños
infectados. Cuando se analizó este hallazgo se constataron
factores predisponentes como la captación tardía de
la embarazada, retraso en los resultados y entregas de las
serologías para VIH de las embarazadas a sus consultorios
y la mala adherencia al tratamiento por parte de la madre Se
describe en la literatura (46) que pueden nacer un 2% de
niños VIH+, aunque la madre lleve la profilaxis
correctamente y se le realice cesárea y el al niño
se le administre el AZT en jarabe y hasta un 8% de casos nacidos
por parto vaginal y donde se utilice el tratamiento
profiláctico según el protocolo ACTG 076. (46, 86,
87).
La edad gestacional en el momento de la
exposición es un factor íntimamente relacionado con
la transmisión, aunque en un principio se consideró
que los niños infectados intrautero eran con más
frecuencia prematuros como consecuencia de la infección
por el VIH. Posteriormente se ha demostrado que es la
prematuridad la que determina un mayor riesgo de
transmisión y no viceversa (88). También los RN de
bajo peso para la edad gestacional (CIUR) tienen un mayor riesgo
de infección (32).
La cesárea disminuye el riesgo de TV en
niños nacidos de madres que no reciben ARV y
también es de utilidad potencial en mujeres tratadas con
AZT. Se desconoce si la cesárea aporta algo en la
reducción de la TV en mujeres con tratamiento ARV
combinado con CV indetectable (41, 79). Además recordar
que la cesárea se acompaña de un aumento de riesgo
de morbilidad postoperatoria. En Cuba con la instauración
de la cesárea programada a todas las gestantes VIH+
captadas, se logró reducir la TV y no se reportaron
complicaciones graves, ni muerte materna por esta
causa.
A partir de 1996 se adquiere en el país el equipo
de realizar los CD4 (Citómetro de flujo) y desde Diciembre
del 2000 el equipo de CV. Sin embargo, debido a la
situación económica del país, no ha sido
posible llevar un control estricto de conteo de CD4 y CV a todas
las gestantes VIH+ por lo que se decidió realizar
cesárea en todos los casos independientemente del estudio
de estos parámetros.
Si hacemos un análisis de la influencia del tipo
de parto en la TV observamos que en todo el período
estudiado, se encontró que el impacto de medidas de
intervención incluidas en el programa (suspensión
de la lactancia materna en 1986, cesárea desde 1989 y
profilaxis con AZT a partir de 1997) hizo que disminuyera la TV
en el país; así como en La Habana, hasta alcanzar
cifras similares a la de los países desarrollados de
Europa (7, 82, 83), donde se reportan tasas entre 2,6 % y
15,5%.
No hay casos para evaluar el simple uso del AZT sin
cesárea porque se necesitaría de un grupo control
de mujeres VIH+ que quedarían expuestas al riesgo por
permitir el paso del niño por el canal del parto , lo cual
constituiría una violación de los principios de la
ética.
Analizando estos resultados se concluye que la
realización de cesárea fue el factor que más
incidencia tuvo en la disminución de la tasa de TV. Aunque
el uso del AZT añadido a la cesárea logró
eficacias crecientes, estas no resultaron estadísticamente
diferentes a la lograda con la simple ejecución de la
cesárea.
Esto puede deberse de un lado al grandísimo
impacto que tiene la cesárea y a la afortunada
situación de que el número de pacientes sea
pequeño. No debe dejarse de tener en cuenta que no se pudo
evaluar el uso de AZT en forma independiente, es decir sin
realizar cesárea.
Con el advenimiento de técnicas muy sensibles
para detectar el virus en la circulación periférica
del infante, es posible estimar con más precisión
la TV. En la ausencia de alimentar al niño con pecho, un
estimado de 50 a 70% de las transmisiones ocurren alrededor del
parto, y el resto ocurre en el útero. Por consiguiente,
sin lactancia materna, la mayoría de la TV se presume sea
el resultado de exposición al VIH en estadío
tardío durante el embarazo, durante el intraparto,
vía la placenta, o durante el paso del niño a
través de la vagina. La transmisión intraparto se
presume puede ocurrir por las membranas mucosas del niño,
principalmente en la orofaringe y posiblemente en el
esófago y estómago (41, 89).
Varios ensayos clínicos y los estudios
observacionales han documentado la eficacia y efectividad
profiláctica de los ARV para la prevención de la TV
a través de una disminución en la CV materna y a
través de la provisión profiláctica de la
pre-exposición al infante. Ensayos que evalúan el
lavado cérvico vaginal con chlorhexidine alrededor del
parto, no han demostrado la eficacia de tales intervenciones por
lo que se refiere a la TV decreciente. La cesárea antes
del trabajo de parto y antes de la rotura de las membranas ha
mostrado ser eficaz con respecto a la prevención de la TV
(90).
El hecho de que el sistema de salud cubano garantice a
los padres VIH+ atención médica y
terapéutica gratuita, además de respaldo
económico y social hace que aumente la expectativa de vida
en las madres VIH+ y de cierta manera influye en disminuir la
orfandad. En el estudio realizado, esta variable no tiene
significación estadística. El único
niño VIH + en la provincia se encuentra vivo con su
tratamiento (TARGA) fue lactado por su madre debido a que fue
captado tardíamente.
Efectivamente en el estudio DITRAME (92) entre los
niños infectados por VIH, el uso de AZT en la madre redujo
el riesgo de muerte en los niños. El riesgo de muerte en
los niños es mayor si la madre presenta menos de 200 CD4
(93).
Otro estudio publicado que no puede considerarse
definitivo, recoge una mayor mortalidad en mujeres que han
amamantado a sus hijos, con una probabilidad de fallecimiento a
los 24 meses del 10,5% frente al 3,8% en las que no amamantaron
(94).
La escasa plausibilidad biológica de este
hallazgo y, sobre todo, la escasez de datos para ver hasta que
punto los grupos son enteramente similares en cuanto a otros
factores que puedan influir en la evolución hace que estos
datos deban ser tomados con cautela (95). Con respecto al grupo
etáreo de las madres paridas VIH+, en la literatura
revisada se encontró (40) que cada 5 años por
encima de los 25 años pudiera estar relacionado con un
aumento del riesgo de transmisión La media de la edad en
este estudio oscila entre los 19 y 25 años.
En la casuística presentada, de los 11
niños vivos VIH+ hasta el momento en que se cerró
el estudio, 10 son asintomático y 1 clasifico como SIDA y
se encuentran con TARGA Como señala la literatura en el
hemos podido lograr mejorarle su calidad de vida y disminuir la
frecuencia de enfermedades oportunistas, pues hasta el momento ha
tolerado bien el tratamiento. Los cambios de esquemas de
tratamiento que en algunos ha sido necesario realizar pues han
estado relacionado con resistencia a los ARV y mala adherencia al
tratamiento, comprobado por disminución del conteo de CD4
y aumento de la CV. (96). Con este tipo de terapia TARGA, los
objetivos ideales son mantener la CV en niveles no detectables
con incremento progresivo del conteo de linfocitos CD4.
Relacionado con el TARGA, si bien es verdad que muchos pacientes
resultan beneficiados por este tipo de terapia muchos no la
toleran y en los niños el cumplimiento es más
cuestionable. Por último existen casos en los cuales
aunque el cumplimiento sea óptimo y el régimen de
antirretrovirales controle eficazmente la CV, no se consigue
restaurar de manera adecuada el sistema inmunitario hasta el
nivel necesario para evitar las infecciones oportunistas. Existe
además, el problema de la resistencia a las terapias
actuales en muchos pacientes en quienes, en un principio, el
TARGA resultó útil (100).
El por qué los niños infectados por el VIH
tienen una susceptibilidad especial para padecer las infecciones
oportunistas, se debe a que guarda una relación
directamente proporcional con el grado de deterioro
inmunológico (101). En este sentido, el recuento de CD4
continúa siendo el indicador más útil para
predecir una infección oportunista. En los niños a
diferencia de lo que ocurre en los adultos, la probabilidad de
padecer uno de estos episodios se correlaciona mejor con el
porcentaje que con el número absoluto de CD4
(102).
La terapia utilizada para el manejo de estas afecciones
se corresponde con lo descrita en la literatura (60) y llama
poderosamente la atención que no se han reportado casos de
resistencia bacteriana; hecho que asociamos al estricto
seguimiento y el manejo especializado y centralizado de la
casuística.
Múltiples impedimentos obstaculizan la
implantación en los países subdesarrollados de
programas preventivos como el cubano.
La cobertura insuficiente de los servicios de
atención prenatal, la falta de recursos financieros y
humanos, el escaso conocimiento del estado serológico
entre las mujeres en edad de procrear, el miedo al estigma, la
discriminación y la tendencia de muchas mujeres en los
países de ingresos bajos y medianos a dar a luz en el
hogar en vez de un centro de salud. Sin embargo constituye un
compromiso de las Naciones Unidas reducir la proporción de
lactantes infectados por el VIH en un 50% para el 2010, lo cual
no será posible sin un aumento inmediato y sustancial de
las actividades como la ampliación de los servicios de
prevención primaria del VIH para las mujeres en edad
fecunda; el acceso al asesoramiento y a pruebas voluntarias para
las mujeres embarazadas; la instauración de servicios
integrales de salud reproductiva y el uso de profilaxis
antirretrovírica para prevenir la TV (75).
Conclusiones
1. La captación tardía del embarazo y
el no uso de la AZT durante el embarazo son factores que se
asocian con la TV del VIH en La Habana.2. El tratamiento con TARGA en niños
infectados con el VIH favorece la recuperación
favorable de las enfermedades oportunistas.
Recomendaciones
1. Incrementar las acciones de vigilancia
epidemiológica en las áreas de salud que
favorezcan la captación precoz de todas las gestantes
seropositivas al VIH y así poder adoptar la conducta
adecuada.2. Incrementar las labores de divulgación
sobre la infección por el VIH en mujeres que se
encuentran en edad fértil, así como incrementar
la labor educativa sobre transmisión vertical en
población de mujeres seropostivas al VIH.
Referencias
Bibliográficas
1. The Working Group of Mother-to-Child
Transmission of HIV in Africa, America and Europe: results
from 13 perinatal studies. J. Acquir Inmune Def Syndr 2004;
8:506-10.2. Currier J. Emerging issues in the clinical
management of HIV in women. [citado el 20 de agosto de 2004,
actualizado en el 2000]. Disponible en:
http://www.medscape.com/Annual.3. UNAIDS/WHO Working Group on Global HIV/AIDS
and STD Surveillance. Report on the global HIV/AIDS epidemic:
estimates december 2004. Ginebra: World Health Organization;
2005. [citado el 14 de marzo de 2004]. Disponible en:
http://www.unaids.org.4. Bulterys M, Fowler MG. Prevention of HIV
infection in children. Pediatr Clin North Am 2000; 47:241-60.
5. Scarlatti G. Pediatric HIV infection. Lancet 2005; 348:
863-8.5. Barnhart HX, Caldwell MB, Thomas P, Mascola
L, Ortiz I, Hsu HW, et al. Natural history of human
immunodeficiency virus disease in perinatally infected
children: an analysis from the Pediatric Spectrum of Disease
Project. Pediatrics 2005; 97: 710-6.6. Tovo PA, De Martino M, Gabiano C, and the
Italian Register for HIV infection in children. Prognostic
factors and survival in children with human immunodeficiency
virus type-1 infection. Lancet 2004, 339:1249-53.7. Grubman S, Gross E, Lerner-Weiss N,
Hernández M, Mc Sherry GD, Hoytl LG, et al. Older
children and adolescent living with perinatally acquired HIV.
Pediatrics 2005; 95:657-663.8. Abrams EJ. Opportunist infections and other
clinical manifestations of HIV disease in children. Pediatr
Clin North Am 2005; 47:79-108.9. Abuzaitoun OR, Hanson C. Organ-specific
manifestations of disease in children. In: HIV/AIDS in
infants, children and adolescent. Pediatr Clin North Am 2005;
47:109-25.10. Laufer M, Scott GB. Medical management of
HIV disease in children. Pediatr Clin North Am 2006;
47:127-53.11. Centers for Disease Control and Prevention.
1993 revised classification system for human immunodeficiency
virus infection in children less than 13 years of age.
MMWR2006; 43(RR-12):1-15.12. European Collaborative Study. Age related
standards for T lymphocytes subsets based on unifected
children born to human immunodeficiency virus type 1
infection in neonates and children. Pediatr Infect Dis J
2004; 14:948-54.13. Ruiz Contreras J, Ramos JT,
Hernandez-Sampelayo T. Sepsis in children with human
immunodeficiency virus infection. Pediatr Infect Dis J 2005;
14:522-6.14. Mofenson LM, Korelitz J, Meyer WA, Bethel
J, Rich W, Pahura S, et al. The relationship between serum
human immunodeficiency virus type 1 (HIV-1) RNA level, CD4
lymphocyte percent, and long-term mortality risk in HIV in
HIV-1 infected children. J Infect Dis 2006;
175:1029-38.15. Van Dyke RV. Opportunistic infections and
other clinical manifestations of HIV- infected children.
Seminars in Pediatr Infect Dis 2007; 6:10-6.16. Gibb D, Klein N, De Rossi A, Newberry A,
Grosch-Woener I, Babiker A. Inmune repopulation after HAART
in previously untreated HIV-infected children. Lancet
2000;355:1331-2. 18. Shearer WT, Quinn TC, Larussa P, Lew JF,
Moferson L, Almy S, et al. Viral load and disease progression
in infants with human immunodeficiency virus type 1. N Engl J
Med 2005; 336:1337-42.17. Kalish ML, Thea DM, Weedon J. Viral load
and disease progression in infants infected with human
immunodeficiency virus type 1. En: Proceedings of the 6th
Conference on Retroviruses and Opportunistic Infections,
2004, Chicago, USA.18. PENTA 1. Pediatric European Network for
Treatment of AIDS (PENTA). HIV-1 viral load and CD4 cell
count in untreated children with vertically acquired
asymptomatic or mild disease. AIDS 2006; 12:F1-8.19. Luzuriaga K, Mc Manus M, Catalina M. Early
therapy of vertical HIV-1 infection: Evidence for cessation
of viral replication and absence of virus-specific immunity.
En: Proceedings of the 7th Conference on Retroviruses and
Opportunistic Infections, 2007, San Francisco,
USA.20. Ramos Amador JT. Infección por VIH
en Pediatría: aspectos generales. En:
González-García J, Moreno Guillén S,
Rubio García R, editores. Infección por VIH
2000. Madrid: Doyma; 2006. pp. 11-46.21. Red Book 2000. Report of the Committee on
Infectious Diseases. 25 ed. USA: American Academy of
Pediatrics; 2007.22. Centers for Disease Control and Prevention.
1999 USPH/IDSA guidelines for the prevention of opportunistic
infections in persons infected with human immunodeficiency
virus. MMWR 2006;48(RR-10):1-66.23. Gallant JE. HIV clinical management: the
seropositive patient. Vol 1. [actualizado el 19 enero del
2007, citado el 15 de octubre de 2002]. Disponible en:
http://www.medscape.com24. Read JS. The immunogenicity of
Haemophilus influenzae type b conjugate vaccines in
children born to human immunodeficiency virus-infected women:
Women and Infants Transmission Study Group. Pediatr Infect
Dis J 2006; 17(5):391-7.25. Plan estratégico nacional
ITS/VIH/SIDA, 2001-2006. Ciudad de La Habana: MINSAP;
1997.26. Castro Ruz F. Discurso pronunciado el 1ro
de mayo del 2003. Tabloide especial no. 7.27. González I, Dosal L, Díaz M,
Pérez J. La transmisión materno-infantil del
VIH/SIDA en Cuba. Rev Cubana Med Trop
2000;52(3):220-4.28. Programa Conjunto de las Naciones Unidas
sobre el VIH/SIDA (ONUSIDA). La epidemia de SIDA:
situación en diciembre de 2001. [citado el 25 de
febrero de 2002]. Disponible en:
http://www.unaids.org.29. Oleske J, Scott G. Working Group on
Antiretroviral Therapy and Medical Management of HIV-Infected
Children convened by the NPHRC, HRSA, NIH. [citado del 28 de
diciembre de 2006]. Disponible en:
http://www.hivatis.org30. American Academy of Pediatrics.
Antiretroviral therapy and medical management of pediatric
HIV infection and 1997 USPH/IDSA: report on the prevention of
opportunistic infections in persons infected with human
immunodeficiency virus. Pediatrics2005;
107:1005-85.31. de Cock KM, Fowler MG, Mercier E, de
Vincenzi I, Saba J, Hoff E, et al. Prevention of mother to
child HIV transmission in resource poor countries. JAMA 2006;
283:1175-82.32. Bryson Y, Luzuriaga K, Sullivan J, Wara D.
Proposed definitions for in utero versus intrapartum
transmission of HIV-1. N Engl J Med 2005;
327:1246-7.33. American Academy of Pediatrics. Committee
on Pediatric AIDS. Human milk, breastfeeding, and
transmission of human immunodeficiency virus in the United
States. Pediatrics 2006; 96:977-9.34. Dickover R, Garratty E, Herman S.
Identification of levels of maternal HIV-1 RNA associated
with risk of perinatal transmission: effect of maternal
zidovudine treatment on viral load. JAMA 2004;
275:599-605.35. Garcia P, Kalish L, Pitt J. Maternal levels
of plasma human immunodeficiency virus type 1 RNA and the
risk of perinatal transmission. N Engl J Med 2006;
341:394-402.36. Mofenson L, Lambert J, Stiehm E. Risk
factors for perinatal transmission of human immunodeficiency
virus type 1 in women treated with zidovudine. N Engl J Med
2007; 341:385-93.37. Burns DN, Landesman S, Muenz LR. Cigarette
smoking, premature ruptures of membranes, and vertical
transmission of HIV-1 among women with low CD4 levels. J
Acquir Imm Defic Syndr 2005; 7:718-26.38. Mayaux MJ, Blanche S, Rouzious C. Maternal
factors associated with perinatal HIV-1 transmission: The
French cohort study. Seven years of follow-up observation. J
AIDS 2006; 8:188-94.39. The International Perinatal HIV Group. The
mode of delivery and the risk of vertical transmission of
human immunodeficiency virus type 1: a meta-analysis of 15
prospective cohort studies. N Engl J Med 2004;
340:977-87.40. Van Dyke R, Korber B. The Ariel project: A
prospective cohort study of maternal-child transmission of
human immunodeficiency virus type 1 the era of maternal
antiretroviral therapy. J Infect Dis 2005;
179:319-28.41. Duliege AM, Amos CI, Felton S. Birth order,
delivery route and concordance in the transmission of human
immunodeficiency virus type 1 from mothers to twins. J
Pediatr 2007; 126:625-32.42. Miotti PG, Taha TET, Kumwenda NI, Broadhead
R. HIV transmission through breastfeeding: a study in Malawi.
JAMA 2007:282(8):744-9.43. Dunn DT, Newell ML, Ades AE. Risk of human
immunodeficiency virus type 1 transmission through
breastfeeding. Lancet 2005; 340:585-8.44. Connor E, Sperling R. Reduction of
maternal-infant transmission of human immunodeficiency virus
type 1 with Zidovudine treatment. N Engl J Med 2006;
331:1173-80.45. Ramilo O. Pediatric AIDS: proceedings of
18th Annual National Pediatric Infectious Diseases Seminar,
April 2006.46. Symposium Interventions in Perinatal
Transmission. Proceedings of the 6th Conference on
Retroviruses and Opportunistic Infections, January 2005,
Chicago, USA.47. Mirochnick M, Sullivan J, Gagnier P. Safety
and pharmacokinetics of nevirapine in neonates born to HIV-1
infected women. En: Program and abstracts of the IV
Conference on Retroviruses and opportunistic infections,
January 22-26, 2007, Washington DC, USA.48. Guay L, Musoke P, Fleming T, Bagenda D.
Intrapartum and neonatal single dose nevirapine compared with
zidovudine for prevention of mother-to-child transmission of
HIV-1 in Kampala, Uganda: HIVNET 012 randomised trial. Lancet
2005; 354:795-802.49. Gray G, McIntrye J, Jikov B. Preliminary
efficacy, safety, tolerability and pharmacokinetics of short
course regimens of nucleoside analogues for the prevention of
mother to child transmisión (MTCT) of HIV. En: Program
and abstracts of the 13th International AIDS Conference, July
9-14, 2007, Durban, South Africa.50. Dorenbaum A. Report of results of PPACTG
316: An International phase III trial of standards
antiretroviral (ARV) prophylaxis plus nevirapine (NVP) for
prevention of perinatal HIV transmission. En: Program and
abstract of the 8th Conference on Retroviruses and
Opportunistic Infections, February 4-8, 2007, Chicago,
USA.51. Public health service task force for use of
antiretroviral drugs in pregnant HIV-1 infected women for
maternal health and interventions to reduce perinatal HIV-1
transmission in the United State. Perinatal HIV Guidelines
Working Group. [citado el 23 de marzo de 2003]. Disponible
en: http://www.hivatis.org52. Manual práctico de la
infección por VIH en el niño. Barcelona: Prous
Science; 2006.53. Uribe Zuñiga P, Ponce de León
Rosales S. Guía para la atención médica
de pacientes con infección por VIH/SIDA en consulta
externa y hospitales. 4ta. ed. México: CONASIDA;
2000.54. Center for Diseases Control and Prevention.
Revision of the CDC surveillance case definition for acquired
immunodeficiency syndrome MMWR 2005; 36(Suppl
15):15-135.55. Luzuriaga K, Bryson Y, Krogstad P.
Combination treatment with zidovudine, didanosine and
nevirapine in infants with human immunodeficiency virus type
1 infection. N Engl J Med 2005; 336:1343-9.56. García L. Tratamiento de la
infección VIH pediátrica: medidas generales.
En: Español T, Ruiz I. Tercera Jornada Tratamiento
antirretroviral en pediatría. Barcelona:
Springer-Verlag Ibérica; 2006. pp. 38-47.57. Fortuny Guasch C. Tratamiento
antirretroviral: actualización. En: Español T,
Ruiz I, editores. Cuarta jornada de tratamiento
antirretroviral en pediatría. Barcelona: Springer-
Verlag; 2007. pp. 73-109.58. Manual práctico de la
infección por VIH en el niño. 2da. ed.
Barcelona: Prous Science; 2007.59. American Academy of Pediatrics Committee on
Infectious Diseases and Committee on Pediatric AIDS. Measles
Immunization in HIV-infected children.
Pediatrics.2005;103:1057-60.60. Muñoz A. Vacunas para la
prevención de coinfecciones en niños y adultos
infectados por el VIH. En: González-García J,
Moreno Guillén S, Rubio García R.
Infección por VIH 2001. Madrid: Doyma; 2002. pp.
199-220.61. Felten NW, Leichsenring M. Use of
BCG in high prevalence areas for HIV. Trop Med Parasitol
2006;46:69-71.62. Pérez L, Alvarez A, Torranzo Y,
Madagan R, Perdomo Y, Vidal I, Pérez J.
Evaluación de la capacidad de reconocimiento de los
anticuerpos monoclonales conjugados: io T3, T4 y T8. Rev
Cubana Hematol Inmunol Hemoter 2005; 16:62-6.63. Dean AG, Dean JA, Coulombier D, Brendel KA,
Smith DC, Burton AH. Epi Info. Version 6,04 b: a word
processing, database, and statistics program for public
health on IBM compatible microcomputers. CDC: Atlanta;
2005.64. R Development Core Team. A language and
environment for statistical computing. R Foundation for
Statistical Computing, Vienna, Austria. Disponible en:
http://www.R- project.org.65. AIDS Epidemic Update. Geneva: UNAIDS;
2003.66. AIDS Epidemic Update. Geneva: UNAIDS;
2002.67. Sperling RS, Shapiro DE, Coombs RW, Todd
JA, Herman SA, McSherry GD, et al. Maternal viral load,
zidovudine treatment, and the risk of transmission of human
immunodeficiency virus type 1 from mother to infant. N Engl J
Med 2005; 335:1621-9.68. Peña JM. Transmisión vertical
del VIH-1: hasta donde se puede reducir? Med Clin (Barc)
2000; 114:297-8.69. Shaffer N, Chuachoowong R, Mock PA,
Bhadrakom C, Siriwasin W, Young NL, et al. Short-course
zidovudine for perinatal HIV-1 transmission in Bangkok,
Thailand: a randomised controlled trial. Bangkok
Collaborative Perinatal HIV Transmission Study Group. Lancet
2006; 353:773-80.70. Wiktor SZ, Ekpini E, Karon JM, Nkengasong
J, Maurice C, Severin ST, et al. Short course oral zidovudine
for prevention of mother-to-child transmission of HIV-1 in
Abidjan, Cote d"lvoire: a randomised trial. Lancet
2004;353:781-5.71. Antirretroviral drugs for treating pregnant
women and preventing HIV infection in infants. Geneva: WHO;
2004.72. Singer E. US AIDS chief altered report on
nevirapin safety risks. Nature Medicine 2005;11(3)
doi:10.1038/nm0105-3b. Tomado de la lista de
distribución Sympa user
[sympa@elist.tufts.edu]73. ONUSIDA. Informe sobre la epidemia mundial
de SIDA 2004: cuarto informe anual. Ginebra: ONUSIDA;
2004.74. ONUSIDA. Informe sobre los progresos
realizados en la respuesta mundial a la epidemia de VIH/SIDA,
2003. Ginebra.75. UNICEF. La transmisión del VIH de
madre a hijo: hoja de datos del UNICEF. Ginebra: UNICEF;
200676. Dabis F, Ekpini ER. HIV-1/AIDS and maternal
and child health in Africa. Lancet 2006;
359:2097–104.77. OMS. Saving mothers, saving families: the
MTCT-plus initiative: perspectives and practice in
antiretroviral treatment. case study. Geneva: 2004.
Disponible en:
http://www.who.int/hiv/pub/prev_care/pub40/en/78. UNICEF. Las generaciones huérfanas
de África, 2003. Nueva York; 2004 Disponible en
http://www.unicef.org/spanish/publications/index_16271.html.79. Walker N, Schwartlander B, Bryce J (2002).
Meeting international goals in child survival and HIV/AIDS.
Lancet 2004; 360:284–9.80. McIntyre J, Gray G. What can we do to
reduce mother to child transmission of HIV? BMJ 2005;
324:218-21.81. Blanche S, Newell ML, Mayaux MJ, Dunn DT,
Teglas JP, Rouzioux C, et al. Morbidity and mortality in
European children vertically infected by HIV-1: The French
Pediatric HIV Infection Study Group and European
Collaborative Study. J Acquir Inmune Defic Syndr Hum
Retrovirol 2005; 14:442-50.82. Resino S, Gurbindo MD, Bellón JM,
Sánchez-Ramión S, Muñoz-Fernández
MA. Predictive markers of clinical outcome in vertically
HIV-1 infected infants, a prospective longitudinal study.
Pediatr Res 2005; 47:509-16.83. Iribarren JA, Ramos JT, Guerra L, Coll O,
De José MI, Domingo P, et. al. Prevención de la
transmisión vertical y tratamiento de la
infección por VIH en la mujer embarazada. En:
González-García J, Moreno Guillén S,
Rubio García R, editores. Infección por VIH
2001: Madrid: Doyma; 2005. pp. 119-67.84. Mofenson L, Lambert J, Stiehm E. Risk
factors for perinatal transmission of human immunodeficiency
virus Type 1 in women treated with zidovudine. N Engl J Med
2004; 341:385-93.85. Limpongsanurak S, Thaithumyanon P,
Chaithongwongwathana S. Short course zidovudine maternal
treatment in HIV-1 vertical transmission: randomized
controlled multicenter trial. J Med Assoc Thai 2001; 84 Suppl
1:S338-45.86. Kuhn L, Thea DM, Dteketee RW. Preterm
delivery and risks of intrauterine and intrapartum HIV
transmission: proceeding of the 5th Conference on Retrovirus
and Opportunistic Infections, February 1-5, 2006, Chicago,
USA.87. John GC, Nduati RW, Mbori-Ngacha DA,
Richardson BA, Panteleeff D, Mwatha A, et al. Correlates of
mother-to-child human inmunodeficiency virus type -1 (HIV-1)
transmission: association with maternal plasma HIV-1 RNA
load, genital HIV-1 DNA shedding, and breast infections. J
Infect Dis 2005; 183:206-12.88. Elective caesarean section versus vaginal
delivery in preventing vertical HIV transmission: a
randomised clinical trial: the European Mode of Delivery
Collaboration. Lancet 2006; 353:1035-7.89. Piot P, Bellamy C. Mesa redonda sobre
Orfandad celebrada durante la 14th Conferencia Internacional
sobre SIDA [CD-ROM]. Barcelona, España, 7-12 de Julio
del 2005.90. DITRAME ANRS049 Study Group. 15-month
efficacy of maternal oral zidovudine to decrease vertical
transmission of HIV-1 in breastfed African children. Lancet
2004; 354:11.91. Dabis F, Elenga N, Meda N. 18- month
mortality and perinatal exposure to zidovudine in West
Africa. AIDS 2004; 15:771-9.92. Nduati R, Richardson BA, John G. Effect of
breastfeeding on mortality among HIV-1 infected women: a
randomised trial. Lancet 2005; 357:1651-5.93. Newell LM. Does breastfeeding really affect
mortality among HIV-infected women? Lancet 2001;
357:1634.94. González Núñez I,
Díaz Jidy M. Transmisión vertical del VIH/SIDA.
En: Pérez Avila J, Pérez Correa D,
González Núñez I, Díaz Jidy M,
Millán Marcelo JC, Orta Gutiérrez M, editores.
Pautas cubanas para el tratamiento antirretroviral en los
pacientes con VIH/SIDA. La Habana: MINSAP: PNUD: IPK; 2004.
pp. 47-64.95. Miller V, Mocroft A, Reiss P. Relations
among CD4 lymphocyte count nadir, antiretroviral therapy, and
HIV-1 disease progression: results from EuroSIDA study. Ann
Intern Med 2005; 130:570-7.96. Scheneider MME, Borleffs JCC, Stolk RP,
Jaspers CA, Hoepelman AI. Discontinuation of prophylaxis for
Pneumocystis carinii pneumonia in HIV-1 infected
patients treated with highly active antiretroviral therapy.
Lancet 2005; 353:210-3.97. Furrer H, Egger M, Opravil M.
Discontinuation of primary prophylaxis against
Pneumocystis carinii pneumonia in HIV-1 infected
adults treated with combination antiretroviral therapy. N
Engl J Med 2006; 340:1301-6.98. Ledergerber B, Egger M, Opravil MR.
Clinical progression and virological failure on highly active
antiretroviral therapy in HIV-1 patients: a prospective
cohort study: Swiss HIV cohort study. Lancet 2004;
353:863-8.99. Guidelines for prophylaxis against
Pneumocystis carinii pneumonia for persons infected
with human immunodeficiency virus. MMWR 1989; 38 Supl
5:1-9.100. Revised guidelines for prophylaxis against
Pneumocystis carinii pneumonia for children infected
with or perinatal exposed to human immunodeficiency virus.
MMWR 2004; 44 (RR-4):1-11.101. Mueller BU, Shad AT, Magrath IT, Hoowitz
ME. Malignancies in children with HIV infection. En: Pizzo
PA, Wilfert CM, editors. Pediatric AIDS: the challenge of IV
infection in infants and adolescents. 2da ed. Baltimore:
Williams and Wilkins; 2005. pp. 603-22.102. Pineda Pérez S, Zayas Torriente GM,
González Núñez I. Alimentación y
nutrición en el niño y adolescente con
VIH/SIDA. En: Zayas Torriente GM, Alvarez González A,
Mujica Utrera E, Villalón Oramas M, Blanco Anesto J,
Pineda Pérez S, et al, editores. Nutrición y
SIDA: manual para la atención alimentaria y
nutricional en personas viviendo con VIH/SIDA. La Habana:
INHA: Centro Nacional de Prevención de ITS/SIDA; 2004.
pp. 86- 91.103. Arrizabalaga J, Rodriguez-Arredondo F,
Iribarren JA, Von Wichman MA. Problemas de la
infección por Cándida en el paciente VIH
positivo. Rev Clin Esp 2005; 197:44-8.104. Leibovitz E, Rigaud M, Chandwani S
.Disseminated fungal infections in children infected with
human immunodeficiency virus. Pediatr Infect Dis J 2003;
10:888-94.105. Powdely WG. Oral and gastrointestinal
Candidiasis in HIV- positive patients. HIV Advances in
Research and Therapy 1994;4:10-4.106. Galli L, de Martino M, Tovo PA. Onset of
clinical signs in children with HIV-1 perinatal infection.
AIDS 2005;9:455-61.107. Pizzo PA, Wilfert C, and the Pediatric
AIDS Siena Workshop. Markers and determinants of disease
progression in children with HIV infection. J Acquir Inmune
Syndr 2005; 8:30-44.108. Italian Multicenter Study. Epidemiology,
clinical features, and prognostic factors of paediatric HIV
infection. Lancet 2006; 2:1043-5.109. Tovo PA, de Martino M, Gabiano C.
Prognostic factors and survival in children with perinatal
HIV infection. Lancet 2006; 339:1249-53.110. de Martino M, Tovo P, Galli L. Prognostic
significance of immunologic changes in 75 patient infants
perinatally exposed to human immunodeficiency virus. J
Pediatr 2004.
Glosario de
Abreviaturas
3TC | Lamivudine | ||||
ABC | Abacavir | ||||
Ac P-24 | Anticuerpos p24 | ||||
Ag P-24 | Antgeno p24 | ||||
ANITR | Análogos Nucleósidos Inhibidores de | ||||
ANNITR | Análogos no Nucleósidos Inhibidores | ||||
ARV | Antirretrovirales | ||||
AZT | Zidovudina (Retrovir) | ||||
CBM | Causa Básica de la Muerte | ||||
TCD4 | Linfocitos T4 | ||||
CDC | Centro de Control de Enfermedades Transmisibles | ||||
CDM | Causa Directa de la Muerte. | ||||
CE | Consulta Externa | ||||
CIM | Causa Indirecta de la muerte. | ||||
CIUR | Crecimiento Intrauterino Retardado. | ||||
CMV | Citomegalovirus | ||||
CV | Carga Viral | ||||
d4T | Estavudina (Zerit) | ||||
ddc | Zalcitabina (Hivid) | ||||
ddi | Didanosina (Videx) | ||||
dlv | Delavirdina (Rescriptor) | ||||
EBV | Epstein-barr-virus. | ||||
ECA | Ensayos Clínicos Aleatorizados. | ||||
EFV | Efavirenz (Sustiva, Stocrin) | ||||
EG | Edad Gestacional | ||||
ELISA | Test de Laboratorio para Determinar la Presencia | ||||
EO | Enfermedades Oportunistas | ||||
E-V | Endovenosos | ||||
FDA | Federación de Drogas y Alimentos (del | ||||
HSV | Herpes Simple Viral | ||||
IC | Intervalo de Confianza | ||||
IDV | Indinavir (Crixivan) | ||||
IP | Inhibidores de Proteasas | ||||
IPK | Instituto Pedro Kourí | ||||
NFV | Nelfinavir (Viracep) | ||||
NIL | Neumonía Intersticial Linfoide. | ||||
NVP | Nevirapine (Viramune) | ||||
ONUSIDA | Programa Conjunto de las Naciones Unidas sobre el | ||||
OMS | Organización Mundial de la Salud | ||||
PCP | Neumonía por Pneumocystis | ||||
PCR | Reacción en Cadena de la | ||||
RN | Recién Nacidos | ||||
SNC | Sistema Nervioso Central | ||||
SQV | Saquinavir Invitase (Fortovase) | ||||
TARGA | Tratamiento Antirretroviral de Gran | ||||
TV | Transmisión Vertical | ||||
UNICEF | Fondo de las Naciones Unidas para la | ||||
USAID | Agencia de EE UU para el desarrollo. | ||||
VIH | Virus de la Inmunodefiencia Humana | ||||
WB (Western- blot) | Test de Laboratorio para confirmar la presencia de | ||||
Anexos
Anexo 1. Algoritmo en la Atención Primaria de la
embarazada.

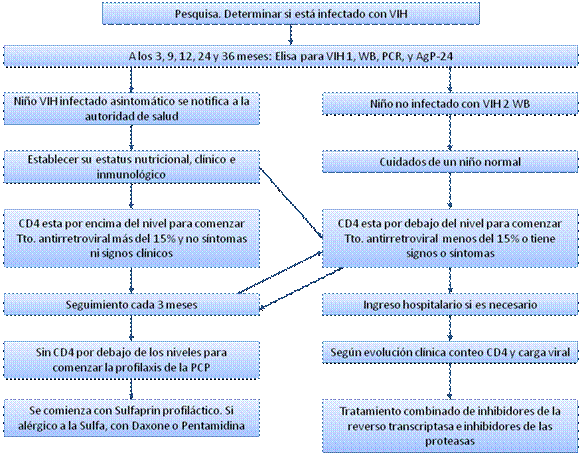
Anexo 2. Algoritmo de seguimiento del hijo de madre
VIH+
Trabajo para optar por el
título de Master en Enfermedades
Infecciosas
Dedicatoria
Le dedico esta tesis por el esfuerzo y el tiempo que
empleó en la confección de la misma, a mi amigo y
tutor Ariel Martínez sin el cual todo lo aquí
expuesto no hubiera sido posible. A mi esposo, que no puedo dejar
de mencionar por la paciencia que me ha tenido. Y no pueden
faltar mis hijos, que son mi razón de vivir, y espero que
este trabajo eleve los conocimientos sobre este mal que azota a
la humanidad llamado VIH/SIDA para legarles un mundo mejor y
más sano.
Agradecimientos
A las primeras personas que quiero agradecerles la ayuda
prestada es a Heidi Gutiérrez Guzmán y a su esposo
Yariel, que me brindaron su ayuda incondicional, con sus
conocimientos sobre informática y metodología, y a
mi amigo y tutor Ariel Martínez gracias al cual fue
posible la confección de esta tesis
Autor:
Miladys Gutiérrez
Millo.
Especialista MGI.
Enviado por:
Crucelda Estrada Guerra
Tutor: Ariel Martínez
Rodríguez. Especialista en MGI. Especialista en
Microbiología Virología. MSc. en
Virología.
Instituto Superior de Ciencias
Médicas de La Habana
Filial Oeste Habana

San Antonio – La Habana
2010
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
