- Qué es una pila
eléctrica - Historia de la pila
eléctrica - Alessandro Volta y la pila
eléctrica - Funcionamiento
- Cuáles son los diferentes tipos de pilas
eléctricas - Materiales
- Procedimiento
- Resultados
- Conclusión
- Bibliografía
Qué es una
pila eléctrica
Una pila eléctrica es un dispositivo
que convierte la energía química en
eléctrica. Todas las pilas consisten en un electrolito, un
electrodo positivo y un electrodo negativo. El electrolito es un
conductor iónico; uno de los electrodos produce electrones
y el otro electrodo los recibe. Al conectarlos al circuito que
hay que alimentar, se produce una corriente eléctrica.Las
pilas en las que el producto químico no puede volver a su
forma original una vez que la energía química se ha
transformado en energía eléctrica, se llaman pilas
primarias o voltaicas. Las pilas secundarias son aquellas pilas
reversibles en las que el producto químico que al
reaccionar en los electrodos produce energía
eléctrica, puede ser reconstituido pasando una corriente
eléctrica a través de él en sentido opuesto
a la operación normal de la pila. Durante los
últimos años se han desarrollado las pilas solares
que producen electricidad mediante un proceso de
conversión fotoeléctrica. La fuente de electricidad
es una sustancia semiconductora fotosensible, como un cristal de
silicio al que se le han añadido impurezas. Cuando la luz
incide sobre el cristal, los electrones de la superficie se
liberan dirigiéndose a la superficie opuesta donde se
distribuyen. Las pilas solares tienen una vida muy larga y se
utilizan sobre todo en los aviones y vehículos espaciales
como fuente de electricidad.
Historia de la pila
eléctrica
La historia de la pila eléctrica
refleja el desarrollo histórico de diferentes celdas
electroquímicas empleadas para obtener una corriente
eléctrica a partir de la energía química
contenida en unas sustancias químicas que sufren una
reacción de oxidación-reducción.
El nombre de la pila se refiere de modo
genérico a todo lo que genera una corriente a partir de
una reacción química, aunque existen diferencias
entre ellos: celdas voltaicas (primarias y secundarias), pilas
eléctricas, acumuladores, baterías y pilas de
combustible.
Alrededor de 1938, los arqueólogos
descubrieron un conjunto de vasijas de terracota cada una de las
cuales contenía un rollo de lamina de cobre que albergaba
una varilla de hierro. Algunos científicos especulas que
esos artilugios podrían ser antiguas celdas
galvánicas , a los que se les denomina la ""Batería
de Bagdad"". Se cree que un ácido común de los
alimentos, como el jugo del limón o el vinagre,
sirvió como un electrolito.
Las réplicas modernas se han
producido con éxito corrientes eléctricas, dando
crédito a esta hipótesis. Si la muestra fue de
hecho una simple batería, utilizada para almacenar rollos
antiguos.
Alessandro Volta y la
pila eléctrica
Alessandro Volta descubrió la pila o
columna, a la que inicialmente llamó "órgano
eléctrico artificial", estudiando los efectos del
galvanismo sobre las ancas de rana.
Volta pensó que lo que el
llamó galvanismo era una corriente eléctrica
animal. Se le llamó así en honor a Galvani,
fundador de la Fisiología nerviosa, el cual
estableció dicha corriente uniendo dos metales diferentes
por medio de nervios o de músculos de un
animal.
En realidad, la corriente galvánica,
es una corriente continua (c.c).
Volta construyó la primera pila que
nosotros podemos reproducir. (Todos los modelos
científicos son reproducibles sin necesidad de
extraños conjuros y sin esperar que unas veces salgan y
otras no).
| Volta apiló discos de igual Conectando con un alambre los discos Impregnando el paño en |
¡Había descubierto la madre de
todas las Pilas!. Esa pila que, evolucionada y de muy
diversos tipos, forma hoy parte de nuestra vida diaria.Recuerda
que los componentes metálicos de las pilas contaminan el
medio ambiente Las pilas de mercurio son muy
contaminantes.
Siempre RRR: Reducir, Reutilizar,
Reciclar.
El funcionamiento de la Pila
Daniell –una variante de la de Volta- para entender
como se genera electricidad en ella, como logramos sacarle
electrones a la materia y como los hacemos circular por un
cable.Este es el montaje que se hace en las prácticas de
Química del bachillerato:
| La pila Daniell consta de: Dos placas, electrodos, una de Cu y Dos disoluciones: una de sulfato de Un puente salino (tubo en U) de También puede ponerse una |
Funcionamiento
Zn –› Zn2+ + 2e- ; V1= +
0,76 v
Los dos electrones que deja en la placa
cada átomo de cinc que pasa a la disolución escapan
por el cable exterior hasta la placa de Cu. En la
disolución los iones SO4 = y los Zn2+ ya no
están en equilibrio ya que ahora hay un exceso de iones
Zn2+. Para neutralizarla los iones nitrato del puente salino se
introducen en la disolución.En el vaso de la derecha,
cuando los electrones llegan a la placa de Cu, se produce una
reducción del Cu+2 de la disolución a Cu
metal:
Cu2+ + 2e- –› Cu ; V2= +
0,33 v
La disolución de sulfato de Cu,
inicialmente neutra, tiene ahora un exceso de iones sulfato al
haberse depositado el Cu y para neutralizarla pasan a ella los
iones K+ del puente salino.
El puente salino se encarga de mantener
neutras las dos disoluciones ya que en caso contrario
sería imposible la circulación de los electrones.
La lámina de Zn pierde masa, y la de Cu la
gana.
La reacción global en la pila
será una reacción redox:
Zn + Cu2+ –› Zn2+ + Cu
y su potencial 0,76 v + 0,33 v = 1,09 v.
A nosotros nos dio 1,226 v: mucha
precisión -tres decimales- para un polímetro barato
y probablemente no muy bien calibrado, pero como se ve en la foto
es el dato que hemos obtenido.
En toda pila se producen dos procesos:
una reducción y una oxidación
simultáneas.
Hemos logrado que por el cable exterior
circulen los electrones que hemos sacado de la placa
metálica y que al mismo tiempo circulen iones a
través de las disoluciones.
Con este circuito cerrado logramos sacar
los electrones de la materia y hacerlos circular.
Cuáles son los
diferentes tipos de pilas eléctricas
Pilas ecológicas: Pueden ser salinas
o alcalinas y se caracterizan por no llevar metales pesados en su
composición, como mercurio o cadmio, para aumentar su
potencia o duración.
Pilas de níquel-cadmio: Son pilas
recargables. Son muy dañinas para el medio ambiente debido
principalmente a su contenido en un metal tóxico: el
cadmio.
Pilas alcalinas: La mayoría contiene
mercurio y ofrecen mayor duración y potencia que las pilas
salinas. No pueden reciclarse pero deben ir a un vertedero
especial.
Pilas salinas: son las primeras que se
fabricaron. Tienen menos duración y potencia que las pilas
alcalinas pero su contenido tóxico es muy bajo.
Pilas botón de mercurio: son muy
contaminantes y pueden reciclarse para recuperar el
mercurio.
Pilas botón de litio: Son la
alternativa a los botones de mercurio.
Materiales
Un vaso
Una botella de vinagre
Un trozo de tubería de cobre (de
las que se usan para las conducciones de agua)Un sacapuntas o afilalápices
metálicoCables eléctricos
Un aparato que vamos a hacer funcionar
con la pila. Se obtienen buenos resultados con los
dispositivos musicales que llevan algunas tarjetas de
felicitación. También puede servir un reloj
despertador de los que funcionan con pilas.
Procedimiento
Primero se llena el vaso de vidrio de
vinagre. Se pealan los extremos de los cables para que quede un
pedazo de los cables
Solo, después se conecta a cada
extremo del cable, en un extremo se conecta el sacapuntas y en el
otro se conecta la tubería de cobre limpia. Ya que
estén conectados, se introducen al vaso que contiene
vinagre, el siguiente paso será que los cables que
quedaron solos debes conectar uno al foco LED, cuando lo hayas
conectado, ahora si agarras tu aparato que necesite pilas, con la
polaridad que se genera conéctalo a donde tienen que ir
las pilas, el foco LED prendera y tu aparato
funcionará.
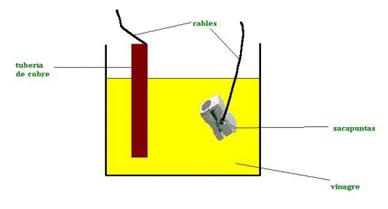
Resultados
La pila proporciono una intensidad de energía baja, por
eso no siempre funciona este experimento. Tienes que tener en
cuentas que debes utilizar un aparato que no necesite de mucha
batería. Por eso sugerimos utilizar un LED, por que no
necesita tanta energía.
Cuando no estés utilizando la energía, retira en
sacapuntas y el tubo de cobre del vinagre, porque pueden
reaccionar de manera química y originar gas hidrogeno.
Explicación
La pila contiene 2 electrodos, dos metales que es el magnesio
y el cobre (en este experimento la tubería de cobre y el
sacapuntas), y la pila que también contiene electrolito (
en este experimento el vinagre)
Conclusión
La pila eléctrica genera energía química
que se transforma en energía eléctrica.
Existen varios tipos de pilas en este caso mencionaremos 3
tipos:
Las primarias, que tienen una pasta consistente, estas
formadas de cloruro de zinc y de amonio, fue inventada por George
leclanché en los 70"s
Las secundarias, (estas se agotan muy rápido) se
utilizan en los autos, aviones y camiones fue inventada por el
francés Gastón Planté
Las solares, esta se utiliza en los aviones y es una pila muy
duradera
Gracias a un experimento iniciado por volta y finalizado por
John frederic daniell se demostró que en efecto es posible
realizar energía eléctrica, con tan solo cables de
electricidad, vinagre, una tubería de cobre y un
sacapuntas.
Bibliografía
http://es.wikipedia.org/wiki/Historia_de_la_pila
http://teleformacion.edu.aytolacoruna.es/FISICA/document/fisicaInteractiva/sacaleE_M2/Volta/Pila_Volta.htm
Autor:
Leslie Larraga


