Introducción
Los diagramas de equilibrio son gráficas que
representan las fases y estado en que pueden estar diferentes
concentraciones de materiales que forma una aleación a
distintas temperaturas. La mayoría de los diagramas de
fase han sido construidos según condiciones de equilibrio,
siendo utilizadas por ingenieros y científicos para
entender y predecir muchos aspectos del comportamiento de
materiales; debido a que aportan valiosa información sobre
la fusión, el moldeo, la cristalización y otros
fenómenos.
Los equilibrios de fase y sus respectivos diagramas de
fase en sistemas multicomponentes tienen aplicaciones importantes
en química, geología y ciencia de los materiales.
Por otra parte, los diagramas de fases son de gran importancia
pues apoyan, entre otros, estudios de solidificación,
microestructura, metalurgia física y el "diseño
de nuevos materiales".
La ciencia de los materiales surgió
después de la Segunda Guerra Mundial, como respuesta a la
necesidad de producir materiales con propiedades especializadas.
Los primeros intentos de modificar científicamente las
propiedades de la materia se remontan a principios del siglo
pasado, cuando los conocimientos de cristalografía, estado
sólido y física atómica convirtieron el arte
de la metalurgia en ciencia. De allí parte la
creación de nuevas aleaciones, como el acero, que es el
resultado de la aleación de hierro y carbono en diferentes
proporciones. La definición en porcentaje de carbono
corresponde a los aceros al carbono, en los cuales este no metal
es el único aleante, o hay otros pero en menores
concentraciones. Es utilizado, por ejemplo, en
construcción, cascos de barcos, maquinaria,
carrocería de automóviles, equipos químicos,
etc.
El acero se calienta a una temperatura determinada, se
mantiene a esa temperatura durante un cierto tiempo hasta que se
forma la estructura deseada y entones se enfría a una
velocidad conveniente, dependiendo del tratamiento térmico
que le sea aplicado, adquiriendo así, gran flexibilidad y
dureza.
La técnica de enfriado (tratamiento
térmico), como se menciono anteriormente, consiste en
someter al material a determinada temperatura y enfriarlo con
cierta velocidad. Los factores temperatura-tiempo dependen del
material, tamaño y forma de la pieza. De esta manera se
conseguirá una modificación microscópica,
transformaciones de tipo físico, cambios de
composición o una determina estructura interna las
propiedades de a cual permitirán alguno de los objetivos
buscados, como aumentar la dureza, mejor mecanizado, eliminar
tensiones internas, evitar deformaciones, etc. Los principales
tratamientos térmicos son: temple, recocido, revenido y
normalizado.
Diagrama de
fases
En termodinámica y ciencia de materiales se
denomina diagrama de fase, diagrama de equilibrio de fases o
diagrama de estados de la materia, a la representación
gráfica de las fronteras entre diferentes estados de la
materia de un sistema, en función de variables elegidas
para facilitar el estudio del mismo.
Los equilibrios entre fases pueden corresponder a los
más variados tipos de sistemas heterogéneos: un
líquido en equilibrio con su vapor, una solución
saturada en equilibrio con el soluto en exceso, dos
líquidos parcialmente solubles el uno en el otro, dos
sólidos totalmente solubles en equilibrio con su fase
fundida, dos sólidos parcialmente solubles en equilibrio
con un compuesto formado entre ellos, etc. El objetivo es
describir completamente el sistema.
El comportamiento de estos sistemas en equilibrio se
estudia por medio de gráficos que se conocen como
diagramas de fase: se obtienen graficando en función de
variables como presión, temperatura y composición y
el sistema en equilibrio queda definido para cada punto (los
gráficos de cambio de estado físico ó de
presión de vapor de una solución de dos
líquidos son ejemplos de diagramas de fases).
La mayoría de los diagramas de fase han sido
construidos según condiciones de equilibrio (condiciones
de enfriamiento lento), siendo utilizadas por ingenieros y
científicos para entender y predecir muchos aspectos del
comportamiento de materiales.
A partir de los diagramas de fase se puede obtener
información como:
1.- Conocer que fases están presentes a
diferentes composiciones y temperaturas bajo condiciones de
enfriamiento lento (equilibrio).
2.- Averiguar la solubilidad, en el estado sólido
y en el equilibrio, de un elemento (compuesto) en
otro.
3.- Determinar la temperatura en la cual una
aleación enfriada bajo condiciones de equilibrio comienza
a solidificar y la temperatura a la cual ocurre la
solidificación.
4.- Conocer la temperatura a la cual comienzan a
fundirse diferentes fases.
Los equilibrios de fase y sus respectivos diagramas de
fase en sistemas multicomponentes tienen aplicaciones importantes
en química, geología y ciencia de los materiales.
La ciencia de materiales estudia la estructura, propiedades y
aplicaciones de los materiales científicos y
tecnológicos.
Diagrama de equilibrio de aleaciones
totalmente solubles en estado liquido y en estado
sólido:
Es el diagrama de fases más sencillo; se dan
aleaciones de algunos pares de sustancias que son completamente
miscibles en fase sólida, como por ejemplo los sistemas
Cu-Ni, Sb-Bi, Pd-Ni, KNO3-NaNO3 y
d-carvoxima-l-carvoxima.
En este tipo de sistema A y B son
totalmente solubles tanto en estado sólido como en estado
líquido.

Si tomamos distintas concentraciones de éste
metal y trazamos sus curvas de enfriamiento empezando por la
aleación del 0%B y terminando en la del 100%B, obtenemos
una serie de curvas, de las cuales las de los metales puros
presentan a las temperaturas inicial y final de la
solidificación un tramo horizontal, ya que esta se
verifica a temperatura constante. Sin embargo, las curvas de
enfriamiento de las aleaciones intermedias presentan dos puntos
singulares o de cambio de pendiente, de los cuales el
correspondiente a la mayor temperatura marca el comienzo de la
solidificación y el otro el final de ésta. La
línea que une todos los puntos de comienzo de
solidificación se denomina línea de líquidos
y la que une el final de solidificación línea de
sólidos. El área situada por encima de la
línea de líquidos representa una región
monofásica, que se presenta en forma de una
solución líquida homogénea. La región
situada por debajo de la línea de sólidos
también corresponde a una sola fase, y las aleaciones
situadas en ésta región presentan la forma de una
solución sólida homogénea. La zona
comprendida entre las dos líneas representa una zona
bifásica, y toda aleación que se encuentre dentro
de esta zona están formadas por una mezcla de una
solución sólida y otra líquida. Si cogemos
un punto que está justo en la línea de
líquido, si el punto de solidificación del elemento
A es superior a la del elemento B, comienza a cristalizar una
solución sólida rica en A quedando un
líquido rico en B, y a medida que seguimos enfriando los
cristales de dicha solución sólida van creciendo
hasta llegar a la línea de sólido, donde termina de
solidificar la aleación. El último líquido
que queda suele ser más rico en metal B por lo que la zona
del límite de grano presenta un porcentaje mayor de
B.
Diagrama de equilibrio de aleaciones
totalmente soluble es estado liquido y parcialmente soluble
en estado sólido:
En éste caso las soluciones sólidas de un
componente en otro que se forman tienen un límite de
saturación.

Los puntos de solidificación de los dos
componentes puros vienen representados por TA y TB
respectivamente. La línea de líquidas será
TAETB y la de sólidas TAFEGTB. Como puede verse en
éste tipo de diagramas de equilibrio en los puntos de
fusión de los metales puros, que a su vez es punto de
encuentro de la línea de líquido y de
sólido, el diagrama adquiere forma la forma de huso
característica de los sistemas que presentan solubilidad
total en estado líquido, lo cual es lógico, ya que
los componentes son parcialmente solubles en estado sólido
y por tanto forman soluciones sólidas. Al solidificar las
aleaciones pertenecientes a éste diagrama, nunca se forman
cristales puros de A o de B sino que se forman soluciones
sólidas o una mezcla de ellas.
Las soluciones sólidas se designan por letras
griegas, siendo en ésta caso a y ß las regiones
correspondientes a las soluciones sólidas
monofásicas, las cuales al formarse en las regiones
contiguas a los ejes se denominan soluciones sólidas
terminales o finales. En él puede verse que al descender
la temperatura y alcanzar la temperatura eutéctica, la
solución sólida a disuelve un máximo de B,
cuya cantidad disminuye si lo hace la temperatura hasta un
mínimo. Y lo mismo ocurre en el caso de ß. Este
cambio de solubilidad lo indican las líneas FH y GJ, las
cuales se denominan líneas de transformación o
cambio de solubilidad, e indican la solubilidad máxima de
B en A o de A en B en función de la temperatura. Si
consideramos el enfriamiento de distintas disoluciones, se
observa que en caso de tomar una aleación cuya
composición sea la eutéctica lo que tenemos es en
primer lugar una solución líquida homogénea
que al descender la temperatura hasta la eutéctica se
transforma a temperatura constante en una mezcla eutéctica
igual que pasara en el caso anterior estudiado, con la
única diferencia que ésta mezcla eutéctica
en lugar de estar constituida por dos componentes puros, la
formarán dos soluciones sólidas. Ahora bien hay que
tener en cuenta que como la solubilidad de B en A y de A en B
varía de acuerdo con las líneas de
transformación, las cantidades relativas de alfa y beta
que componen el eutéctico a temperatura ambiente difieren
ligeramente de las obtenidas después de la
transformación eutéctica.
Si tomamos por otro lado cualquier aleación que
no llegue a cortar a la línea del eutéctico,
seguirá en su solidificación un proceso igual a la
de cualquier aleación del tipo de solubilidad total, es
decir comenzará a solidificar una solución
sólida rica en uno de los componentes dependiendo si no
encontramos a uno u otro extremo del diagrama de equilibrio,
quedando un líquido rico en el otro que disminuye al
disminuir la temperatura hasta que llega al punto de final de la
solicitación donde todo el liquido se ha cristalizado en
una solución sólida. Si tomamos por último
una aleación que se encuentre dentro de la línea
que define el eutéctico, como se puede observar por el
diagrama de equilibrio lo que comienza a solidificar es un
solución sólida proeutéctica (alfa o beta
dependiendo si tenemos una aleación hipo o
hipereutéctica respectivamente), quedando al llegar a la
temperatura de la transformación eutéctica un
líquido de composición eutéctica que se
transformará por tanto en la mezcla eutéctica
(a+ß). Debido al cambio de solubilidad que presenta un
componente en otro las cantidades relativas de cada
solución en el eutéctico variará, como se
comentó anteriormente, a temperatura ambiente. A
continuación se muestra sobre un diagrama de equilibrio de
éste tipo cuáles son los constituyentes o
estructura de las aleaciones que se dan en cada zona del
diagrama.
Diagrama de equilibrio de aleaciones
totalmente solubles en estado liquido e insolubles en estado
sólido:
Los sistemas que presentan un diagrama de fase como el
antes descrito se llaman sistemas eutécticos
simples. Algunos de ellos son los sistemas Pb-Sb,
benceno-naftaleno, Si-Al, KCl-AgCl, Bi-Cd, C6H6-CH3Cl y
cloroforma-anilina.
Sean A y B dos sustancias miscibles en todas
proporciones en la fase líquida y completamente
inmiscibles en fase sólida. La mezcla de cantidades
arbitrarias de los líquidos A y B origina un sistema
monofásico que es una disolución de A y B. Como los
sólidos A y B son completamente insolubles entre
sí, el enfriamiento de la disolución líquida
de A y B ocasiona que A o B se congelen, abandonando la
disolución.
Una forma común de este tipo de diagramas es,
donde TA y TB son los puntos de congelación de A puro y B
puro.
En el límite de baja temperatura, existe una
mezcla bifásica del sólido puro A y el
sólido puro B, ya que los sólidos son inmiscibles.
En el límite de temperatura elevada existe una
única fase formada por la disolución líquida
de A y B, ya que los líquidos son miscibles.
La curva DE da el descenso del punto de
congelación de A por la presencia del soluto B.
CFGE es la curva de descenso del punto de
congelación de B por el soluto A.
Las dos curvas del punto de congelación se
interceptan en el punto E. Este punto (E) es el punto
eutéctico ("que funde con facilidad").
Si se parte del punto R de la figura, y se enfría
isobáricamente una disolución de A y B de
composición XA. El sistema es cerrado, por lo que la
composición global permanece constante y se desciende
verticalmente desde el punto R. Cuando T alcanza T1, empieza a
aparecer el sólido B separado de la disolución.
Cuando B se congela, el valor de XA, aumenta y (como A es ahora
el soluto) el punto de congelación disminuye aún
más. A una temperatura T2, existe un equilibrio entre una
disolución cuya composición viene dada como XA por
el punto G y el sólido B, cuya composición viene
dada por el punto I con XA=0. Los extremos de la línea de
conjunción (GHI) dan las composiciones de las dos fases en
equilibrio.
Si T continúa disminuyendo se alcanza finalmente
la temperatura eutéctica T3 en el punto K. En ese
punto la disolución tiene una composición XA (punto
E), y tanto A como B se congelan, por lo que ambos sólidos
aparecen cuando se enfría una disolución de
composición eutéctica. El resto de la
disolución se congela también a la temperatura T3.
En el punto K existen tres fases en equilibrio
(disolución, sólida A y sólido B), por lo
que no se puede aplicar la regla de la palanca. Con tres fases se
tiene 1 grado de libertad (F= 2- 3+2=1), este grado de libertad
se elimina si se considera P constante e igual a 1atm. Por lo que
no existen grados de libertad para el sistema trifásico, y
la temperatura T3 permanece constante hasta que toda la
disolución se haya congelado y el número de fases
se reduzca a
2. Por debajo de T3 se enfría una mezcla de
sólido A y sólido B (punto S).
Si se invierte el proceso y se parte desde el punto S
con A y B sólidos, el primer líquido que se forma
tendrá la composición eutéctica XA. El
sistema se mantiene en el punto K hasta que se haya fundido todo
A más la cantidad suficiente de B necesaria para formar
una disolución de composición eutéctica.
Luego, el sólido B restante se funde entre las
temperaturas T3 y T1. Una mezcla sólida que posea la
composición eutéctica fundirá completamente
a una sola temperatura, la T3. Una disolución de A y B con
la composición eutéctica congela a la temperatura
T3. Pero, una mezcla eutéctica no es un compuesto, sino
una mezcla íntima de cristales de A y cristales de
B.

Importancia de los diagramas de
fases:
Los diagramas de fase son de gran importancia en la
ingeniería de materiales, pues apoyan, entre otros,
estudios de solidificación, microestructura, metalurgia
física y diseño de nuevos materiales.
También lo son en la práctica general de
ingeniería relacionada de algún modo con la
manipulación y el procesamiento de materiales, donde
permiten relacionar los procesos de obtención con la
estructura y ésta con propiedades de diseño y de
este modo concebir y optimizar dichos procesos para obtener el
producto deseado.
Teóricamente los diagramas de fase pueden ser
obtenidos mediante relaciones termodinámicas, pero en la
práctica el modelado preciso es bastante complejo y en la
mayoría de los casos se necesitan datos
termodinámicos que muchas veces no están
disponibles. Por esta razón suelen usarse relaciones
relativamente simples como base de modelos que pueden ser
sensiblemente mejorados con la ayuda de técnicas
computacionales y de disciplinas como la termodinámica
estadística. Los modelos termodinámicos que
permiten obtener los diagramas de fase son de gran importancia ya
que los datos experimentales no son totalmente confiables, bien
porque se obtuvieron con técnicas poco precisas o porque,
en general, hay poca precisión en la región de baja
temperatura debido a que en estas condiciones la difusión
es muy lenta y tomaría muchísimo tiempo alcanzar el
equilibrio.
Diagrama de
hierro-carbón
En el diagrama de equilibrio Fe-C, se representan las
transformaciones que sufren los aceros al carbono con la
temperatura, admitiendo que el calentamiento (o enfriamiento) de
la mezcla se realiza muy lentamente de modo que los procesos de
difusión (homogeneización) tienen tiempo para
completarse. Dicho diagrama se obtiene experimentalmente
identificando los puntos críticos (temperaturas a las que
se producen las sucesivas transformaciones) por métodos
diversos.
El diagrama hierro-carbono nos sirve para saber donde se
funden los metales y que porcentaje de carbono tiene cada
metal.
Los aceros eutectoides son aquellos en los que la fase
austenitica sólida tiene composición del eutectoide
0,77%
Los aceros hipereutectoides son aquellos en los que la
fase austenítica sólida tiene un contenido en
carbono entre 0,77% y 0,022%.
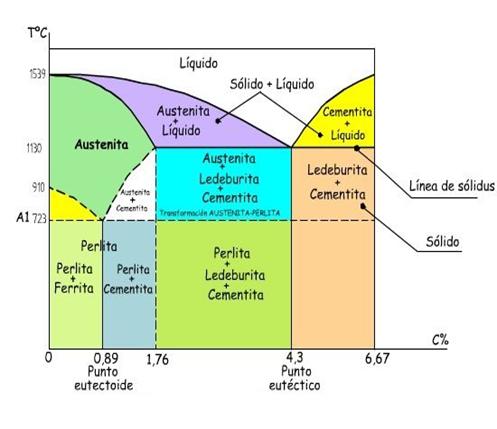
Principales metales que conforman el diagrama
Fe-C:



Técnicas de
enfriamiento:
Es una operación o combinación de
operaciones que comprenden el calentamiento o enfriamiento del
material, con el fin de mejorar algunas propiedades, en
relación con la condición original del material. El
objetivo de los tratamientos térmicos es:
Conseguir una estructura de menor dureza y mayor
maquinabilidad.Eliminar la acritud (la acritud aumenta la
fragilidad) que originó un mecanizado en
frio.Eliminar las tensiones internas originada por la
deformación de la red cristalina (las cuales elevan la
dureza y fragilidad).Conseguir la homogeneización de la estructura
de una pieza.Conseguir la máxima dureza y
resistencia.Mejorar la resistencia a los agentes
químicos.Modificar algunas propiedades
magnéticas.
Clasificación de las técnicas
de enfriamiento:
Temple: su finalidad es el aumento de la
dureza y de la resistencia mecánica, la
disminución de la tenacidad (la tenacidad aumenta la
fragilidad), la disminución del alargamiento unitario
y la tenacidad (implica mayor fragilidad) y la
modificación de algunas propiedades físicas y
químicas: magnetismo, resistencia eléctrica y
resistencia a ciertos ácidos. La velocidad de
enfriamiento es muy rápida para conseguir estructura
martensítica, en un medio como agua, aceite,
etcétera.
El vidrio templado es un ejemplo un material creado por
esta técnica. Para fabricar vidrio templado
térmicamente, el vidrio flotado se calienta gradualmente
hasta una temperatura de reblandecimiento de entre 575 y 635
grados Celsius para después enfriarlo muy
rápidamente con aire. De esta manera se consigue que el
vidrio quede expuesto en su superficie a tensiones de
compresión y en el interior esfuerzos de tensión,
confiriéndole mayor resistencia estructural y al impacto
que el vidrio sin tratar, teniendo la ventaja adicional de que en
caso de rotura se fragmenta en pequeños trozos inofensivos
(por lo cual se le considera uno de los tipos de vidrio de
seguridad). Todas las manufacturas, ya sean cortes de
dimensiones, canteados o taladros deberán ser realizadas
previamente al templado. De realizarse posteriormente, se
provocaría la rotura del vidrio.
Revenido: su finalidad es aumentar la
plasticidad, tenacidad, alargamiento, resilencia y
estricción, la disminución de la fragilidad y
la disminución de la resistencia mecánica,
dureza y límite elástico.
La velocidad de enfriamiento más bien
rápido (menor que el temple).
Recocido: su finalidad es
homogeneizar la estructura interna (elimina tensiones
internas), conseguir una microestructura específica,
aumentar la plasticidad, tenacidad y ductilidad, facilitar el
mecanizado, eliminar la acritud que produce el trabajo en
frio, aumentar el alargamiento, aumentar la
extricción, disminuir la tensión de rotura,
disminuir el límite real de elasticidad, disminuir la
dureza y en general suprimir los defectos del temple. La
velocidad de enfriamiento lento hasta temperatura ambiente,
generalmente en el horno en que se calentó. Esta
técnica se utiliza, por ejemplo, en el ablandamiento
de aceros aleados para herramientas de más de 0.8% de
C.Normalizado: su finalidad es
eliminar los defectos de un tratamiento defectuoso, eliminar
tensiones interna y uniformizar el tamaño del grano.
La velocidad de enfriamiento es al aire en calma.
Aceros
El Acero es básicamente una aleación o
combinación de hierro y carbono (alrededor de 0,05%
hasta menos de un 2%). Algunas veces otros elementos de
aleación específicos tales como el Cr (Cromo) o Ni
(Níquel) se agregan con propósitos
determinados.
Ya que el acero es básicamente hierro altamente
refinado (más de un 98%), su fabricación comienza
con la reducción de hierro (producción de arrabio)
el cual se convierte más tarde en acero.
El acero conserva las características
metálicas del hierro en estado puro, pero la
adición de carbono y de otros elementos tanto
metálicos como no metálicos mejora sus propiedades
físico-químicas.
Los dos componentes principales del acero se encuentran
en abundancia en la naturaleza, lo que favorece su
producción a gran escala. Esta variedad y disponibilidad
lo hace apto para numerosos usos como la construcción de
maquinaria, herramientas, edificios y obras públicas,
contribuyendo al desarrollo tecnológico de las sociedades
industrializadas. A pesar de ello existen sectores que no
utilizan acero (como la construcción aeronáutica),
debido a su densidad (7.850 kg/m³ de densidad en
comparación a los 2.700 kg/m³ del aluminio, por
ejemplo).
Clasificación del
acero:
Los diferentes tipos de acero se clasifican
de acuerdo a los elementos de aleación que producen
distintos efectos en el Acero :
Aceros al carbono: Más del 90% de
todos los aceros son aceros al carbono. Estos aceros
contienen diversas cantidades de carbono y menos del 1,65% de
manganeso, el 0,60% de silicio y el 0,60% de cobre. Entre los
productos fabricados con aceros al carbono figuran
máquinas, carrocerías de automóvil, la
mayor parte de las estructuras de construcción de
acero, cascos de buques, somieres y horquillas.
Aceros aleados: Estos aceros contienen una
proporción determinada de vanadio, molibdeno y otros
elementos, además de cantidades mayores de manganeso,
silicio y cobre que los aceros al carbono normales. Estos
aceros de aleación se pueden subclasificar
en:
Estructurales | Son aquellos aceros que se emplean | ||
Para Herramientas | Aceros de alta calidad que se emplean | ||
Especiales | Los Aceros de Aleación | ||
Aceros de baja aleación
ultrarresistentes: Esta familia es la más reciente
de las cuatro grandes clases de acero. Los aceros de baja
aleación son más baratos que los aceros aleados
convencionales ya que contienen cantidades menores de los
costosos elementos de aleación. Sin embargo, reciben
un tratamiento especial que les da una resistencia mucho
mayor que la del acero al carbono. Por ejemplo, los vagones
de mercancías fabricados con aceros de baja
aleación pueden transportar cargas más grandes
porque sus paredes son más delgadas que lo que
sería necesario en caso de emplear acero al carbono.
Además, como los vagones de acero de baja
aleación pesan menos, las cargas pueden ser más
pesadas. En la actualidad se construyen muchos edificios con
estructuras de aceros de baja aleación. Las vigas
pueden ser más delgadas sin disminuir su resistencia,
logrando un mayor espacio interior en los
edificios.Aceros inoxidables: Los aceros inoxidables
contienen cromo, níquel y otros elementos de
aleación, que los mantienen brillantes y resistentes a
la herrumbre y oxidación a pesar de la acción
de la humedad o de ácidos y gases corrosivos. Algunos
aceros inoxidables son muy duros; otros son muy resistentes y
mantienen esa resistencia durante largos periodos a
temperaturas extremas. Debido a sus superficies brillantes,
en arquitectura se emplean muchas veces con fines
decorativos. El acero inoxidable se utiliza para las
tuberías y tanques de refinerías de
petróleo o plantas químicas, para los fuselajes
de los aviones o para cápsulas espaciales.
También se usa para fabricar instrumentos y equipos
quirúrgicos, o para fijar o sustituir huesos rotos, ya
que resiste a la acción de los fluidos corporales. En
cocinas y zonas de preparación de alimentos los
utensilios son a menudo de acero inoxidable, ya que no
oscurece los alimentos y pueden limpiarse con
facilidad.
Conclusión
Los éxitos obtenidos en la producción de
nuevos aceros empezaron a extenderse a los materiales como los
polímeros y las cerámicas, obligando a crear nuevas
investigaciones sobre las propiedades de la materia.
En las investigaciones destaca la búsqueda de
propiedades específicas orientadas a lograr la eficiencia
global de los procesos, se incide así en aspectos como la
resistencia a las altas temperaturas, la resistencia
mecánica, la resistencia a la corrosión, así
como una mayor eficiencia energética, a la par de
reducciones en la densidad y en peso, o bien, capacidades
conductoras ampliadas, texturas, transparencia, etc. Estas
características se han logrado obtener por combinaciones y
procesos.
Los diagramas de fases son de gran utilidad para estas
investigaciones. Debido a que al aplicarle a un material cierto
tratamiento térmico (temple, recocido, revenido o
normalizado), el diagrama de fases ayuda a predecir, por ejemplo,
a que temperatura el material lograría la
solidificación, a que temperatura fundiría, a que
temperatura lograría el equilibrio cierta aleación,
averiguar la solubilidad, etc.
En muy diversas formas, la creación y
difusión de nuevos materiales ha llevado a estos a ocupar
mercados que por muchos años fueron exclusivos,
principalmente de metales tradicionales. Uno de los ejemplos
más claros se ha dado en la industria del cobre, donde los
principales sectores tradicionalmente basados en este metal han
sufrido gradualmente la inserción de los plásticos,
el aluminio y la fibra óptica, por mencionar sólo
algunos materiales.
El mayor desplazamiento del cobre se ha producido en
ciertas áreas del sector eléctrico. Una de ellas,
es la de las comunicaciones a distancia, con alta densidad de
mensajes/información. Allí se ha preferido la fibra
óptica por su capacidad para transmitir grandes
volúmenes de información. A partir de la
década de los noventa ésta se ha constituido como
parte importante del sistema de comunicaciones a distancia entre
países y al interior de algunos de ellos. Sin embargo,
dado que este tipo de uso representa menos del 10% del cobre
consumido en telecomunicaciones, el impacto puede ser graduado.
Aunque podría ser distinto si la fibra óptica
penetrase el sistema domiciliario, que consume el resto del
cobre. Aunque esto es poco probable, pues el alto costo de la
fibra óptica sólo justifica su uso en aquellos
casos en que se requiere manejar un gran volumen de
información.
Autor:
Ana Ramírez
Ángel Manzanillo
Wilfredo Estrada
Jorley López
Daniel Bermúdez
Prof.: Omer Padrón
República Bolivariana de
Venezuela.
Ministerio del Poder Popular para la
Educación superior.
I.U.P. Santiago Mariño.
Maracaibo- Edo. Zulia.
