Evaluación electroquímica de soluciones acuosas de jugos de frutas – Inhibidores de corrosión
Objetivos de la
monografía
Objetivo General
Realizar la selección de diferentes compuestos
orgánicos, con características de inhibición
de la corrosión, utilizando técnicas de
electroquímica.
Objetivos Específicos
Proponer una método que permita seleccionar
los compuestos adecuado para desarrollar inhibidores de
corrosiónEvaluar la respuesta electroquímica que
presentan los compuestos orgánicos (jugo de frutas de
corredor andino), utilizando la técnica de
polarización potencio dinámica.Evaluar la eficiencia del jugo de frutas como
inhibidores de corrosión a través de las
corrientes de las corrientes de corrosión.Determinar las características de los jugos
naturales que pudieran ser precursores para la
síntesis de inhibidores de corrosión, de
acuerdo con los resultados obtenidos por las técnicas
electroquímicas y tomando en cuenta su estructura
química.
CAPÍTULO 1
Resumen
La corrosión es una de los principales problemas
que causan pérdidas económicas en el ámbito
industrial. La industria petrolera no está exenta de este
fenómeno.
La perdida de una pequeña porción del
material representa una pérdida millonaria anualmente, por
el efecto de la corrosión de tuberías, codos,
empaques o cualquier otro material metálico que se
encuentre en contacto con el medio ambiente.
El uso de inhibidores de corrosión ha
proporcionado, por mucho tiempo, una solución a los
daños ocasionados por la corrosión de la industria
petrolera, sin embargo, debido a la gran cantidad de ambientes
corrosivos, la selección de un inhibidor de
corrosión es un trabajo duro. Ya que existe una gran
variedad de inhibidores, y su elección dependerá
del tipo de metal que se quiera proteger, de la
corrosión.
El diseño, desarrollo y selección de los
inhibidores de corrosión para este tipo de medios, es un
trabajo que requiere de mucho conocimiento, en las
técnicas experimentales utilizadas para la
evaluación del porcentaje de inhibición, que
generalmente se ven afectadas por el medio usado y las etapas
predominantes, del mecanismo global de
corrosión.
Actual mente el campo de desarrollo de inhibidores se
encuentra en la etapa de evaluación de diferentes
compuestos heterocíclicos, con fuertes
características inhibidoras de corrosión, los
cuales promete ser una excelente materia prima para el desarrollo
de inhibidores de corrosión eficiente.
Los jugos de frutas del corredor andino tienen una gran
cantidad de compuestos heterocíclicos por lo que les hacen
un buena fuente de para producir un inhibidor de corrosión
que es orgánico y amigable con el ambiente.
Introducción
Los metales están constantemente expuestos a la
acción de la atmósfera, que como se sabe,
está compuesta principalmente de 79 partes de
nitrógeno y 21 partes de oxígeno. Como el
nitrógeno es un gas muy poco activo, puede decirse que
prácticamente inerte, toda la acción
atmosférica depende de la actividad del oxígeno,
que no es mucha por estar en estado molecular (con enlaces
homopolares formando moléculas de O2).
Y como, por otra parte, los metales son muy estables,
resulta que, sin la intervención de otro agente, la
acción del oxigeno solo sobre los metales resulta muy
débil. Los agentes colaboradores del oxigeno son
principalmente dos: el calor y la humedad.
El oxígeno con el calor produce la
oxidación de los metales. Y el oxígeno con la
humedad produce la corrosión.
Ambos procesos son completamente distintos, aunque se
emplean generalmente protecciones comunes para
prevenirlos.
Conceptos Fundamentales
Corrosión
Se define la corrosión, en general, como la
destrucción lenta y progresiva de un metal por la
acción de un agente exterior. Uno de los factores que
limitan la vida de las piezas metálicas en servicio es el
ataque químico o físico-químico que sufren
en el medio que les rodea.
Los metales están continuamente expuestos a la
acción atmosférica, que, como ya se ha dicho,
está compuesta principalmente de 79 partes de
nitrógeno y 21 partes de oxígeno. También
sabemos que el nitrógeno es un gas prácticamente
inerte, por lo que la acción atmosférica depende
prácticamente del oxígeno. Los metales son por lo
general bastante estables por lo que sin colaboración de
otro agente la acción del oxígeno sobre estos es
muy débil.
Tipos de Corrosión
Corrosión atmosférica: Es la
producida por la acción combinada del oxigeno del aire
y la humedad. Pero existe también la corrosión
química, producida por la acción de los
ácidos y los álcalis.La corrosión por acción
electroquímica: Es la que tiene lugar sobre los
metales expuestos a la atmósfera húmeda, o
sumergidos en agua, o enterrados. Este tipo de
corrosión se refiere, principalmente, a los casos en
que el metal es atacado por el agente corrosivo en presencia
de un electrolito. Esta clase de corrosión puede
producirse sin fuerza electromotriz exterior, constituyendo
la corrosión galvánica, y por la acción
además, de una fuerza electromotriz exterior,
constituyendo la corrosión electroquímica,
propiamente dicha.La corrosión química Es la
producida por los ácidos y álcalis, y tiene
interés para la construcción de aparatos
resistentes a la corrosión de los productos
químicos que intervienen en el proceso de
fabricación.La corrosión bioquímica:
Producida por bacterias, suele tener lugar en objetos
metálicos enterrados. Es específica de cada
metal o aleación. Las bacterias no atacan directamente
a los metales; sin embargo, pueden estimular reacciones que
destruyen capas protectoras de la corrosión.
Así, en las tuberías de hierro, la pared
interior se recubre de una fina película de
hidróxido de hierro calcáreo, que le protege,
pero ciertas bacterias aerobias, como la gallionella
ferruginea, oxidando los iones ferrosos a férricos se
provee de la energía necesaria para asimilar el CO2 y
formar su materia orgánica, al mismo tiempo que
disminuye el pH e impiden la formación de la
película protectora, con lo que se produce una
corrosión localizada.
1.3.2. Corrosión
Electroquímica
La corrosión electroquímica es un proceso
espontáneo que denota siempre la existencia de una zona
anódica (la que sufre la corrosión), una zona
catódica y un electrolito, y es imprescindible la
existencia de estos tres elementos, además de una buena
unión eléctrica entre ánodos y
cátodos, para que este tipo de corrosión pueda
tener lugar. La corrosión más frecuente siempre es
de naturaleza electroquímica y resulta de la
formación sobre la superficie metálica de multitud
de zonas anódicas y catódicas; el electrolito es,
en caso de no estar sumergido o enterrado el metal, el agua
condensada de la atmósfera, para lo que la humedad
relativa deberá ser del 70%.
El proceso de disolución de un metal en un
ácido es igualmente un proceso electroquímico. La
infinidad de burbujas que aparecen sobre la superficie
metálica revela la existencia de infinitos cátodos,
mientras que en los ánodos se va disolviendo el metal. A
simple vista es imposible distinguir entre una zona
anódica y una catódica, dada la naturaleza
microscópica de las mismas (micropilas galvánicas).
Al cambiar continuamente de posición las zonas
anódicas y catódicas, llega un momento en que el
metal se disuelve totalmente.
Las reacciones que tienen lugar en las zonas
anódicas y catódicas son las
siguientes:

Ya que la corrosión de los metales en ambientes
húmedos es de naturaleza electroquímica, una
aproximación lógica para intentar parar la
corrosión sería mediante métodos
electroquímicos. Los métodos electroquímicos
para la protección contra la corrosión requieren de
un cambio en el potencial del metal para prevenir o al menos
disminuir su disolución.
La protección catódica, en este sentido,
es un tipo de protección (electroquímico) contra la
corrosión, en el cual el potencial del electrodo del metal
en cuestión se desplaza en la dirección negativa.
Los principios de la protección catódica pueden
ilustrarse mediante un diagrama termodinámico
potencial – pH, como se muestra en la figura 10, en
el caso del hierro (Fe).
1.3.3. Formas de
Corrosión
Corrosión uniforme: La
corrosión uniforme se caracteriza por un ataque
corrosivo sobre toda la superficie, o una gran parte de la
superficie. La corrosión uniforme se presenta cuando
el material no exhibe diferencias en su microestructura y el
ambiente que lo rodea tiene una composición uniforme.
Toda el área superficial se corroe a la misma
velocidad y podemos predecir la pérdida de material en
un cierto período de tiempo. El hecho de que el
daño que se produce sea previsible hace que la
corrosión uniforme sea menos seria que la
localizada.Corrosión galvánica: Es
un proceso electroquímico en el que
un metal se corroe preferentemente cuando
está en contacto eléctrico con un tipo
diferente de metal (más noble) y ambos metales se
encuentran inmersos en un electrolito o medio
húmedo.1 Por el contrario, una reacción
galvánica se aprovecha
en baterías y pilas para generar
una corriente eléctrica de
cierto voltaje. Un ejemplo común es la pila
de carbono-zinc donde el zinc se corroe
preferentemente para producir una corriente.
La batería de limón es otro ejemplo
sencillo de cómo los metales diferentes reaccionan
para producir una corriente eléctrica.Corrosión por grietas: Más
conocida por el nombre que se le da en inglés:
corrosion crevice, es un fenómeno corrosivo que ocurre
en espacios en los cuales el acceso del fluido con el que se
está trabajado en el medio ve limitada su
difusión. Estos espacios son llamados
comúnmente como "rendijas", también se les
conoce con el nombre que se les da en inglés, es
decir, "crevices". Ejemplos de rendijas son los espacios y
áreas de contactos entre piezas, en juntas o sellos,
dentro de cavidades, grietas y costuras.Corrosión por picaduras o pitting: Es
el ataque localizado (picaduras) que produce
penetración en el acero inoxidable. El pitting se
asocia con la discontinuidad local del film de
pasivación, puede ser debido a condiciones extremas de
agentes corrosivos o a imperfecciones mecánicas, tales
como partículas extrañas, daño en la
superficie del material, o por fallas en la película
de óxido de cromo. El fenómeno ocurre cuando se
rompe la capa pasivante y hay un ataque muy localizado. Es
posible prevenir o retardar este efecto utilizando aceros
inoxidables con contenido de molibdeno.Corrosión intergranular:
También conocida como ataque
intergranular (IGC y IGA por sus siglas en
inglés), es un fenómeno corrosivo que
sucede en los aceros inoxidables, el mismo consiste
en una decarburización del acero debido a un
fenómeno difusivo del carbono hacia los bordes de
grano, en el proceso el carbono arrastra átomos de
cromo, lo cual hace que el acero pierda sus propiedades
anticorrosivas. Este fenómeno es característico
de los aceros inoxidables, sin embargo se puede presentar en
otras aleaciones resistentes a la
corrosión.Corrosión selectiva: La
disolución selectiva es la eliminación
preferencial de un elemento de una aleación
sólida por procesos corrosivos. El ejemplo más
común de este tipo de corrosión es la
descincificado que tiene lugar en los latones, consistente en
la eliminación selectiva del cinc que está
aleado con cobre. Procesos similares también ocurren
en otras aleaciones, como la pérdida observable de
níquel, estaño y cromo de las aleaciones de
cobre; de hierro en hierro fundido, de níquel en
aceros y de cobalto en las estelitas.Corrosión por erosión: Es el
efecto producido cuando el movimiento de un
agente corrosivo sobre una superficie
de metal acelera sus efectos destructivos a causa
del desgaste mecánico. La importancia
relativa del desgaste mecánico y de la
corrosión es a menudo difícil de determinar, y
varía considerablemente de una situación a
otra. El papel de la erosión se atribuye
generalmente a la eliminación de películas
superficiales protectoras: por ejemplo, las películas
protectoras formadas por el óxido generado
por el aire. Un metal oxidado ralentiza su deterioro porque
la superficie ya oxidada dificulta que el interior
continúe oxidándose. Si por ejemplo el polvo o
la arena, impulsadas por el viento, eliminan esa capa
exterior de óxido, el metal continuará
deteriorándose al haber perdido su
protección.Corrosión bajo tensión: Es un
proceso en el que la combinación de carga
mecánica, ambiente corrosivo y temperaturas elevadas
pueden llevar al deterioro. Surgen delgadas grietas,
que pueden extenderse bastante rápido, llegando al
fallo de alguna parte e incluso de la estructura
completa. Las grietas son difícilmente visibles
en la superficie y difíciles de detectar con un examen
visual.
1.3.4. Formas de Combatir la
Corrosión
La lucha contra la corrosión es un problema muy
complejo, debido al gran número
De factores que entran en juego; por tanto, cada caso
específico requiere un tratamiento particular y no es
posible encontrar soluciones generales.
Se procurará proyectar la estructura de manera
que por su forma o el ambiente en que se encuentre no se
favorezcan las circunstancias corrosivas. Se tratará de
evitar las zonas de estacionamiento de líquidos, las
uniones remachadas, el contacto de metales muy separados en la
serie galvánica, ángulos vivos, zonas con acritud,
etc.
1.3.4.1. Inhibidores de
Corrosión
Producto químico, constituido generalmente
por mezclas de substancias nitrogenadas o fosforadas, usado en
el carburante para limitar o evitar el fenómeno
de la corrosión en las partes metálicas del sistema
de alimentación.Ejerce su función ya sea
manteniendo en suspensión el agua (en forma de
minúsculas gotas o partículas) o bien formando una
película protectora sobre las paredes metálicas. La
formación de óxido en el sistema de
alimentación de
la gasolina (depósito carburador y
colector) puede crear algunos problemas, como la
obstrucción del filtro y de los surtidores del
carburador.Algunos inhibidores de corrosión poseen
también propiedades detergentes y "antiicing' Esos
inhibidores deben emplearse con cautela, ya que, en presencia de
notables cantidades de agua, pueden formar emulsiones
indeseables.
1.3.4.2. Protección por el Empleo de
Inhibidores
Un inhibidor es una sustancia que se añade,
generalmente en proporción muy pequeña, a un medio
corrosivo, para detener o disminuir la velocidad de la
corrosión formando un compuesto protector insoluble sobre
la superficie del metal, bien sea catódica o
anódica.
Los inhibidores se emplean mucho en el decapado
ácido, para disminuir la velocidad de ataque del metal a
decapar sin interferir la eliminación de la capa de
oxido.
El principio de funcionamiento de los inhibidores es
formar en la superficie misma del metal expuesto a
corrosión, ya sea un compuesto insoluble o la
fijación de una determinada materia orgánica, con
el objetivo de polarizar la celda de corrosión y disminuir
la velocidad de degradación del metal. Los inhibidores
pueden clasificarse en pasivantes, anódico y
catódicos.
Inhibidores
anódicos.
Los inhibidores anódicos reaccionan sobre las
partes anódicas del metal, formando un compuesto
protector. Se emplean como inhibidores anódicos el
carbonato sódico, el bicarbonato sódico, el fosfato
sódico, el silicato sódico y el cromato
sódico. También se emplea el bicromato
potásico en la proporción de 0,2 por
ciento.
Los inhibidores anódicos producen una velocidad
de corrosión pequeña, con alto potencial de
electrodo.
Figura 1.3.4.2-1
Inhibidores
Anódicos

Fuente:
http://www.slideshare.net/acazro/inhibidores-de-la-corrosion
Inhibidores
catódicos.
Los inhibidores catódicos forman compuestos
protectores sobre el cátodo, empleándose para este
fin sulfato de magnesio, de níquel y de cinc. Los
inhibidores catódicos se utilizan para evitar la
corrosión del acero en aguas neutras.
Existen otros inhibidores denominados de
absorción, que son sustancias coloidales
Que se fijan sobre el metal. Entre estos pueden citarse
la gelatina, el tanino, el agar-agar, etc.
Inhibidores pasivantes
Estos causan un cambio de potencial de corrosión,
forzando la superficie metálica a presentar una conducta
pasiva ante la corrosión. Los ejemplos de los inhibidores
que provocan pasividad son aniones oxidantes, tales como iones de
cromato, del nitritos, y del nitratos y los no oxidantes tales
como fosfatos y molibdatos.
Protección por el empleo de
pasivadores.
En algunos casos se forma una película en la
superficie del metal que detiene la corrosión apenas
iniciada. Se dice entonces que estos metales tienen
pasividad natural contra la corrosión en
el medio que ocurre esto. También puede conseguirse la
pasividad tratando previamente el metal, y entonces se dice que
la pasividad ha sido provocada por un pasivadores. Un
ejemplo de pasividad provocada es la que se
obtiene sumergiendo una pieza de acero en ácido
nítrico concentrado, resultando así inatacable por
el ácido nítrico diluido, que sin esta
pasivación lo ataca fácilmente.
No se conocen bien las causas de la pasivación,
pero se atribuye, en general, o bien a la formación de
películas gaseosas protectoras, generalmente de
oxígeno e hidrogeno, o bien a la formación de
películas sólidas, generalmente de óxidos,
que protegen el metal, como ocurre con el aluminio, que posee
pasividad natural.
Los pasivadores mas empleados son el minio y el cromato
de cinc, ambos muy usados como impregnadores de las piezas de
acero antes de aplicar cualquier pintura sobre ellos.
Minio
El minio es oxido de plomo (Pb3 O4), y es quizá
el pigmento pasivador más empleado.
Cromato de Cinc
El cromato de cinc (Cr O4 Zn) transforma los iones
ferrosos generados en el agua en férricos, produciendo una
capa bastante insoluble, en el ánodo, de bióxido
férrico.
La diferencia entre un pasivador como el minio, por
ejemplo, y una pintura antioxidante, preparada.
Figura 1.3.4.2-2
Inhibidores Pasivantes.

Fuente:
http://www.slideshare.net/acazro/inhibidores-de-la-corrosion
Inhibidores
orgánicos
Los inhibidores orgánicos son generalmente
protectores en soluciones neutrales o alcalinas, pero ofrecen
poco o nula protección en ácidos, salmueras medios
reductores. En tales circunstancias, los compuestos
orgánicos polares y los materiales orgánicos
coloidales son más utilizados como inhibidores. Los
inhibidores orgánicos protegen al metal mediante una
película hidrofobia en la superficie del metal. Los
inhibidores serán fijados por adsorción
según la carga iónica del ion y la carga de la
superficie.
Figura 1.3.4.2-3
Inhibidor
Orgánico

Fuente:
http://www.slideshare.net/acazro/inhibidores-de-la-corrosion
Tabla 1.3.4.2-1
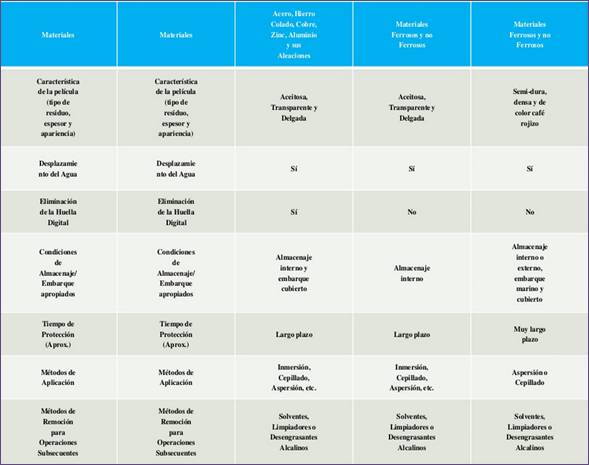
Fuente:
http://www.slideshare.net/acazro/inhibidores-de-la-corrosion
1.3.4.3. Inhibidores no Tóxicos y
Biodegradables
El desarrollo de inhibidores de corrosión no
tóxicos y compatibles con el medio ambiente es un
área de gran importancia en el campo de la ciencia y la
tecnología de la corrosión como alternativa al uso
de cromatos, altamente contaminantes.
Una de las estrategias posibles consiste en la
sustitución de dichas sustancias por compuestos que formen
una capa auto-esmaltable (SAM) sobre el metal a proteger,
preparadas a partir de compuestos no tóxicos y que puedan
fusionarse convenientemente según el uso final. En este
sentido, los desarrollos de SAM apuntan al empleo de
ácidos grasos y ácidos órganos como
inhibidores de corrosión en medios ácidos o
neutros.
1.3.4.4. Elección de un
Inhibidor
Los materiales que se van a proteger
Tiempo efectivo de protección
Método de aplicación
Tipo de protección requerida
Manejo de la pieza y eliminación de huella
dactilarTipo y espesor de recubrimiento deseado
Condiciones de almacenaje, empaque y/o
embarqueCondición de temperatura, humedad y
condiciones ambientalesMétodo de remoción
Interacción con el proceso subsecuente, si no
es removidoRequerimiento ambiental, de salud y
seguridadTipos de productos deseados Bases aceites/Solventes
o agua
1.3.5. Técnicas electroquímicas
para la determinación de la velocidad de
corrosión
La mayoría de los fenómenos de
corrosión que afectan a los materiales metálicos
son de naturaleza electroquímica, es decir, su desarrollo
implica transferencia de carga.
El desarrollo de métodos electroquímicos
permitió la detección precoz de la rotura de la
pasividad de las armaduras y la adopción de medidas
preventivas. Midiendo las variables eléctricas, es posible
determinar las velocidades de corrosión y otros
parámetros importantes.
Un gran avance tecnológico en este campo radica
en el hecho de poder hacer ensayos no destructivos e "in situ".
Como podremos ver a lo largo del presente trabajo, es posible la
determinación de velocidades de corrosión, mediante
combinación de técnicas electroquímicas, sin
la necesidad de tener que proceder a la polarización de
las muestras, lo que supondría la pérdida de
material al formarse los productos de corrosión, y el
ensayo de armaduras embebidas en mortero u hormigón, sin
la necesidad de tener que propiciar la reacción de
oxidación, que supondría dañar
permanentemente la armadura.
Dentro de las técnicas electroquímicas,
podemos obtener dos tipos de resultados:
Datos cualitativos: Nos aportan información
sobre las cualidades del sistema que estamos ensayando. Busca
la explicación de los diferentes aspectos de un
comportamiento. Responde a las preguntas de por qué y
el cómo.Datos cuantitativos: Permite examinar los datos de
manera numérica, apoyándose frecuentemente en
la estadística, buscando modelos
numéricos.
1.3.5.1 Técnicas Cualitativas
El método más utilizado es la medida del
potencial del sistema a circuito abierto. En combinación
con el pH del medio, el potencial de corrosión nos puede
orientar sobre los estados activos o pasivos de la
estructura.
No obstante, la variación de los potenciales de
corrosión es muy amplia en función del grado de
humectación de la red de poros del mortero u
hormigón, pudiendo inducir a graves errores en la
interpretación de los datos obtenidos. Este tipo de
ensayos nos dan información del estado del proceso de
corrosión pero es necesario la realización de
ensayos cuantitativos que nos ayuden a obtener mayor
información.
1.3.5.2. Técnicas Electroquímicas
Cuantitativas
Cualquier material metálico sumergido en un medio
corrosivo tiene un potencial característico en ausencia de
influencias externas, que se conoce como potencial de reposo o de
corriente cero (OCP). Externamente se puede actuar sobre el
elemento imponiéndole un potencial y registrando la
intensidad de corriente que circula por el sistema. Si restamos
al potencial aplicado al OCP, obtenemos la medida de la
modificación impuesta, lo que se conoce como
polarización, y a la relación que se establece
entre el potencial e intensidad, como curva de
polarización.
Existen dos métodos para la determinación
de las velocidades de corrosión, método de
intersección y el de resistencia a la polarización.
En ambos métodos se emplea la técnica de la
voltametría cíclica, que consiste en aplicar al
electrodo un proceso de carga y descarga, normalmente con un
mínimo de dos ciclos, comprobándose la respuesta
del potencial en función de la intensidad de carga
transmitida.
Para la realización del ensayo de
voltametría cíclica es necesario trabajar con tres
electrodos.
-Electrodo de trabajo: Es el elemento que
queremos ensayar, por lo que propiciaremos su proceso de
oxidación. Su nivel de Fermi estará por encima del
nivel del contraelectrodo para que la retirada de electrones
tenga lugar. Es necesario que el electrodo sea rotatorio para
eliminar las burbujas de aire que puedan existir en la
superficie, eliminar los productos de corrosión generados
que pueden interferir en los resultados y provocar el movimiento
de la disolución para que, por convección, el
oxígeno pueda penetrar hasta la zona que se está
polarizando.
– Contraelectrodo: Su función es propiciar
la reacción redox. Debe tener un nivel de Fermi por debajo
del nivel del electrodo de trabajo. Suelen utilizarse materiales
nobles, como el platino, o no polarizables, como el acero
inoxidable.
– Electrodo de referencia: Son elementos no
polarizables que mantienen un potencial eléctrico
constante independientemente de la naturaleza de la
disolución. Se suelen utilizar electrodo de
hidrógeno o calomelanos (conductor metálico de Ag
embebido en una disolución de haluro solubre de Ag y KCl).
En la gráfica nº podemos observar el doble ciclo de
carga-descarga aplicado al electrodo:
Figura 1.3.5.2-1
Fase de carga y descarga de electrodo
en ensayo de voltametría cíclica.

Fuente:http://www.uaeh.edu.mx/docencia/Tesis/icbi/licenciatura/documentos/Seleccion%20electroquimica.pdf
Donde E0 (v) es el potencial inicial, Emax (v) es el
potencial máximo aplicado y Emin (v) es el potencial
mínimo aplicado.
Las curvas de polarización nos aportan más
información, por ejemplo, si se trata o no de materiales
pasivables, ya que la forma de sus curvas es
característica, el riesgo de ataque por picaduras, a
través de la existencia de potenciales de ruptura, o el
efecto de factores múltiples de corrosión a
través de la modificación de las curvas.
Como principales ventajas de este tipo de
técnicas podemos enumerar:
– Tienen una gran sensibilidad.
– Nos permiten conocer la velocidad instantánea
de corrosión, al tratarse de métodos
diferenciales.
– Se reduce en gran medida los tiempos de ensayos, en
comparación con los métodos
gravimétricos.
– No es necesario modificar las condiciones del medio
(pH, temperatura, concentración de iones, etc.) para poder
obtener datos.
Desde el punto de vista cinético, en un sistema
donde tiene lugar la oxidación, existe un balance
equilibrado entre las reacciones anódicas y las
catódicas, dando lugar al potencial de equilibrio de la
reacción. El fenómeno de la polarización es
el desplazamiento del potencial de equilibrio. Una forma de
representar esta reacción de polarización de un
metal, es el diagrama de Evans, en el que se relaciona la
intensidad de corriente con el potencial aplicado, o el de Tafel,
cuando se representa el logaritmo de la intensidad con el
potencial.
Figura 1.3.5.2-2
Proceso de realización de un
diagrama de Evans.

Fuente: Corrosión de
armaduras embebidas en hormigón carbonatado. Materiales de
Construcción. Nº 181, pág. 50.
(1981)
Figura 1.3.5.2-3
Polarización de materiales.
Diagrama de Evans.

Fuente: Corrosión de
armaduras embebidas en hormigón carbonatado. Materiales de
Construcción. Nº 181, pág. 50.
(1981)
La base electroquímica del método
establece que la barrera de energía que debe vencerse en
la transferencia de carga es afectada por el campo
eléctrico.
1.4 Jugos Naturales
1.4.1. Composición de los jugos
naturales
Hay una gran variedad de frutas que se cultivan en el
corredor andino del ecuador. Durante todo el año hay una
gran producción de diferentes frutas por ejemplo, la
frutilla, manzana, papaya, tomate de árbol… se ofertan
en este mes en grandes cantidades y a bajos precios con respecto
a otras épocas del año. La frutilla y la manzana
son otros productos que tienen gran demanda, al igual que la
papaya y la piña. Estas frutas, aparte de ser ricas,
tienen un alto poder nutritivo y medicinal. Por ejemplo, la
piña ayuda a la circulación sanguínea; la
guayaba destaca por su alto contenido de vitamina C, superior a
los críticos, como la naranja. La composición
de las frutas es muy variada pero tienen unos componentes en
común como que está presente el acido
cítrico y que están formados por compuestos
heterocíclicos.
Constituye, en general, más del 80% del peso de
la porción comestible, oscilando entre un 82% en las uvas,
un 90% en las fresas y hasta un 93% en la
sandía.
Valor plástico
Viene dado en función de su contenido en
proteínas, que habitualmente representa menos del 1% del
peso fresco de las frutas. Las proteínas están
compuestas por aminoácidos, diez de los cuales (leucina,
isoleucina, valina, treonina, triptófano, metionia,
lisina, fenilalanina, histidina y arginina) son esenciales para
el ser humano. El término esencial hace referencia a que
el organismo no los puede producir por sí mismo y, por
tanto, debe obtenerlos necesariamente de la alimentación
cotidiana. Una proteína que contenga, en cantidad y
calidad, los diez aminoácidos esenciales se considera
completa o de alto valor biológico. En las frutas, las
proteínas son de bajo valor biológico. En los
cítricos y fresas abundan sustancias nitrogenadas simples
como la asparagina y la glutamina y los ácidos
aspártico y glutámico. En las manzanas y las peras
abunda la asparagina y las naranjas son ricas en
prolina.
Otros componentes no nutritivos pero
también importantes
Fibra: parte de la que aportan las frutas
son pectinas, un tipo de fibra soluble en agua que juega un papel
fundamental en la consistencia de las frutas y que, asimismo,
posee efectos beneficiosos para nuestra salud. La fibra en las
frutas frescas se encuentra en una proporción entre el
0,7% y el 4,7%. Las frutas con un menor contenido de agua o cuya
porción comestible contiene semillas, tienen valores de
fibra dietética más elevados. El contenido de fibra
se ve reducido con el pelado de la fruta. Así en las
manzanas, se reduce en un 11% y en las peras, alrededor del
34%.Ácidos orgánicos: (0,5% – 6%):
influyen en el sabor y aroma de las frutas. El ácido
cítrico (cítricos, fresas, peras…), potencia la
acción de la vitamina C y ejerce una acción
desinfectante y alcalinizadora de la orina. Otros ácidos
orgánicos de las frutas son el málico (manzanas,
cerezas, ciruelas, albaricoques) y el salicílico (fresas y
fresones), este último de acción anticoagulante y
antiinflamatoria.Elementos
fitoquímicos (colorantes, aromas y compuestos
fenólicos): a pesar de estar presentes en muy bajas
concentraciones, influyen decisivamente en la aceptación y
apetencia por las frutas, y muchos de ellos son, además,
antioxidantes que contribuyen a reducir el riesgo de enfermedades
degenerativas, cardiovasculares e incluso del
cáncer.
1.4.1.1. Composición Química de Algunos
Jugos de Frutas
Tabla 1.4.1.1-1
Composición del jugo de
piña

Fuente:http://www.uaeh.edu.mx/docencia/Tesis/icbi/licenciatura/documentos/Seleccion%20electroquimica.pdf
1.4.1.2. Compuestos
Heterocíclicos
Los compuestos
heterocíclicos son compuestos
orgánicos cíclicos en los que al menos
uno de los componentes del ciclo es de
un elemento diferente al carbono. Los
átomos distintos de carbono presentes en el ciclo se
denominan heteroátomos, siendo más comunes los
heteroátomos
de nitrógeno, oxígeno y azufre.
Ya que presentan cada una de los aminoácidos
presentes.
La química de los compuestos
heterocíclicos sigue siendo un campo activo en
la química orgánica. Mucha tención se
presta atención en la síntesis de compuestos
heterocíclicos de nitrógeno y el oxígeno.
Puede ser principalmente debido a su amplia gama de
síntesis biológica. Principalmente en el desarrollo
de medicamentos modernos y también hace hincapié en
la actividad biológica de la modificación de la
estructuras de los inhibidores.
Tabla 1.4.1.2-1
Composición de la
Zanahoria

Fuente:http://www.uaeh.edu.mx/docencia/Tesis/icbi/licenciatura/documentos/Seleccion%20electroquimica.pdf
Figura 1.4.1.2-1
Compuesto
Heterocíclico

Fuente:http://www.uaeh.edu.mx/docencia/Tesis/icbi/licenciatura/documentos/Seleccion%20electroquimica.pdf
Compuestos heterociclos presentes en el jugo de
frutas
Alcaloides
Se
llaman alcaloides (de álcali,
carbonatos de alcalinos, y -oide, parecido a,
en forma de) a aquellos metabolitos secundarios de las
plantas sintetizados, generalmente, a partir
de aminoácidos, que tienen en común su
hidrosolubilidad a pH ácido y su solubilidad en solventes
orgánicos a pH alcalino. Los alcaloides verdaderos derivan
de un aminoácido, son por lo tanto nitrogenados. Todos los
que presentan el grupo
funcional amina o imina son básicos.
La mayoría de los alcaloides poseen acción
fisiológica intensa en los animales aun a bajas dosis con
efectos psicoactivos, por lo que son muy usados en medicina
para tratar problemas de la mente y calmar el dolor.
Ejemplos conocidos son la cocaína, la morfina,
la atropina, la colchicina,
la quinina, cafeína, la estricnina y
la nicotina.
Sus estructuras químicas son variadas.1 Se
considera que un alcaloide es, por definición, un
compuesto químico que posee un nitrógeno
heterocíclico procedente del metabolismo de
aminoácidos; de proceder de otra vía, se define
como pseudoalcaloide.
Figura 1.4.1.2-2
Alcaloide

Fuente:http://www.uaeh.edu.mx/docencia/Tesis/icbi/licenciatura/documentos/Seleccion%20electroquimica.pdf
Aminoácidos
Un aminoácido es
una molécula orgánica con un
grupo amino (-NH2) y un
grupo carboxilo (-COOH). Los aminoácidos
más frecuentes y de mayor interés son aquellos que
forman parte de las proteínas. Dos aminoácidos se
combinan en una reacción de condensación entre el
grupo amino de uno y el carboxilo del otro, liberándose
una molécula de agua y formando un enlace amida
que se denomina enlace peptídico; estos dos
"residuos" de aminoácido forman un dipéptido.
Si se une un tercer aminoácido se forma
un tripéptido y así, sucesivamente, hasta
formar un polipéptido. Esta reacción tiene lugar de
manera natural dentro de las células, en
los ribosomas.
Todos los aminoácidos componentes de las
proteínas son L-alfa-aminoácidos. Esto significa
que el grupo amino está unido al carbono
contiguo al grupo carboxilo (carbono alfa) o, dicho de
otro modo, que tanto el carboxilo como el amino están
unidos al mismo carbono; además, a este carbono alfa se
unen un hidrógeno y una cadena (habitualmente
denominada cadena lateral o radical R) de estructura
variable, que determina la identidad y las propiedades de cada
uno de los diferentes aminoácidos. Existen cientos de
radicales por lo que se conocen cientos de aminoácidos
diferentes, pero sólo 22 (los dos últimos fueron
descubiertos en el año 2002) forman parte de las
proteínas y tienen codones específicos en
el código genético.
La unión de varios aminoácidos da lugar a
cadenas llamadas péptidos o polipéptidos, que se
denominan proteínas cuando la cadena polipeptídica
supera una cierta longitud (entre 50 y 100 residuos
aminoácidos, dependiendo de los autores) o la masa
molecular total supera las 5000 uma y,
especialmente, cuando tienen una estructura tridimensional
estable definida.
CAPÍTULO 2
Metodología
2.1.1. Pasos de la
Metodología
1° Elección de los compuestos a
evaluar, el medio corrosivo a utilizar, las condiciones de
operación que se evaluarán y las técnicas de
evaluación. En este trabajo se utilizan los compuestos que
se presentan en la tabla IV. , un medio corrosivo similar al
propuesto en la norma NACE TM 0177 y se evalúan diferentes
concentraciones de los compuestos, tiempos de inmersión y
ausencia o presencia de agitación. Las técnicas de
evaluación que se utilizan en este trabajo con la
Polarización Lineal y las Curvas de Polarización o
Polarización de Tafel.
Página siguiente  |
