
Trabajo en los procesos termodinámicos

Trabajo en los procesos termodinámicos: variables de estado
En termodinámica, el estado macroscópico de un sistema mediante magnitudes tales como la presión, el volumen, la temperatura y la energía interna.
Por eso a estas magnitudes se las denomina como variables de estado.
Para cualquier condición dada del sistema, podemos identificar los valores de las variables de estado
Pero, para definirla es necesario darse cuenta de que el estado macroscópico de un sistema sólo puede quedar especificado si el sistema se encuentra en equilibrio térmico interno
Por ejemplo, en el caso de un gas contenido en un recipiente, el equilibrio térmico interno exige que todas las partes del gas estén a la misma presión y temperatura
Las variables de estado son características de un sistema en equilibrio térmico

Trabajo en los procesos termodinámicos: variables de transferencia
Estas variables sólo tienen un valor distinto de cero si tiene lugar un proceso en el que se transfiera energía a través de los límites del sistema
No están asociadas a un estado determinado del sistema, sino a un cambio en el estado del mismo
Las variables de transferencia son características de un proceso en el que se transfiere energía entre un sistema y su entorno

Trabajo en los procesos termodinámicos: trabajo realizado sobre un sistema deformable (gas)
Supongamos que el gas se comprime cuasi-estáticamente (lo suficientemente despacio como para conseguir que el sistema esté en equilibrio térmico en todo momento)
(Gp:) Supongamos un gas en equilibrio térmico contenido en un recipiente cilíndrico cerrado mediante un émbolo móvil y sin rozamiento de área
(Gp:) El gas ocupa un volumen y ejerce una presión uniforme sobre las paredes del cilindro y del émbolo
(Gp:) Cuando una fuerza exterior empuja el émbolo hacia el interior del cilindro (si tomamos el eje y creciendo hacia arriba, la fuerza tendrá signo negativo) , desplazándolo una distancia
El trabajo realizado sobre el gas
(Gp:) Dado que es la variación del volumen del gas

Trabajo en los procesos termodinámicos: trabajo realizado sobre un sistema deformable (gas)
(Gp:) Si se comprime el gas es negativo y el trabajo realizado sobre el gas es positivo
(Gp:) Si se expande el gas es positivo y el trabajo realizado sobre el gas es negativo
Si el volumen permanece constante, el trabajo realizado sobre el gas es cero

Trabajo en los procesos termodinámicos: trabajo realizado sobre un sistema deformable (gas)
(Gp:) El trabajo total realizado sobre el gas cuando el volumen varía de a es
Para evaluar esta integral es necesario saber cómo varía la presión en función del volumen durante el proceso de expansión
Trabajo en los procesos termodinámicos: trabajo realizado sobre un sistema deformable (gas)
En general, la presión no es constante durante el proceso que lleva un gas desde el estado inicial hasta un cierto estado final
Si la presión y el volumen son conocidos en caso paso del proceso, podemos dibujar el estado del sistema en cada paso del proceso en un diagrama PV
La curva representada es la trayectoria seguida entre los estados inicial y final
El trabajo realizado sobre un gas en un proceso cuasi-estático que lo lleve desde un estado inicial a un estado final es igual al área (con signo negativo) situada bajo la curva del diagrama PV, evaluada entre los puntos inicial y final

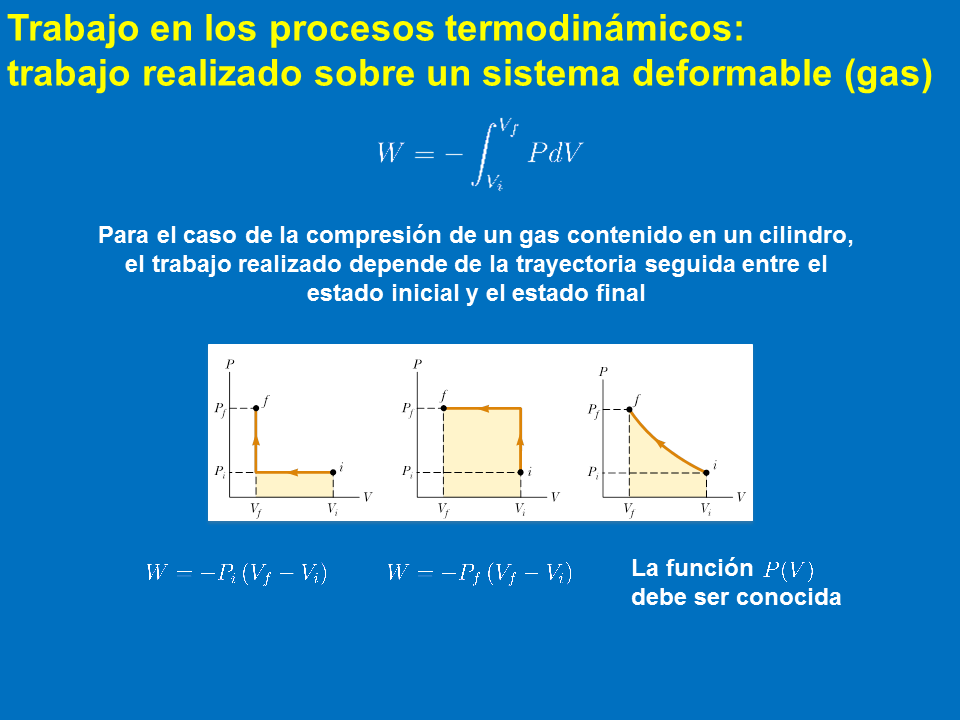
Trabajo en los procesos termodinámicos: trabajo realizado sobre un sistema deformable (gas)
Para el caso de la compresión de un gas contenido en un cilindro, el trabajo realizado depende de la trayectoria seguida entre el estado inicial y el estado final
(Gp:) La función debe ser conocida

Primera ley de la termodinámica
(Gp:) Es un caso particular de la ley de conservación de la energía, en la cual:
– la única variación en la energía de un sistema se produce en su energía interna
– los únicos mecanismos de transferencia de energía son el calor y el trabajo
La variación de la energía interna de un sistema es igual a la suma de la energía transferida a través de los límites del sistema por medio de calor y la transferida por medio de trabajo
Aunque el calor y el trabajo considerados por separado dependan del camino recorrido para conectar los estados inicial y final, la suma de ambos es independiente, y sólo está determinada por los estados inicial y final

Aplicaciones de la primera ley de la termodinámica: proceso adiabático
(Gp:) En un proceso adiabático ninguna energía entra o sale del sistema en forma de calor ( )
Ejemplo 1: caso en el que todas las superficies del émbolo son aislantes perfectos
Ejemplo 2: procesos muy rápidos (la transmisión de energía en forma de calor es un proceso lento)
(Gp:) Cuando se expande un gas adiabáticamente, es negativa
(Gp:) Cuando se comprime un gas adiabáticamente, tanto como son positivos (se realiza un trabajo sobre el gas, es decir, se transfiere energía hacia el sistema de modo que su energía interna aumenta.

Aplicaciones de la primera ley de la termodinámica: proceso adiabático
(Gp:) En un proceso adiabático ninguna energía entra o sale del sistema en forma de calor ( )
Ejemplo 1: caso en el que todas las superficies del émbolo son aislantes perfectos
Ejemplo 2: procesos muy rápidos (la transmisión de energía en forma de calor es un proceso lento)
(Gp:) Cuando se expande un gas adiabáticamente, es negativa
(Gp:) Cuando se comprime un gas adiabáticamente, tanto como son positivos (se realiza un trabajo sobre el gas, es decir, se transfiere energía hacia el sistema de modo que su energía interna aumenta.

Aplicaciones de la primera ley de la termodinámica: proceso isobárico
Un proceso que se realiza a presión constante se denomina proceso isobárico
Si el émbolo puede moverse libremente, la presión del gas que haya en el interior del cilindro se debe a la presión atmosférica y al peso del émbolo
El trabajo realizado sobre el gas es simplemente el producto de la presión constante por la variación en el volumen (cambiado de signo)
El émbolo puede considerarse como una partícula en equilibrio
En un diagrama PV, un proceso isobárico se representa por una línea horizontal

Aplicaciones de la primera ley de la termodinámica: proceso isócoro
Un proceso en el que el volumen se mantiene constante: proceso isócoro
Si fijamos el émbolo para que no se pueda mover
En un proceso isócoro, si se suministra energía en forma de calor toda la energía se utiliza en aumentar su energía interna
El trabajo realizado es cero (ya que el volumen no varía)
En un diagrama PV, un proceso isócoro se representa por una línea vertical

Aplicaciones de la primera ley de la termodinámica: proceso isotérmico
Un proceso que se desarrolla a temperatura constante: proceso isotérmico
En un gas ideal, la energía interna es función únicamente de la temperatura.
Si la temperatura es constante
En un proceso isotérmico, cualquier cantidad de energía que se suministre al gas en forma de trabajo abandona el sistema en forma de calor, por lo que la energía interna permanece constante
En un diagrama PV, un proceso isotérmico se representa por una línea curva

Trabajo realizado sobre un gas ideal en expansión en un proceso isotérmico
El trabajo realizado sobre el gas viene dado por la expresión
Como el gas es ideal y el proceso es cuasiestático (a temperatura constante)
Supongamos un gas ideal al que se le permite expandir de forma cuasi-estática a temperatura constante

Aplicaciones de la primera ley de la termodinámica: sistema no aislado en un proceso cíclico
Un proceso cíclico es aquel que comienza y termina en el mismo estado
La variación de energía interna debe ser cero, ya que la energía interna es una variable de estado y los estados inicial y final son los mismos
Durante un ciclo, la energía en forma de calor suministrada al sistema debe ser igual al opuesto del trabajo realizado sobre el sistema
El trabajo neto realizado en un ciclo es igual al área delimitada por la trayectoria que representa el proceso en un diagrama PV
| Página siguiente |
