
Números cuánticos.
Número cuántico secundario o azimutal (l):
Designa la forma del orbital. Los valores permitidos de l son: 0, 1, 2, 3…(n-1) denotados por los símbolos s, p, d, f … Respectivamente. Los valores de l correspondientes a un mismo valor de n se llaman subniveles.
EII 441-01 Andrea Fredes
37

Números cuánticos
Número cuántico magnético (m):
Define las orientaciones del orbital en el espacio. Comprende los valores entre +l y-l es decir puede tener los valores: -l, -l+1, …0,+1,…,l –1,l.
Si l= 0 (orbital s) m= 0
Si l= 1 (orbital p) m= -1, 0, +1
Si l=2 (orbital d) m= -2, -1,0, +1, +2.
EII 441-01 Andrea Fredes
38

EII 441-01 Andrea Fredes
39

Números Cuánticos
Número cuántico de spin (s):
Determina la orientación del giro del electrón frente a un cuerpo magnético. Puede tomar sólo los valores +1/2 ( ) ó
–1/2 ( ).
EII 441-01 Andrea Fredes
40

Giro del electrón
EII 441-01 Andrea Fredes
41

Configuración electrónica
Los electrones se distribuyen alrededor del núcleo en los diferentes niveles y orbitales. Para saber como se ordenan se deben tener en cuenta las siguientes reglas:
-Principio de exclusión de Pauli.
-Regla de Hund.
EII 441-01 Andrea Fredes
42

Principio de exclusión de Pauli:
Dos electrones de un mismo átomo no pueden tener los cuatro números cuánticos iguales. Así en cada orbital sólo pueden haber dos electrones, uno con espín +1/2 y el otro –1/2.
Los orbitales se llenan según sus energías relativas, empezando por los de menor energía.
EII 441-01 Andrea Fredes
43

Regla de Hund
Dos orbitales con los mismos números cuánticos n y l tienen la misma energía. Para llenarlos, primero se coloca un electrón en cada orbital; a continuación se llenan con el segundo electrón.
EII 441-01 Andrea Fredes
44

La comprensión de muchas propiedades físicas de los materiales se basa en la comprensión de las fuerzas interatómicas que enlazan los átomos.
Estas interacciones dependen mucho de la distancia y posicionamiento espacial entre átomos.
Estas fuerzas pueden ser de atracción y repulsión (relacionadas con sus cargas eléctricas), y la resultante de la combinación de estas fuerzas, es la que determina el tipo de interacción entre átomos, en lo que se llama “enlace atómico”
Enlaces

El siguiente gráfico, esquematiza la distancia a la que se encuentran los átomos de acuerdo a la suma de fuerza de atracción y repulsión, o también visto desde el prisma de un menor estado energético.
Enlaces

En los sólidos existen tres tipos de enlaces:
Enlaces iónicos: es el enlace conformado por un elemento metálico y un no metálico. Los electrones de valencia del metálico se acoplan con los electrones faltantes del no metálico, creando un compuesto con configuración de gas inerte.
Un ejemplo clásico de enlace iónico es la sal común, el cloruro de sodio, NaCl
Enlaces

Enlaces covalentes: estos enlaces se logran entre elementos que comparten electrones de valencia.
Estos electrones se consideran de ambos átomos
Este enlace aparece en sólidos elementales, como el carbono (diamante), silicio, algunos no metálicos (H2,Cl2, etc), o moléculas como las de naturaleza orgánica (CH4) y el agua (H2O)
Enlaces

Enlaces metálicos: se presenta en metales y aleaciones.
Los metales presentan uno, dos o a lo sumo tres electrones de valencia.
Estos electrones circulan libremente a través de todo el metal. Conforman una “nube electrónica”
Debido a esta circulación de electrones, son buenos conductores del calor y la electricidad.
Enlaces

Enlaces

Estructura cristalina
Los materiales sólidos se pueden clasificar de acuerdo al arreglo existente entre sus átomos o iones.
En algunos casos, los átomos se sitúan en una disposición repetitiva y periódica a lo largo de muchas distancias atómicas, dando a lugar a lo que se conoce como “estructura cristalina”.
Los metales, algunos cerámicos y algunos polímeros adquieren estas estructuras en condiciones normales de solidificación

Estructura cristalina
De este ordenamiento dependen muchas propiedades de los sólidos cristalinos.
El caso más analizado corresponde a la estructura de los metales, que poseen un ordenamiento atómico relativamente simple.
El orden atómico de los sólidos cristalinos se puede reducir a un ordenamiento que se repite en el espacio, denominado “celda unitaria”.
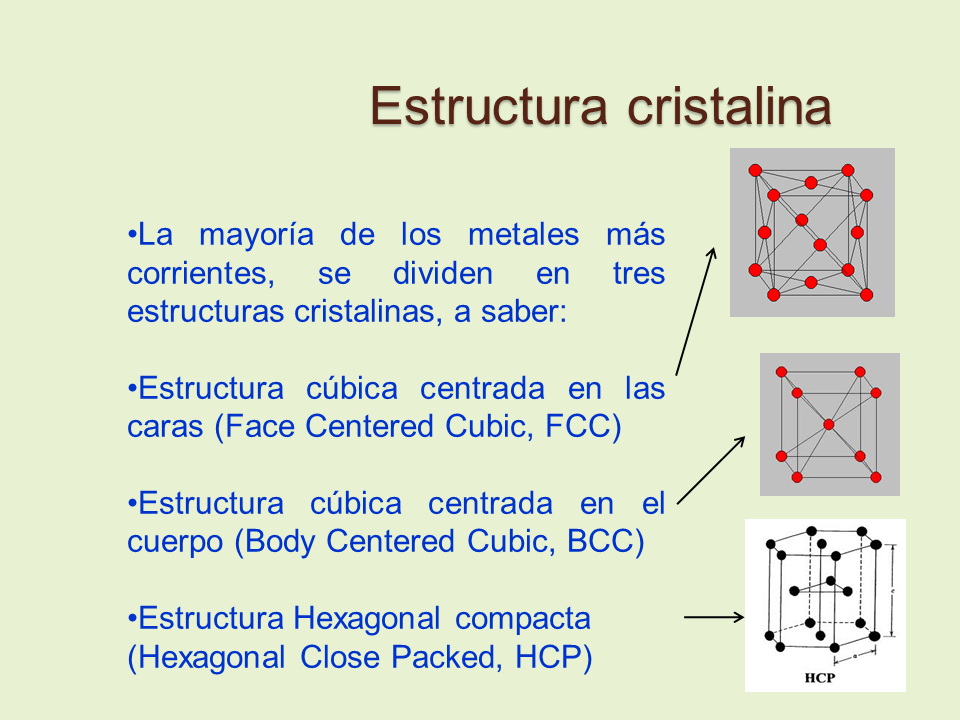
Estructura cristalina
La mayoría de los metales más corrientes, se dividen en tres estructuras cristalinas, a saber:
Estructura cúbica centrada en las caras (Face Centered Cubic, FCC)
Estructura cúbica centrada en el cuerpo (Body Centered Cubic, BCC)
Estructura Hexagonal compacta (Hexagonal Close Packed, HCP)

Composición Química
Es el porcentaje en peso de cada elemento presente en un material.
Las propiedades de un material de puro carbón es diferente a uno de puro fierro.
Un diamante se comporta diferente a un grafito aunque ambos tienen 100% átomos de carbón puro. Por qué?
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
