 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
De modo geral, nas condições tropicais, o nível de proteína na dieta é deficiente, devido à utilização de forragens com baixo nível de proteína bruta (PB), principalmente na época seca, no caso de novilhas, a deficiência protéica provoca o subdesenvolvimento dos ovários e do útero. Há evidências de que a carência de proteínas provoca uma redução no nível de gonadotrofinas circulantes e consequentemente a hipofunção das gônadas.
Diante disso, objetivou-se demonstrar como a proteína e compostos nitrogenados não-protéicos influenciam diretamente os parâmetros reprodutivos de vacas leiteiras.
Segundo o NRC (1989), a ingestão de MS é o principal fator determinante da performance animal, uma vez que controla o ingresso de nutrientes, principalmente energia e proteína para atender as exigências nutricionais. A quantidade de MS ingerida depende do peso vivo, do nível de produção de leite, do estádio da lactação, de condições climáticas, do manejo nutricional, de fatores sociais do grupo, do histórico da alimentação, da condição corporal e do tipo e da qualidade dos alimentos fornecidos, principalmente das forragens.
Segundo Van Soest (1994), o controle da ingestão de alimentos é o resultado de vários mecanismos interrelacionados, que são integrados na resposta final de alimentação. A IMS (ingestão de matéria seca) é controlada por fatores fisiológicos de curto e longo prazo, em que o controle é realizado pelo balanço nutricional da dieta, especificamente relacionada à manutenção do equilíbrio energético, por fatores físicos, que estão associados à capacidade de distensão do próprio rúmen, e por fatores psicogênicos, que envolvem a resposta do animal a fatores inibidores ou estimuladores relacionados ao alimento e, ou, ao ambiente (Sniffen et al., 1993; Mertens, 1994; e Van Soest, 1994).
Na estimativa do consumo, devem ser consideradas as limitações relativas ao animal, alimento e às condições de alimentação (Mertens, 1992). Quando rações são formuladas para apresentar na composição elevado teor de fibra, ou baixa densidade energética em relação às exigências dos animais, o consumo é limitado pelo efeito de "enchimento" do rúmen-retículo. Entretanto, se a densidade energética da ração é elevada, ou a concentração de fibra é baixa em relação às exigências dos animais, a ingestão passa a ser limitada pela demanda fisiológica de energia (Mertens, 1994).
Segundo Sniffen et al. (1993), a capacidade dos animais de consumir alimentos em quantidades suficientes para alcançar suas exigências de mantença e produção é um dos fatores mais importantes em sistemas de alimentação, em grande parte dependentes de volumosos.
Holter et al. (1968) verificaram que a uréia fornecida até o nível de 2,5% em misturas de concentrados não apresentou efeitos prejudiciais significativos no consumo de alimento, em sua digestibilidade ou na produção de leite. Contudo, Wilson et al. (1975) observaram decréscimo no consumo de MS de uma ração completa contendo 2,3% de uréia (425 a 450 g/dia), quando a uréia foi administrada oralmente ou por intermédio da fístula ruminal.
A produção animal por área é o resultado do número de animais por área e do desempenho individual animal. Este desempenho por sua vez depende do potencial genético deste animal, da qualidade da dieta consumida e do consumo voluntário, sendo a qualidade da dieta e o consumo em função da pastagem e do animal. Portanto, desde que o potencial genético do animal não seja limitante, o desempenho individual será em função das características da forragem disponível, das características do animal (espécie, estádio fisiológico e tipo de produção) e do comportamento animal frente às condições das pastagens (Damasceno et al., 1997).
Na criação de ruminantes, tanto em confinamento quanto a pasto, a alimentação é responsável por grande parte dos custos (60 a 70%). Portanto, é de fundamental importância conhecer as características dos alimentos e seu balanceamento nas rações, as quais devem ser formuladas para suprir as necessidades dos animais, explorando sua máxima capacidade digestiva. Um dos fatores mais críticos a ser alcançado é determinar a relação ideal entre volumoso e concentrado, principalmente no que diz respeito à relação entre energia e proteína (Silva, 1999).
Para obtenção de altas produções de leite, as vacas devem ser alimentadas com quantidade suficiente de energia e de proteína (Ekinci e Broderick, 1997; Valadares Filho et al., 2000).
Em dietas com níveis elevados de proteína degradável, observa-se possível toxidez pelo excesso de liberação de amônia no rúmen, que também interfere negativamente no consumo (Borges, 1999a).
No início da lactação, é normal que o animal mobilize suas reservas corporais, devido à alta produção de leite, porém sua capacidade de suprir suas demandas energéticas é limitada. Em comparação com a energia, a quantidade de proteína que pode ser mobilizada das reservas corporais por dia é muito limitada (máximo de 145 g), e a dieta é praticamente a única fonte de proteína para suprir as necessidades da vaca, sendo que a síntese microbiana no rúmen supre parte dessa proteína. Recomenda-se, então, concentração protéica de 18 a 19% na MS da dieta nessa fase (Borges, 1999b).
Huber (1984) considera que os mecanismos envolvidos na redução do consumo, provenientes da ingestão de uréia, podem estar relacionados a uma rejeição pelo paladar (sabor amargo) e não a eventos ruminais ou pós-ruminais, quando o consumo diário de uréia é de até 300 g do alimento, e que pode ocorrer também uma resposta condicionada pelos animais, como verificado por Chalupa et al. (1979).
São vários os estudos que relataram alta correlação negativa entre a quantidade de fibra em detergente neutro (FDN) nos alimentos e o consumo de matéria seca (MS), além de fatores físicos limitando o consumo de alimento, havendo correlação negativa da extensão de degradação da FDN com o conteúdo de FDN. A indigestibilidade da MS é o principal fator que diminui o consumo de alimentos em ruminantes (Conrad, 1966; NRC, 1989; Mertens, 1994; Van Soest, 1994; e Allen, 1996).
Mertens (1994) verificou que o consumo de MS e a produção de leite foram máximos para consumo de FDN de 1,25% do peso vivo para vacas em meio e final de lactação. Woodford et al. (1986), trabalhando com vacas em meio de lactação, encontraram máxima produção de leite corrigido para 4% de gordura, quando os animais foram alimentados com dietas contendo em torno de 27% de FDN. Segundo Oba e Allen (1999), elevada digestibilidade da FDN da forragem aumenta significativamente a IMS e produção de leite.
Segundo Lucci (1997), a composição nitrogenada da dieta pode influir na taxa de gordura láctea: aumentos na concentração protéica da ração de 12-14% para 18% podem reduzir a porcentagem de gordura até 0,5%, o que pode ser atribuído ao incremento do volume de leite produzido. No tocante à proteína láctea, pequenos acréscimos podem ser medidos, quando é aumentado o teor de proteína dietética.
2.1 - Proteína na reprodução animal
Alguns mecanismos sobre os possíveis efeitos da proteína na fertilidade podem ser postulados fundamentados no metabolismo protéico do ruminante. O primeiro efeito pode ser o excesso de ingestão de proteína degradável no rúmen (PDR), que provoca uma elevação nos níveis plasmáticos e teciduais de amônia (NH3), uréia e outros compostos nitrogenados. A maioria da amônia absorvida no rúmen é convertida em uréia pelo fígado. Níveis elevados de uréia e amônia no sangue provocam aumento nos níveis presentes nos tecidos e flúidos reprodutivos (Ferguson & Chalupa, 1989).
A ingestão de quantidades excessivas de proteína bruta ou PDR aumenta a concentração de nitrogênio uréico no sangue (NUS) e no leite (NUL), e altera algumas funções uterinas, que podem comprometer a taxa de concepção (Santos & Amstalden, 1998). Segundo Barton et al. (1996), dietas contendo elevado teor de proteína, em geral, com incremento na PDR têm mostrado decréscimo na fertilidade, causando morte embrionária devido ao comprometimento do ambiente uterino.
O excesso de PDR, PNDR (proteína não degradável no rúmen) ou de NNP (nitrogênio não protéico) nas dietas de vacas em lactação provocam redução da fertilidade no pós-parto, alteração da fisiologia ovariana e uterina, monitorados pelos teores de uréia no sangue e no leite. Assim, Butler (1998) observou que teor de N-uréia plasmática (NUP) acima de 19 mg/dL foi associado à redução da concentração plasmática de progesterona e alteração do pH e ambiente uterino, constituindo as principais causas da redução da fertilidade de vacas no início da lactação.
Segundo o NRC (1989), a recomendação de proteína para vacas de leite produzindo leite com 3% de gordura é de 77 g PB/kg. Para vacas produzindo 30 a 40 kg de leite/dia, a recomendação, incluindo mantença é de 2,8 a 3,1 kg e 3,6 a 3,9 kg PB/dia, respectivamente.
Para cada 1% de PB incrementado no teor de proteína da dieta, quando sua concentração está entre 9-17%, há aumento de 0,02% na proteína do leite (50 vezes menos). Assim, pode-se concluir que a variação da PB na dieta influencia muito mais a produção de leite do que sua composição protéica. A proteína solúvel no rúmen é um aspecto importante para dar suporte ao crescimento microbiano. Em geral, é recomendado cerca de 30% da proteína fornecida seja solúvel no rúmen (Fontaneli, 2001).
Elrod et al. (1993), utilizando dietas com PDR e PNDR balanceadas: PDR normal e 25% de excesso nas exigências de PNDR, e PNDR normal e 25% de excesso de PDR, verificaram que as duas dietas com alta ingestão de proteína, independente da degradabilidade, alteraram o pH uterino no dia sete do ciclo estral. No grupo que recebeu dieta balanceada, o pH uterino aumentou de 6,83 no dia do estro para 7,13 no diestro, sendo essa uma condição fisiológica da fase luteal, resultante do aumento dos teores de Na, K, P e também de anidrase carbônica. Analogamente, a redução do pH uterino na fase luteal observada nas vacas que receberam excesso de proteína na dieta, 6,85 no tratamento com alta PDR e 6,95 no tratamento com alta PNDR, quando comparadas ao grupo que recebeu dieta balanceada (7,13), pode ser conseqüência dos menores teores de Mg, K e P, também observadas durante a fase luteal por Jordan et al. (1983), em animais consumindo dietas contendo 23% de PB e, ou, da inibição da atividade da anidrase carbônica endometrial, que é sensível a alterações na composição iônica. Os tratamentos não influenciaram o pH uterino durante o estro, que foi 6,83; 6,81 e 6,84, para dietas com proteína balanceada, alta PNDR e alta PDR, respectivamente.
Elrod e Butler (1993) observaram que, no dia sete do ciclo estral, a excreção urinária de NH4 foi mais elevada nos animais recebendo dietas que continham 50% além das exigências de PDR.
Outro possível mecanismo fisiológico, que pode estar envolvido na redução da fertilidade, em animais alimentados com elevados teores de PDR ou NNP nas dietas, é a redução das concentrações plasmáticas de progesterona (Oliveira, 2001). Para Findlay (1994), o ambiente luminal uterino é dinâmico e exibe diferenças fisiológicas entre os estádios do ciclo estral que são conseqüência da ação de hormônios esteróides na regulação das secreções endometriais.
Por outro lado, Carrol et al. (1988) não observaram diferenças nos perfis de progesterona plasmática antes do primeiro serviço após o parto de vacas que ficaram ou não gestantes à inseminação, recebendo dietas com 13% ou 20% de proteína bruta. Entretanto, vacas com infecções uterinas no puerpério, devidamente medicadas e recebendo 20% de PB na dieta, apresentaram menores concentrações de progesterona no ciclo estral, antes do primeiro serviço, o que foi atribuído a uma interação entre elevados teores de N e distúrbios patológicos no pós-parto.
Ferguson et al. (1988) relataram uma redução de 50 para 20% nas taxas de concepção ao primeiro serviço, em um rebanho de vacas leiteiras de alta produção, previamente caracterizado por boa eficiência reprodutiva, com média de 1,7 serviços/concepção e de 12,5 meses de intervalo de partos, quando aumentou a proteína da ração para 18,5% de PB na matéria seca da dieta completa. A alteração no manejo nutricional, com objetivo de fornecer um incremento adicional de proteína e sustentar elevadas produções de leite no início da lactação, quando o consumo de matéria seca está reduzido, resultou em teores de NUP de 23mg/dL, tendo sido relacionado o excesso da ingestão de PDR ao declínio da fertilidade.
As recomendações do NATIONAL RESEARCH COUNCIL - NRC (1989), para vacas leiteiras de alta produção, são dietas contendo 17% a 18% de PB, sendo 35% de PNDR e 65% de PDR. Em decorrência do consumo de matéria seca, reduzido no início da lactação, a máxima síntese de proteína microbiana não é atingida até 8 a 12 semanas pós-parto. Assim, recomendações um pouco mais elevadas, da ordem de 18,5% a 19% de PB na dieta, durante as primeiras semanas de lactação, visam compensar comprometimento do consumo de matéria seca. Para prover um fluxo ideal de aminoácidos essenciais para o intestino delgado, a elevação das porcentagens de PNDR, para 35% a 40% da PB, é também recomendada, uma vez que pode reduzir os efeitos da produção de proteína microbiana, a qual só atinge o potencial máximo quando o consumo de matéria seca é ótimo.
Elrod e Butler (1993) observaram taxas de fertilização de 82% em novilhas alimentadas com dietas com conteúdo de proteína, para atender às exigências nutricionais; e de 61% nos animais que receberam dietas excedendo os requerimentos de PDR em 50%. Entretanto, sete das dezesseis novilhas, que receberam excesso de PDR e que não ficaram gestantes, apresentaram um prolongamento da fase luteal, resultando em intervalos de estros de 26 a 36 dias, sugerindo morte embrionária ocorrida após o período crítico do reconhecimento materno da gestação (15 a 16 dias pós-cobertura).
A glutamina, a qual atua como carreador de nitrogênio no sangue, é reconhecida como uma fonte de amônia. Normalmente a glutamina circula no sangue e, quando presente nos rins, é deaminada via glutaminase renal, resultando em amônia que é excretada na urina. Por ser a glutamina utilizada na síntese protéica, sob a influência anabólica do estradiol, a diferença na excreção urinária no estro e no dia sete do ciclo estral, provavelmente, ocorreu devido ao anabolismo decorrente da maior ação do estradiol, e não a uma redução do consumo de matéria seca dos animais durante o estro (Oliveira, 2001).
Elrod et al. (1993) verificaram que o pH uterino é inversamente relacionado aos teores de N-uréia plasmática (NUP) e que ocorre a redução específica do pH durante a fase lútea, sugerindo que o comprometimento da fertilidade seja resultado de alterações dos efeitos da progesterona, no microambiente uterino, gerando condições subótimas para o desenvolvimento embrionário.
O desenvolvimento embrionário inicial requer ambiente adequado no oviduto e no útero, o qual é conseqüência da ação da progesterona. Assim, o aumento da progesterona, no terceiro e no quarto dia após a ovulação, é uma condição essencial para viabilizar o desenvolvimento embrionário inicial e aumentar as taxas de gestação (Oliveira, 2001).
O controle endócrino da reprodução nos animais domésticos é mediado pelo eixo hipotalâmico-hipofisário-ovariano. Em resposta a estímulos externos, fatores ambientais ou demanda fisiológica do organismo, o hipotálamo produz o hormônio liberador de gonadotropinas (GnRH), o qual estimula a síntese e secreção adenohipofisária do hormônio luteinizante (LH) e do hormônio estimulante do crescimento folicular (FSH). As gonadotropinas, por sua vez, regulam a síntese e a secreção ovariana de estrógeno e de progesterona, pelos folículos ovarianos e pelo corpo lúteo, respectivamente. Os esteróides ovarianos exercem efeitos de retroalimentação negativa ou positiva nos centros cerebrais superiores, hipotálamo e/ou adenohipófise, regulando as secreções de gonadotropinas e mantendo os ciclos reprodutivos. A concepção e o estabelecimento da gestação envolvem todos os tecidos dos órgãos reprodutivos e são conseqüência de uma progressão ordenada de eventos interrelacionados: desenvolvimento folicular ovariano resultando na ovulação, fertilização do oócito, transporte e desenvolvimento embrionário, reconhecimento materno da gestação e implantação (Oliveira, 2001).
O controle dos esteróides sobre as secreções de gonadotropinas, por meio de retroalimentação positiva ou negativa no hipotálamo e na adenohipófise, pode ser mediado pela modulação das secreções de GnRH ou por alterações na responsividade da adenohipófise ao GnRH, e variam em função do estágio do ciclo estral. Nas fêmeas bovinas, assim como nas suínas, ovinas e primatas, ocorre uma elevação das concentrações de LH no início do estro, induzido pelo estradiol secretado por folículos pré-ovulatórios, resultando em aumento da responsividade adenohipofisária ao GnRH, que pode ser proveniente de uma elevação do número de receptores celulares para o hormônio (Gregg e Nett, 1989) bem como um aumento na síntese de gonadotropinas (Gharib et al.,1990, citados por Phogat et al., (1997).
Há evidências de que o estradiol também possui retroalimentação negativa na secreção tônica de LH, visto que sua concentração basal é menor em animais intactos, quando comparado a ovariectomizados da mesma espécie. A regulação do LH pelo estradiol pode ser em nível hipotalâmico e/ou hipofisário. Carity et al. (1989), citados por Phogat et al. (1997), verificaram rápida redução nas concentrações de LH, após administração de estradiol, enquanto os pulsos de GnRH continuaram, sugerindo uma redução da responsividade hipofisária e subseqüente redução nos pulsos de GnRH, indicando um efeito adicional tardio, em nível hipotalâmico. Os pulsos de LH são mais freqüentes na fase folicular do que na luteal, sendo uma conseqüência da remoção da retroalimentação negativa da progesterona.
Para Nett (1987), durante o período pós-parto nas fêmeas bovinas, ocorrem duas etapas distintas de recuperação do eixo hipotalâmico-hipofisário-ovariano. A primeira fase, da segunda a quinta semana após o parto, é caracterizada por descargas relativamente infrequentes de GnRH, com pulsos intervalados de 4-8 h, estimulando a biossíntese de LH. Nessa freqüência, os pulsos de GnRH estimulam aumento das taxas de síntese de LH. Apenas quantidades pequenas da gonadotropina recém-sintetizada são secretadas, ocasionando restauração dos estoques adenohipofisários de LH. Como a magnitude dos pulsos de LH é dependente da quantidade do hormônio estocado na glândula, durante a fase de recuperação, a secreção pulsátil de LH é insuficiente para induzir a maturação folicular. Somente após a reposição da concentração normal dos estoques adenohipofisários de LH são liberados picos (secreção tônica) com amplitude suficiente para estimular o crescimento folicular, correspondendo ao início da segunda fase de recuperação do eixo hipotalâmico-hipofisário-ovariano. O reinício do crescimento folicular e, consequentemente, das secreções de estradiol sugerem que o primeiro efeito do esteróide seja o estímulo a biossíntese de seus próprios receptores no hipotálamo e na hipófise, aumentando a sensibilidade desses tecidos ao efeito de retroalimentação positiva do estradiol.
A exposição de um folículo dominante, produzindo estrógeno, a pulsos freqüentes de LH, é a chave para a maturação final e ovulação desse folículo (Roche et al., 1992), resultando na primeira ovulação no pós-parto, que, na maioria das vezes, representa o reinício da atividade ovariana luteal cíclica. Para Savio et al. (1990), são necessários, no mínimo, seis dias para o crescimento, a maturação final e a ovulação de folículos ovarianos de vacas em anestro pós-parto.
Jordan e Swanson (1979) encontraram como efeito de alta ingestão de proteína, redução da concentração de progesterona, aumento da concentração de LH e redução da responsividade do LH-RH.
Por outro lado, Blauwiekel et al. (1986) compararam efeitos de dietas contendo 15 ou 25% de PB em vacas não-lactantes, ovariectomizadas ou não e verificaram que as concentrações basais de LH tenderam a ser menores durante a fase folicular e foram significativamente mais altas durante a fase luteal nos animais que receberam 25% de proteína na dieta. Também, não foram observadas diferenças nas concentrações de progesterona e de LH liberados em resposta a hormônio liberador luteinizante (LH-RH). Nas vacas intactas e nas ovariectomizadas, os padrões da secreção pulsátil de LH, o conteúdo adenohipofisário do hormônio e o número de receptores para LH-RH não foram influenciados pelo conteúdo dietético de proteína. As diferenças dos resultados podem ter sido uma conseqüência da freqüência das coletas de sangue que no experimento de Jordan e Swanson (1979) não foi eficiente na diferenciação do modo de secreção basal ou tônico do hormônio luteinizante.
Com o objetivo de conhecer os efeitos da restrição da energia da dieta sobre a performance reprodutiva de vacas de corte, Burns et al. (1997) forneceram dietas isonitrogenadas, contendo energia para prover ganho (controle) ou perda de peso corporal, verificando que as menores concentrações do IGF-1 (fator de crescimento semelhante à insulina) das vacas submetidas à restrição resultaram em alterações no crescimento folicular e na presença de corpo lúteo subfuncional. Todavia, as baixas concentrações de IGF-1 podem reduzir as células da granulosa, uma vez que o fator atua como regulador da proliferação e diferenciação dessas células, resultando em menores folículos ovulatórios e, subsequentemente, pequenos corpos lúteos. Há evidências da presença de receptores para IGF-1 nas células luteais, e a adição do fator a células luteais em cultivo resultou em aumento das concentrações de progesterona (Sauerwein et al. (1992), citados por Burns et al., 1997).
Para Spicer et al. (1993), a insulina é o principal hormônio metabólico estimulador do desenvolvimento das células foliculares, e o IGF-1, cujas concentrações foram reduzidas em vacas submetidas à restrição de energia na dieta (Burns et al., 1997), regulam a proliferação e diferenciação das células da granulosa de folículos em desenvolvimento.
O declínio da enzima aspartato aminotransferase também sugere uma redução da utilização de aminoácidos como precursores gliconeogênicos, por causa da menor utilização da proteólise muscular como substrato energético e maior disponibilidade de propionato, bem como de glicose para o trato gastrintestinal, cerca de 12 dias antes da primeira ovulação no pós-parto. O propionato pode estimular o aumento da concentração plasmática de insulina, que é necessária para um aumento dos receptores de IGF-1, sendo o fator também considerado um outro possível sinal metabólico para o retorno da atividade ovariana no pós-parto. Durante o período de recuperação do ponto mínimo do balanço energético até a primeira ovulação no pós-parto, foi observado baixa concentração de IGF-1, que foi positivamente relacionada com a freqüência pulsátil de LH. A redução da utilização de aminoácidos para produção de glicose foi associada à aproximação da primeira ovulação no pós-parto e o aumento da concentração de LH (Zurek et al., 1995).
Por outro lado, avaliando alguns parâmetros na dinâmica folicular e da resposta superovulatória de vacas não-lactantes, Garcia-Bojalil et al. (1994) não constataram efeitos de dietas contendo 12,3% ou 27,4% de PB, com ingestão de 70,7% de proteína de alta degradabilidade, fornecida na forma de uréia e/ou farelo de soja, no diâmetro máximo de folículos pré-ovulatórios (16,4 vs. 15,8 mm), no dia da emergência do folículo dominante (2,2 vs. 2,1d), no tempo necessário para o folículo dominante atingir o diâmetro máximo (7,3 vs. 7,5d) e no diâmetro máximo de folículos dominantes (14,0 vs. 14,4 mm) para animais recebendo quantidade de proteína adequada ou em excesso, respectivamente. Quando submetidas ao tratamento superovulatório, nenhuma diferença foi verificada no número e na porcentagem de folículos pré-ovulatórios, anovulatórios e ovulatórios. Também não foi verificada diferença nas médias do número total de embriões recuperados (aproximadamente 50%), do número e da porcentagem de embriões normais, de anormais, de estruturas não-fertilizadas, e o número de embriões transferíveis ou desclassificados. A concentração plasmática de insulina não variou em função das dietas, durante a primeira onda de crescimento folicular, após a sincronização do cio e durante a indução da superovulação. Entretanto, a concentração de insulina foi mais elevada, após a cobertura, em vacas recebendo alto teor de proteína na dieta. A concentração plasmática de progesterona não diferiu, e a de estradiol, durante a superovulação, tendeu a ser menor nas vacas consumindo quantidades adequadas de proteína.
Na Tabela 1, pode ser observado o número de dias transcorridos do parto até a detecção ultra-sonográfica do primeiro folículo ovariano e da primeira ovulação pós-parto, a observação da primeira manifestação de estro no pós-parto, o número de inseminações/concepção e o período de serviço em função dos níveis de NNP das dietas. Não houve efeito dos níveis de NNP das dietas, sobre a presença do primeiro folículo dominante, verificada em média aos 19 dias pós-parto, permitindo inferir que, ao término do período de 21 dias, considerando a adaptação às dietas, já havia estruturas estrógeno ativas nos ovários (Oliveira et al.,2004). Observa-se, também que o número de dias transcorridos entre o parto e a primeira ovulação pós-parto não foi influenciado pelos níveis de NNP das dietas, ocorrendo em média aos 55 dias pós-parto. Os resultados encontrados para a primeira ovulação no período pós-parto são tardios, se comparados aos de Zurek et al. (1995), que observaram as primeiras ovulações aos 24,1 dias nesse período, correspondendo à média de 15,4 dias após o ponto máximo do BEN.
Tabela 1 – Características reprodutivas do pós-parto, em função dos níveis de NNP das rações, coeficientes de variação (CV) e nível de probabilidade dos efeitos linear (L) e quadrático (Q).

Níveis de NNP (%) CV P

 Variáveis
Variáveis
 2,08 4,01 5,76 8,07 (%) L Q
2,08 4,01 5,76 8,07 (%) L Q
PFOL 19,5 18,2 19,0 19,7 15,32 n.s. n.s
POPP 53,2 62,5 57,0 47,7 46,02 n.s. n.s
PEPP 71,7 104,2 84,0 65,5 45,99 n.s. n.s
PS 102,2 119,5 84,0 71,0 34,82 n.s. n.s
 NI/C 1,5 1,2 1,0 1,2 37,64 n.s. n.s
NI/C 1,5 1,2 1,0 1,2 37,64 n.s. n.s
n.s.: não-significativo, a 5% de probabilidade pelo teste de F.
Fonte: Oliveira (2001).
PFOL - primeiro folículo dominante (dia)
POPP – primeira ovulação do pós-parto (dias)
PEPP – primeiro estro do pós-parto (dias)
PS – período de serviço (dias)
NI/C – número de inseminações/concepção.
Butler e Smith (1989) consideram que a minimização do intervalo parto-primeira ovulação pós-parto seja um fator essencial no incremento da eficiência reprodutiva dos rebanhos, uma vez que possibilita maior tempo para a ocorrência de ciclos ovarianos antes da inseminação, resultando em maiores taxas de concepção.
Para Smith (1986), os principais fatores limitantes da identificação de estro, por meio das observações visuais, são a maior freqüência (70%) de montas durante a noite, entre 18 e 6h; a duração do estro de 25% dos animais inferior a oito horas; o tempo da monta, em média de 10 segundos; e nos rebanhos com pequeno número de animais a freqüência da atividade de monta de 1,2h, quando os animais não são sincronizados.
Opsomer et al. (1996) consideraram que as falhas na observação de estro constituem a principal causa do anestro no pós-parto, sendo uma maior acurácia, na sua detecção, o principal fator para melhorar a eficiência reprodutiva. Por outro lado, Butler e Smith (1989) verificaram que a redução da ingestão de nutrientes é a principal causa de perda de peso corporal, do atraso da primeira ovulação, da redução da atividade luteal e prolongamento do anestro no período pós-parto.
2.1.2 – Uréia na reprodução de ruminantes
Os suplementos protéicos são normalmente os componentes mais caros da ração para vacas leiteiras. O uso de uréia (composto nitrogenado não-protéico - NNP) pode representar uma alternativa para atender às exigências de vacas leiteiras em proteína, ao mesmo tempo que reduz os custos deste nutriente (Lopez, 1984).
A uréia é um composto quartenário, constituído por nitrogênio, oxigênio, carbono e hidrogênio, de cor branca cristalina, de sabor amargo e solúvel em água e álcool, tendo a seguinte fórmula: CO(NH2)2. e solúvel em água e álcool. Quimicamente é classificada como amida, daí ser considerada um composto nitrogenado não protéico (Teixeira, 1991).
A síntese industrial da uréia ocorre inicialmente a partir do gás metano (CH4) que, sob alta temperatura se decompõe em hidrogênio (H2), monóxido de carbono (CO) e dióxido de carbono (CO2). Por sua vez, o hidrogênio e o nitrogênio do ar, formam a amônia (NH3). A amônia na presença do gás carbônico do ar forma o carbamato de amônio (NH4COONH2). Finalmente, o carbamato de amônio é decomposto em uréia e água (Lehninger et al., 1995).
3 H2 + N2 ( 2 NH3 + calor
2 NH3 + CO2 ( NH4 __ COO __ NH2
NH4 __ COO __ NH2 ( NH2 __ CO __ NH2 + H2O (uréia + água)
Segundo Teixeira (1990), a composição química da uréia produzida, em porcentagem, é a seguinte: 46,50 de nitrogênio, 0,55 de biureto, 0,25 de água, 0,008 de amônia livre, 0,003 de cinza e 0,003 de ferro + chumbo.
A uréia sintética é um produto químico obtido a partir da síntese de amônia com o dióxido de carbono, sob condições elevadas de temperatura e pressão. O produto tem a fórmula estrutural NH2CONH2 e apresenta na sua composição 46,4% de nitrogênio; 0,55% de biureto; 0,25% de água e 0,08% de amônia livre e cinzas. É encontrado na maioria das vezes no estado sólido, higroscópico e possui elevada solubilidade em água, álcool e benzina (Coelho da Silva e Leão, 1979).
Nos organismos ureolíticos, ou seja, aqueles que excretam o nitrogênio do grupo amino na forma de uréia, a amônia é convertida em uréia na mitocôndria dos hepatócitos, através do "ciclo da uréia". Este é o destino da maior parte da amônia que chega até o fígado (Teixeira, 1991).
Porém, quando não estiver em excesso no organismo, o nitrogênio reciclado na forma de uréia pode voltar ao sistema digestivo pela saliva, ou difusão através da parede do rúmen (Van Soest, 1994).
Os compostos de NNP, tais como uréia e amidas, são convertidos pelos microrganismos do rúmen a amônia, a qual é então utilizada para a síntese de proteína microbiana, ou absorvida através da parede ruminal. Os níveis de amônia no sangue geralmente permanecem baixos, pois o fígado rapidamente converte amônia a uréia (uma forma de desintoxicação), conversão esta que custa ao animal aproximadamente 12 kcal/g de nitrogênio (Van Soest, 1994).
Independente da fonte de uréia que chega ao rúmen ou o ceco dos animais é inegável a contribuição deste composto na síntese de todos os aminoácidos, e é considerável seu valor na sobrevivência de animais que se alimentam de rações deficientes em aminoácidos não-essenciais ou proteína (Correia, 1992).
A uréia constitui a forma principal pela qual o nitrogênio é eliminado do organismo de mamíferos e, quando taxas de síntese de amônia é maior que sua utilização pelos microrganismos, observa-se elevação da concentração de NH3 no rúmen, com conseqüente aumento na excreção de uréia, aumentando o custo energético da produção de uréia, resultando, dessa forma em perda de proteína (Russel et al., 1992; Morrison e Mackie, 1996).
Nos ruminantes, parte da uréia sanguínea é reciclada para o rúmen pela saliva ou por difusão via epitélio ruminal. A potencialidade desta reciclagem de uréia é elevada, quando o composto está presente em altas concentrações sangüíneas; há grande atividade da enzima urease; o pH ruminal é baixo; e ocorre diminuição do teor ruminal de amônia (Siddons et al., 1985).
Segundo o NRC (1989), o uso de uréia nas dietas de ruminantes é semelhante ao da PDR, embora a uréia não seja fonte de esqueletos de carbono de cadeia ramificada e nem de enxofre, os quais devem ser supridos pela PDR ou sulfato de amônia, uma vez que ambos são requeridos para a síntese microbiana de aminoácidos.
A uréia também é um metabólito endógeno que tem sido utilizado como uma eficiente ferramenta para avaliar o equilíbrio de N nos ruminantes. Os teores de uréia nos fluidos orgânicos são reflexo da quantidade e degradabilidade da proteína ingerida e da disponibilidade ruminal de carboidratos fermentáveis, como também da severidade do balanço energético em jejum, ou da combinação da ingestão de energia e do BEN no pós-parto, quando se esgotam as reservas energéticas do animal e passam a ser mobilizadas as protéicas (Elrod e Butler, 1993).
Outra fonte de uréia produzida pelo fígado é proveniente da deaminação e do metabolismo de aminoácidos nesse órgão. Os aminoácidos circulantes são resultantes do catabolismo de proteína dietética não-degradável no rúmen (PNDR) da proteína microbiana e de estoques corporais (Oliveira, 2001).
Dentre os principais fatores limitantes ao uso de uréia na alimentação de ruminantes, estão sua baixa aceitabilidade pelos animais (sabor amargo), e o risco de intoxicação, que está relacionado ao modo de fornecimento do produto. A alta solubilidade da uréia em água permite a ingestão de grandes quantidades na forma líquida, comum no meio rural, quando associações de cana-de-açúcar e uréia ou misturas múltiplas, contendo elevadas concentrações do produto são fornecidas em cochos descobertos (Oliveira, 2001).
A intoxicação e morte causada pela ingestão de grandes quantidades de uréia em reduzido espaço de tempo estão relacionadas aos teores de amônia no sangue, que excedem a capacidade tamponante, com aumento do pH e da incapacidade de eliminação de gás-carbônico (Van Soest, 1994).
A reversão do processo de intoxicação pode ser realizada por meio da administração oral de ácido acético, que abaixa o pH ruminal e, consequentemente, a absorção de amônia e a formação de ácido oxálico (Oliveira, 2001).
O fornecimento da uréia na alimentação de ruminantes tem sido relacionado a problemas reprodutivos, mesmo nas quantidades comumente recomendadas, o que tem limitado o seu uso por elevado número de produtores. Todavia, a literatura mostra que diferentes níveis de uréia ou de proteína, a fonte protéica e sua degradabilidade ou o conteúdo de N-total da dieta podem influenciar ou não alguns aspectos reprodutivos, e também que outros fatores adversos podem potencializar esses efeitos (Oliveira, 2001).
A uréia tem se mostrada tóxica ao espermatozóide e ao óvulo e pode causar aborto quando injetada intraaminioticamente (Ferguson e Chalupa, 1989). Níveis sanguíneos de uréia maiores do que 20 mg/dL provocam redução nas taxas de concepção de 60 para 20% (Ferguson et al., 1988).
Word et al. (1969), citados por Boin (1984), verificaram que vacas experimentalmente intoxicadas por uréia e recuperadas por meio de tratamento estratégico, com ácido acético, não apresentaram maior incidência de abortos e partos distócicos, e que a taxa de gestação, calculada 165 dias após a cobertura, também não foi influenciada pela intoxicação, bem como o peso da cria ao parto e a desmama. Também Patton et al. (1970), citados por Boin (1984), observaram que a substituição do farelo de soja por uréia, com NNP, fornecendo 45% do N-total, não influenciou o desempenho reprodutivo de novilhas leiteiras à primeira cobertura.
Erb et al. (1976) forneceram dietas com 12% de PB para novilhas entre 7 e 12 meses de idade, até a metade da gestação, nas quais a uréia substitui 0%, 50% e 100% do farelo de soja, correspondendo a 0; 22% e 45% do N-total da dieta na forma de NNP. A partir da metade e até duas semanas antes do parto previsto, a uréia substituiu 0%, 8% e 16% do nitrogênio total da dieta e, durante a lactação, foi utilizada uma dieta contendo 14% de PB e a substituição do N-total por uréia foi de 0%, 18% e 36%. Na primeira lactação, os consumos médios de uréia foram de 0; 145 e 290 g/animal/dia, respectivamente, atingindo um consumo máximo de 180 a 360 g, no pico da lactação, para os tratamentos com menor e maior teor de uréia, respectivamente. Foi verificada uma incidência de 14% de aborto, quando na dieta a uréia substituiu 100% do farelo de soja. Em outro experimento, novilhas holandesas alimentadas com dietas contendo 0 (controle) e 36% do N-total fornecido pela uréia, após três partos consecutivos, observou-se maior incidência de retenção de placenta (37% e 20%) e menor taxa de gestação após duas inseminações (65% e 77%) nos animais que consumiram uréia, permitindo concluir que nas dietas com silagem de milho e gramínea associada à leguminosa, a substituição do farelo de soja do concentrado por uréia e milho (uréia equivalente a aproximadamente 1,8% da matéria seca da ração total) influenciou a eficiência reprodutiva de vacas nas três primeiras lactações. Entretanto, o uso de 50% de substituição, equivalente a 0,9% de uréia na dieta completa, proporcionou desempenho reprodutivo pelo menos igual ao de animais que não consumiram uréia.
O consumo da matéria seca e a produção de leite também podem ser influenciados pelos teores de NNP ou proteína da dieta. Holter et al. (1968) verificaram que a uréia fornecida até o nível de 2,5% em misturas de concentrados, não apresentou efeito no consumo de alimento, na digestibilidade ou na produção de leite, enquanto Wilson et al. (1975) observaram decréscimo no consumo de MS de uma ração completa, contendo 2,3% de uréia (425 a 450 g/dia), quando a uréia foi administrada oralmente ou via fístula ruminal.
Oliveira (2001) verificou que a adição de 2,5% de uréia em rações completas reduziu a ingestão de matéria seca total, em relação à dieta sem uréia, o que foi atribuído a uma indisposição do animal, provocada pela toxidez da amônia a nível celular, e ao aroma das dietas. Huber e Kung (1981) também observaram redução do consumo, quando dietas contendo níveis acima de 1,5% a 2,0% de uréia foram fornecidas a animais aparentemente adaptados, e citaram como provável causa a baixa palatabilidade devido ao sabor amargo da uréia.
Silva (2000) verificou que os consumos de MO (matéria orgânica), EE (extrato etéreo), PB (proteína bruta), CHO (carboidrato), FDN (fibra em detergente neutro) e NDT (nutrientes digestíveis totais) diminuíram com o aumento nas proporções de NNP nas dietas, refletindo o mesmo comportamento do consumo de MS, o que permite inferir que a redução da produção de leite, observada pelo autor, foi decorrente do menor consumo de nutrientes pelos animais que receberam maiores quantidades de uréia.
2.2 – Compostos nitrogenados vs. parâmetros reprodutivos
O ambiente uterino é dinâmico e apresenta diferenças acentuadas nas fases do ciclo estral devido à regulação esteroidogênica dos ovários e a secreção endometrial (Butler, 2000). O pH e a concentração iônica da secreção uterina, durante a fase luteal, podem ser influenciados pela ingestão de dietas contendo elevados teores de proteína, provocando redução da fertilidade de vacas leiteiras no pós-parto (Butler, 1998).
Como PDR ou NNP e PDR são metabolizados e utilizados em órgãos diferentes e a resposta fisiológica comum decorrente da ingestão do excesso desses nutrientes é a formação de uréia no fígado e, consequentemente, a elevação dos teores de uréia nos fluidos orgânicos, pode-se sugerir que a uréia seja o mediador uterino das alterações locais que ocorrem quando dietas contendo elevadas quantidades de proteína são consumidas (Butler, 1998).
Dietas com excesso de PB ou PDR, ou baixos níveis de carboidratos degradáveis no rúmen, ou que apresentam assincronia entre a degradação de proteína e a disponibilidade de energia no rúmen irão aumentar os níveis de NUP. Por outro lado, dietas que fornecem quantidades inadequadas de amônia e PDR limitam o crescimento microbiano, e comprometem a digestão da fração fibrosa dos carboidratos, limitam o consumo de matéria seca e consequentemente, o consumo de energia (Santos & Santos, 2003).
Os efeitos do excesso de proteína, independente de sua degradabilidade, e, ou, de compostos nitrogenados não-protéicos (NNP) nas dietas de vacas em lactação, tem sido atribuídos, isoladamente ou associados à redução da concentração plasmática de progesterona (Jordan e Swanson, 1979); alteração na composição iônica do fluido uterino e redução do pH intra-uterino (Jordan et al., 1983; Elrod e Butler, 1993; Elrod et al., 1993); exacerbação do BEN e aumento da secreção endometrial de PGF2a (Butler, 1998); presença de componentes tóxicos do metabolismo do nitrogênio (amônia ou uréia) nas secreções dos órgãos reprodutivos, comprometendo a viabilidade de espermatozóides e ovócitos ou a sobrevivência e o desenvolvimento embrionário inicial (Santos e Amstalden, 1998).
2.2.1 – NUP, NUL e NUS
O consumo de dietas contendo elevadas quantidades de proteína bruta (PB) ou de proteína degradável no rúmen (PDR) aumenta o teor de nitrogênio uréico no sangue (NUS) e no leite (NUL) e altera algumas funções uterinas, as quais podem comprometer a fertilidade no pós-parto, principalmente por meio da redução das taxas de concepção (Santos e Amstalden, 1998).
A utilização de dietas com alto teor de proteína, com grande fração de rápida degradação ruminal, sem o adequado suporte de energia acarreta um aumento no NNP no leite, o que pode ser aferido pela presença elevada de uréia no leite. O teor de nitrogênio uréico no leite (NUL) é altamente relacionado com o de uréia no sangue que, por sua vez, reflete o excesso de proteína degradável no rúmen ou a falta de carboidratos fermentáveis no rúmen, cuja degradação seja sincronizada a degradação protéica. A Tabela 2 mostra fatores que influenciam o valor normal do NUL, que para ruminantes é de 12 mg/dL.
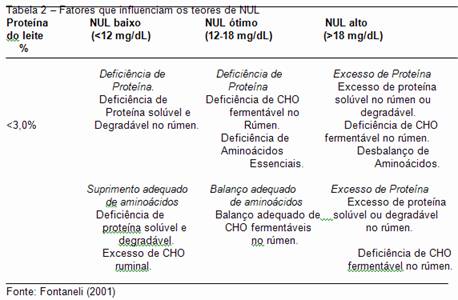
A uréia pode passar livremente do sangue para o leite na glândula mamária, sendo que o tempo de equilíbrio entre os teores é menor que 1h (Butler et al., 1995). Assim, o teor de N-uréia no leite (NUL) também pode constituir um método rápido, não invasivo e eficiente para avaliar os teores sanguíneos de N-uréia e o metabolismo protéico de vacas em lactação.
Os teores de uréia presentes no sangue (NUS), no leite (NUS), na saliva, no fluido endometrial e na urina podem ser avaliados pelo seu conteúdo de nitrogênio, que representa 46,6% da molécula. Já o conteúdo de nitrogênio da uréia (N-uréia), presente na circulação sanguínea pode ser medido nas frações plasmáticas, como nitrogênio uréico plasmático (NUP) ou sérico e, na maioria das vezes, essas siglas se referem de modo genérico aos teores de uréia no sangue (Oliveira, 2001).
Nos bovinos, teor de NUP acima de 20 mg/dL, pode indicar que as rações contenham excesso de PB ou que a quantidade excedente de proteína é degradável no rúmen. Após a reformulação das dietas, para prover um balanço ótimo de PDR e PNDR, 62% e 38% respectivamente, as taxas de concepção retomaram os percentuais anteriores à alteração no manejo nutricional, em torno de 50, sugerindo que os efeitos negativos do excesso de proteína na dieta sobre a fertilidade podem ser eliminados por meio do manejo nutricional adequado (Ferguson et al., 1988).
Por outro lado, Canfield et al. (1990) verificaram taxas de concepção ao primeiro serviço de 31% em vacas que receberam dietas contendo 19% de PB e excesso de PDR, e de 48% para os animais recebendo 13% de PB. A diferença foi atribuída aos efeitos negativos de elevados teores de NUP na fertilidade durante o pós-parto. Os animais que ficaram gestantes tiveram teores de NUP menores que 18,6 mg/dL.
Nos experimentos de Howard et al. (1987), os teores de NUP aumentaram mais rápido, e atingiram valores máximos em animais que consumiram dietas contendo 20% de PB. Após cinco semanas do pós-parto, o teor de NUP foi relativamente constante, não exibindo diferenças para animais que consumiram 15% de PB na dieta.
Carrol et al. (1988) verificaram que o pico das concentrações de NUP foi maior nos animais que receberam dietas contendo alta proteína e volumoso e concentrado separados, quando comparados aos alimentados com mistura completa. Entretanto, resultados sugeriram pequeno efeito biológico sobre a performance reprodutiva dos animais quando foram comparadas as taxas de concepção de 65% e 57% para os grupos que consumiram dietas com 20% e 13% de PB, respectivamente. Os teores de NUP nas vacas que ficaram ou não gestantes , foram de 16,2 e 16,7 mg/100 mL, respectivamente, e não diferiram.
Para Roseler et al. (1993), o NUP e NUL são influenciados similarmente por alterações nos conteúdos de PDR e PNDR nas dietas, e negativamente pelo aumento da ingestão de energia líquida para a lactação. Pequenos desbalanceamentos na PDR e PNDR podem ser mascarados pela ingestão total de proteína bruta e energia, e verificaram também que os teores de NUP foram altamente correlacionados aos de NUL (r = 0,88) e ao nitrogênio não-protéico do leite (r = 0,76), sendo NUL um indicador mais sensível dos teores de compostos não-nitrogenados no leite.
Para Elrod (1995), os teores de NUP e NUL são reflexos da ingestão de proteína, da degradabilidade das fontes protéicas e da energia disponível no rúmen, e apresentam uma correlação negativa com a fertilidade, sendo que níveis acima de 16 mg/dL de NUP, correspondendo a um excesso de N de 92 g/dia pela predição do Sistema Cornell, exibiram uma redução de 30% da taxa de concepção ao primeiro serviço das novilhas. A análise dos dados das vacas em lactação mostrou um nível crítico de NUP de 19 mg/dL, equivalente a um excesso de N da ordem de 130 g/dia.
O principal mecanismo envolvido na redução da fertilidade de vacas leiteiras no pós-parto, relacionado às variações nos teores de NUP, são as variações no ambiente uterino decorrentes de alterações no fluxo iônico entre as camadas do endométrio.
2.2.2 – pH uterino
O pH uterino apresenta um aumento fisiológico durante a fase luteal, variando de 6,8 no estro para 7,1 no sétimo dia do ciclo estral (Elrod e Butler, 1993), resultante do aumento das concentrações de Na, K, P e da anidrase carbônica, decorrentes da ação da progesterona. Elrod et al. (1993) verificaram que o pH uterino é inversamente relacionado aos teores plasmáticos de uréia, e que ocorre uma redução específica do pH durante a fase luteal, sugerindo que a redução da fertilidade seja resultado de alterações dos efeitos da progesterona no microambiente uterino, gerando condições subótimas para o desenvolvimento embrionário, quando existem elevadas concentrações de uréia na corrente sangüínea.
Os efeitos diretos do pH uterino, na sobrevivência embrionária nas espécies domésticas, ainda não são totalmente conhecidos e, para Elrod (1995), as alterações na disponibilidade de íons para os embriões podem influenciar nas interações dos hormônios com seus receptores e, ou, na utilização de aminoácidos, glicose ou lactato, comprometendo a viabilidade dos conceptos, principalmente na fase de rápida expansão, após o oitavo dia de gestação, quando a demanda de nutrientes é crescente.
Elrod et al. (1993) verificaram que o pH uterino é inversamente relacionado aos teores de NUP, e que ocorre uma redução específica do pH durante a fase luteal, sugerindo que a redução da fertilidade seja resultado de alterações dos efeitos da progesterona no microambiente uterino, gerando condições subótimas para o desenvolvimento embrionário.
Elrod et al. (1993) verificaram que dietas contendo excesso de proteína, independente da sua degradabilidade, diminuem o pH uterino no dia sete do ciclo estral, e que o mecanismo fisiológico envolvido é uma redução nas concentrações de Mg ++, K+ e P- no ambiente uterino durante a fase luteal, o que também foi detectado por Jordan et al. (1983) em animais consumindo dietas contendo 23% de PB.
Butler (1998) observou que o teor de NUP acima de 19 mg/dL foi associado à redução da concentração plasmática de progesterona e alteração do pH e ambiente uterino, constituindo as principais causas de redução da fertilidade de vacas leiteiras no início da lactação.
No início da lactação, quando o aumento na produção de leite excede a quantidade de nutrientes ingerida, devido o consumo subótimo de matéria seca, ocorre o balanço energético negativo (BEN), que é diretamente relacionado à produção de leite e, frequentemente, é máximo durante as duas ou três primeiras semanas de lactação, resultando em mobilização de reservas e perda de peso corporal que podem persistir por 10 a 12 semanas de lactação (Butler e Elrod, 1991).
O retorno dos ciclos ovarianos no período pós-parto pode ser influenciado pela intensidade e extensão do BEN, que ocorre em função do nível de produção de leite e, ou, do fornecimento de dietas desbalanceadas. Vacas subalimentadas pós-parto têm maior mobilização de reservas corporais, codificadas por maiores perdas de peso e atraso no retorno da atividade ovariana, provavelmente, devido a supressão da liberação pulsátil de LH. Portanto, o efeito do BEN pode ser comparado ao da subnutrição, uma vez que, em função da severidade com que ocorre, há um prolongamento do número de dias transcorridos do parto até a primeira ovulação (Randel, 1990).
Para Butler (1998), uma possível explicação das diferenças encontradas na literatura pode ser o status lactacional das vacas nos diferentes estudos. As concentrações plasmáticas de progesterona aumentam progressivamente do primeiro para o terceiro ciclo estral no pós-parto, sendo que esse aumento pode ser influenciado pelo BEN.
Quando vacas são alimentadas com excesso de proteína ou compostos nitrogenados não-protéicos (NNP), no início da lactação, o BEN é exacerbado, devido ao custo energético da detoxificação da amônia que escapa do rúmen (Staples et al., 1993) resultando numa redução do nível de progesterona, e conseqüentemente redução da fertilidade.
O efeito de dietas contendo elevadas quantidades de proteína degradável no retorno da atividade ovariana é semelhante ao status energético negativo de vacas no início da lactação e do pós-parto. A extensão e a intensidade do BEN são fatores que influenciam o retorno da atividade ovariana no pós-parto (Oliveira, 2001). Butler e Smith (1989) verificaram que a primeira ovulação no pós-parto foi retardada, em média, 2,75 dias para cada 1 Mcal de status energético negativo, durante os primeiros 20 dias do pós-parto, sugerindo que o excesso de proteína na dieta resulta num custo energético significativo para a vaca ou em comprometimento das vias metabólicas de produção de energia.
Zurek et al. (1995) trabalhando com vacas de alta produção (média de leite de 40 kg), recebendo dietas na forma de mistura completa, na razão volumoso:concentrado de 60:40, contendo 1,47 a 1,86 Mcal/kg de MS, visando atender as exigências nutricionais de proteína para mantença e produção, observaram que as primeiras ovulações ocorreram 24,1 dias pós-parto, correspondendo à média de 15,4 dias após o balanço energético negativo mínimo. O menor tempo transcorrido entre a primeira ovulação pós-parto e o ponto mínimo do BEN foram oito dias, sugerindo ser o limiar necessário para a atividade do sistema sinalizador e o tempo para o crescimento folicular, a maturação final de folículos pré-ovulatórios e a ovulação. Por meio da determinação da concentração plasmática de 3-metilhistidina, foram detectados aumentos na mobilização de proteína circulante, durante as três primeiras semanas do pós-parto, relacionados ao BEN. As elevadas concentrações plasmáticas da enzima aspartato aminotransferase foram inversamente correlacionadas ao BEN e diretamente às concentrações de 3-metilhistidina e de LH, e decresceram significativamente nove a 12 dias antes da primeira ovulação no pós-parto. Esse período foi considerado suficiente para o início da atividade ovariana, inclusive crescimento e maturação de um folículo do primeiro "pool" recrutado.
Sendo a reprodução um dos fatores de produtividade dentro de um rebanho bovino, é de fundamental importância suprir as exigências nutricionais das vacas, uma vez que, são elas as responsáveis pela produção de bezerros e consequentemente a produção efetiva de leite dentro da propriedade.
Dentro da nutrição de vacas leiteiras, é importante voltar-se para as proteínas, pois é o nutriente de maior custo da ração e com isso, busca-se ingredientes alternativos para substituí-la, como exemplo, a uréia usada como fonte de nitrogênio não protéico que supre as bactérias ruminais para a produção da proteína microbiana de alto valor biológico.
ALLEN, M.S. Physical constraints on voluntary intake of forage by ruminants. Journal of Animal Science, 74(12):3063-3075, 1996.
BARTON, B.A.; ROSARIO, H.A.; ANDERSON, G.W. et al. Effects of dietary crude protein, breed, parity, and health status on the fertility of dairy cows. Journal of Dairy Science, v.79, p.2225-2236, 1996.
BOIN, C. 1984. Efeitos desfavoráveis da utilização de uréia. In: 2º Simpósio sobre Nutrição de Bovinos, 1984, Piracicaba. Anais... Piracicaba: FEALQ,p.25-79, 1984.
BLAUWIEKEL, R., KINCAID, R. L., REEVES, J.J. Effects of high crude protein on pituitary ovarian function in Holstein cows. Journal of Dairy Science, 69(2):439-446, 1986.
BORGES, A.L.C.C. Controle da ingestão de alimentos. Cad. Téc. Esc. Vet. UFMG, 27:67-79, 1999a.
BORGES, A.L.C.C. Experiência na condução de um sistema intensivo de produção de leite, com ênfase nos aspectos nutricionais. In: SIMPÓSIO MINEIRO DE NUTRIÇÃO DE GADO DE LEITE, 2, Belo Horizonte, 1999. Anais ... Belo Horizonte, 1999b. p.22-38.
BURNS, P.D., SPITZER, J.C., HENRICKS, D.M. Effects of dietary energy restriction on follicular development and luteal function in nonlactating beef cows. Journal of Animal Science, 75:1078-1086, 1997.
BUTLER, W.R. Nutritional interactions with reproductive performance in dairy cattle. Animal Reproduction Science, v.60-61, p.449-457, 2000.
BUTLER, W.R. Effect of protein nutrition on ovarian and uterine physiology in dairy cattle. Journal of Dairy Science, v.81, (9): 2533-2539, 1998.
BUTLER, W.R, CHERNEY, D.J.R., ELROD, C.C. Milk urea nitrogen (MUN) analysis: field trial results on conception rates and dietary inputs. Department of Animal Science, Cornell University, 1995.
BUTLER, W.R., SMITH, R.D. Interrelationships between energy balance and postpartum reproductive function. Journal of Dairy Science, 72:767-783, 1989.
CANFIELD, R.W., SNIFFEN, C.J., BUTLER, W.R. Effects pf excess degradable protein on postpartum reproduction and energy balance in dairy cattle. Journal of Dairy Science, 73(9):2343-2349, 1990.
CARROL, D.J., BARTON, B.A., ANDERSON, G.W. et al. Influence of protein intake and feeding strategy on reproductive performance of dairy cows. Journal of Dairy Science, 71(12): 3471-3481, 1988.
CHALUPA, W. Problems in feed urea to ruminants. Journal of Animal Science. Champaing, v.27, n.1, p.207-219, Jan. 1968.
COELHO DA SILVA, J.F.; LEÃO, M.I. Fundamentos de Nutrição dos Ruminantes. Livroceres, Piracicaba. 380p. 1979.
CORREIA, L. de F.A. Utilização da amiréia na alimentação de coelhos em crescimento da raça Nova Zelândia Branco. 90f. Dissertação (Mestrado em zootecnia) – Escola Superior de Agricultura de Lavras, Lavras, 1992.
CONRAD, H.R. Symposium on factors influencing the voluntary intake of herbage by ruminant: physiological and physical factors limiting feed intake. Journal of Animal Science, 25:227-235, 1966.
DAMASCENO, J.C., CECATO, U., DO CANTO, M.W. Limitações nutricionais para produção animal em pastagens. Produção e utilização de pastagens. CPAF. Maringá, 1998. p. 19-30.
ELROD, C.C. High dietary protein and high fertility: can we have both? In: Cornell Cooperative Extension, Waterloo, NY, p.32-39, 1995.
ELROD, C.C., Van AMBURG,M., BUTLER, W.R. Alterations of pH in response to increased dietary protein in cattle are unique to the uterus. Journal of Animal Science, v.71, n.3, p.702-706, 1993.
ERB, R.E., BROWN JR., C.M., CALLAHAN, C.J. et al. Dietary urea for dairy cattle. II. Effect on functional traits. Journal of Dairy Science, 59(4): 656-667, 1976.
EKINCI, C., BRODERICK, G.A. Effect of processing high moisture ear corn on ruminal fermentation and milk yield. Journal of Dairy Science, 80(12):3298-3307, 1997.
FERGUSON, J.D., BLANCHARD, T., GALLIGAN, D.T., et al. Infertility in dairy cattle fed high percentage of protein degradable in the rumen. JAVMA., 192 (5):659-662, 1988.
FERGUSON, J.D.; CHALUPA, W. Impact of protein nutrition on reproduction in dairy cows. Journal of Dairy Science, v.72, p.747-766, 1989.
FINDLAY, P., SALAMONSE, L.A., CHERNEY, R.A. Endometrial function: studies using isolated cells in vitro. Oxford Rev. Reproduction Biologic, 12:181-223, 1990.
FINDLAY, J.K. Peripheral and local regulators of folliculogenesis. Reprod. Fertil., 6:127-139, 1994.
FONTANELI, R.S. Fatores que afetam a composição e as características Físico-Químicas do leite. 2001. Disponível em:
Universidade Federal do Rio Grande do Sul – UFRGS, 2001.
GARCIA-BOJALIL, C.M., STAPLES, C.R., THATCHER, W.W. et al. Protein intake and development of ovarian follicles and embryos of superovulated nonlactating dairy cows. Journal of Dairy Science, 77(9):2537-2548, 1994.
GREGG, D.W., NETT, T.M. Direct effects of Estradiol 17-ÃY on the number of gonadotropin-releasing hormone receptors in the ovine pituitary. Biologic Reproduction, 40:288-293, 1989.
HOLTER, J.B., COLOVOS, N.F., DAVIS, H.A. et al. Urea for lactating dairy cattle. III. Nutritive value of rations of corn silage plus concentrate containing various levels of urea. Journal of Dairy Science, 51(8): 1243-1248, 1968.
HOWARD, H.J., AALSETH, E.P., ADAMS, G.D. et al. Influence of dietary protein on reproductive performance of dairy cows. Journal of Dairy Science, 70(8):1563-1571, 1987.
HUBER, J. T. Uréia ao nível do rúmen. In: 2º Simpósio sobre Nutrição de Bovinos, 1984, Piracicaba. Anais... Piracicaba: FEALQ, p.25-79, 1984.
HUBER, J.T., COOK, R.M. Influence of site of administration of urea on voluntary intake of concentrate by lactating cows. Journal of Dairy Science, 55(10):1470-1473, 1972.
HUBER, J.T., KUNG, JR.L. Protein and nonprotein nitrogen utilization in dairy cattle. Journal of Dairy Science., 64(6): 1170-1195.
JORDAN, E.R.,CHAPMAN, T.E., HOLTAN, D.W. et al. Relationship of dietary crude protein to composition of uterine secretions and blood in high-producing postpartum dairy cows. Journal of Dairy Science, 66(9): 1854-1862, 1983.
JORDAN, E.R., SWANSON, L.V. Effect of crude protein on reproductive efficiency, serum total protein, and albumin in the high-producing dairy cow. Journal of Dairy Science, 62(1):58-63, 1979.
LEHNINGER, A.L.; NELSON, D.L.; COX, M.M. Princípios de Bioquímica. 2.ed. São Paulo: SARVIER, 839p, 1995.
LUCCI, C. S. Nutrição e manejo de bovinos leiteiros. 1.ed. São Paulo: Manole Ltda. 169p, 1997.
MERTENS, D.R. Analysis of fiber in feeds and its uses in feed evaluation and ration formulation. In: SIMPÓSIO INTERNACIONAL DE RUMINANTES, REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 29, 1992, Lavras. Anais... Lavras: SBZ, 1992. p.188-219.
MERTENS, D.R. Regulation of forage intake. In: FAHEY JR., G.C. (Ed) Forage quality, evaluation and utilization. Madison: American Society of Agronomy. p.450-493, 1994.
MINSON, D.J. Nutritional differences between tropical and temperate pastures. In: MORLEY, F.H.W. Grazing animals. New York: Elsevier, p.143-157, 1981.
NATIONAL RESEARCH COUNCIL - NRC. 1989. Nutrient requirement of dairy cattle. 6.ed. Washington: National Academy. 242p.
NETT, T.M. Function of the hypothalamic-hypophysial axis during the post-partum period in ewes and cows. Journal Reproduction Fert., Supp, 34 (1987):201-213, 1987.
OBA, M., ALLEN, M.S. Evaluation of the importance of the digestibility of neutral detergent fiber from forage: effects on dry matter intake and milk yield of dairy cows. Journal of Dairy Science, 82(3):589-596. 1999.
OLIVEIRA, M.M.N.F. Uréia para Vacas Leiteiras no pós-parto: Dinâmica Folicular e Características Reprodutivas. Tese de doutorado. Viçosa. Minas Gerais. 2001.
OPSOMER, G., MITJEN, P., CORYN, M. et al. Post-partum anoestrus in dairy cows: a review. Vet. Quarter., 18:68-75, 1996.
PHOGAT, J.B., SMITH, R.F., DOBSON, H. The influence of stress on neuroendocrine control of the hypothalamic-pituitary-ovarian axis. Vet. Bulletin., 67(7):552-567, 1997.
RANDEL, R.D. Nutrition and postpartum rebreeding in catlle. Journal of Animal Science, 68:853-862, 1990.
ROCHE, J.F., CROWE, M.A., BOLAND, M.P. Postpartum anoestrus in dairy and beef cows. Animal Reproduction Science, 28:371-378, 1992.
ROSELER, D.K., FERGUSON, C.J., SNIFFEN, C.J. et al. Dietary protein degradability effects on plasma and milk nonprotein nitrogen in holstein cows. Journal of Dairy Science, 76(2):525:534, 1993.
RUSSEL, J.B. Minimização das perdas de nitrogênio pelos ruminantes. In: SIMPÓSIO INTERNACIONAL DE RUMINANTES, 1992, Lavras. Anais... Lavras: SBZ, 1992. p.232-251.
SANTOS, F.A.P.; SANTOS, J.E.P. Volumosos na produção de ruminantes: Valor alimentício de forragens. Jaboticabal, FUNEP, 264p.:il, 2003.
SANTOS, J.E.; AMSTALDEN, M. Effects of Nutrition on Bovine Reproduction. Arq. Fac. Vet. UFRGS, Porto Alegre, v.26, n.1, 1998 (Supl.).
SAVIO, J.D., BOLAND, M.P., HYNES, N. et al. Resumption of follicular activity in the early postpartum period of dairy cows. J. Reprod. Fert., 88:569-579, 1990.
SILVA, R.M.N. Uréia para vacas em lactação: consumo, digestibilidade, produção e composição do leite, e estimativas do volume urinário, da produção microbiana e da excreção de uréia. Viçosa, MG: UFV, 85p. Dissertação (Mestrado em Medicina Veterinária) – Universidade Federal de Viçosa, 2000.
SMITH, D.R. Estrus Detection. In: Current therapy in Theriogenology. 2. West Washington Square, Philadelphia, 1143p, 1986.
SNIFFEN, C.J., BEVERLY, R.W., MOONEY, C.S. et al. Nutrient requirements versus supply in the dairy cow: strategies to account for variability. Journal of Dairy Science, 76(10):3160-3178, 1993.
SONDERMAN, J.P., LARSON, L.L. Effect of dietary protein and exogenous gonadotropin-releasing hormone on circulating progesterone and performance Holstein cows. Journal of Dairy Science, 72:2179-2183, 1989.
SPICER, L.J., ALPIZAR, E., ECHTERNKAMP, S.E. Effects on insulin, insulin-like growth factor I, and gonadotropins on bovine granulosa cell proliferation, progesterone production, Estradiol production, and (or) insulin-like growth factor I production in vitro. Journal of Animal Science, 71:1232-1241, 1993.
STAPLES, C.R., GARCIA-BOJALIL, C.M., OLDICK, B.S. et al. Protein intake and reproductive performance of dairy cows: a review, a suggested mechanism, and blood and milk urea measurement. In: Proc. 4th Annu. Florida Ruminant Nutr. Symp. Univ. Florida, Gainesville, 1993.
SWANSON et al. Interactions of Nutrition and Reproduction. Journal of Dairy Science, v. 72, n.3, 1989.
ROSELER, D.K., FERGUSON, C.J., SNIFFEN, C.J. et al. Dietary protein degradability effects on plasma and milk nonprotein nitrogen in Holstein cows. Journal of Dairy Science, 76(2): 525:534, 1993.
TEIXEIRA, A.S. Alimentos e Alimentação. Lavras: ESAL/FAEPE, 357p, 1990.
TEIXEIRA, A.S. Nutrição de Ruminantes. Lavras. ESAL/FAEPE, 267p, 1991.
VALADARES, R.F.D., VALADARES FILHO, S.C., GONÇALVES, L.C. et al. Níveis de proteína em dietas de bovinos. 4. concentrações de amônia ruminal e uréia plasmática e excreções de uréia e creatinina. Revista Brasileira de Zootecnia, 26(6):1270-1278, 1997.
VALADARES FILHO, S.C., BRODERICK, G.A., VALADARES, R.F.D. et al. 2000. Effect of replacing alfafa silage with high moisture corn on nutrient utilization and milk production. Journal of Dairy Science, 83(1):106-114.
VAN SOEST, P.J. Nutritional ecology of the ruminants. 2.ed. Ithaca: Cornell University. 476p, 1994.
ZUREK, E., FOXCROFT, G.R., KENNELY, J.J. Metabolic status and interval to first ovulation in postpartum dairy cows. Journal of Dairy Science, 78(9): 1909-1920, 1995.
WILSON, G., MARTZ, F.A., CAMPBELL, J.R. et al. Evaluation of factors responsible for reduced voluntary intake of urea for ruminants. Journal of Animal Science, 41(5): 1431-1437, 1975.
WOODFORD, J.A., JORGENSEN, N.A., BARRINGTON, G.P. Impact of dietary fiber and physical form on performance of lactating dairy cows. Journal of Dairy Science, 69(4):1035-1047, 1986.
Dedicatória
Agradeço primeiramente a Deus pela força de continuar estudando nos momentos mais difíceis;
A Meus pais Vidal Carneiro Neto e Maria Augusta L. Carneiro (in memorian) pelo apoio e carinho fora de casa;
A meus irmãos Vitor Ugo Carneiro e Nabila Carneiro Margarido também pelo apoio e compreensão e aos meus cunhados Alberto Margarido e Siméia Souza Pereira.
Aos meus colegas de sala pela companhia durante todo o curso;
Aos meus mestres pela brilhante formação profissional, em especial a Profª.Drª. Margarida M. N. Figueiredo de Oliveira pela amizade sincera e pelo exemplo de profissional que me inspira.
Autor:
Camila Carneiro
ca.carneiro[arroba]hotmail.com
Orientadora
PROFª.Drª. Margarida Maria Nascimento Figueiredo de Oliveira


UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI
FACULDADE DE CIÉNCIAS AGRÁRIAS
DEPARTAMENTO DE ZOOTECNIA
Diamantina/MG
Dezembro de 2006.
UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI
FACULDADE DE CIÉNCIAS AGRÁRIAS
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|