ESTRUCTURA DEL ÁTOMO
1. Modelo
científico
2. Evolución de los modelos
atómicos
-Modelo de
Thompson
-Modelo de
Rutherford
-Modelo de
Böhr
-Modelo
mecano-cuántico
3. Estructura del
átomo
-Estructura del
núcleo
-Estructura de
la corteza
1. MODELO CIENTÍFICO.-
Supongamos que nos dan una caja cerrada que no nos
está permitido abrir y que contiene algo en su interior.
Como no la podemos abrir, tendremos que recurrir a hacer una
serie de pruebas o
ensayos para
averiguar lo que contiene: agitarla, pesarla, … Con los
datos
obtenidos podremos forjar una idea, una imagen mental,
sobre el contenido de la caja. Por otra parte, la idea o modelo
que imaginamos nos permitirá formular predicciones: si,
por ejemplo, concluimos que se trata de un líquido,
podremos predecir que al hacerle un agujero, tal líquido
se derramará.
Una idea o teoría
sobre la naturaleza de un
fenómeno para explicar hechos experimentales constituye lo
que en ciencias se
denomina modelo científico.
Un ejemplo de modelo científico es el modelo
atómico. Nadie ha visto nunca un átomo. Es
más, la propia ciencia
predice que nunca se podrá ver. Sin embargo, observando
una serie de fenómenos en el comportamiento
de la materia es
posible desarrollar una serie de ideas de como será la
estructura de
la materia.
2. EVOLUCIÓN DE LOS MODELOS
ATÓMICOS.-
Demócrito, filosofo griego, fueron probablemente
los primeros en creer que la materia estaba
constituida por partículas que denominaron
átomos, palabra que significa "sin
división", ya que consideraban el átomo como
único e indivisible. Se basaba, no en pruebas
experimentales, sino en un razonamiento que puede sintetizarse
así: un trozo de metal puede cortarse en 2 pedazos y
cada uno de éstos en dos pedazos más…; estos
pueden dividirse sucesivamente hasta llegar a un momento en que
se obtenga una partícula que ya no sea posible dividirla:
el átomo. Pensaba que los átomos
tendrían formas y tamaños distintos:
esféricos ,cilíndricos, irregulares…
Empédocles, otro filósofo griego, no
creía en tal teoría
y postulaba la idea de que la materia estaba
constituida por 4 elementos que se combinaban entre sí.
Según él, la vida sólo era posible donde
había humedad: una flor sin agua se muere;
luego el primer elemento era el agua. Pero
el agua no es
sólida, se escapa de las manos. Una montaña no
puede estar formada de agua y
necesita, por tanto, otro elemento que le dé consistencia,
solidez. La tierra fue
el segundo elemento de que habló Empédocles, pues,
a su juicio, daba consistencia al agua. Sin
embargo, el barro que resultaba de esta mezcla era muy blando.
Creyó entonces que quien le daba dureza era un tercer
elemento, el aire, pues seca o
evapora el agua que
contienen las cosas. Por último, Empédocles
consideró el fuego como 4º elemento.
Posteriormente transcurre un largo período en la
historia de la
Química,
la Alquimia, donde la preocupación primordial es tratar de
convertir los metales conocidos en
oro.
Hacia el 1800, el profesor inglés
John Dalton recogió la idea del átomo que
dio el filosofo Demócrito, si bien esta vez
basándose en métodos
experimentales. Mediante el estudio de las leyes
ponderales, concluye que:
- la materia
está constituida por partículas
indivisibles (átomos), - todos los átomos de un mismo elemento
químico son iguales, - los átomos de elementos diferentes son
también diferentes.

Modelo atómico de
Thompson.-

En 1897 Joseph John Thompson realiza una serie de
experimentos y
descubre el electrón. En tubos de gases a baja
presión en los que se establece una diferencia de
potencial superior a 10.000 voltios, se comprobó que
aparecían partículas con carga eléctrica
negativa a las que se llamó electrones, y demostró
que habían sido arrancados de los átomos (los
cuales eran neutros). Tal descubrimiento modificó el
modelo atómico de Dalton, que lo consideraba indivisible.
Thompson supuso el átomo como
una esfera homogénea e indivisible cargada positivamente
en la que se encuentran incrustados los electrones.
Modelo atómico de
Rutherford
Posteriormente otro físico inglés,
Ernest Rutherford, realizó una serie de experimentos.
Hizo incidir sobre una lámina finísima de oro un
delgado haz de partículas cargadas positivamente de masa
mucho mayor que el electrón y dotadas de energía
cinética alta. En el choque observó distintos
comportamientos:
- la mayoría atravesaban la lámina sin
desviarse - algunas se desviaban
- muy pocas retrocedían
Esta experiencia implicaba:
- que los átomos estaban casi vacíos,
pues la mayoría de las partículas las
atravesaban - que hay una zona cargada positivamente, ya que
algunas partículas retrocedían o se desviaban.
Esta zona debe estar muy concentrada ya que es mayor el
número de desviaciones que de choques.
Esto le condujo a proponer en 1911 un nuevo modelo
atómico en el que se afirmaba que los átomos
estaban constituidos por 2 zonas bien
diferenciadas:

- Una de carga positiva con el 99,9% de la masa muy
concentrada y por tanto de gran densidad a la
que llamó núcleo. - Otra rodeando al núcleo a la que llamó
corteza donde estaban los electrones con carga negativa
girando alrededor del núcleo.
Sin embargo, el modelo de Rutherford presentaba
fallos:
- Según la teoría clásica de electromagnetismo, una partícula
eléctrica acelerada emite energía. Y el
electrón girando el torno al
núcleo está sometido a una aceleración
centrípeta por lo que irradiaría energía,
perdería velocidad y,
por fin, caería al núcleo desestabilizando el
átomo. Pero como el átomo de hecho
es estable, las cosas no pueden ocurrir según el modelo
de Rutherford. - No explicaba los espectros
Radioactividad
Radioactividad es la propiedad que
presentan los núcleos atómicos de ciertos
isótopos de modificar espontáneamente su constitución, emitiendo
simultáneamente una radiación característica.
La radioactividad puede ser:
- Radioactividad natural: Es la que manifiestan los
isótopos que se encuentran en la naturaleza. - Radiactividad artificial o inducida: Es la que ha
sido provocada por transformaciones nucleares
artificiales.
Radiactividad natural
En 1896 Becquerel descubrió que ciertas sales de
uranio emitían radiaciones espontáneamente, al
observar que velaban las placas fotográficas envueltas en
papel
negro.
Hizo ensayos con el
mineral en caliente, en frío, pulverizado, disuelto en
ácidos y la intensidad de la misteriosa radiación
era siempre la misma. Por tanto, esta nueva propiedad de
la materia, que recibió el nombre de radiactividad, no
dependía de la forma física o química en la que se
encontraban los átomos del cuerpo radiactivo, sino que era
una propiedad que
radicaba en el interior mismo del átomo.
El estudio del nuevo fenómeno y su desarrollo
posterior se debe casi exclusivamente a los esposos Curie,
quienes encontraron otras sustancias radiactivas como el torio,
polonio y radio. La
intensidad de la radiación emitida era proporcional a la
cantidad de uranio presente, por lo que dedujo Marie Curie que la
radiactividad era una propiedad
atómica
El fenómeno de la radiactividad se origina
exclusivamente en el núcleo de los átomos
radiactivos. Y la causa que lo origina se cree que es debida a la
interacción neutrón-protón del
mismo.

Al estudiar la radiación emitida por el radio se
comprobó que era compleja, pues al aplicarle un campo
magnético parte de ella se desviaba de su trayectoria y
otra parte no.
Se comprobó que dicha radiación consta de
3 partes:
- Radiación a : Identificada con núcleos
de Helio ( ),
),
constituidos por dos protones y dos neutrones. Por tanto,
poseen dos cargas positivas y son desviadas por campos
eléctricos y magnéticos. Es poco penetrante
aunque muy ionizante. - Radiación b : Son electrones resultantes de la
desintegración de los neutrones del
núcleo:
neutrón® protón + electrón +
neutrino
Debido a su carga es desviada por campos
eléctricos y magnéticos. Es más
penetrante, aunque su poder de
ionización no es tan elevado como el de la
radiación a
.
- Radiación g : No es corpuscular como las 2
anteriores, sino de naturaleza
electromagnética. Al no tener carga, los campos
eléctricos y magnéticos no la afectan. Es la
más penetrante, y muy peligrosa.
Las leyes de
desintegración radiactiva, descritas por Soddy y Fajans,
son:
- Cuando un átomo radiactivo emite una
partícula a
, la masa del átomo resultante disminuye en 4
unidades y el número atómico en 2. - Cuando un átomo radiactivo emite una
partícula b
, la masa del átomo resultante no varía y
su número atómico aumenta en una
unidad. - Cuando un núcleo exitado emite una
radiación g
no varía ni su masa ni su número
atómico, solo pierde una cantidad de energía
hv.
Las dos primeras leyes nos indican
que cuando un átomo emite una radiación
a o b se transforma en otro
átomo de un elemento diferente. Este nuevo elemento puede
ser radiactivo, transformándose en otro, y así
sucesivamente, dando lugar a las llamadas series
radiactivas.
Radiactividad artificial.
Se produce la radiactividad inducida cuando se
bombardean ciertos núcleos estables con partículas
apropiadas.
Si la energía de estas partículas tiene un
valor adecuado
penetran dentro del núcleo bombardeado y forman un nuevo
núcleo que, en caso de ser inestable, se desintegra
después radiactivamente.
Fue descubierta por los esposos Curie, bombardeando
núcleos de boro y aluminio con
partículas a
. Observaron que las sustancias bombardeadas emitían
radiaciones después de retirar el cuerpo radiactivo emisor
de las partículas a de bombardeo.
El estudio de la radiactividad permitió un mayor
conocimiento
de la estructura del
núcleo atómico y de las partículas
subatómicas. Se abre la posibilidad de convertir unos
elementos en otros. Incluso el sueño de los alquimistas de
transformar otros elementos en oro se hace realidad, aunque no
resulte rentable.
ESPECTROS
ÓPTICOS.-


Cuando se hace pasar la radiación emitida por un
cuerpo caliente a través de un prisma óptico, se
descompone en distintas radiaciones electromagnéticas
dependiendo de su distinta longitud de onda (los distintos
colores de la
luz visible,
radiaciones infrarrojas y ultravioleta) dando lugar a un
espectro óptico. Todas las radiaciones obtenidas
impresionan las películas fotográficas y así
pueden ser registradas.
Cada cuerpo caliente da origen a un espectro diferente
ya que esta depende de la propia naturaleza del
foco.
Los espectros pueden ser de emisión y
absorción. A su vez ambos se clasifican en continuos y
discontinuos:
- ESPECTROS DE EMISIÓN: Son aquellos que
se obtienen al descomponer las radiaciones emitidas por un
cuerpo previamente exitado.
– Los espectros de emisión continuos se
obtienen al pasar las radiaciones de cualquier
sólido incandescente por un prisma. Todos los
sólidos a la misma Temperatura
producen espectros de emisión iguales.

Espectro continuo de la luz
blanca
– Los espectros de emisión discontinuos
se obtienen al pasar la luz de vapor
o gas exitado. Las radiaciones emitidas son características de los átomos
exitados.

Espectro de emisión de vapores de
Li
- ESPECTROS DE ABSORCIÓN:
Son los espectros resultantes de intercalar una
determinada sustancia entre una fuente de luz y un
prisma
– Los espectros de absorción continuos
se obtienen al intercalar el sólido entre el foco de
radiación y el prisma. Así, por ejemplo, si
intercalamos un vidrio de
color azul
quedan absorbidas todas las radiaciones menos el
azul.
– Los espectros de absorción
discontinuos se producen al intercalar vapor o gas entre la
fuente de radiación y el prisma. Se observan bandas o
rayas situadas a la misma longitud de onda que los espectros de
emisión de esos vapores o gases.

Espectro de absorción de vapores de
Li
Se cumple así la llamada ley de
Kirchhoff, que dice:
Todo cuerpo absorbe las mismas radiaciones que es capaz
de emitir.
TEORÍA DE PLANCK
En 1900 emitió una hipótesis que interpretaba los resultados
experimentales satisfactoriamente como los cuerpos captaban o
emitían energía.
Según Planck, la energía emitida o captada
por un cuerpo en forma de radiación
electromagnética es siempre un múltiplo de la
constante h, llamada posteriormente constante de
Planck por la frecuencia v de la
radiación.
e
=nhv
h=6,62 10-34 J·s, constante de
Planck
v=frecuencia de la radiación
A hv le llamó cuanto de
energía. Que un cuanto sea más
energético que otro dependerá de su
frecuencia.
Modelo atómico de Bohr.-
Para salvar los inconvenientes del modelo anterior, N
Bohr estableció una serie de postulados (basados en la
teoría
de Planck y los datos
experimentales de los espectros) que constituyen el modelo
atómico de Bohr:
- Admitió que hay ciertas órbitas
estables en las cuales los electrones pueden girar alrededor
del núcleo sin radiar energía. Deduce que
sólo son posibles aquellas órbitas en las que el
momento angular del electrón es múltiplo entero
de
.
![]()
Introduce un número n, llamado
número cuántico principal, que da nombre a las
distintas órbitas del
átomo.

- El electrón, cuando emite energía cae
de una órbita a otra más próxima al
núcleo. Lo contrario ocurre si capta
energía.
Como según la teoría
electromagnética una carga acelerada tiene que irradiar
energía, no puede haber ningún orbital permanente.
Por eso, Bohr argumentaba que no se podía perder
energía continuamente, sino en cuantos (de acuerdo con la
teoría de Planck) equivalentes a la diferencia de
energía entre las órbitas
posibles.

Cuando a un átomo se le suministra energía
y los electrones saltan a niveles más energéticos,
como todo sistema tiende a
tener la menor energía posible, el átomo es
inestable y los electrones desplazados vuelven a ocupar en un
tiempo
brevísimo (del orden de 10-8) el lugar que
dejasen vacío de menor energía, llamados niveles
energéticos fundamentales.

Así pues, ya tenemos una explicación de
los espectros atómicos con el modelo de Bohr. Cuando un
átomo es exitado por alguna energía exterior,
algún electrón absorbe dicha energía pasando
de un nivel energético fundamental a niveles de
energía superior. Como, según Planck, la
absorción de energía está cuantizada, la
diferencia de energía entre ambos niveles será
hv. El electrón absorbe solo una radiación
de frecuencia v determinada mayor cuanto mayor sea el
"salto" del electrón.
Así, en el espectro de absorción
aparecerá una banda continua con algunas rayas negras que
corresponderán a aquellas frecuencias determinadas que los
electrones han captado para pasar de un nivel a otro más
energético.

Como el átomo exitado es inestable, en un
tiempo
brevísimo el electrón desplazado volverá al
nivel energético fundamental, emitiendo una energía
de la misma frecuencia hv que absorbió
anteriormente.
Así, el espectro de emisión del elemento
estará formado por líneas definidas, situadas en la
misma longitud de onda que el espectro de emisión,
separadas por zonas oscuras.
Ello explica por que los espectros de los vapores o
gases (en los
que nos encontramos los átomos o moléculas aislados
sin interaccionar entre sí) son discontinuos.
Es un hecho experimental que cada elemento
químico tiene su espectro atómico característico.
Fue a partir de las series del hidrógeno, de las
frecuencias de las distintas radiaciones emitidas, de donde Bohr
dedujo los niveles de energía correspondientes a las
órbitas permitidas. Sin embargo, al aplicar esta distribución de los niveles
energéticos a otros elementos no se correspondían
esos cálculos teóricos con los resultados
experimentales de los espectros, que eran muchos más
complejos. Incluso el mismo átomo de Hidrógeno con
espectroscopios más precisos producía líneas
que con el modelo de Bohr no se podía explicar.
Corrección de
Somerfield.-

Al perfeccionarse los espectroscopios (aparatos que
muestran los espectros) se observó que las líneas
del espectro del hidrógeno eran en realidad varias
líneas muy juntas. Y lo que Bohr Creyó que eran
estados únicos de energía eran varios estados muy
próximos entre sí.
Sommerfield lo interpretó diciendo que las
órbitas podían ser elípticas. Para ello
introdujo un nuevo número cuántico l,
también llamado número azimutal, que puede
valer:
l=0,1,…,(n-1)
Este número nombra a cada uno de los niveles de
energía posibles para cada valor de
n. Con Sommerfield, para determinar la posición del
electrón en el átomo de hidrógeno hay que
dar 2 números cuánticos l y
m.
Efecto Zeeman.-
Cuando se obtiene el espectro del átomo de
hidrógeno mientras el gas está
dentro de un campo magnético se observa un desdoblamiento
de las líneas que analizó Sommerfield. Cada una de
estas líneas se desdoblaba en varias. Este fenómeno
desaparecía al desaparecer el campo magnético por
lo que no se debe a que existan nuevos estados distintos de
energía del electrón, sino que está
provocado por la interacción del campo magnético
externo y el campo magnético que crea el electrón
al girar en su órbita.
Este problema se solucionó pensando que para
algunas de las órbitas de Sommerfield existen varias
orientaciones posibles en el espacio que interaccionan de forma
distinta con el campo magnético externo. Para ello se creo
un nuevo número cuántico magnético, que vale
para cada valor de
l:
m=-l,…,-1,0,1,…,+l
Para determinar pues la posición del
electrón en el átomo de hidrógeno hay que
dar 3 números cuánticos: n, l, m.
Efecto Zeeman anómalo.-
Al perfeccionar los espectroscopios y analizar los
espectros obtenidos por el efecto Zeeman, se comprobó que
cada línea era en realidad dos líneas muy juntas.
Esto se llamó efecto Zeeman anómalo, y si
desaparecía el campo magnético externo
también desaparecía este efecto.
Se explicó admitiendo que el electrón
puede girar sobre sí mismo y hay dos posibles giros, que
interaccionaban de forma distinta con el campo magnético
externo y que por eso cada línea se desdoblaba en 2. Se
creó un nuevo número cuántico s, o
número de spin (giro), al que se le dio 2 valores, uno
para cada sentido:
s=+1/2,-1/2
Para describir la posición de un electrón
se necesitan 4 números cuánticos:
(n,l,m,s).
Sin embargo, todo lo anterior sólo era
útil para el átomo de hidrógeno, pues su
aplicación en la descripción de otros átomos
fracasó.
PRINCIPIO DE INCERTIDUMBRE
Principio enunciado en 1927 por el alemán Werner
Heisenberg según el cual no puede ser conocida
con exactitud y simultáneamente la posición y la
cantidad de movimiento de
un electrón..
Este principio tiene su origen en la mecánica cuántica según la
cual el mismo hecho de medir la velocidad o la
posición de un electrón implica una
imprecisión en la medida
Por ejemplo, en el caso de que pudiéramos "ver"
un electrón u otra partícula subatómica,
para poder medir la
velocidad
habría que iluminarlo. Pues bien, el fotón que
ilumina a ese electrón modifica la cantidad de movimiento del
mismo. Por tanto, modificaría su velocidad
original que es lo que queríamos medir.
DUALIDAD ONDA-CORPÚSCULO
Al igual que el átomo, la luz ha sido
motivo de estudio del hombre desde
hace mucho tiempo, debido a
su afán de comprender mejor las cosas que le
rodean.
Ya 500 años antes de Jesucristo, Pitágoras
afirmaba que la luz está formada por partículas que
fluyen en línea recta y a gran velocidad del
propio cuerpo luminoso que captan nuestros ojos.
Más tarde, Aristóteles sostuvo que la luz se propaga
desde el cuerpo hasta el ojo, análogamente a como el
sonido parte
del cuerpo y llega al oído por vibraciones del aire.
Newton (1642-1727), se opuso tenazmente a esta
teoría ondulatoria y fue partidario de la teoría
corpuscular, cuya idea coincidía con la de
Pitágoras. Esta teoría explica bien la
reflexión (la luz se refleja en un espejo de modo
análogo como una bola de billar rebota en la banda de la
mesa). La refracción de la luz, aunque con más
dificultades es también explicada, pero otros
fenómenos como la polarización y la
difracción no encuentran respuestas.
Para otros, partidarios de la teoría ondulatoria
de Huyghens (1629-1695), la luz está formada por
vibraciones del éter. Sin embargo, pese a que esta explica
perfectamente fenómenos como la polarización y la
defracción, el gran prestigio de Newton, hizo
que la teoría corpuscular prevaleciera durante todo el
siglo XVIII.
Hasta el siglo XIX los físicos estaban divididos
sobre la naturaleza de la
luz. En 1815, el inglés
Maxwell dedujo teóricamente que la velocidad de las
ondas
electromagnéticas era la misma que la de la luz. Este
hecho le sugirió la idea de que la luz debía estar
formada por vibraciones electromagnéticas de frecuencia
elevada que no necesitan ningún medio material para
propagarse. Según esta teoría no era necesaria la
existencia del hipotético éter y la luz entraba a
formar parte de las radiaciones electromagnéticas. Esto
supuso un golpe de muerte para la
teoría corpuscular.
Cuando parecía que el modelo ondulatorio de
Huygens había logrado dar una explicación exacta
sobre la naturaleza de la luz, los experimentos de
Hertz en el año 1887 vienen a introducir un nuevo
problema: el efecto fotoeléctrico: cuando se ilumina una
superficie metálica con una radiación de frecuencia
adecuada se produce una emisión de electrones. La
teoría ondulatoria no da explicación suficiente del
efecto fotoeléctrico, ya que según la misma la
energía transportada por una onda es independiente de su
frecuencia, mientras que la experiencia nos demuestra que por
debajo de cierta frecuencia el efecto fotoeléctrico no se
produce.
La explicación del efecto fotoeléctrico
fue dada por A. Einstein, basándose en la Teoría de
Planck. Para Einstein, si la energía es emitida o
absorbida de manera discontinua mediante cuantos de
energía (como sostenía Planck) es porque la misma
naturaleza de la luz (la energía radiante) es discontinua
y está formada por paquetes de energía hv a
los que llamó fotones, de modo que actúan de manera
similar a los corpúsculos de Newton.
Se permaneció así, con un doble
carácter corpuscular y ondulatorio, que prevalecía
uno sobre otro según qué fenómeno se
tratase, hasta que en 1923 Luis de Broigle acabó con las
discrepancias y estableció la dualidad
onda-corpúsculo. Según Broigle, el fotón
puede ser considerado como un corpúsculo que parte del
cuerpo luminoso y que en su rápido movimiento
origina una onda electromagnética (cuya longitud de onda
dedujo: l
=h/mv), convertiendose así en un
corpúsculo-onda, del mismo modo que al avanzar
rápido un proyectil origina un movimiento
periódico que nosotros percibimos como
sonido. Del
mismo modo que electrón transporta su campo
eléctrico, cada cuanto de radiación transporta
consigo un fenómeno periódico
que se extiende por el espacio circundante. Por consiguiente, la
aparente contradicción sobre la doble naturaleza de la luz
cesa desde el momento en que la energía radiante
constituida a la vez por ondas y
corpúsculos, indisolublemente asociados. Porque
entonces se concibe sin dificultad que el carácter
ondulatorio se manifiesta más especialmente en ciertos
fenómenos, mientras que en otros prevalece el
carácter corpuscular.
Modelo mecanocuántico del
átomo.-
Una de las consecuencias deducidas del Principio de
Indeterminación de Heisenberg es que la interacción
entre los aparatos de medida y los objetos de la medición
hace imposible determinar simultáneamente y con
precisión la posición y la velocidad del
electrón. De aquí se sigue la imposibilidad de
hablar de trayectorias: una trayectoria significa el
conocimiento de la posición de una partícula en
cada instante, y de la velocidad correspondiente a cada
posición. Con este punto de vista, los modelos de
Bohr y Sommerfield, muy intuitivos, han de parecer forzosamente
limitados. En 1924 el francés Luis de Broigle
amplía al electrón (y a otras partículas) la
noción de dualidad onda-corpúsculo, según la
cual el electrón lleva asociada una onda
electromagnética de longitud l =h/mv. La hipótesis ondulatoria de la materia y el
principio de indeterminación, alteraron los conceptos de
posición, velocidad y orbital electrónico.
Nació así un nuevo dominio de la
física, la
mecánica cuántica, que explica
coherentemente los fenómenos del microcosmos.
En 1926 el austríaco Schrödiger
basándose en la hipótesis de De Broigle y la idea de
órbitas permitidas de Bohr, supone que esas órbitas
debían de contener un número entero de longitudes
de onda lo que daría origen a una onda estacionaria.
Considerar una onda asociada al electrón explicaría
la razón de ser de los orbitales posibles que Bohr
estableció como postulado, cuya circunferencia
sería un múltiplo de la longitud de onda de los
electrones.
El estado de un
electrón de obtendría mediante la ecuación
que Shröringer postula en 1926. Teniendo en cuenta el
principio de incertidumbre dichas ecuaciones no
se pueden resolver, pero se obtienen la llamada función de
onda (Y ),
aproximación de carácter estadístico que nos
permite deducir para cada nivel de energía la probabilidad de
que los electrones estén en una u otra situación.
Las órbitas electrónicas quedan sustituidas por
zonas del espacio en la que existe el 99% de encontrar al
electrón, a la que llamamos orbitales.
3. ESTRUCTURA DEL
ÁTOMO.-
a) Núcleo
atómico.
Tiene un tamaño diminuto respecto al volumen del
átomo.
P. ej., para el átomo de Al:![]()
Con Rutherford sólo se sabía que tiene
carga eléctrica positiva. Hoy en día se sabe que,
con el excepción que el átomo de hidrógeno
(que sólo tiene un protón), los núcleos
atómicos contienen una mezcla de protones y neutrones,
colectivamente llamados como nucleones. El protón tiene la
misma carga que el electrón pero positiva. El
electrón es de tamaño similar, pero
eléctricamente neutro. Ambos tienen una masa de 1 UMA. Los
protones y los neutrones en el núcleo atómico se
mantienen unidos por la acción de la fuerza nuclear
fuerte, que supera a la fuerza de
repulsión electromagnética mucho más
débil que actúa entre los protones de carga
positiva.
La corteza del átomo está formada por unas
partículas llamadas electrones y de masa 1/1836 UMA, por
lo que al ser tan pequeña se desprecia. Como el
átomo es neutro debe haber el mismo número de
electrones que de protones.
Al número de protones se le llama Z o
número atómico, y se corresponde con el
número de orden en el sistema periódico.
Como el átomo es eléctricamente neutro
debe haber el mismo número de protones que de
electrones.
Al número de neutrones se llama N
La masa atómica (A) de un átomo
será la suma de los protones y de los neutrones (ya que la
del electrón por ser muy pequeña se
desprecia).
A=N+Z
Los átomos se representan así:![]() (puede que nos encontremos
(puede que nos encontremos
el número atómico y la masa cambiada, pero simepre
sabremos cual es uno y cual es otro porque la masa atómica
siempre será mayor que el número atómico).
Ej.:
![]() ,
,![]()
Para un mismo elemento químico, el número
de protones que tienen sus átomos en sus núcleos es
el mismo, pero no el de neutrones, el cual puede variar. Se
llaman Isótopos de un elemento químico a los
átomos deun mismo elemento químico que tienen el
mismo número atómico pero distinto número de
electrones. Ej.:
Isótopos del Hidrógeno:![]() (protón),
(protón), ![]() (deuterio),
(deuterio), ![]() (titrio)
(titrio)
Esto es opuesto a lo que afirmaba Dalton, ya que
creía que lo característico de los átomos de un
mismo elemento químico era su masa atómica . Pero
no, lo característico es su número
atómico, es decir, todos los átomos de un mismo
elemento químico siempre tienen igual número de
protones en sus núcleos, pero pueden tener distinto
número de neutrones, y por tanto diferentes masas
atómicas.
Los isótopos son los responsables de que la masa
de los elementos químicos en el sistema periódico
no sea un número entero, ya que la masa que presentan las
tablas periódicas es una masa resultante de promediar las
masas de los diferentes isótopos existentes de un mismo
elemento.
Los átomos son neutros, pues el número de
cargas positivas es igual al número de cargas, es decir,
el número de electrones es igual al número de
protones.
Puede ocurrir que el átomo pierda o gane
electrones (nunca que pierda o gane protones pues esto
acarrearía la transformación de ese átomo en
otro átomo de un elemento químico diferente),
adquiriendo carga eléctrica neta y dando lugar a un
ión:
- Si pierde electrones, adquiere carga eléctrica
positiva y el ión se llama
catión. - Si gana electrones, adquiere carga eléctrica
negativa y el ión se llama
anión.
b) Corteza atómica.-
NÚMEROS CUÁNTICOS
La situación de los electrones, su nivel de
energía y otras características se expresan
mediante los números cuánticos. Estos
números cuánticos, que se fueron introducinedo como
postulados a partir de las modificaciones introducidas en el
modelo de Böhr para explicar los fenómenos
experimentales, se pueden deducir teóricamente al resolver
la ecuación de onda Shrödinger.
Cada electrón dentro de un átomo viene
identificado por 4 números cuánticos:
- Número cuántico principal. Se
reperesenta por la letra n.
Nos da idea del nivel de energía y el volumen real
del orbital. Puede tomar los
valores:
n=1, 2, 3, 4, …
(K, L, M, N,…)
- Número cuántico secundario o
azimutal. Se representa por la letra l.
Determina la forma del orbital. Puede tomar los
valores:
l=0, 1, 2, 3, …,n-1
(s, p, d, f,…)
O sea,
Para n=1 ® l=0 (s)
n=2 ® ![]()
n=3 ® 
n=4 ® 
…
- Número cuántico
magnético. Se representa por la letra
m.
Nos indica la orientación que tiene el orbital
al someter el átomo a un campo magnético fuerte
(efecto Zeeman).
Puede tomar los
valores:
m=-l,…,0,…,+l
O sea,
Para l=0 ® m=0
l=1 ® 
l=2 ® 
l=3 ® 
Cada valor de m
es un orbital. En cada orbital caben como máximo 2
electrones.
Aspectos espaciales de los orbitales
atómicos.-
- Los orbitales s (l=0) son esféricos. Su
volumen depende
del valor de
n.
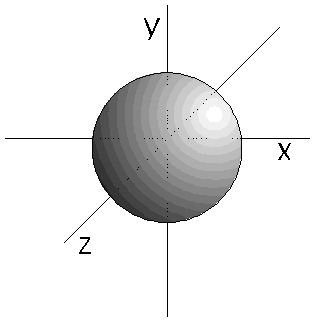
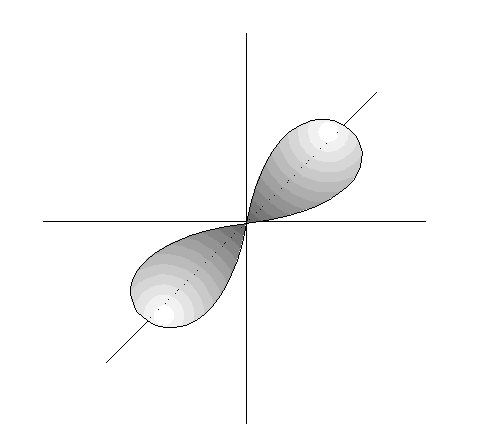
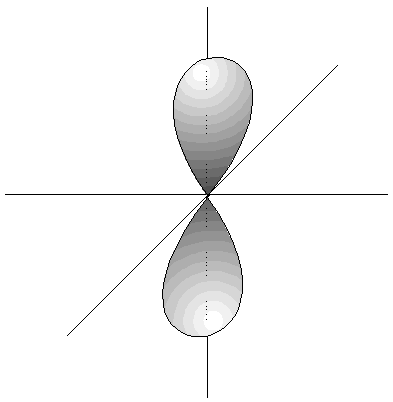
- Los orbitales p son 3, tienen forma de 2
lóbulos unidos por los extremos y orientados en la
dirección de los 3 ejes del
espacio. 
- Los orbitales d son 5, cuya disposición
y orientación dependen de los valores
de m. 

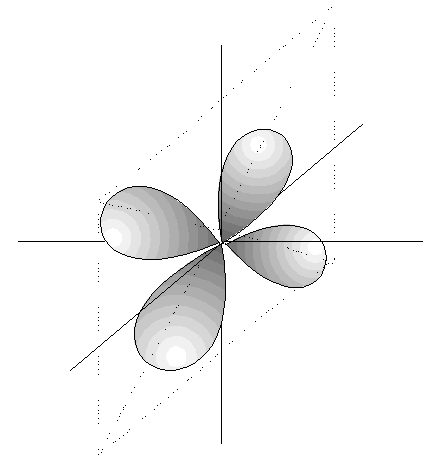
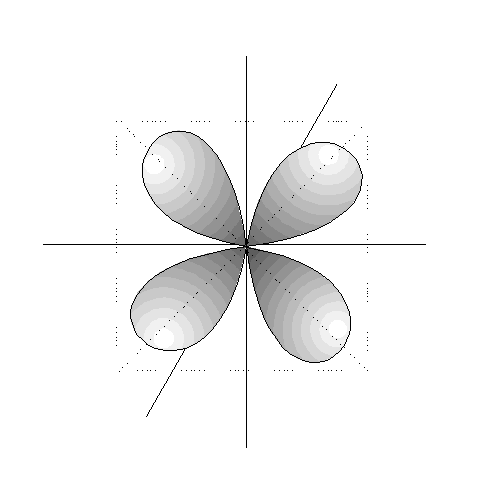
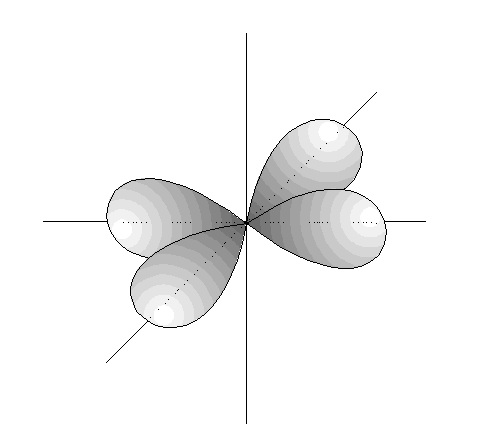
CONFIGURACIÓN
ELECTRÓNICA
Se entiende por configuración electrónica la distribución más estable, y por
tanto, más probable de los electrones en torno al
núcleo.
Para distribuir los electrones en los distintos niveles
de energía tenemos en cuenta los siguientes pricipios y
reglas:
- Principio de relleno o Aufbau. Los electrones
entran en el átomo en los distintos orbitales de
energía ocupando primero los de menor
energía.
Para saber el orden de energía de los orbitales
se usa el diagrama de
Mouller.

O Bien se sigue esta regla: "Los orbitales menos
energéticos son los de menor valor de n+l. Si los
orbitales tienen el mismo valor de n+l, tandrá menos
energía los de menor valor de n".
De acuerdo con estas reglas el orden es el
siguiente:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f,
5d, 6p, 7s
Sin embargo, este orden teórico presenta
algunas excepciones. Por ejemplo, en las configuraciones de los
lantánidos, aunque en teoría los orbitales 4f son
más energéticos que los 5d, en realidad el
átomo coloca primero un electrón en el 5d que
entonces se vuelve más energético, y empieza a
rellenar los 4f.
- En cada orbital sólo caben 2 electrones. Por
tanto, la capacidad de los distintos subniveles
son:
Subnivel | Nº de orbitales |
| Electrones por orbital | Número de electrones |
s | 1 (l=0) | * | 2 | 2 |
p | 3 (l=-1,0,+1) | * | 2 | 6 |
d | 5 (l=-2+1,0,1,2) | * | 2 | 10 |
f | 7 (l=-3,-2,-1,0,1,2,3) | * | 2 | 14 |
El número de electrones que caben
en cada sunivel se puede tambien facilmente mediante la
fórmula 2(2l+1) y el de cada nivel mediante la
fórmula 2n2.
- Principio de exclusión de Pauli. No
pueden existir dentro de un átomo dos electrones con sus
4 números cuánticos iguales. La consecuencia de
esto es que en un orbital sólo puede haber 2 electrones
con spines diferentes. - Principio de Hund o de máxima
multiplicidad. Un segundo electrón no entra en un
orbital que esté ocupado por otro mientras que haya otro
orbital desocupado de la misma energía (o sea, igual
los valores
de n y l)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 6f | 7s |
H | 1 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li | 3 | 2 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Be | 4 | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B | 5 | 2 | 2 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C | 6 | 2 | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N | 7 | 2 | 2 | 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O | 8 | 2 | 2 | 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F | 9 | 2 | 2 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ne | 10 | 2 | 2 | 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na | 11 | 2 | 2 | 6 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mg | 12 | 2 | 2 | 6 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al | 13 | 2 | 2 | 6 | 2 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si | 14 | 2 | 2 | 6 | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P | 15 | 2 | 2 | 6 | 2 | 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S | 16 | 2 | 2 | 6 | 2 | 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl | 17 | 2 | 2 | 6 | 2 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar | 18 | 2 | 2 | 6 | 2 | 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K | 19 | 2 | 2 | 6 | 2 | 6 |
| 1 |
|
|
|
|
|
|
|
|
|
|
|
|
Ca | 20 | 2 | 2 | 6 | 2 | 6 |
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Sc | 21 | 2 | 2 | 6 | 2 | 6 | 1 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Ti | 22 | 2 | 2 | 6 | 2 | 6 | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
V | 23 | 2 | 2 | 6 | 2 | 6 | 3 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Cr | 24 | 2 | 2 | 6 | 2 | 6 | 5 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
Mn | 25 | 2 | 2 | 6 | 2 | 6 | 5 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Fe | 26 | 2 | 2 | 6 | 2 | 6 | 6 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Co | 27 | 2 | 2 | 6 | 2 | 6 | 7 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Ni | 28 | 2 | 2 | 6 | 2 | 6 | 8 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Cu | 29 | 2 | 2 | 6 | 2 | 6 | 10 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
Zn | 30 | 2 | 2 | 6 | 2 | 6 | 10 | 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Ga | 31 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 1 |
|
|
|
|
|
|
|
|
|
|
|
Ge | 32 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 2 |
|
|
|
|
|
|
|
|
|
|
|
As | 33 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 3 |
|
|
|
|
|
|
|
|
|
|
|
Se | 34 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 4 |
|
|
|
|
|
|
|
|
|
|
|
Br | 35 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 5 |
|
|
|
|
|
|
|
|
|
|
|
Kr | 36 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 |
|
|
|
|
|
|
|
|
|
|
|
Rb | 37 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 |
|
| 1 |
|
|
|
|
|
|
|
|
Sr | 38 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 |
|
| 2 |
|
|
|
|
|
|
|
|
Y | 39 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 1 |
| 2 |
|
|
|
|
|
|
|
|
Zr | 40 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 2 |
| 2 |
|
|
|
|
|
|
|
|
Nb | 41 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 4 |
| 1 |
|
|
|
|
|
|
|
|
Mo | 42 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 5 |
| 1 |
|
|
|
|
|
|
|
|
Tc | 43 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 6 |
| 1 |
|
|
|
|
|
|
|
|
Ru | 44 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 7 |
| 1 |
|
|
|
|
|
|
|
|
Rh | 45 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 8 |
| 1 |
|
|
|
|
|
|
|
|
Pd | 46 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
|
|
|
|
|
|
|
|
|
|
Ag | 47 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 1 |
|
|
|
|
|
|
|
|
Cd | 48 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 |
|
|
|
|
|
|
|
|
In | 49 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 1 |
|
|
|
|
|
|
|
Sn | 50 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 2 |
|
|
|
|
|
|
|
Sb | 51 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 3 |
|
|
|
|
|
|
|
Te | 52 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 4 |
|
|
|
|
|
|
|
I | 53 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 5 |
|
|
|
|
|
|
|
Xe | 54 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 6 |
|
|
|
|
|
|
|
Cs | 55 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 6 |
|
|
| 1 |
|
|
|
Ba | 56 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 6 |
|
|
| 2 |
|
|
|
La | 57 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 |
| 2 | 6 | 1 |
|
| 2 |
|
|
|
Ce | 58 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 2 | 6 |
|
|
| 2 |
|
|
|
Pr | 59 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 3 | 2 | 6 |
|
|
| 2 |
|
|
|
Nd | 60 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 4 | 2 | 6 |
|
|
| 2 |
|
|
|
Pm | 61 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 5 | 2 | 6 |
|
|
| 2 |
|
|
|
Sm | 62 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 6 | 2 | 6 |
|
|
| 2 |
|
|
|
Eu | 63 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 7 | 2 | 6 |
|
|
| 2 |
|
|
|
Gd | 64 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 7 | 2 | 6 | 1 |
|
| 2 |
|
|
|
Tb | 65 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 9 | 2 | 6 |
|
|
| 2 |
|
|
|
Dy | 66 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 10 | 2 | 6 |
|
|
| 2 |
|
|
|
Ho | 67 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 11 | 2 | 6 |
|
|
| 2 |
|
|
|
Er | 68 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 12 | 2 | 6 |
|
|
| 2 |
|
|
|
Tm | 69 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 13 | 2 | 6 |
|
|
| 2 |
|
|
|
Yb | 70 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 |
|
|
| 2 |
|
|
|
Lu | 71 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 1 |
|
| 2 |
|
|
|
Hf | 72 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 2 |
|
| 2 |
|
|
|
Ta | 73 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 3 |
|
| 2 |
|
|
|
W | 74 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 4 |
|
| 2 |
|
|
|
Re | 75 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 5 |
|
| 2 |
|
|
|
Os | 76 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 6 |
|
| 2 |
|
|
|
Ir | 77 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 7 |
|
| 2 |
|
|
|
Pt | 78 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 9 |
|
| 1 |
|
|
|
Au | 79 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 1 |
|
|
|
Hg | 80 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 |
|
|
|
Tl | 81 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 1 |
|
|
Pb | 82 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 2 |
|
|
Bi | 83 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 3 |
|
|
Po | 84 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 4 |
|
|
At | 85 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 5 |
|
|
Rn | 86 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 6 |
|
|
Fr | 87 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 6 |
| 1 |
Ra | 88 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 6 |
| 2 |
Ac | 89 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 6 | 1 | 2 |
Th | 90 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 |
|
| 2 | 6 | 2 | 2 |
Pa | 91 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 2 |
| 2 | 6 | 1 | 2 |
U | 92 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 3 |
| 2 | 6 | 1 | 2 |
Np | 93 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 4 |
| 2 | 6 | 1 | 2 |
Pu | 94 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 5 |
| 2 | 6 | 1 | 2 |
Am | 95 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 6 |
| 2 | 6 | 1 | 2 |
Cm | 96 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 7 |
| 2 | 6 | 1 | 2 |
Bk | 97 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 8 |
| 2 | 6 | 1 | 2 |
Cf | 98 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 9 |
| 2 | 6 | 1 | 2 |
Es | 99 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 10 |
| 2 | 6 | 1 | 2 |
Fm | 100 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 11 |
| 2 | 6 | 1 | 2 |
Md | 101 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 12 |
| 2 | 6 | 1 | 2 |
No | 102 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 13 |
| 2 | 6 | 1 | 2 |
Lr | 103 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 | 2 | 6 | 10 | 14 |
| 2 | 6 | 1 | 2 |
Autor:
José González



