- Objetivos
- Marco
Teórico - Materiales
- Datos
teóricos y Experimentales - Cálculos y Resultados
- Discusión de los
resultados - Conclusiones
- Referencias
Objetivos
1) Pasar un objeto que determine
el profesor, dadas las instrucciones sobre el uso y manejo de
las balanzas monoplato.2) Determinar el volumen real de
una pipeta volumétrica y de un cilindro graduado para
las condiciones ambientales del laboratorio.3) Demostrar que con la pipeta se
miden volúmenes más exactos que con el cilindro
graduado, basándose en la técnica de
calibración.4) Calcular el promedio, mediana,
desviación absoluta, desviación
estándar, error absoluto y error relativo de los
mismos, dados una serie de datos.
Marco
Teórico
Se entiende por calibración al conjunto de
operaciones que establece, bajo condiciones específicas,
la relación entre las señales producidas por un
instrumento analítico y los correspondientes valores de
concentración o masa del juego de patrones de
calibrado.
Calidad de una Calibración
La calidad de la determinación de una
concentración no puede ser mejor que la calidad
intrínseca de la calibración. Los factores que
determinan la calidad de una calibración son:
La precisión de las
medidas
Estimada a través de la repetitividad y
la reproducibilidad de las medidas. La repetitividad se
evalúa a través del cálculo de la
desviación estándar relativa (RSD%) de la medida de
los patrones de calibrado. En la práctica puede ocurrir
que la repetitividad para los patrones sea más
pequeña que para las muestras, por lo que será
necesario fabricar patrones similares a las muestras o agregar el
analíto a las mismas.
Exactitud de los patrones
El valor de concentración o masa asignado a cada
patrón trae aparejado un error pequeño si es
preparado a partir de reactivos puros (grado analítico)
con estequiometría bien definida. Este error en general se
desprecia, frente al error en las medidas de las señales
producidas por el instrumento.
Validez de la calibración
Generalmente es el factor más importante. Cuando
se calibra un instrumento se debe tener una razonable certeza de
que éste responderá de igual manera a los patrones
así como a las muestras, aunque estas tengan una matriz
relativamente diferente. Si estas diferencias son muy grandes,
pueden llegar a invalidar el proceso de calibración. Es
necesario estar completamente seguro de que el calibrado es
válido antes de utilizarlo para obtener
el valor de concentración de muestras incógnita. En
caso contrario, pueden cometerse serios errores en la
determinación.
Fundamentos
teóricos:
Procedimiento experimental:
Se llevará a cabo la
calibración de una pipeta volumétrica de 25,00 ml y
un cilindro graduado de 25,00 ml de capacidad, los pasos a
realizar son los siguientes:
1) Determinar el peso del vaso de
precipitado vacío.2) Introducir aproximadamente
25,00 ml de agua destilada en un vaso de
precipitado.3) Luego con el cilindro graduado
medir esa cantidad de agua y la vertemos en el vaso de
precipitado.4) Determinar el peso del vaso de
precipitado con la cantidad de agua, y luego con el
termómetro tocando el fondo del vaso, determinar su
temperatura.5) Realizarlo 3 veces y luego
hacer el mismo procedimiento con la pipeta.6) Después de realizar el
experimento 3 veces con cada instrumento se precisarán
sus promedios, el valor de la masa, densidad y volumen del
agua, errores y desviaciones.
Para la realización de la
práctica se usarán las siguientes
fórmulas:

Materiales
Agua destilada.
Cilindro graduado de 25ml.
Pipeta volumétrica de
25ml.Vaso de precipitado de
150ml.Termómetro.
Balanza monoplato.
Datos teóricos
y Experimentales
Datos experimentales:
Tabla de datos experimentales para la
pipeta.
Peso Vaso Vacío | Peso vaso con agua (g) | Temperatura (ºC) |
112,45 g | 137,21 g | 25 ºC |
112,45 g | 137,21 g | 25 ºC |
112,45 g | 137,21 g | 25 ºC |
Tabla de datos experimentales para el
cilindro.
Peso Vaso Vacío | Peso vaso con agua (g) | Temperatura (ºC) |
112,45 g | 136,76 g | 25 ºC |
112,45 g | 136,79 g | 25 ºC |
112,45 g | 136,78 g | 25 ºC |
Datos teóricos:
Densidad (g/ml) | 0,99707 g/ml |
Cálculos y
Resultados
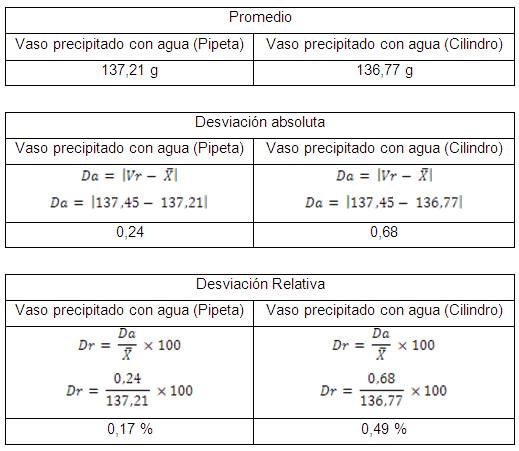
1) Calcular el promedio, desviación
absoluta, desviación media de las tres pesadas del vaso de
precipitado vacío.

2) Calcular el promedio, desviación
absoluta, desviación media de las tres pesadas del vaso de
precipitado con agua.
3) Calcular la masa del agua por
diferencia.

4) Calcular el volumen del agua con el
valor de su densidad para la temperatura medida durante el
desarrollo de la experiencia:

5) Al volumen obtenido determínele
promedio, desviación absoluta, desviación media de
los tres valores.

6) Calcular el error absoluto y error
relativo para el volumen de cada instrumento.
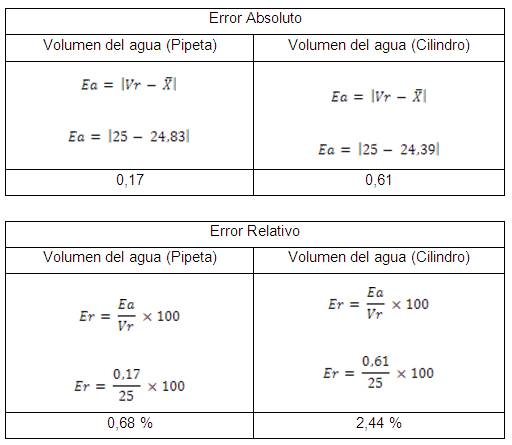
7) Comparar el valor obtenido en ambos
casos y determinar cuál de los dos instrumentos es
más exacto, en base al valor del error
relativo.

Discusión de
los resultados
Según el proceso llevado para realizar la
práctica, al pesar el vaso de precipitado vacío en
la balanza ya calibrada para las dos experiencias se hace con el
objeto de obtener una masa patrón. De esta forma al volver
a pesarlo pero con el volumen de agua medido en la pipeta y en el
cilindro se puede notar una diferencia de acuerdo con la masa del
vaso vacio, por lo que sale a resaltar que, al restarle los pesos
obtenidos del vaso con agua a la masa patrón que se obtuvo
primeramente, se puede obtener el peso del agua. De la
experiencia anterior ya se puede comenzar a apreciar los
resultados que determinan la eficacia de cada instrumento, puesto
que al repetir el proceso tres veces se obtiene una
variación de resultados (masas). Unido a esto se procede a
medir la temperatura del agua en cada repetición, y por
medio de una tabla teórica se puede obtener la densidad
del agua para dicha temperatura. Igualmente con la densidad y la
masa del agua se puede calcular su volumen.
De igual forma, una vez obtenido todos los resultados se
procede a sacar un promedio los datos y se a calcular las
desviaciones y los errores, mediantes las formula expuestas en el
desarrollo del informe. Una vez que se determina el valor de las
desviaciones y errores tanto absolutas como relativas se puede
concluir la precisión y exactitud de cada instrumento.
Sabiendo que la precisión se refiere a la variación
de los valores obtenidos de mediciones repetidas, equivale a que
mientras menor sea la variación más preciso es el
instrumento y esta se ve medida por la desviación, por lo
que se puede concluir que el instrumento que presente menor
desviación será más preciso.
Igualmente, sabiendo que la exactitud se refiere a
cuán cerca del valor real se encuentra el valor medido y
que se ve relacionada con el error de la estimación.
Cuando expresamos la exactitud de un resultado se obtiene
mediante el error absoluto que es la diferencia entre el valor
experimental y el valor verdadero. Según los valores
reflejados en el cuadro de resultados se concluye que la pipeta
es más exacta que el cilindro.

Conclusiones
1. Se logró pesar un objeto
(vaso precipitado).2. Se consiguió determinar
el volumen real de una pipeta volumétrica y de un
cilindro graduado.3. Se pudo demostrar que con la
pipeta se miden volúmenes más exactos que con
el cilindro graduado.4. Se alcanzó calcular el
promedio, desviación absoluta, desviación
estándar, error absoluto, y error relativo, a
excepción de la mediana.
Referencias
Libro:
-Chang R. (2005). Química séptima
edición. México, D. F. McGraw Hill Interamericana
Editores S. A. P. 13 y 24.
Recursos electrónicos:
–Ingeniería Dictuc (Noviembre 01,
2011)
http://www.dictuc.cl/metrologia/quees.htm
Autor:
Pablo Turmero

Universidad Nacional Experimental
Politécnica
"Antonio José de Sucre"
Vice-Rectorado Puerto Ordaz
Cátedra: Laboratorio de
Química I
Sección: M1
