Aun cuando los humanos consuman una dieta rica en
nucleoproteínas, las bases púricas y
pirimídicas de estas no se incorporan de manera directa a
los ácidos nucleicos de las células tisulares, sino
que se biosintetizan de novo a partir de intermediarios
anfibólicos. Sin embargo, los análogos de purinas y
pirimidinas inyectados (incluyendo medicamentos potenciales
contra el cáncer) pueden incorporarse al DNA, lo cual se
utiliza como terapia curativa.
El ser humano no depende de las bases nitrogenadas de la
dieta para atender a las necesidades de la síntesis de
ácidos nucleicos y nucleótidos libres. Las bases
son producidas en casi todas las células con tal eficacia,
que el organismo puede prescendir totalmente del aporte
exógeno.
FUNCIÓN METABÓLICA DE LOS
NUCLEÓTIDOS
Los nucleótidos y sus derivados desempeñan
papeles fundamentales en el metabolismo celular. En las
células de mamíferos se encuentran muchos tipos
diferentes de nucleótidos. Entre las funciones de
éstos se incluyen las siguientes:
1. Papel en el metabolismo energético. El
ATP es la principal forma de energía química
asequible a la célula. Se genera en la
fosforilación oxidativa y en la fosforilación a
nivel de sustrato. Esta moléculas se utiliza como un
agente fosforilante, para impulsar reacciones metabólicas
diversas. También se lo utiliza como dador de fosfato
necesario para la generación de otros nucleósidos
5´-trifosfato.
2. Unidades monoméricas de los ácidos
nucleicos DNA y RNA.
3. Mediadores fisiológicos. Los
nucleótidos y nucleósidos actúan como
mediadores de procesos metabólicos claves. La adenosina es
importante en la regulación del flujo sanguíneo
coronario; el ADP es crítico para la agregación
plaquetaria y, por tanto, de la coagulación de la sangre;
el cAMP y cGMP actúan como segundos mensajeros; el GTP es
necesario para terminación del mRNA, la
transducción de señales mediante proteínas
de unión al GTP, y la formación de
microtúbulos.
4. Función como precursores. El GTP es el
precursor para la formación del cofactor
tetrahidrobiopterina, necesario para la reacciones de
hidroxilación y la generaión de óxido
nítrico.
5. Componentes de coenzimas. Coenzimas tales como
el NAD+, NADP+, FAD, sus formas reducidas y la coenzima A
contienen como parte de sus estructuras una porción
5´-AMP.
6. Intermediarios activados. Los
nucleótidos también sirven como portadores de
intermediarios "activados" necesarios para diversas reacciones.
Un compuesto tal como la UDP-glucosa es un intermediario clave en
la síntesis de glucógeno y de las
glucoproteínas. Lo mismo sucede con el CTP, que interviene
como intermediario de la síntesis de fosfolípidos.
Otro intermediario es la S-adenosilmetionina (SAM), que
actúa como donador de metilos en las reacciones de las
bases y residuos glucídicos del ARN y el DNA, así
como la formación de compuestos tales como la
fosfatidilcolina.
7. Efectores alostéricos. Muchos de los
pasos regulados en las vías metabólicas
están controlados por las concentraciones intracelulares
de nucleótidos. Tal es el caso, como veremos, de la
síntesis de los nucleótidos, donde son ellos mismos
quienes regulan su biosíntesis.
QUÍMICA DE LOS
NUCLEÓTIDOS
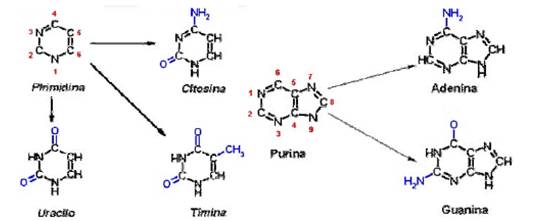
Los ácidos nucleicos contienen cinco bases
heterocíclicas principales, las purinas adenina (A) y
guanina (G); y las pirimidinas citosina (C), timina (T) y uracilo
(U). Las estructuras de estas bases se muestran en la figura 11.
Todos los ácidos nucleicos contienen A, G y C pero
sólo el DNA contiene además T, mientras que el RNA
contiene en su lugar U.
El agregado de un azúcar cíclico,
específicamente una D-ribosa o una 2-desoxi-D-ribosa, por
enlace covalente en posición N-9 de una purina, o en N-1
de una pirimidina, forma un nucleósido. Ahora bien,
se en el grupo oxidrilo del carbono 5´ de la pentosa se
produce una fosforilación, se obtendrá un
mononucleótido, o simplemente llamado
nucleótido; dependiendo de cual es el azúcar
implicado tendremos: ribonucleótido, cuando se trata de
D-ribosa, o bien desoxirribonucleótido para el caso de
2-desoxi-D-ribosa. En el cuadro 7 se hace una lista de las
principales purinas y pirimidinas, así como de sus
derivados nucleósidos y nucleótidos. Por
último, la unión entre el carbono 5 y el carbono 3
de las pentosas de dos nucleótidos consecutivos,
utilizando un grupo fosfato como puente de ensamble, llamado a
esto enlace fosfodiéster, formará, con la
sucesión de más nucleótido, una cadena a la
que se denomina polinucleótido. Esta estructura
básica de la cadena es válida para todos los tipos
de ácidos nucleicos: ácidos desoxirribonucleicos
(DNA) y ribonucleicos (RNA).

METABOLISMO DE LAS BASES
NITROGENADAS
El metabolismo de los nucleótidos esta centrado
en el anfibolismo de las bases nitrogenadas que los
forman.
Como sucede con los aminoácidos, en el organismo
puede hacerse una separación virtual entre exógeno
y endógeno formándose dos pools
metabólicamente independientes. Las bases procedentes de
los alimentos son degradadas y sus productos finales excretados,
mientras que la síntesis de nuevos nucleótido y
polinucleótidos se realiza con purinas y pirimidinas
formadas en las células.
Los ácidos nucleicos del organismo, al igual que
las proteínas, están en continuo recambio. Una
parte de las bases liberada durante los procesos de
degradación puede ser reutilizada para la síntesis
de nucleótidos y ácidos nucleicos, a través
de la vía llamada de "reciclaje". El resto termina siendo
catabolizado y los productos finales son excretados.
Metabolismo de
purinas
BIOSÍNTESIS DE PURINAS
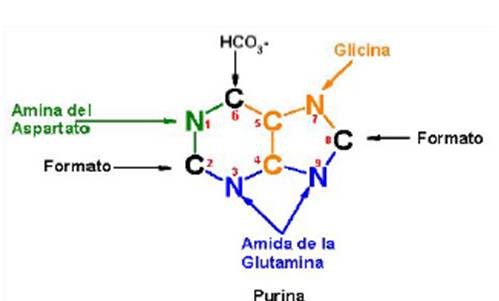
El anillo purínico se sintetiza de novo
en las células del organismo utilizando como "materia
prima": aminoácidos, como dadores de carbonos y
nitrógeno, y otras moléculas pequeñas que
completan el esqueleto de la base.
Estudios con isótopos han permitido establecer el
origen de cada uno de los átomos constituyentes del
núcleo purina (Cuadro 8 y Figura 13).

El ensamblaje de los segmentos se realiza en una
secuencia de reacciones llevadas a cabo por enzimas que se hallan
en el citosol de la mayoría de las células (Figura
14). Desde el comienzo participa ribosa-5-fosfato, sobre la cual
se van realizando todas las adiciones, por consecuente el
producto final de la vía no es una base libre, sino un
nucleótido (IMP).
La ribosa-5-fosfato se genera en la vía de las
hexosas monofosfato, ésta debe ser activada para ingresar
a la síntesis usando una ATP, el cual le transfiere
pirofosfato en el carbono 1. Esta reacción es catalizada
por la fosforribosilpirofosfato sintetasa, dando como producto
5-fosforribosil-1-pirofosfato (PRPP), compuesto que participa
tanto de la síntesis de novo de purinas y pirimidinas como
en la vía de reciclaje.

La siguiente reacción, catalizada por la
glutamina PRPP amidotransferasa, transfiere el grupo amida
de una glutamina en el carbono donde se encuentra el pirofosfato
de la PRPP, al cual desplaza formado un enlace C–N que
será el enlace N-glucosídico entre el C1 de la
pentosa y el N9 de la purina en el nucleósido que se ha de
formar. El producto es 5-foforribosil-1-amina, la cual reacciona
con glicina y ATP para dar 5-fosforribosilglicinamida,
reacción llevada a cabo por la fosforribosilglicinamida
sintetasa.
Los demás átomos del heterociclo purina se
agregaran en 8 etapas sucesivas. La actividad enzimática
de varios pasos de ésta vía, residen en dominios
separados de proteínas enzimáticas
multifuncionales. De toda estas etapas el primer
nucleótido que se obtiene es inosina monofosfato
(IMP), cuya base nitrogenada es la hipoxantina.
Formación de AMP y
GMP.
A partir del IMP se produce una bifurcación de la
vía de síntesis, debido a que el IMP se
convertirá en AMP o GMP. Posteriormente estos
nucleótidos formarán ATP y GTP respectivamente,
utilizando las enzimas 5´-monofosfato quinasa y
nucleósido-5´-disfosfato quinasa. La
conversión hacia uno u otro nucleótido no es al
azar; la formación de GMP requiere energía de ATP,
mientras que la formación de AMP requiere GTP. Esto se
interpreta como una reacción reciproca, es decir, un
aumento de ATP provoca un aumento de GMP y viceversa, mucho GTP
aumenta la producción de AMP. Esto es una forma de
regulación que equilibra las cantidades de GTP y ATP
sintetizadas dentro de la célula.
REGULACIÓN DE LA SÍNTESIS DE
PURINAS
La biosíntesis de nucleótidos
purínicos se regula fundamentalmente por feed-back (Figura
14). La formación de 5-fosforribosil-1-amina a partir de
glutamina y 5-fosforribosil-1- pirofosfato es la etapa
comprometida de la vía y en la enzima que la realiza se
halla el punto principal de regulación.
La glutamina PRPP amidotransferasa es regulada
alostéricamente por los productos finales de la vía
IMP, AMP y GMP que actúan como efectores negativos;
mientras que los sustratos PRPP y glutamina, son efectores
positivos. En realidad se podría considerar al PRPP como
verdadero efector por la alta Km de la enzima para este
sustrato.
La enzima es un monómero enzimático
activo, pero en presencia de IMP, AMP y GMP forma un
dímero menos activo. La PRPP favorece la forma
monomérica. La enzima posee dos centros
alostéricos, en uno se fijan IMP y GMP, nucleótidos
oxopurínicos; y en el otro AMP, nucleótido
aminopurínicos. La fijación simultanea de AMP y IMP
o GMP produce un efecto aditivo o sinérgico en la
inhibición del enzima.
No se conoce control alguno entre la formación de
5-fosforribosil-1-amina y el IMP. Por el contrario si se sabe que
existe regulación en la bifurcación del IMP a AMP o
a GMP. Debido a que el IMP se convierte en AMP o en GMP, un
aumento de estos productos inhibe por competición a la
enzima que los forman. También debe destacarse que al
usarse ATP para formar GMP y, a la inversa, GTP para formar AMP
se crea un dispositivo regulador para el funcionamiento
coordinado de ambas ramas. Un exceso de ATP producirá un
aumento de GMP y luego GTP, el cual favorecerá la
formación de AMP y consecuentemente ATP. Debe haber
además otros mecanismos, hasta ahora desconocidos, que
regulen el cociente ATP/GTP, dado que en la mayoría de las
células, la concentración total de
nucleótidos de adenina (AMP, ADP y ATP) es de 4 a 6 veces
la de nucleótidos de guanina.
VÍA DE RECICLAJE, RECUPERACIÓN O
SALVATAJE DE PURINAS.
Esta es una vía alternativa para formar
nucleótidos a partir de bases preformadas procedentes de
la degradación de ácidos nucleicos en tejidos o
absorbidos de la dieta. La vía necesita de las enzimas
fosforribosil transferasas, las cuales son dos:
1. Adenina fosforribosil transferasa
(APRTasa): sus sustratos son adenina y PRPP, y su
producto es AMP.

2. Hipoxantina-guanina fosforribosil
transferasa (HGPRTasa): utiliza hipoxantina o
guanina más PRPP para formar los nucleótidos
correspondientes: IMP y GMP.

Ambas enzimas se regulan por feed-back,
inhibición competitiva de los productos. Estas vías
alternativas de síntesis de nucleótidos interrumpen
eficazmente la síntesis de novo de estos
compuestos. En primer lugar, por el uso de PRPP, activador de la
Gln PRPPamido transferasa, lo que provoca una gran
disminución de su velocidad de catálisis; y en
segundo lugar, la formación de AMP, GMP y IMP provocan
efecto negativo sobre la misma enzima. Esto evita el uso de
energía innecesario, pero más importante
aún, desciende marcadamente la síntesis de AMP y
GMP así como el metabolito de su degradación, el
ácido úrico. Esto se ve reflejado en el
síndrome de Lesch-Nyhan, enfermedad
neurológica hereditaria ligada al cromosoma X, donde la
actividad de la HGPRTasa esta disminuida de forma importante,
dando hiperuricemia, retraso mental y trastornos sensoriales que
pueden llevar a la automutilación.
CATABOLISMO DE PURINAS.
La degradación de DNA y RNA por nucleasas produce
nucleótidos (ribo y desoxiribonucleótidos) y estos
a su vez son sometidos a hidrólisis de nucleotidasas con
acción fosfatasa dando nucleósidos libres, en el
caso de las purinas, adenosina y guanosina; esta última es
degradada a guanina y ribosa-1-fosfato por la nucleósido
purínico fosforilasa.
El nucleósido adenosina, por acción de la
adenosina desaminasa, se convierte en inosina, luego una
nucleósido fosforilasa divide a la inosina en hipoxantina
y pentosa-1-fosfato. La hipoxantina se oxida a xantina por la
xantina oxidasa, flavoproteína que contiene Fe y Mo
(molibdeno). Por otro lado la guanina, por acción de la
guanasa, se convierte también en xantina. Tanto adenina
como guanina convergen en xantina. Este metabolito es sustrato de
la xantina oxidasa, nuevamente en escena, que lo convierte en
ácido úrico, producto terminal de la
degradación de purinas, el cual es escretado
principalmente por orina. La figura 15 muestra la vía de
degradación de las purinas.
Ácido úrico.
En el adulto normal se producen unos 500mg por
día de ácido úrico, 80% del cual se excreta
por orina, el resto se degrada a CO2 y NH3 o urea.
En el plasma normal, el ácido úrico
alacanza una concentración de 4 a 6mg por 100ml. Los
varones tienen niveles de 1mg por 100ml más que las
mujeres, diferencia que desaparece después de los 45-50
años de edad, lo cual se relaciona a diferencias
hormonales entre ambos sexos.
Consideración de la solubilidad del
ácido úrico.
El ácido úrico posee un pKa de alrededor
de 5,75, lo que indica que a pH plasmático normal (7,4)
este ácido libera su protón del grupo OH del C8 y
se convierte en la forma iónica urato. A pH 5,75 la forma
iónica se equilibra con la no ionizada, mientras que a pH
menor predomina la forma no disociada. Esto tiene importancia, ya
que el ácido úrico es menos soluble en agua que el
urato, por lo que una orina acidificada aumenta la cantidad de
ácido úrico y este tiende a precipitar; en cambio,
si la orina se alcaliniza se produce un aumento de urato, con
mayor posibilidad de excreción en el medio acuso de la
orina.
Consideraciones de los alimentos
hiperurimiantes.
Una dieta rica en ácidos nucleicos aumenta la
cantidad de purinas y en consecuencia la producción de
ácido úrico. Los alimentos que contribuyen a esto
son aquellos con alta cantidad de nucleoproteínas, tales
como carnes, vísceras, tejidos glandulares, extractos de
carne (picadillos), legumbres, hongos y espinaca. Ciertos
compuestos químicos del café (cafeína),
cacao (teobromina), té (teofilina), mate (mateína)
y algunas bebidas carbonatadas contienen gran cantidad de
xantinas metiladas, purinas que favorecen la formación de
ácido úrico.
APLICACIÓN CLÍNICA:
GOTA
Definición. Con el término de gota
se designa a la enfermedad caracterizada por niveles elevados de
ácido úrico en plasma
(hiperuricemía).
Cuadro Clínico. Muchos de los
síntomas, sino todos, relacionados con la hiperuricemia,
aparecen como resultado de la escasa solubilidad del ácido
úrico, esto junto a su abundancia, lleva a la
formación y precipitación de cristales de urato
sódico que se depositan principalmente en las
articulaciones de las extremidades, produciendo artritis
(inflamación de las articulaciones) muy dolorosas. Se
afectan preferentemente las articulaciones interfalángicas
y del metatarso, siendo típico el compromiso del dedo
grueso del pie (Figura 16). También se producen
precipitados de urato sódico en cartílagos, siendo
el cartílago de la oreja el más frecuentemente
comprometido, formándose nódulos indurados que se
conocen con el nombre de "tofos".

Figura 16.
Fisiopatología. La máxima cantidad de
uratos que puede disolverse en sangre es de 7mg/dL, razón
por la cual cuando se excede este nivel se produce el
precipitado. El urato de sodio precipitado es fagocitado por
macrófagos residentes del tejido, una vez dentro de la
célula, los cristales de urato interaccionan con la
membrana dando su ruptura, liberándose, en consecuencia,
enzimas lisosomales que pueden atacar al tejido circundante
produciéndose productos de degradación que
interaccionan con monocitos sanguíneos los que son
atraídos al lugar y se activan a macrófagos. Estos
producen numerosas citoquinas que inician el proceso
inflamatorio.
Etiología. Gota primaria: causada por trastornos
metabólicos de origen genético, que lleva a la
formación excesiva de ácido úrico o de sus
precursores. Los siguientes son ejemplos de alteraciones
enzimáticas:
AUMENTO EN LA ACTIVIDAD DE LA PRPPSINTETASA:
esto produce un incremento de PRPP, efector positivo de la
Gln PRPP amidotransferasa lo que da un aumento de la
síntesis de novo de purinas.ACTIVIDAD PARCIAL DE LA HGPRTASA: una
disminución parcial de la actividad de ésta
enzima tiene dos consecuencias con respecto a las ruta de
síntesis de novo de nucleótidos
purínicos. En primer lugar, al haber una
disminución en el reciclaje de hipoxantina y guanina,
el PRPP no se consume por la reacción de la HGPRTasa y
puede activar la Gln PRPP amidotransferasa. En segundo lugar,
al disminuir el reciclaje de hipoxantina y guanina, no se
forma IMP y GMP a través de esta vía, de manera
que la regulación de la etapa de la PRPP
amidotransferasa por el IMP y GMP como efectores negativos se
ve comprometida.DEFICIENCIA DE GLUCOSA-6-FOSFATASA: en
pacientes que presentan enfermedad de Von Gierke se da
también frecuentemente hiperuricemia y gota. La
pérdida de actividad glucosa-6-fosfatasa tiene como
consecuencia que una mayor cantidad de glucosa-6-fosfato se
desvíe hacia la ruta de las hexosas monofosfato, se
genere más ribosa-5-fosfato y se incremente el nivel
de PRPP intracelular. El PRPP es un efector positivo de la
PRPP amidotransferasa.GOTA SECUNDARIA: se debe a una
complicación de hiperuricemia producida por otra
enfermedad de base como leucemia, nefritis crónica,
policitemia, entre otras.TRATAMIENTO: Para el control del dolor en
caso de un cuadro agudo se recurre a analgésicos. Para
el control a largo plazo, uno de los fármacos de
primera elección es el alopurinol, compuesto con
estructura similar a la hipoxantina que tiene la capacidad de
inhibir a la xantina oxidasa en forma competitiva, lo que
reduce la formación de xantina y ácido
úrico, pero también produce aumento de
hipoxantina, sustrato de la HGPRTasa, enzima del salvataje
que genera IMP, efector alostérico negativo de la Gln
PRPP amidotransferasa, además de consumir PRPP, otro
efector alostérico, pero positivo, de esta
última. El efecto global del alopurinol es la
disminución de la formación de ácido
úrico como de la síntesis de novo de
nucleótidos purínicos.
Como complemento al tratamiento medicamentoso, se
recomienda una dieta baja en purinas para no contribuir con bases
adicionales en la formación de ácido úrico y
abundante líquido para alcalinizar la orina.
Metabolismo de
pirimidinas
BIOSÍNTESIS DE PIRIMIDINAS
De la misma forma que las purinas, el núcleo
pirimidina se forma de precursores diversos. Su síntesis
conduce a la formación de uridina-5´-monofosfato
(UDP), a partir del cual se deriva la formación de CTP,
TMP y TTP (Figura 17).

REGULACIÓN DE LA
SÍNTESIS DE PIRIMIDINAS
Al igual que la vía de síntesis de
purinas, esta vía se regula por feed-back. Las enzimas que
son punto de regulación de esta cascada de reacciones son
dos:
Carbamoil fosfato sintetasa: esta enzima es
inhibida por UTP, uno de los productos finales de la
vía. Por el contrario es activada por PRPP, que no es
su sustrato.Asapartato carbamoil transferasa: por su
parte, esta enzima es inhibida por UMP y CTP, también
productos finales; y es activada por sus sustratos carbamoil
fosfato y Aspartato.
Además, se da un feed-back negativo en la
formación de CTP a partir de UTP, lo que asegura niveles
equilibrados de CTP y UTP, este último factible de
convertirse en TTP.
REGULACIÓN DE LA
SÍNTESIS DE PIRIMIDINAS
El recambio de los ácidos nucleicos da lugar a la
liberación de nucleótidos de pirimidina y purina.
La degradación de los nucleótidos
pirmidínicos siguen la ruta que los convierte en
nucleósidos por acción de fosfatasas
inespecíficas. La citidina y desoxicitidina son
desaminadas a uridina y desoxiuridina, por la
nucleósido pirimidina desaminasa. La uridina
fosforilasa cataliza la fosforólisis de la uridina,
desoxiuridina y timidita, para formar las bases
pirimídinicas uracilo y timina como producto
final
Las bases pirmídicas son degradadas hasta
productos muy solubles y fácilmente eliminados o
utilizados por las células.
El uracilo recibe dos hidrógenos donados por
NADPH para convertirse en dihidrouracilo.

FORMACIÓN DE
DESOXIRRIBONUCLEÓTIDOS
La enzima ribonucleósido-5´-difosfato
reductasa, cataliza la reacción en la que se reduce el
C2 de la ribosa de los ribonucleótidos difosfato (ADP,
GDP, UDP y CDP) para dar los correspondientes
2´-desoxirribonucleótidos difosfatos. La enzima
requiere una coenzima de bajo peso molecular llamada
tiorredoxina, quien reduce el C2 del azúcar, previa
reducción de ésta por un NADPH. La
regulación se da por los productos, que actúan como
efectores negativos.
FOSFORILACIÓN DE NUCLEÓSIDOS Y
NUCLEÓTIDOS. PAPEL DE NUCLEÓSIDO Y
NUCLEÓTIDO QUINASA
Los nucleósidos exógenos o
endógenos de la célula son sustratos de la
nucleósido quinasa específica para cada uno
de ellos. El producto, un nucleótido monofosfato (NMP), es
el sustrato de una nucleótido monofosfato quinasa,
dando un nucleótido difosfato (NDP) para que luego este se
convierta en un trifosfato (NTP) por acción de una
nucleotido difosfato quinasa. Las dos últimas
enzimas no son específicas para los distintos
nucleótidos. En cada reacción de
fosforilación se utiliza un ATP como dador del grupo
fosfato.
Estas reacciones son particularmente
importantes en una célula como el eritrocito que no puede
formar nucleótidos de novo.
APLICACIÓN CLÍNICA.
COMPUESTOS QUE OBSTACULIZAN EL METABOLISMO DE LOS
NUCLEÓTIDOS: UTILIZACIÓN COMO AGENTES
QUIMIOTERÁPICOS.
La síntesis de novo de
nucleótidos purínicos y pirimidínicos es
crítica para la replicación, mantenimiento y
función celular normales. La regulación de estas
vías es importantes ya que defectos en las enzimas
reguladoras producen estados patológicos. Se han
sintetizado o aislado (como productos naturales de plantas,
hongos o bacterias) muchos compuestos que son análogos
estructurales de las bases o los nucleósidos utilizados en
la reacciones metabólicas. Estos compuestos son
inhibidores relativamente específicos de enzimas
implicadas en la síntesis o interconversión de
nucleótidos. Estos fármacos, útiles en
terapia de cuadros clínicos, se han clasificados en
antimetabolitos, antifolatos, antagonistas de la glutamina y
otros compuestos.
Antimetabolitos: son, generalmente,
análogos estructurales de las bases o
nucleósidos purínicos y pirimidínicos
que obstaculizan centros metabólicos muy
específicos. Mucho de los actuales quimioterapicos
pertenecen a este grupo.Antifolatos: compuestos que obstaculizan la
formación de tetrahidrofolato (THF) a partir de
dihidrofolato (H2folato) por inhibición de la
dihidrofolato reductasa.Antagonistas de la glutamina: en la
células tienen lugar muchas reacciones en las que la
glutamina actúa como dador de grupos amino. Estas
reacciones de amidación son muy críticas para
la síntesis de novo del anillo
purínico (N3 y N9), en la conversión de IMP en
GMP, en la formación del carbamoil fosfato
citosólico, en la conversión de UTP a CTP y en
la síntesis de NAD+. Los compuestos que inhiben estas
reacciones se conocen como antagonistas de la
glutamina.
Bibliografía
1. Devlin, Thomas M. Bioquímica.
Libro de texto con aplicaciones clínicas. Tercera
edición. Editorial Revereté. 2000.
2. R. Murria et al. Bioquímica de
Harper. Decimoquinta edición. Editorial Manual Moreno.
2001
3. Blanco, Antonio. Química
biológica. Séptima edición. Editorial El
Ateneo. 2000
4. Harrison et al. Principios de Medicina
Interna. Decimocuarta edición. Editorial Mc
Graw-Hill-Interamericana. Madrid 1998.
5. Farreras-Rozman. Medicina Interna.
Decimocuarta edición. Editorial Harcourt. 2002
6. Conferencia Médica del Rep.
Argentina (COMRA). Formulario terapéutico Nacional. Novena
edición. 2003.
Autor:
Delia Sernaque
Rubiños
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
