- Resumen
- Introducción
- Desarrollo del Tema
- Orbitales híbridos
- Interacción de canje
magnético - Enlace
de coordinación - Conclusiones
- Referencias
Resumen
La nueva regla del octeto sostiene aquí que para
que se pueda configurar un enlace químico covalente o
iónico, es estrictamente necesario el debido acoplamiento
electromagnético de los momentos angulares totales
espín-órbita de un par de orbitales puros
enlazantes, donde uno de ellos tiene que estar constituido por
dos electrones apareados y de espines contrarios mientras que el
otro, debe estar compuesto por un par de huecos apareados
también con sus espines encontrados. Estos orbitales
enlazantes generalmente se forman por efectos del canje
magnético externo o ionizante que consiste en un
intercambio eléctrico y reciproco de electrones por huecos
efectuado por dos orbitales atómicos híbridos que
son aquellos orbitales que tienen un hueco apareado a un
electrón, hoy señalado como electrón
desapareado. Algunos átomos que cuentan con escaso
número de huecos como el nitrógeno, pues el canje
magnético no ionizante no cuenta con los huecos
suficientes para poder hibridar al par de electrones libres, si
ese nitrógeno reacciona con átomos como el
oxígeno que aun son más deficientes que él
en huecos, una opción es dejar intocable a ese par de
electrones libres como en los nitritos, o enfrentar al orbital
puro del nitrógeno y un orbital hibrido de otro
átomo de oxígeno, efectuar entre ellos un canje
magnético externo que aunque ioniza al nitrógeno y
al oxígeno, logra formar nitratos y es propio de la
moléculas hipervalentes. Pero si ese nitrógeno
reacciona con átomos como el platino que sí cuenta
con suficiente cantidad de huecos, entonces ese mismo
nitrógeno se porta como una base de Lewis y sin recurrir
al canje magnético ionizante, configura el enlace
coordinado. Para no utilizar modelos hamiltonianos aproximados,
basados en una mecánica ficticia y simplificada que lo que
solo busca es reproducir valores de interés particular,
por eso adjuntamos el estado físico de unas
partículas subatómicas que serían una forma
de materia o energía oscura llamadas huecos que tienen
espín, carga positiva pero no emiten suficiente
radiación electromagnética para ser detectadas con
los medios técnicos actuales pero cuya existencia se puede
deducir a partir de la mecánica que adoptan los orbitales
en los canjes magnéticos. Por esto sostenemos
además que la deslocalización electrónica es
aquel fenómeno que es originado por la
configuración de enlaces químicos deficientes en la
cantidad de orbitales enlazantes puros en huecos, en el que dos
orbitales enlazantes puros en electrones que pertenecen a dos
enlaces químicos contiguos y distintos, comparten de
acople intermitente el mismo orbital enlazante puro en huecos,
pues le toca a este par de huecos trabajar como parejas de acople
temporal en los dos enlaces ubicados en lugares distintos del
mismo grupo funcional o de la propia molécula. Esto sucede
por ejemplo en los enlaces de hidrógenos, en la base
conjugada del acido carboxílico, en los enlaces
peptídicos, en las moléculas hipervalentes, en los
aromáticos y en los compuestos nitroderivados. El
apareamiento de las bases nitrogenadas del DNA se debe a la
deslocalización externa que tienen los pares de huecos,
originado por un gradiente electrostático que es
ocasionado por la deslocalización electrónica
interna del anillo de cada base nitrogenada, creando la
circulación externa de orbitales enlazantes vacíos
a través de los puentes de hidrógeno. El orbital
enlazante vacío explica aquí con esto la
razón del porqué el puente de hidrógeno es
un enlace parcialmente covalente.
Palabras claves: Impedimento
Estérico, Orbital Molecular, DNA, Huecos.
Abstract
Thanks to the new rule of byte, it is predicted that a
chemical bond can be configured, is necessary because mesh that
makes a couple of orbital enlazantes where one of them must be
composed of two paired electrons and the other supposedly vacuum
corresponds to a pair of holes also paired as different subatomic
particles. The orbital two that assemble a chemical bond differ
also in the location of each orbital, which are usually full of
electrons are located between the atoms that originate the
respective chemical bond while the empty orbital ordinarily move
by the functional group or the entire molecule. The orbital empty
enlazantes are the cause of the tautomerism and aromatization in
bases of the nucleic acids, because they tend to uncoupling of
its orbital original linking and occupied, to mate with another
pair of electrons different who formerly had been an orbital
antienlazante full to become after their new coupling of orbital
occupied linking. The relocation of the orbital linking vacuum,
explains the resonance of the conjugate base of much better than
the so-called electronic delocalization carboxylic acid. When the
orbital is needed linking vacuum as in hipervalentes links, even
if the presence of the pair of electrons cannot be the full
configuration of the respective chemical bond leaving just the
molecule with the simple effects of ionic electrostatic
interaction by the attraction that makes the ligand towards you
on the orbital occupied antienlazante. In the DNA the orbital
empty enlazantes how orbital molecular are borne the entire
molecule of the nitrogenous base far ends their respective sugar,
site where the steric hindrance that the atoms of oxygen in the
steric form imposed on you.
Keywords: Molecular Orbital, steric
hindrance, DNA, hollow.
© heberpico@hotmail.com
todos los derechos reservados1.
Introducción
Precisamos que la introducción de todos estos
artículos son iguales, debido que el objetivo es sostener
la nueva regla del octeto. Es la misma introducción de los
dos últimos artículos referidos a la
configuración electrónica y la posición del
hidrógeno en la nueva tabla periódica. En este
trabajo es básico el trabajo Anomalías de
configuración electrónica.
Desarrollo del
Tema
Entendiendo el concepto de orbital, no simplemente como
aquellas funciones de ondas matemáticas de alguna
ecuación en especial, que aunque si describen el
comportamiento ondulatorio que pueden tener los electrones en el
átomo y las moléculas, no son suficientes en la
práctica para describir los sistemas físicos de las
partículas, no señor, en la nueva regla del octeto
entendemos como orbital molecular es al hecho físico de
sorprender directamente como partículas subatómicas
a un electrón o a un hueco en una determinada orbita del
espacio atómico o molecular.
Tras esto se asume un estado físico de huecos que
cuentan con materia oscura, carga eléctrica positiva y su
respectivo espín, además se entiende que no pueden
existir orbitales que no representen trayectoria de
partículas algunas.
Estamos de acuerdo que los orbitales reales moleculares
se construyen por combinación de los orbitales
atómicos.
Es indiscutible que los orbitales moleculares describen
la distribución electrónica en el campo
eléctrico generado por los respectivos núcleos
atómicos.
Una característica muy interesante para mostrarse
de acuerdo de conferirles propiedades de partículas
subatómicas a los huecos en la nueva regla del octeto, es
el reconocimiento que hace la mecánica cuántica de
que el número preciso de orbitales atómicos que se
solapan en una molécula, es el mismo número de
orbitales moleculares que resultan en la determinada
molécula.
Un argumento de excepcionales pruebas para la
teoría de la nueva regla del octeto, es el reconocimiento
académico que han tenido los llamados orbitales
moleculares antienlazantes vacíos.
Otro reconocimiento de la mecánica
cuántica que prueba a la nueva regla del octeto, es el
concepto de canje o intercambio
magnético.
Para entregar pruebas de lo cierto de esta teoría
de la nueva regla del octeto, comenzamos describiendo a los
orbitales moleculares más simples que son los relacionados
con la molécula de hidrógeno H2.
CONFIGURACION DEL ORBITAL ATÓMICO
EN EL ÁTOMO DE HIDRÓGENO.
El átomo de hidrógeno como elemento tiene
de manera natural ya híbrido a su único orbital
atómico, ocupado por un único electrón
identificado convencionalmente en el orbital atómico por
el exponente de color azul, ubicado en el único subnivel
s y además en la nueva regla del octeto
este orbital híbrido está preparado para efectuar
el canje magnético con el orbital también
híbrido pero de otro átomo porque ese
electrón, está apareado de forma fundamental con un
hueco, también de valencia como una partícula,
identificado convencionalmente ese hueco en el único
orbital atómico con el exponente de color rojo.
Hidrógeno
1s1-1
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL HIDRÓGENO MOLECULAR
H2.
Partiendo de que el átomo de hidrógeno
tiene un solo orbital atómico y un solo electrón
apareado con un hueco, entonces por lógica, si ese orbital
consistiera solamente en la presencia solitaria de un
electrón y la simple falta material de otro
electrón y ese hueco, no tuviera características
físicas especiales de partícula, entonces la
molécula de hidrógeno debería resultar con
un solo orbital que sería el orbital s
(sigma) enlazante totalmente lleno y ocupado por los dos
electrones respectivos que estarían apareados y con
espines contrarios.
Resulta, que si los huecos no conservaran propiedades
físicas especiales de partícula todo debería
quedar así, pero por efecto de que la cosa no queda de esa
manera y persiste experimentalmente la presencia física de
otro orbital molecular sin electrones, que aparentemente se
encuentra vacío pero de electrones.
Ese otro orbital molecular que resulta en la
molécula de hidrógeno hoy es llamado como un
orbital s (sigma) antienlazante vacío, a
quien además de registrarle mayor cantidad
energética, se le reconocen efectos estabilizadores en la
respectiva molécula. Ese orbital antienlazante
vacío prueba de que en realidad lo que hubo fue un canje
entre los dos orbitales atómicos híbridos
originales.
Los dos orbitales moleculares en la molécula de
hidrógeno molecular H2, quedan representado de la
siguiente manera:
1ss1-1
1ss1-1
Ó
1ss2
1ss2
La nueva regla del octeto sostiene que el reconocido
orbital antienlazante vacío de la molécula de
hidrógeno, quien estaría configurado por el
apareamiento de un par de huecos que proceden originalmente de
cada uno de los dos hidrógenos, además con cargas
positivas con respecto a las cargas negativas de los electrones,
entonces se forma ese orbital que no es antienlazante, que es
rechazado por los dos núcleos atómicos y cuyo
objetivo, es de ubicarse en alguno de los dos orbitales
atómicos originales para romper la simetría
eléctrica de la molécula, pero en el
hidrógeno molecular es rechazado por los núcleos
positivos también y no le toca sino ubicarse transversal
al orbital enlazante lleno y dejar que los espines nucleares
escuetos se encarguen ellos mismos de fortalecer los efectos del
orbital enlazante lleno quien precisamente estaría
configurado por el apareamiento de un par de electrones con
espines contrarios.
El nuevo concepto de la nueva regla del octeto es que en
la molécula de hidrógeno, hay dos orbitales
enlazantes productos del canje magnético y donde uno de
ellos está lleno de electrones y el otro, está sin
electrones pero lleno de huecos como partículas
subatómicas.
Por esta anterior razón en la molécula de
dihidrógeno, existen dos tipos distintos de
moléculas diatómicas que difieren en el tipo de
relación que hay entre los respectivos espines de sus
núcleos desnudos.
A este grupo pertenecen las moléculas
diatómicas de flúor F2, O2, N2, Cl2, I2.
CONFIGURACION DEL ORBITAL MOLECULAR DEL
CATIÓN HIDRÓGENO H+ O
HIDRÓN.
Hablamos de orbital molecular en este ión llamado
también protón o hidrogenión, porque es un
átomo de hidrógeno que en alguna molécula ha
perdido su electrón, pero por el canje magnético ha
adquirido un par de huecos por lo tanto, ha quedado con un solo
orbital enlazante vacío compuesto por un par de huecos
apareados. El protón sin huecos jamás podrá
existir solitario, sin huecos ni electrones.
1s1-1
Ó
1s2
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL CATIÓN DIHIDRÓGENO
H2+.
El catión dihidrógeno H2+
está compuesto por dos protones con cargas positivas, un
electrón con carga negativa y según la nueva regla
del octeto hay un hueco con carga positiva apareado a ese
único electrón por lo tanto el único orbital
sigue siendo híbrido.
El catión dihidrógeno se forma en la
naturaleza, por la ionización de una molécula de
hidrógeno molecular, a través de la
interacción de los rayos cósmicos.
Las partículas de los rayos cósmicos
tienen suficiente energía para sacar de la molécula
a un electrón pero lo sacan apareado con un hueco porque
resulta que según la nueva regla del octeto, los
electrones jamás pueden viajar solos sino siempre lo
harán apareados con un hueco.
En la molécula de hidrógeno los rayos
cósmicos dejan de la siguiente manera al único
orbital molecular en el catión dihidrógeno
H2+.
1ss1-1
En el catión dihidrógeno H2+ no hay
presencia del orbital molecular enlazante vacío ya que el
único orbital enlazante está semilleno o
híbrido.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL CATIÓN DE HIDRÓGENO MOLECULAR
PROTONADO H3+.
El catión de hidrógeno molecular protonado
queda compuesto por tres protones, dos electrones apareados en el
único orbital molecular enlazante lleno y dos huecos
también apareados que cristalizan la presencia de un
orbital enlazante vacío.
En el catión de hidrógeno molecular
protonado H3+ quedan los dos siguientes orbitales
moleculares: uno enlazante lleno y el otro también
enlazante pero vacío.
1sss1-1
1sss1-1
Ó
1sss2
1sss2
En el catión de hidrógeno molecular
protonado H3+, los 3 protones desnudos al lado y lado del
orbital molecular enlazante vacío, aunque se repelen por
tener la misma carga eléctrica, se atraen por la fuerza de
la organización orto y
para de los espines, al igual de lo que sucede en
la molécula de hidrógeno H2.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL BORANO BH3.
El átomo de Boro tiene
según la nueva regla del octeto la siguiente
configuración electrónica:
[He]
2s22p11-12p222p32
Por lo tanto el Boro tiene a dos
electrones apareados en el único orbital 2s y un solo
electrón en el orbital híbrido de origen natural
2p1 apareado con un hueco sin embargo, hay dos pares de huecos
apareados en los dos orbitales atómicos 2p2 y
2p3.
Al llevarse a cabo un canje magnético interno
entre los orbitales 2s2 y 2p22 puro o no desapareados del mismo
átomo de Boro y podrá adquirir la
siguiente configuración electrónica con dos
orbitales híbridos adicionales para un total de 3
orbitales híbridos:
[He]
2s1-12p11-12p21-12p32
Este átomo de boro con esta anterior
configuración electrónica, podrá construir 3
enlaces covalentes completos con 3 átomos de
hidrógenos y le quedará un orbital que tiene a un
par de huecos apareados.
El borano BH3, tiene entonces a 3
orbitales moleculares enlazantes llenos, ocupados cada uno de
ellos por un par de electrones apareados de espines contrarios,
también tiene a 3 orbitales moleculares también
enlazantes pero vacíos en electrones conformados cada uno
de ellos por un par de huecos apareados como partículas y
además existe finalmente un orbital 2p32 antienlzante
vacío. Un total de 7 orbitales.
2ss1-1
2sp11-1
2sp21-1
2ss1-1
2sp11-1
2sp21-1
2p31-1
Ó
2ss2
2sp12
2sp22
2ss2
2sp12
2sp22
2p32
Podemos notar que en el borano BH3, cada
orbital molecular enlazante que está totalmente lleno,
tiene su respectivo orbital enlazante vacío, sin embargo
existe un orbital que si es antienlazante vacío adicional,
que es el orbital que le da las características de
ácido de Lewis al borano y al
diborano y además, es el orbital molecular
antienlazante que al inclinar la molécula le confiere al
borano las características de ser un
orto o para borano, de acuerdo a
la relación que tengan los espines de los 3 núcleos
escuetos de los hidrógenos.
En el borano BH3, los espines nucleares
de los protones de los 3 átomos de hidrógeno,
quedan totalmente desnudos al igual que quedan los dos
núcleos de hidrógenos en el hidrógeno
molecular y los tres núcleos del hidrógeno en el
reconocido hidrógeno molecular protonado
H3+.
Ese par de huecos en el orbital molecular antienlazante
2p32, es el que genera la posible configuración del
orto-borano o
para-borano.
En el orto-borano, la dirección
de espín en el hidrógeno orto, es
perpendicular al plano construido con el boro por el alineamiento
de los espines de los otros dos hidrógenos.
En el orto-borano, el boro mantiene 6
orbitales enlazantes, 3 son totalmente llenos de electrones con
enlaces tipos 2c-2e, dos con los dos hidrógenos terminales
de espines alineados en un plano con el boro y otro orbital
enlazante también 2c-2e lleno con el hidrógeno que
tiene espín perpendicular o hidrógeno
orto. Hay 3 orbitales enlazantes
vacíos.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL DIBORANO
Hasta ahora casi todo el mundo trata de definir al
diborano, es con los 3 centros B-H-B haciendo
puente entre los dos boranos,
concibiéndolos así como enlaces de tres centros y
dos electrones (3c-2e).
Sin embargo, por el hecho de que en el
borano BH3, los dos electrones del orbital
enlazante con el hidrógeno orto,
están apareados, pensamos que la realidad es otra, que los
tres centros vociferados en el enlace 3c-2c son B-H-H. De esa
manera se sigue respetando el apareamiento de los electrones que
constituyen el orbital enlazante del hidrógeno
orto, pues no se rompe.
Se puede mirar esta situación como un enlace de 3
centros con dos electrones 3c-2e pero, la esencia del enlace
entre los dos boranos, son el juego de los
espines complementarios de los dos hidrógenos
orto de cada borano en
particular, para formar al diborano.
Podemos decir que el diborano
está constituido por dos boranos
recíprocamente protonados.
Los orbitales moleculares del diborano
son 14 en total es decir, el diborano tiene dos veces la cantidad
de orbitales moleculares que tiene el borano, 2
de ellos son orbitales moleculares antienlazantes vacíos y
los 12 restantes son orbitales enlazantes donde la mitad
están compuestos cada uno por un par de electrones
apareados y el resto por un par de huecos apareados.
Los dos orbitales enlazantes con dos electrones
apareados que están enlazando igual que en el
hidrógeno molecular protonado, a 3 centros que son a los
dos núcleos escuetos de los hidrógenos de
transición procedente de cada borano, con un boro al lado
y lado del par de núcleos de hidrógenos.
En el hidrógeno molecular protonado H3+,
el único orbital enlazante lleno con tres centros
está rodeado por los 3 núcleos desnudos de
hidrógenos mientras que en el diborano,
los dos orbitales enlazantes llenos con tres centros,
están enlazando a los mismos dos núcleos de
hidrógenos pero cada uno por un lado distinto a un
átomo distinto de boro.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL ION HIDRONIO U OXONIO H3O+.
El átomo de oxígeno tiene según la
nueva regla del octeto, la siguiente configuración
electrónica:
[He]
2s22p122p21-12p31-1
Por lo tanto al cumplir la regla de Hund, el
átomo de oxígeno no tiene que sufrir ninguna
interacción de canje magnético interna dentro de
él, porque los dos orbitales 2p2 y 2p3 son híbridos
para efectuar el canje magnético externo de los enlaces
químicos porque cada uno de ellos está apareado con
un hueco, identificados como electrones 2p2 y 2p3.
El ion hidronio u oxonio, tiene una configuración
de orbitales moleculares muy parecida al borano
con la diferencia de que este último es una
molécula neutra, el orbital antienlazante vacío del
borano no está lleno de electrones y el elemento central
en el borano es el átomo de boro mientras que en el
hidronio el centro es el oxígeno. También se
diferencian en que el orbital antianlazante lleno en el
oxígeno del hidronio es un orbital s y no
un p3 como el antienlazante vacío del boro
en el borano.
El hidronio tiene el mismo número de orbitales
moleculares que tiene el borano, ambos tienen el mismo
número de orbitales enlazantes llenos y vacíos,
tienen la misma cantidad de orbitales antienlazantes y la misma
cantidad de átomos de hidrógenos.
2sp11-1
2sp21-1
2sp31-1
2sp11-1
2sp21-1
2sp31-1
2s1-1
Ó
2sp12
2sp22
2sp32
2sp12
2sp22
2sp32
2s2
Para poder configurar los orbitales llenos y
vacíos de uno de los 3 enlaces covalentes del H3O+
hidronio, el orbital lleno es aportado por el oxígeno de
una molécula de agua H2O y el vacío, lo
facilita totalmente el ión hidrogeno H+ como
ácido de Lewis que es.
El único orbital antienlazante lleno del
H3O+, es totalmente aportado por el átomo de
oxígeno de la molécula de H2O.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL ANIÓN HIDRÓXIDO
HO-.
El anión hidróxido es una molécula
que tiene dos orbitales enlazantes, uno lleno y otro vacío
pero además tiene 3 orbitales antienlazantes
también totalmente llenos, para un total de 5 orbitales
moleculares.
2sp11-1
2sp11-1
2s1-1
2p21-1
2p31-1
Ó
2sp12
2sp12
2s2
2p22
2p32
El orbital enlazante vacío del HO-,
está desplazado hacía el polo negativo del
átomo de oxígeno, dejando al protón mucho
más adherido y atraído al oxigeno porque
está huérfano sin el par de huecos, que es de la
única manera que él se pueda desprender debido a
que sin huecos él no puede liberarse ya que ha quedado
huérfanos de ellos.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN LA MOLÉCULA DE FLÚOR
El átomo de flúor tiene según la
nueva regla del octeto la siguiente configuración
electrónica:
[He]
2s22p122p222p31-1
Por lo tanto tiene un solo electrón 2p3 apareado
con un solo hueco, que por esto es el único
electrón que podrá formar los orbitales enlazantes
necesarios en la posterior molécula de
flúor.
La molécula de flúor, aparte de los 3
orbitales antienlazantes llenos, tendrá dos orbitales
moleculares adicionales: uno de ellos será el orbital
enlazante lleno que está compuesto por el apareamiento de
un par de electrones 2p3, el otro orbital también
enlazante pero vacío en el sentido tradicional porque
adolece de electrones y está compuesto por el apareamiento
de un par de huecos también p3 como
partículas subatómicas, cuya intención
será ubicarse de regreso en los orbitales atómicos
originales. La molécula de flúor tiene un total de
8 orbitales moleculares enseguida describimos solamente a 5 de
ellos ya que faltan 3 pero son idénticos a los 3
últimos.
2p3p31-1
2p3p31-1
2s1-1
2p11-1
2p21-1
Ó
2p3p32
2p3p32
2s2
2p12
2p22
El orbital enlazante vacío de la molécula
de flúor, como tiene carga positiva semejante a la carga
eléctrica contraria que tendría un par de
electrones que estuvieran apareados en un orbital
idéntico, entonces ese orbital es atraído por los
electrones de los orbitales antienlazantes llenos, cuando ese par
de huecos ocupe a uno de los orbitales atómicos
originales, se pierde al instante la simetría
eléctrica de la molécula y los átomos de
flúor se atraen, fortaleciendo los efectos de los
orbitales enlazantes, esta situación fluctúa en uno
u otro sentido y se convierte en una frecuencia vibratoria de la
molécula.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN LA MOLÉCULA DE OXÍGENO
TRIPLETE
La molécula más estable es la de
oxígeno triplete por varias razones, primero porque los
dos orbitales moleculares los formaría el par de
electrones 2p2 que son los electrones y huecos de menor
energía.
La molécula de oxígeno triplete,
además de los dos orbitales antienlazantes puros o llenos
de electrones tiene un orbital también antienlazante pero
es híbrido o semilleno en cada oxigeno que le confiere las
calidades de paramagnético, tendrá dos orbitales
moleculares enlazantes adicionales: uno de ellos será el
orbital enlazante puro que está compuesto por el
apareamiento de un par de electrones 2p2, el otro orbital que
tendría sería un orbital enlazante también
puro pero vacío, compuesto por el apareamiento de un par
de huecos también 2p2 como partículas
subatómicas.
Ese orbital enlazante vacío ocuparía a uno
de los dos orbitales atómicos originales que precisamente
forman al orbital enlazante, rompen la simetría
eléctrica de la molécula y fortalecen al orbital
enlazante del oxígeno triplete.
El oxigeno triplete tiene un total de 8 orbitales
moleculares pero solo vamos a describir a 5 de ellos y
faltarían 3 más del otro oxígeno que son
idénticos a los 3 últimos.
2p2p21-1
2p2p21-1
2p31-1
2p11-1
2s1-1
Ó
2p2p22
2p2p22
2p31-1
2p12
2s2
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN LA MOLÉCULA DE OXÍGENO
SINGLETE
El oxígeno singlete a pesar de que es una
molécula con dos enlaces covalentes, es menos estable que
el triplete primero porque en ella los orbitales antienlazantes
vacíos, no pueden permanecer juntos en el mismo
núcleo que es la única manera de romper la
simetría eléctrica para fortalecer a los dos
orbitales enlazantes, se repelen demasiado y entonces deben
repartirse en los núcleos atómicos y eso genera
mayor repulsión eléctrica entre ellos.
La molécula de oxígeno singlete, a pesar
de que adolece del orbital antienlazante semi-lleno del triplete
presenta los dos orbitales antienlazantes llenos en cada
oxígeno del mismo, pues además de ellos
tendrá 4 orbitales moleculares adicionales: 2 de ellos
serán orbitales enlazantes llenos cada uno compuesto por
el apareamiento de un par de electrones p2 y
p3, los otros 2 orbitales que tendría
serían enlazantes vacíos, compuesto cada uno por el
apareamiento de un par de huecos también
p2 y p3 como partículas
subatómicas.
El oxígeno singlete tiene un total de 8 orbitales
moleculares aquí solo describiremos los cuatro
enlazantes.
2p2p21-1
2p3p31-1
2p2p21-1
2p3p31-1
Ó
2p2p22
2p3p32
2p2p22
2p3p32
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN LA MOLÉCULA DE NITRÓGENO
El átomo de nitrógeno tiene según
la nueva regla del octeto, la siguiente configuración
electrónica:
[He]
2s22p11-12p21-12p31-1
Por lo tanto al cumplir la regla de Hund, tiene los 3
electrones p híbridos porque cada uno de
ellos, tiene a un electrón apareado con un hueco,
identificados como electrones 2p1, 2p2 y electrón 2p3.
Además de eso el átomo de boro tiene al orbital 2s
totalmente puro porque tiene a dos electrones apareados y ese
elemento no tiene más huecos para hibridar a esos dos
electrones.
La molécula nitrógeno molecular es muy
estable por varias razones, primero porque tiene 3 orbitales
moleculares enlazantes compuestos por 3 pares de electrones
p1, p2 y
p3.
La molécula de nitrógeno además de
que tiene un solo orbital antienlazante lleno por cada
nitrógeno, tendrá 6 orbitales moleculares
adicionales: 3 de ellos serán orbitales enlazantes llenos,
cada uno compuesto por el apareamiento de un par de electrones
p, los otros 3 orbitales son orbitales enlazantes
vacíos, compuestos cada uno por el apareamiento de 3 pares
de huecos también p como partículas
subatómicas.
Esos orbitales antienlazantes vacíos mantienen la
molécula siempre polarizada moviéndose entre los 3
orbitales atómicos originales que precisamente forman al
orbital enlazante, rompen la simetría eléctrica de
la molécula y fortalecen al orbital enlazante de la
molécula de nitrógeno.
La molécula de dinitrógeno tendrá
un total de 8 orbitales moleculares aquí solo
describiremos los enlazantes y faltarían los
antienlazantes llenos tipo s que son
dos.
2p1p11-1
2p2p21-1
2p3p31-1
2p1p11-1
2p2p21-1
2p3p31-1
Ó
2p1p12
2p2p22
2p3p32
2p1p12
2p2p22
2p3p32
CONFIGURACIÓN DE ORBITALES
MOLECULARES DEFICIENTES EN LA CANTIDAD DE HUECOS CON RESPECTO AL
NÚMERO DE ELECTRONES
Cuando se solapan dos orbitales atómicos
semi-llenos, donde el número de electrones es igual al
número de huecos como hemos visto hasta el momento en este
trabajo, siempre resultarán dos orbitales enlazantes
configurándose ya sea enlace covalente o un enlace
iónico, donde es una regla que uno de los orbitales
moleculares enlazantes estará completamente lleno y el
otro, será un orbital también enlazante de los que
tradicionalmente se les llaman vacíos pero, son los
orbitales moleculares compuestos de un par de huecos apareados
como partículas subatómicas.
Estos mismos orbitales moleculares también
resultarán si se solapa un orbital atómico lleno y
el otro esté como se dice tradicionalmente totalmente
vacío. En este caso se configurará un enlace de
coordinación.
Pero cuando se solapan dos orbitales atómicos
donde uno está lleno y el otro híbrido o semilleno,
es decir el número de electrones es mayor que el
número de huecos, entonces para que se alcance el
equilibrio y se formen orbitales moleculares, se hace necesario
la intervención al mismo tiempo de por lo menos otro
orbital atómico, que no podría estar totalmente
lleno ni vacío, necesariamente tendría que estar
híbrido también o semi-lleno.
Intervendrán 3 orbitales atómicos: uno de
ellos estará totalmente lleno y dos de los orbitales
participes estarán semi-llenos o
híbridos.
Como participan 3 orbitales atómicos, entonces
respetando la regla, deben surgir también 3 orbitales
moleculares enlazantes, dos orbitales enlazantes estarán
llenos y solo uno de los 3 orbitales será un enlazante
tradicionalmente vacío.
Entonces se configurará y estamos en presencia,
de un enlace hipervalente que es un enlace descrito como de 3
centros y 4 electrones.
ENLACES DE TRES CENTROS CON CUATRO
ELECTRONES
Los enlaces de 3 centros con 4 electrones son ejemplo de
enlaces deficientes en el número de huecos con respecto a
la cantidad de electrones. Una de las moléculas con
deficiencia de huecos o excesos relativos de electrones, son
enlaces que las que los tienen moléculas conocidas como
hipervalentes.
El dilema de este enlace es que a pesar de que se
originan 2 orbitales enlazantes llenos resulta un solo orbital
molecular enlazante vacío sin electrones.
Debido a que el orbital enlazante vacío
está constituido por huecos, entonces en las
moléculas hipervalentes no queda sino un solo orbital con
un solo par de huecos apareados en el único orbital
enlazante tradicionalmente vacío acoplando a dos orbitales
enlazantes llenos.
El problema radica en que el átomo central no
tiene huecos para poder efectuar un canje magnético
interno para hibridar los dos electrones del orbital
s que él ofrece a los dos ligandos
está lleno, con dos electrones apareados de espines
contrarios del cual se originan los dos orbitales moleculares con
los dos ligandos. El hueco que tienen apareados cada ligando con
cada uno de sus respectivos electrones, originado por un orbital
híbrido o semilleno, quienes forman un solo orbital
enlazante donde yacen un par de huecos apareados. Esta es la
razón por la cual los dos ligandos terminales son
altamente electronegativos, ya que ellos solos aportan sus dos
huecos con carga positiva.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL ANIÓN FOSFATO PO43-.
Hemos escogido esta molécula hipervalente por lo
esencial que es para la vida, por su papel en los ácidos
nucleídos, en el almacenamiento de energía y su
labor de soporte estructural en la transmisión de
señales de los fosfolípidos en las membranas
celulares activas.
Las configuraciones electrónicas del átomo
de oxígeno y el átomo de fósforo son las
siguientes.
Oxígeno
[He]
2s22p122p21-12p31-1
Fósforo
[Ne]
3s23p11-13p21-13p31-1
El átomo de fósforo, tiene 4 orbitales de
valencia y los orbitales 3p1, 3p2 y 3p3 son orbitales hibridados
de forma fundamental a través de la regla de máxima
multiplicidad de Hund y el orbital 3s, no es híbrido
porque tiene en su seno a un par de electrones apareados, el
átomo de fósforo no tiene más huecos para
poder efectuar un canje magnético interno que le permita
de por sí hibridar a esos dos electrones del orbital 3s y
la única opción que le queda en el PO43- es
recurrir a un enlace coordinado o efectuar canje magnético
externo con un ligando de oxígeno, para configurar enlaces
hipervalentes.
El primer paso para formar el anión PO43-
lo hace el fósforo, cuando efectúa un canje
magnético externo con un átomo de oxígeno
para convertirse en el ión P+. Este ión de
fósforo híbrida así a los 4 orbitales de
valencia y quedan el fósforo y el oxígeno O–
del canje con la siguiente configuración
electrónica:
Oxígeno
[He]
2s22p122p222p31-1
Fósforo
[Ne]
3s1-13p11-13p21-13p31-1
El ión P+ queda con carga positiva porque
el fósforo neutro entrega un electrón y recibe un
hueco del oxígeno convirtiéndose en un
catión o ión positivo. Los 4 orbitales del
fósforo 3s1-1, 3p11-1 y 3p31-1 quedan
híbridos, cuestión que lo deja apto para formar
cuatro enlaces covalentes con 4 iones O-
distintos de oxígeno.
El oxígeno queda con doble carga negativa por
entregar un electrón negativo y recibir un hueco
O-.
El anión fosfato PO43- está
compuesto por un catión central de fósforo, que
tiene a 4 oxígenos a su alrededor con idénticas
ionizaciones, se forman 8 orbitales enlazantes, 4 llenos y 4
vacíos, que configuran a 4 enlaces covalentes entre el
fósforo central y los 4 átomos distintos de
oxígenos, dispuestos tetraédricamente a su
alrededor.
2p23p11-1
2p23p21-1
2p23p31-1
2p23s1-1
2p23p11-1
2p23p21-1
2p23p31-1
2p22p21-1
Ó
2p23p12
2p23p22
2p23p32
2p23s2
2p23p12
2p23p22
2p23p32
2p22p22
En esta molécula de PO43- hay que destacar
varios aspectos por ejemplo, es una molécula donde existe
deslocalización de 4 orbitales enlazantes vacíos y
la deslocalización también de 4 orbitales
enlazantes llenos. Además cada oxígeno presenta a 3
orbitales antienlazantes llenos de alta energía. Los 4
enlaces que podían ser enlaces dobles pero en realidad lo
que hay es una resonancia por la deslocalización interna
del orbital enlazante vacío, entre el enlace covalente
simple y la interacción iónica con dos electrones
de cada uno de los 3 orbitales antienlazantes llenos de los
oxígenos, interacción entre el anión
oxígeno con el catión fósforo.
Es decir el orbital enlazante vacío resuena en
una y otra posición pero siempre entre los mismos dos
átomos de oxígeno y fósforo, pero resuenan
todos dos.
Debido a la distinta electronegatividad entre el
oxígeno y el fósforo, existe un desplazamiento
hacía el oxígeno de los dos electrones que
podrían configurar un orbital enlazante lleno de un enlace
doble con el fósforo, electrones que al quedar sin orbital
enlazante vacío, no alcanzan a configurar un enlace doble
dejándolo con el carácter de un enlace sencillo
resonante, debido a esto el fósforo se queda con carga
positiva mientras que todos los oxígenos que lo rodean,
quedan con cargas eléctricas contrarias a la del
fósforo.
En el anión fosfato PO43-, cada
oxígeno aporta a 3 orbitales antienlazantes llenos para
haber un total de 12 de ellos y uno solo de estos en cualquiera
de los oxígenos, hace la interacción que aparenta
ser un enlace covalente pero no es así, porque le hace
falta un orbital enlazante vacío.
Esa interacción interna donde hace falta un
orbital enlazante vacío, se mueve de forma resonante entre
los 2 enlace con cada uno de los oxígenos del
PO43-.
Todo esto nos dice que el PO43- tiene un total de
20 orbitales moleculares.
Podemos decir que el PO43- tiene 4 veces el
fenómeno donde hay 3 orbitales enlazantes llenos que
comparten a un solo orbital enlazante vacío.

Figura No.1
En la anterior figura No.1, las líneas dobles
punteadas con cada uno de los 4 oxígenos, señala la
resonancia por la deslocalización del orbital enlazante
vacío quien se mueve entre uno y el otro par de electrones
configurando siempre a un solo enlace covalente pero, resuena
entre una y otra posición.
Un solo átomo de fósforo central en el
PO43- donde resuena el orbital enlazante vacío
quien mantiene la carga eléctrica del fósforo,
además existen 4 oxígenos cargados sin la
posibilidad de que haya transferencia de electrones
deslocalizados.
El PO43- es el extremo del nucleótido
donde se encuentra el polo del orbital enlazante
vacío.
CONFIGURACIÓN DE ORBITALES
MOLECULARES EN EL ANIÓN TRIFOSFATO
P3O105-.
A pesar de que en el anión PO43- ,
además de deslocalizados los 3 orbitales antienlazantes
llenos de baja energía, tiene un solo orbital enlazante
vacío deslocalizado con también un solo orbital
enlazante lleno deslocalizados, al anión trifosfato
P3O105- triplica esta cantidad es decir, presenta
deslocalizados esta vez a 3 orbitales enlazantes vacíos en
los 3 fósforo con 3 orbitales enlazantes llenos pero
también deslocalizados y además tiene a 5 orbitales
antienlazantes llenos aun deslocalizados.
El trifosfato multiplica por 3 las veces de la cantidad
de orbitales enlazantes que tiene el anión fosfato
PO43- es decir, que entonces tiene a 12 orbitales
enlazantes llenos y 12 orbitales enlazantes vacíos, para
un total de 24 orbitales enlazantes.
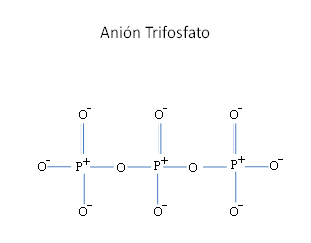
Figura No.3
Página siguiente  |
