- Introducción
- Cinética
química - Velocidad de reacción
- Ecuación de velocidad
- Mecanismos de reacción.
Molecularidad - Teoría de las colisiones. Energía
de activación (EA) - Industria química
- Aplicación de la cinética
química en la industria farmacéutica y la
industria alimentaria - Utilización de catalizadores en procesos
de interés industrial - Investigación y ensayos
clínicos - Conclusión
- Bibliografía
Introducción
El presente trabajo tiene
como objetivo comprender del estudio de la
cinética química y
la industria farmacéutica, para lo cual es
necesario realizar un estudio sobre la relación de la
cinética química con la industria
farmacéutica.
La presencia del tiempo como un factor en la
cinética química añade
tanto interés como dificultad a esta área
de la química.
Como anoté en la introducción, la
Industria farmacéutica es el sector dedicado a la
fabricación y preparación de productos
químicos medicinales para la prevención o
tratamiento de las enfermedades.
Otros preparados pueden chuparse como los dulces
ó caramelos, tomarse oralmente (como los jarabes) ó
administrarse en forma de inhalaciones
con aerosoles dosificados, de gotas para la nariz,
oídos u ojos, ó de cremas, pomadas y lociones
aplicadas sobre la piel.
Algunas empresas también
fabrican anestésicos y medios de contraste
utilizados para visualizar estructuras corporales
mediante rayos X ó resonancia
magnética nuclear (RMN).
No en vano una gran parte de
la producción de la industria
farmacéutica corresponde a vacunas.
De esta manera presentamos este trabajo la
relación que guarda la cinética química y la
industria farmacéutica.
DESARROLLO DEL TEMA
LA CINETICA Y LA INDUSTRIA
QUIMICA
La cinética química o llamada
también cinética de las reacciones esta estudia las
velocidades y mecanismos de las reacciones químicas .Las
aplicaciones de la cinética son múltiples .En la
síntesis industrial de sustancias , las velocidades de
reacción son tan importantes como las constantes de
equilibrio .Las velocidades de reacción son fundamentales
en el funcionamiento de los organismos vivos .Los catalizadores
biológicos controlan el funcionamiento de un organismo
acelerando ciertas reacciones .En suma , para comprender y
predecir el comportamiento de un sistema químico, deben
considerarse conjuntamente la termodinámica y la
cinética .
Cinética
química
CONCEPTO:
Es un área de
la fisicoquímica que se encarga del estudio de
la rapidez de reacción, cómo cambia la rapidez de
reacción bajo condiciones variables y qué eventos
moleculares se efectúan mediante la reacción
general (Difusión, ciencia de
superficies, catálisis). La cinética
química es un estudio puramente empírico y
experimental; el área química que permite indagar
en las mecánicas de reacción se conoce
como dinámica química.
Estudia las velocidades de las reacciones
químicas los factores que determinan la velocidad y el
mecanismo que incluyen cambios de enlaces covalentes como no
covalentes
Los procesos químicos en función de la
concentración de las especies que reaccionan de los
productos de reacción de los catalizadores los medios
disolventes de la temperatura y todos los demás variables
pueden afectar a la velocidad de reacción
OBJETIVO DE LA CINETICA
QUIMICA:
Es medir las velocidades de las reacciones
químicas y encontrar ecuaciones que relacionen la
velocidad de una reacción con variables
experimentales.
Se encuentra experimentalmente que la velocidad de una
reacción depende mayormente de la temperatura y
las concentraciones de las especies involucradas en la
reacción. En las reacciones simples, sólo la
concentración de los reactivos afecta la velocidad de
reacción junto con la temperatura, pero en reacciones
más complejas la velocidad también puede depender
de la concentración de uno o más productos. La
presencia de un catalizador también afecta la velocidad de
reacción; en este caso puede aumentar su velocidad. Del
estudio de la velocidad de una reacción y su dependencia
con todos estos factores se puede saber mucho acerca de los pasos
en detalle para ir de reactivos a productos. Esto último
es el mecanismo de reacción.
Las reacciones se pueden clasificar cinéticamente
en homogéneas y heterogéneas. La primera ocurre en
una fase y la segunda en más de una fase. La
reacción heterogénea depende del área de una
superficie ya sea la de las paredes del vaso o de
un catalizador sólido. En este capítulo
se discuten reacciones homogéneas.
Velocidad de
reacción
Cuando se produce una reacción química,
las concentraciones de cada uno de los reactivos y productos va
variando con el tiempo, hasta que se produce el equilibrio
químico, en el cual las concentraciones de todas las
sustancias permanecen constantes.
La velocidad de una reacción es la derivada de la
concentración de un reactivo o producto con respecto al
tiempo tomada siempre como valor positivo.
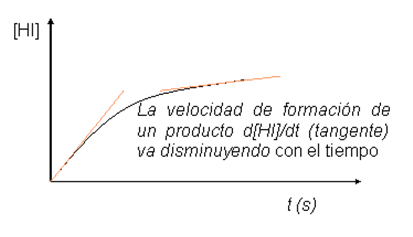
Es decir, es el cociente de la variación de la
concentración de algún reactivo o producto por
unidad de tiempo cuando los intervalos de tiempo tienden a
0.
Ecuación de
velocidad
En general, la velocidad depende de las concentraciones
de los reactivos siguiendo una expresión similar a la
siguiente para la reacción estándar:

Es importante señalar que "m" y "n" no tienen por
qué coincidir con los coeficientes estequiométricos
"a" y "b", sino que se determinan experimentalmente.
A la constante "k" se le denomina constante de velocidad
(No confundir con KC o KP)
Mecanismos de
reacción. Molecularidad
La reacción: H2 (g) + I2 (g) ? 2 HI (g), cuya
ecuación de velocidad tiene la forma: v = k [H2] [I2], es
una reacción elemental (que sucede en una sola etapa) y
para que suceda es necesario el choque de dos moléculas
(una de H2 y otra de I2). Se dice que es una reacción
"bimolecular".
Se llama molecularidad al número de
moléculas de reactivos que colisionan
simultáneamente para formar el complejo activado en una
reacción elemental. Se trata de un número entero y
positivo. Así hablamos de reacciones unimoleculares,
bimoleculares, trimoleculares, etc… Generalmente, en
reacciones elementales, coincide con el orden de reacción.
Sin embargo, existen casos en los que no coinciden, como las
reacciones de hidrólisis en los que interviene una
molécula de agua ya que al ser [H2O] prácticamente
constante la velocidad es independiente de
ésta.
Es raro que una reacción intervenga más de
tres moléculas, pues es muy poco probable que chocan entre
sí simultáneamente con la energía y
orientación adecuadas.
Por dicha razón, la mayoría de las
reacciones suceden en etapas. El conjunto de estas etapas se
conoce como "mecanismo de la reacción". Las sustancias que
van apareciendo y que no son los productos finales se conocen
como "intermedios de reacción".
La velocidad de la reacción dependerá de
las sustancias que reaccionen en la etapa más lenta.
Ejemplo de mecanismo de reacción :

Teoría de las
colisiones. Energía de activación (EA)
El número de moléculas de productos es
proporcional al número de choques entre las
moléculas de los reactivos. De éstos, no todos son
efectivos, bien porque no tienen la energía necesaria para
constituir el "complejo activado", (asociación transitoria
de moléculas muy inestable, porque su energía es
mayor a la de reactivos y productos por separado, pero por el
cual debe transcurrir necesariamente la reacción), o bien
porque no tienen la orientación adecuada.
La energía de activación es la necesaria
para formar el "complejo activado", a partir del cual la
reacción transcurre de forma natural.

1. FACTORES DE LOS QUE DEPENDE
LA VELOCIDAD DE UNA REACCIÓN
QUÍMICA.
Existen varios factores que afectan la rapidez de una
reacción química: la concentración de los
reactivos, la temperatura, la existencia de catalizadores y la
superficie de contactos tanto de los reactivos como del
catalizador. Los catalizadores pueden aumentar o disminuir la
velocidad de reacción.
· Naturaleza
de las sustancias.
· Estado
físico.
· Superficie
de contacto o grado de pulverización (en el caso de
sólidos)
· Concentración
de los reactivos.
· Temperatura.
· Presencia de
catalizadores.
TEMPERATURA
Por norma general, la rapidez de reacción aumenta
con la temperatura porque al aumentarla incrementa
la energía cinética de
las moléculas. Con mayor energía
cinética, las moléculas se mueven más
rápido y chocan con más frecuencia y con
más energía.

donde K es la constante de la rapidez, A es el factor de
frecuencia, EA es la energía de activación
necesaria y T es la temperatura, al linealizarla se tiene que
el logaritmo neperiano de la constante de rapidez es
inversamente proporcional a la temperatura, como sigue: ln(k1 /
k2) la hora de calcular la energía de activación
experimentalmente, ya que la pendiente de la recta obtenida al
graficar la mencionada ley es: -EA/R, haciendo un simple despeje
se obtiene fácilmente esta energía de
activación, tomando en cuenta que el valor de
la constante universal de los gases es 1.987cal/K mol.
Para un buen número de reacciones químicas la
rapidez se duplica aproximadamente cada diez grados
centígrados.
ESTADO FÍSICO DE LOS REACTIVOS
Si en una reacción interactúan reactivos
en distintas fases, su área de contacto es menor y su
rapidez también es menor. En cambio, si el área de
contacto es mayor, la rapidez es mayor.
Al encontrarse los reactivos en distintas fases aparecen
nuevos factores cinéticos a analizar. La parte de la
reacción química, es decir, hay que estudiar la
rapidez de transporte, pues en la mayoría de los casos
estas son mucho más lentas que la rapidez
intrínseca de la reacción y son las etapas de
transporte las que determinan la cinética del
proceso.
No cabe duda de que un mayor área de contacto
reduce la resistencia al transporte, pero también son muy
importantes la difusividad del reactivo en el medio, y su
solubilidad, dado que este es el límite de la
concentración del reactivo, y viene determinada por el
equilibrio entre las fases.
PRESENCIA DE UN CATALIZADOR
Los catalizadores aumentan o disminuyen la rapidez de una
reacción sin transformarse. Suelen empeorar la
selectividad del proceso, aumentando la obtención de
productos no deseados. La forma de acción de los mismos es
modificando el mecanismo de reacción, empleando pasos
elementales con mayor o menor energía de
activación.
Existen catalizadores homogéneos, que se
encuentran en la misma fase que los reactivos (por ejemplo, el
hierro III en la descomposición del peróxido de
hidrógeno) y catalizadores heterogéneos, que se
encuentran en distinta fase (por ejemplo la malla de platino en
las reacciones de hidrogenación).
Los catalizadores también pueden retardar
reacciones, no solo acelerarlas, en este caso se suelen conocer
como retar dantes o inhibidores, los cuales impiden la
producción.
Los catalizadores no modifican la entalpia, la
entropía o la energía libre de Gibbs de los
reactivos. Ya que esto únicamente depende de los
reactivos.
CONCENTRACIÓN DE LOS REACTIVOS
La mayoría de las reacciones son más
rápidas en presencia de un catalizador y cuanto más
concentrados se encuentren los reactivos, mayor frecuencia de
colisión.
Si los reactivos están en disolución o son
gases encerrados en un recipiente, cuanto mayor sea su
concentración, más alta será la velocidad de
la reacción en la que participen, ya que, al haber
más partículas en el mismo espacio,
aumentará el número de colisiones.
El ataque que los ácidos realizan sobre algunos
metales con desprendimiento de hidrógeno es un buen
ejemplo, ya que este ataque es mucho más violento cuanto
mayor es la concentración del ácido.
La obtención de una ecuación que pueda
emplearse para predecir la dependencia de la rapidez de
reacción con las concentraciones de reactivos es uno de
los objetivos básicos de la cinética
química. Esa ecuación, que es determinada de forma
empírica, recibe el nombre de ecuación de
rapidez.
De este modo, si consideramos de nuevo la
reacción hipotética la rapidez de reacción
"r" puede expresarse como

Los términos entre corchetes son las molaridades
de los reactivos y los exponentes m y n son coeficientes que,
salvo en el caso de una etapa elemental no tienen por que estar
relacionados con el coeficiente
estequiométrico de cada uno de los reactivos. Los
valores de estos exponentes se conocen como orden de
reacción.
Hay casos en que la rapidez de reacción no es
función de la concentración, en estos casos la
cinética de la reacción está condicionada
por otros factores del sistema como por ejemplo la
radiación solar, o la superficie específica
disponible en una reacción gas-sólido
catalítica, donde el exceso de reactivo gas hace que
siempre estén ocupados todos los centros activos del
catalizador.
PRESIÓN
En una reacción química, si existe una
mayor presión en el sistema, ésta va a variar la
energía cinética de las moléculas. Entonces,
si existe una mayor presión, la energía
cinética de las partículas va a aumentar y la
reacción se va a volver más rápida; al igual
que en los gases, que al aumentar su presión aumenta
también el movimiento de sus partículas y, por
tanto, la rapidez de reacción es mayor. Esto es
válido solamente en aquellas reacciones químicas
cuyos reactantes sean afectados de manera importante por la
presión, como los gases. En reacciones cuyos reactantes
sean sólidos o líquidos, los efectos de la
presión son ínfimos.
LUZ
La luz es una forma de energía. Algunas
reacciones, al ser iluminadas, se producen más
rápidamente, como ocurre en el caso de la reacción
entre el cloro y el hidrógeno. En general, la luz arranca
electrones de algunos átomos formando iones, con lo que
aumenta considerablemente la velocidad de
reacción.
Véase también: Principio de
Le Châtelier
ENERGÍA DE ACTIVACIÓN
En 1888, el químico sueco Svante
Arrhenius sugirió que
las moléculas deben poseer una cantidad
mínima de energía para reaccionar. Esa
energía proviene de la energía
cinética de las moléculas que colisionan. La
energía cinética sirve para originar las
reacciones, pero si las moléculas se mueven muy lento, las
moléculas solo rebotarán al chocar con otras
moléculas y la reacción no sucede.
Para que reaccionen las moléculas, éstas
deben tener una energía cinética total que sea
igual o mayor que cierto valor mínimo de energía
llamado energía de
activación (Ea). Una colisión con
energía Ea o mayor, consigue que los
átomos de las moléculas alcancen el estado de
transición. Pero para que se lleve a cabo la
reacción es necesario también que las
moléculas estén orientadas
correctamente.
La constante de la rapidez de una
reacción (k) depende también de
la temperatura ya que la energía cinética depende
de ella. La relación entre k y la
temperatura está dada por la ecuación de
Arrhenius:

Donde A es el factor de frecuencia de la
materia prima con la presión.
Industria
química
Son sectores empresariales que están constituidas
pòr organizaciones publicas y privadas dedicadas ala
investigacion,desarrollo, fabricación y
comercialización de medicamentos para la salud humana
.para la prevención de enfermedades y alteraciones
producidas por el organismo de los seres vivos .La gran parte de
las industria farmacéutica se encarga de la
fabricación de fármacos dosificados como pastillas
y capsulas; etc.
Y también se encarga de fabricar productos
químicos de productos primarios mediante métodos
colectivamente como producción secundaria. Analiza y
estudia relativamente la importancia de la cinética
química y la relación que existe entre la industria
farmacéutica ya que con esta se determina la velocidad de
reacciones en el organismo de los seres vivos.
Aplicación de
la cinética química en la industria
farmacéutica y la industria alimentaria
La aplicación de la cinetica química se
realiza en diferentes actividades en las que existe una
reacción química. Por ejemplo en la síntesis
de productos como el ácido sulfúrico, ácido
nítrico y otros. Así como también en los
productos farmacéuticos ejemplo en la larifinacion de
petróleo y petroquímica.
Otras de sus aplicaciones es en el medio ambiente, las
aguas naturales adquieren su composición que está
controlado por los principios termodinámicos del
equilibrio químico y de la cinética
Los procesos utilizados en la industria alimentaria , es
un factor importante en la condiciones de vida y en soluciones
que nos permitan preservar los alimentos en largos periodos
utilizando adecuadamente la aplicación de sustancias
químicas en nuestros alimentos tales como la
congelación , el enfriamiento ,pasteurización,
secado, ahumado y otros .
Utilización de
catalizadores en procesos de interés
industrial
La mayoría de los procesos industriales utilizan
catalizadores sólidos. Estos sólidos, de
composición altamente compleja (en ocasiones llegan a
tener 10 o más elementos en su fórmula), pueden ser
sin embargo descritos en forma de tres componentes elementales:
la fase activa, el soporte y el promotor.
La fase activa, como su nombre lo indica, es
la directamente responsable de la actividad catalítica.
Esta fase activa puede ser una sola fase química o un
conjunto de ellas, sin embargo, se caracteriza porque ella sola
puede llevar a cabo la reacción en las condiciones
establecidas. Sin embargo, esta fase activa puede tener un costo
muy elevado, como en el caso de los metales nobles (platino,
paladio, rodio, etc.) o puede ser muy sensible a la temperatura
(caso de los sulfuros de molibdeno y cobalto), por lo cual se
requiere de un soporte para dispersarla,
estabilizarla y proporcionarle buenas propiedades
mecánicas.
El soporte es la matriz sobre la cual
se deposita la fase activa y el que permite optimizar sus
propiedades catalíticas. Este soporte puede ser poroso y
por lo tanto presentar un área superficial por gramo
elevada.
El promotor es aquella sustancia que
incorporada a la fase activa o al soporte en pequeñas
proporciones, permite mejorar las características de un
catalizador en cualquiera de sus funciones de actividad,
selectividad o estabilidad.

Investigación
y ensayos clínicos
La innovación prosigue su veloz curso a medida
que la investigación básica en universidades,
hospitales y laboratorios, financiada tanto por contribuciones de
la industria como por otras fuentes, realiza nuevos
descubrimientos sobre los tejidos y órganos de los seres
vivos.
En la actualidad la investigación de los
laboratorios de las compañías farmacéuticas
centra su interés en el hallazgo de tratamientos mejorados
para el cáncer, las enfermedades del sistema
nervioso central, las enfermedades virales como
el síndrome de inmunodeficiencia
adquirida (SIDA), la artritis y las enfermedades
del aparato circulatorio.
El descubrimiento de la estructura del ácido
desoxirribonucleico (ADN) a principios de la década
de 1950 hizo posible el desarrollo de nuevas técnicas que
han llevado a la producción
de prostaglandinas, interferón, nuevas vacunas,
el factor de coagulación sanguínea y muchos otros
compuestos bioquímicos complejos que antes eran
difíciles ó imposibles de fabricar.
Los directivos de las compañías
farmacéuticas comprenden plenamente la importancia de la
ingeniería genética para el desarrollo de nuevos
fármacos en la actualidad y en el futuro.
El uso de animales vivos en la investigación
médica es fuente de polémica. Aunque los
farmacólogos han desarrollado y siguen desarrollando
técnicas para evitar su uso, los animales vivos
(fundamentalmente ratas y ratones) siguen siendo cruciales para
muchos procedimientos. Los organismos de control médico
insisten en que se deben utilizar dos especies distintas para
comprobar la posible toxicidad de una nueva sustancia antes de
conceder el permiso para comenzar ensayos
clínicos.
La primera fase de estos ensayos implica la
cooperación voluntaria de personas sanas que reciben un
breve tratamiento del nuevo fármaco. Si no aparecen
problemas, el organismo oficial que otorgó la
autorización permite el inicio de la segunda fase de los
ensayos, en la que unos pocos asesores especializados prueban el
producto con un grupo seleccionado de pacientes. Basándose
en sus recomendaciones, la compañía puede solicitar
permiso para llevar a cabo la tercera fase de los ensayos, de
carácter más amplio. Si esta última fase
produce resultados satisfactorios, se solicita la
autorización del fármaco. En algunos casos es
necesario repetir un procedimiento similar en aquellos
países donde se quiera comercializar.
Generalmente los ensayos se llevan a cabo en hospitales,
donde es posible organizar ensayos denominados 'de doble
ciego'. Los pacientes se dividen en dos ó tres grupos. Uno
de ellos recibe el fármaco que se quiere probar, otro
recibe un placebo (una sustancia inactiva) y a veces un
tercer grupo recibe otro producto con el que se quiere comparar
el nuevo fármaco. Los tres compuestos se presentan de
forma que ni el paciente ni el médico puedan
diferenciarlos.
Sólo el farmacéutico del hospital sabe
qué grupo recibe cada compuesto y no divulga los
resultados hasta el final del ensayo, cuando los médicos
hayan evaluado los resultados clínicos. En el caso de
medicinas para animales, se realizan ensayos similares que son
llevados a cabo por veterinarios.
En la actualidad la mayoría de los gobiernos
occidentales considera que un requisito para la producción
y distribución de fármacos seguros y eficaces es
que la industria farmacéutica continúe en manos de
la empresa privada. Otro requisito es el establecimiento de
organismos gubernamentales de vigilancia compuestos por expertos
y con poderes para conceder o negar la autorización a las
compañías farmacéuticas para comercializar
sus productos, según criterios de calidad de los mismos y
seguridad para los pacientes. Estos organismos de control son los
responsables de impedir abusos ó irresponsabilidades por
parte de los fabricantes, con lo que reducen la posibilidad de
que aparezcan peligros para la salud y se produzcan desastres
como el de la talidomida.
MODO DE ACCION DE LOS FARMACOS

Ciertos fármacos funcionan por interacción
con los receptores, lugares especiales en la superficie de las
células del cuerpo. Los fármacos pueden unirse a un
receptor específico, impidiendo que las sustancias
químicas se unan con normalidad al receptor. De ese modo,
si un fármaco intensifica la actividad celular, se
llama agonista; si bloquea la actividad celular, se
llama antagonista.
FARMACOLOGIA
Farmacología, ciencia de la interacción
entre las sustancias químicas y los tejidos
vivos.
Si la sustancia química es ante todo beneficiosa,
su estudio se llama terapéutica; si ante todo es
perjudicial, su estudio se denomina toxicología. En
cualquier caso, la farmacodinámica define cómo se
absorbe el material en el organismo, dónde actúa,
cuál es su efecto, y cómo se metaboliza y
elimina.
Los farmacólogos establecen la
clasificación terapéutica de los fármacos,
es decir, el beneficio relativo que proporcionan frente a su
toxicidad a dosis diferentes.
Esto ayuda a definir la dosis de un fármaco que
más beneficiará a una persona enferma.
También estudian cómo afectan las distintas
situaciones a la excreción del fármaco. Por
ejemplo, muchas drogas se metabolizan con más lentitud en
los ancianos, por lo que es necesario administrarlas con menor
frecuencia.
Debido a que muchos fármacos se excretan por el
riñón, quienes sufren enfermedades renales pueden
presentar una alteración de la excreción del
fármaco.
Los médicos especializados en farmacología
se llaman farmacólogos clínicos.
Los farmacéuticos que desempeñan su labor
en un hospital también están especializados en
farmacología, y asesoran a los médicos sobre el uso
adecuado de los fármacos.
Conclusión
Después de estudiar detalladamente esta
investigación llegamos a las siguientes
conclusiones:
La cinética química estudia la
velocidad de reacción.Es necesario conocer la velocidad de reacción
para la fabricación de fármacos.La fabricación de medicamentos no se
llevaría a cabo sin el estudio de la
química.Las industrias farmacéuticas aplican la
cinética química en sus laboratorios
especializados.Los profesionales farmacéuticos investigan
más aplicaciones de la cinetica
química.La química es una ciencia muy importante para
la medicina y en especial para la industria
farmacéutica.La Industria Farmacéutica no puede existir
sin la química. Van ligadas de la mano.Cabe resaltar el interés de muchas personas
por lograr cada día avances en el descubrimiento de
químicos que ayudan a la farmacología para
lograr la prevención y la sanidad de muchas
enfermedades.Es importante conocer que los estudios siguen
progresando a gran carrera, para desarrollar químicos
que puedan -en un futuro, ojalá no muy lejano-, lograr
curar enfermedades tan mortales como las que hoy vemos: El
Cáncer, El SIDA, sólo por citar
algunas.Resalto muchísimo a las Empresas
Farmacéuticas que creen y dan apoyo a todas esas
personas que dedican su tiempo en la investigación.
Sin ellas, no podría el investigador lograr llegar a
su meta, porque necesita mucho apoyo económico para
lograrlo.
Bibliografía
Gilbert W. Castellan Pearson
Educación, 1987 – 1057
Fisicoquimica, 6ta Edicion – Peter William
Atkins.
Fisicoquímica Vol. 1, 5ta
Edición – Ira N. Levine.
LINKOGRAFIA
http://es.wikipedia.org/wiki/Cin%C3%A9tica_qu%C3%ADmica
http://www.juntadeandalucia.es/averroes/recursos_informaticos/concurso2005/06/quimbach/apuntes_cinetica.pdf
http://fresno.pntic.mec.es/~fgutie6/quimica2/ArchivosHTML/Teo_3_princ.htm
http://www.ing.unp.edu.ar/asignaturas/quimica/teoria/cinetica.pdf
Autor:
Dery Veronica Barrantes
Pacori
CIENCIAS DE LA SALUD
FARMACIA Y BIOQUIMICA
UNIVERSIDAD ANDINA NESTOR CACERES
VELASQUEZ
