
CONTENIDO 1.- Trabajo, Calor, Energía. 2.- El Primer
Principio de la Termodinámica. Energía Interna (U)
3.- Entalpía (H) 4.- Capacidad Calorífica 5.-
Cálculo de ?U y de ?H en procesos sencillos de sistemas
cerrados

PRIMER PRINCIPIO LA ENERGÍA DEL UNIVERSO SE CONSERVA Es
imposible realizar un trabajo sin consumir una energía
(Gp:) . (Gp:) uff, uff (Gp:) W=F x (Gp:) Trabajo realizado por el
hombre (Gp:) Fuerza aplicada (Gp:) Distancia que se desplaza el
objeto (Gp:) Fuerza (Gp:) distancia (Gp:) X1 (Gp:) X2 (Gp:)
Trabajo=área (Gp:) [N.m=J] (Gp:) Energía =
Capacidad para realizar un trabajo

PRIMER PRINCIPIO LA ENERGÍA DEL UNIVERSO SE CONSERVA (Gp:)
La energía potencial se transforma en energía
cinética (Gp:) La pérdida de energía
potencial acelera el deslizamiento del objeto (Gp:) cae (Gp:) se
acelera energía química (carbón)
energía interna (agua líquida vapor de agua) el
vapor se expande Trabajo energía cinética (Gp:)
Reacción Química (Gp:) Cambio de Fase

1.- TRABAJO. CALOR, ENERGÍA. TRABAJO (PV) (Gp:) Pext (Gp:)
Pint Equilibrio mecánico Pext = Pint (Gp:) Pext > Pint
(Gp:) Pext (Gp:) Pint (Gp:) dx (Gp:) Unidades Pext = Pint Estado
inicial Estado final

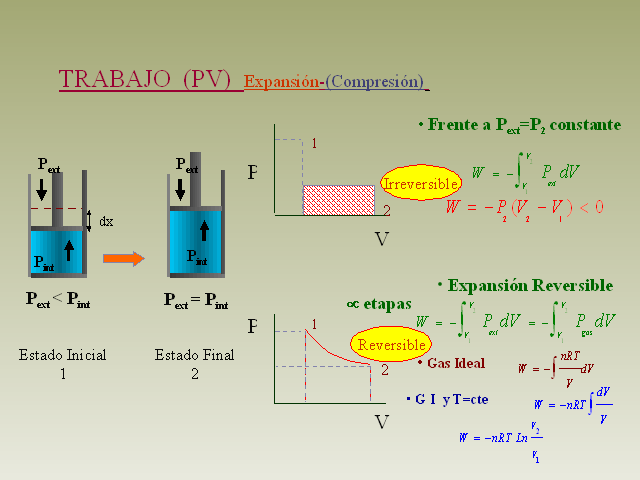
TRABAJO (PV) Expansión-(Compresión) (Gp:) Pext <
Pint (Gp:) Pext (Gp:) Pint (Gp:) dx Estado Inicial 1 P V 1 (Gp:)
Pext (Gp:) Pint (Gp:) Pext = Pint (Gp:) Estado Final 2 (Gp:) 2
P’ 2 etapas (Gp:) Frente a Pext=P2 constante V’
TRABAJO (PV) Expansión-(Compresión) (Gp:) Pext <
Pint (Gp:) Pext (Gp:) Pint (Gp:) dx Estado Inicial 1 P V 1 (Gp:)
Pext (Gp:) Pint (Gp:) Pext = Pint (Gp:) Estado Final 2 2 (Gp:) V
(Gp:) 1 (Gp:) P (Gp:) 2 (Gp:) Frente a Pext=P2 constante
Expansión Reversible ? etapas (Gp:) Gas Ideal (Gp:) G I y
T=cte (Gp:) Irreversible (Gp:) Reversible

1.- TRABAJO. CALOR, ENERGÍA. CALOR Un sistema cede E en
forma de Q si se transfiere como resultado de una diferencia de T
entre el sistema y el entorno. la T sistema varía hasta
igualar la Talrededores Unidades : Julio 1 cal = 4.184 J

PRIMER PRINCIPIO (Gp:) T=20ºC Estado Inicial (Gp:)
T=40ºC (Gp:) Estado Final 1.- TRABAJO. CALOR,
ENERGÍA. Q
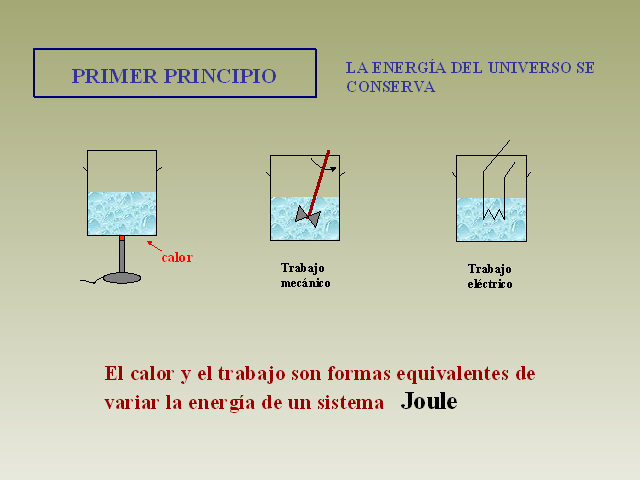
PRIMER PRINCIPIO LA ENERGÍA DEL UNIVERSO SE CONSERVA El
calor y el trabajo son formas equivalentes de variar la
energía de un sistema Joule (Gp:) Trabajo mecánico
(Gp:) calor (Gp:) Trabajo eléctrico

1.- TRABAJO. CALOR, ENERGÍA. Calor y el trabajo se
“distinguen” por su efecto sobre las moléculas
del entorno Q W

1.- TRABAJO. CALOR, ENERGÍA. SISTEMA TRABAJO CALOR son
formas de variar la E del sistema no son funciones de estado no
es “algo” que posea el sistema BANCO efectivo cheques
Transferencia electrónica

1.- TRABAJO. CALOR, ENERGÍA. (Gp:) Criterio de signos
(Gp:) SISTEMA (Gp:) Q > 0 (Gp:) W > 0 (Gp:) W < 0 (Gp:)
Q < 0

La energía es la capacidad para hacer un trabajo 1.-
TRABAJO. CALOR, ENERGÍA. ENERGÍA Esistema= U+
Eotras E debida a la posición del sistema en un campo de
fuerzas (gravitacional, eléctrico, magnético) y a
su movimiento en conjunto: Energía Interna, U
característica del sistema (Et, Er, Ev de
moléculas) depende del estado de agregación del
sistema Eotras La energía es una función de estado
La energía es una propiedad extensiva Unidades: Julio (J)
Puedo definir una propiedad intensiva

No es posible conocer la energía de un sistema,
sólo conocemos su cambio en un proceso ?U=U2-U1 2.- PRIMER
PRINCIPIO. ENERGÍA INTERNA. ENERGÍA (Gp:)
Energía interna (U) (Suma de energías a nivel
molecular) (Gp:) Función de estado Magnitud extensiva
¿Cómo podemos aumentar U de un sistema cerrado?
(Gp:) Realizando un trabajo Calentándolo Þ calor
(Gp:) DU = Q + W (Gp:) 1er Principio de
laTermodinámica

2.- PRIMER PRINCIPIO. ENERGÍA INTERNA. (Gp:) DU = Q + W
(Gp:) 1er Principio de laTermodinámica P V A B Proceso
Cíclico A?A Es imposible realizar un trabajo sin consumir
una energía

2.- PRIMER PRINCIPIO. ENERGÍA INTERNA. (Gp:) DU = Q + W
(Gp:) 1er Principio de laTermodinámica P V A B Proceso
Cíclico A?A Es imposible realizar un trabajo sin consumir
una energía U ? función de estado

(Gp:) Proceso a V = cte (Gp:) V2 = V1 dV=0 v (Gp:) DU = Q + 0 = Q
(Gp:) Þ (Gp:) Nuevo significado de DU = QV Nos da una forma
de determinar DU 2.- PRIMER PRINCIPIO. ENERGÍA INTERNA.
ENERGÍA INTERNA V

Proceso a P = cte v 3.- ENTALPÍA. 1º Principio ?U=Q+W
(Gp:) P=cte H2 H1 = ?H (Gp:) QP ?U=U2-U1 H ? U + PV
Entalpía (H) Función de estado H?f(T,P,V,U)
Propiedad extensiva Unidades de energía (J) Nos da una
forma de determinar ?H

3.- ENTALPÍA. H ? U + PV Relación entre DH y DU DH
= DU + D(PV) (Gp:) Si P=cte DH = DU + PDV DH @ DU proceso
sól/líq ?(PV) = P?V+V?P+?P?V = P2V2-P1V1 Una forma
de determinar ?U = QV Una forma de determinar ?H = QP
Q=I.V.t

4.- CAPACIDAD CALORÍFICA. El Q se definió como la
energía trasferida como consecuencia de una diferencia de
T (Gp:) Capacidad Calorífica Capacidad calorífica
de una sustancia: cantidad infinitesimal de calor necesaria para
elevar su T en una cantidad dT . [J×K-1] Depende de la
naturaleza de la propia sustancia Puesto que Q depende de la
trayectoria del cambio de estado, para definir C hay que definir
la trayectoria si no hay cambio de fase ni reacción
química

Capacidad calorífica molar a P cte Capacidad
calorífica molar a V cte 4.- CAPACIDAD CALORÍFICA.
Puesto que QV = ?U y QP = ?H en un sistema cerrado, en equilibrio
o proceso reversible y sólo W(P-V) es posible definir :
U,H?f(T,P,V) (Gp:) Capacidad calorífica molar de una
sustancia: cantidad de calor necesaria para elevar la T de un mol
de dicha sustancia un grado. Calor específico de una
sustancia: cantidad de calor necesaria para elevar la T de un
gramo de dicha sustancia un grado. [J×g-1×K-1] p.
Intensivas f=(T,P,V)

Differential Scanning Calorimetry (DSC) (Gp:) CP (Gp:) (J/g.K)
(Gp:) t (ºC) (Gp:) 300bar (Gp:) 500bar (Gp:) 1bar (Gp:) 0
(Gp:) 5 (Gp:) 25 (Gp:) 350 (Gp:) 650 (J/g.K) 150bar (Gp:) CP
(Gp:) P (bar) (Gp:) 400ºC (Gp:) 0 (Gp:) 5 (Gp:) 30 (Gp:) 0
(Gp:) 1000 (Gp:) 500 (Gp:) 500ºC (Gp:) 350ºC (Gp:)
600ºC H2O CP?f(T,P,V) CP > 0 CV > 0 CP ? CV

¿Cuál es la relación entre CP y CV? 4.-
CAPACIDAD CALORÍFICA.

¿Cuál es la relación entre CP y CV? 4.-
CAPACIDAD CALORÍFICA. Gas Ideal CP-CV = nR Gas Ideal

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados De forma general En un proceso cíclico

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Cambio de Fase a T y P constante (Gp:) T (Gp:) tiempo
(Gp:) 100ºC (Gp:) H2O (Gp:) 1at El QP se emplea en ?V y en
?U, que depende del estado de agregación

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Proceso Isobárico (P?cte) sin cambio de fase
P=cte Si CP cte P=cte Proceso Isocórico (V?cte) V=cte Si
CV cte V=cte (Gp:) T (Gp:) tiempo (Gp:) 100ºC (Gp:) H2O
(Gp:) 1at

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Cambio de estado de un Gas Ideal G I Si CP cte (Gp:) 0 G
I Si CV cte (Gp:) 0 Proceso Isotérmico (T=cte) de un Gas
Ideal (Gp:) ?U=0 ?H=0 (Gp:) P cte (Gp:) rev. o irrev. (Gp:) T cte
(Gp:) rev. (Gp:) Q = -W G I

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Proceso Adiabático (Q=0) de un Gas Ideal 0
Proceso Adiabático (Q=0) Irreversible (P cte) de un G.I.
(Gp:) Si CV cte (Gp:) Si CP cte

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Proceso Adiabático (Q=0) de un Gas Ideal 0
Proceso Adiabático (Q=0) Reversible de un Gas Ideal (Gp:)
Si CP cte

4.- CÁLCULO DE ?U y ?H en procesos sencillos de sistemas
cerrados Proceso Adiabático (Q=0) Reversible de un Gas
Ideal P V G I Q = 0 T=cte
