
1 (Gp:) UCLM Un gas ideal de coeficiente adiabático ? =
1.4 con un volumen específico inicial de 0.008 m3/mol se
somete a un calentamiento isocórico que hace variar su
presión entre 2.65 bar y 4.20 bar. Seguidamente el gas se
expande adiabáticamente hasta un volumen adecuado, y por
último se somete a una compresión isoterma hasta
que recupera su volumen específico inicial. Se pide:
PROBLEMA 1 C) Determine el rendimiento del ciclo
termodinámico que ha descrito el gas. B) Determine
presión, volumen y temperatura del punto común del
proceso adiabático y del proceso isotermo sufrido por el
gas. A) Dibuje esquemáticamente en forma cualitativa los
procesos sufridos por este gas en un diagrama p – v. (Gp:)
P (Gp:) v ADIABÁTICA ISOTERMA (Gp:) v0 (Gp:) P1 (Gp:) P2
(Gp:) v3 (Gp:) P3 Apartado A) (Gp:) 1 (Gp:) 2 (Gp:) 3 El gas
describe un ciclo de potencia (sentido horario) cuyos puntos
notables son 1, 2 y 3. Apartado B) (Determinación
coordenadas punto 3) Las temperaturas de los puntos notables se
determinan inmediatamente a partir de la ecuación de
estado del gas: Las temperaturas T3 y T1 son iguales,
están sobre la misma isoterma Dato: R = 8,314 kJ/(K?kmol)
Para obtener el volumen del punto 3: Ecuación de la
isoterma: Ecuación de la adiabática: En
términos de volúmenes molares: Dividiendo miembro a
miembro: Presión del punto 3:

2 (Gp:) UCLM Un gas ideal de coeficiente adiabático ? =
1.4 con un volumen específico inicial de 0.008 m3/mol se
somete a un calentamiento isocórico que hace variar su
presión entre 2.65 bar y 4.20 bar. Seguidamente el gas se
expande adiabáticamente hasta un volumen adecuado, y por
último se somete a una compresión isoterma hasta
que recupera su volumen específico inicial. Se pide:
PROBLEMA 1 (Continuación) C) Determine el rendimiento del
ciclo termodinámico que ha descrito el gas. B) Determine
presión, volumen y temperatura del punto común del
proceso adiabático y del proceso isotermo sufrido por el
gas. A) Dibuje esquemáticamente en forma cualitativa los
procesos sufridos por este gas en un diagrama p – v. Dato:
R = 8,314 kJ/(K?kmol) Apartado C) (Gp:) ISOTERMA (Gp:) P (Gp:) v
(Gp:) ADIABÁTICA (Gp:) 1 (Gp:) 2 (Gp:) 3 Veamos
cualitativamente trabajo y calor en cada etapa del ciclo
Rendimiento: Pregunta: ¿Es casual que el resultado
numérico para qV coincida con wad?
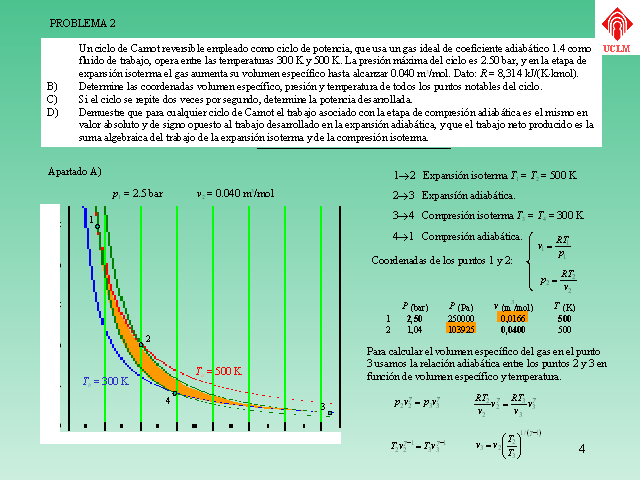
3 PROBLEMA 2 Un ciclo de Carnot reversible empleado como ciclo de
potencia, que usa un gas ideal de coeficiente adiabático
1.4 como fluido de trabajo, opera entre las temperaturas 300 K y
500 K. La presión máxima del ciclo es 2.50 bar, y
en la etapa de expansión isoterma el gas aumenta su
volumen específico hasta alcanzar 0.040 m3/mol. Dato: R =
8,314 kJ/(K?kmol). Determine las coordenadas volumen
específico, presión y temperatura de todos los
puntos notables del ciclo. Si el ciclo se repite dos veces por
segundo, determine la potencia desarrollada. Demuestre que para
cualquier ciclo de Carnot el trabajo asociado con la etapa de
compresión adiabática es el mismo en valor absoluto
y de signo opuesto al trabajo desarrollado en la expansión
adiabática, y que el trabajo neto producido es la suma
algebraica del trabajo de la expansión isoterma y de la
compresión isoterma. Apartado A) (Gp:) 1 (Gp:) 2 (Gp:) 3
(Gp:) 4 Ta = 500 K Tb = 300 K p1 = 2.5 bar v2 = 0.040 m3/mol 1?2
Expansión isoterma T1 = T2 = 500 K 3?4 Compresión
isoterma T3 = T4 = 300 K 2?3 Expansíón
adiabática. 4?1 Compresión adiabática.
Coordenadas de los puntos 1 y 2: Para calcular el volumen
específico del gas en el punto 3 usamos la relación
adiabática entre los puntos 2 y 3 en función de
volumen específico y temperatura. (Gp:) UCLM

4 PROBLEMA 2 (Continuación) Apartado A) Una vez calculado
el volumen específico del punto 3, se obtiene su
presión usando la ecuación de estado El punto 4 es
donde concurren la isoterma 3?4 y la adiabática 4?1, por
lo que debe cumplirse Usando otra vez la ecuación de
estado (Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) 4 (Gp:) Ta = 500 K (Gp:) Tb
= 300 K (Gp:) v (m3/mol) (Gp:) P (bar)

5 Apartado B) PROBLEMA 2 (Continuación) Hay que calcular
el trabajo producido por el ciclo. Esto puede hacerse de dos
formas. B1. Cálculo directo del trabajo de cada etapa
isoterma (en el apartado C demostraremos que las
adiabáticas no intervienen en el neto) El tiempo que tarda
esta máquina térmica en describir un ciclo es t =
0.5 s, por tanto la potencia específica es B2.
Cálculo del trabajo a partir del rendimiento del ciclo
reversible. Para este ciclo el rendimiento es: La energía
que debe suministrarse para el funcionamiento del mismo es el
calor de la etapa isoterma de alta temperatura, que es igual al
trabajo de la expansión isoterma 1?2, ya que la
energía interna del gas ideal sólo depende de su
temperatura y por lo tanto no sufre variación en dicha
etapa: El trabajo específico neto es: Apartado C) Trabajo
de un proceso adiabático entre las condiciones (vi,pi) y
(vf,pf). (Gp:) p (Gp:) v ADIABÁTICA (Gp:) w Aplicando la
ecuación de estado del gas ideal: En el ciclo de Carnot
hay dos adiabáticas: el proceso 2?3 y el proceso 4?1
(véase apartado A). Puesto que en el proceso 2?3 Ti = T2 y
Tf = T3, mientras que en el proceso 4?1 las temperaturas son Ti =
T3 (= T4) y Tf = T2 (= T1), se deduce que Por lo tanto, el
trabajo neto del ciclo corresponde a la suma (algebraica) de los
trabajos de las etapas isotermas 1?2 y 3?4.

6 PROBLEMA 3 Un ciclo de Stirling de refrigeración que
consta de dos isotermas y dos isocóricas utiliza como
fluido de trabajo 0.50 moles de un gas ideal y opera entre las
temperaturas 253 K y 300 K. Los volúmenes máximo y
mínimo del ciclo son 40 litros y 20 litros
respectivamente. Suponga que todas las etapas de este ciclo son
reversibles. Dato: R = 8,314 kJ/(K?kmol). Determine las
coordenadas volumen específico, presión y
temperatura de todos los puntos notables del ciclo. Sabiendo que
el coeficiente adiabático del gas es 1.4, calcule el calor
y el trabajo asociado a cada etapa del ciclo y determine su
eficiencia. Calcule el índice politrópico de un
proceso termodinámico que una directamente el punto de
mayor presión con el punto de menor presión de este
ciclo. Apartado A) (Gp:) 300 K (Gp:) 253 K Volúmenes
específicos máximo y mínimo 1 2 3 4
Isocórica 1?2 Isocórica 3?4 Las presiones se
calculan aplicando a cada punto la ecuación de
estado

7 B) Sabiendo que el coeficiente adiabático del gas es
1.4, calcule el calor y el trabajo asociado a cada etapa del
ciclo y determine su eficiencia. PROBLEMA 3 (Continuación)
(Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) 4 Ciclo de refrigeración
(sentido antihorario) Determinación de calores
específicos: Proceso isocórico 1?2 Proceso isotermo
2?3 Proceso isocórico 3?4 Proceso isotermo 4?1 (Gp:) 253
(Gp:) 300 (Gp:) 300 (Gp:) 253 (Gp:) T (K) (Gp:) 0,04 (Gp:) 4
(Gp:) 0,04 (Gp:) 3 (Gp:) 0,08 (Gp:) 2 (Gp:) 0,08 (Gp:) 1 (Gp:) v
(m3/mol) (Gp:) 0,53 (Gp:) 52586 (Gp:) 0,62 (Gp:) 62355 (Gp:) 0,31
(Gp:) 31178 (Gp:) 0,26 (Gp:) 26293 (Gp:) P (bar) (Gp:) P (Pa) La
eficiencia del ciclo es igual al calor extraído del foco
dividido por el valor absoluto del trabajo necesario para
hacerlo. En nuestro caso: El trabajo de las etapas
isocóricas es nulo, al no haber variación de v.
Forma alternativa: como se trata de un ciclo reversible,
Comentario: la eficiencia representa el calor extraído del
foco frío por cada unidad de trabajo invertido en el
funcionamiento del ciclo.

8 PROBLEMA 3 (Continuación) C) Calcule el índice
politrópico de un proceso termodinámico que una
directamente el punto de mayor presión con el punto de
menor presión de este ciclo. (Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:)
4 Se pide calcular el exponente k de la ecuación del
proceso politrópico (Gp:) Teniendo en cuenta los valores
numéricos (Gp:) la ecuación de esta
politrópica es 3?1

9 PROBLEMA 4 Un gas perfecto de volumen específico 0.008
m3/mol a una presión de 4.00 bar se calienta
isocóricamente hasta que su presión alcanza 8.00
bar. Después se expande adiabáticamente hasta
alcanzar 0.014 m3/mol, luego se enfría
isocóricamente y finalmente se comprime
adiabáticamente hasa restituir las condiciones iniciales.
Todas las transformaciones son reversibles (ciclo ideal de Otto).
Dato: R = 8,314 kJ/(K?kmol). Determine las coordenadas volumen
específico, presión y temperatura de todos los
puntos notables del ciclo. Si se sabe que el coeficiente
adiabático del gas es 1.4, calcule el calor y el trabajo
asociado a cada etapa del ciclo y determine su rendimiento.
Apartado A) Coordenadas de los puntos extremos de la
isocórica 1 (4 bar) ? 2 (8 bar) Ecuación de la
adiabática que pasa por 1: Ecuación de la
adiabática que pasa por 2: (Gp:) 3 (Gp:) 4

10 Apartado B) Si se sabe que el coeficiente adiabático
del gas es 1.4, calcule el calor y el trabajo asociado a cada
etapa del ciclo y determine su rendimiento PROBLEMA 4
(Continuación)

11 Un gas ideal a 273 K tiene una densidad de 50 moles/m3. Su
coeficiente adiabático es ? = 1.4. Este gas se somete a
una compresión adiabática reversible hasta que su
presión se duplica y luego a una expansión isoterma
reversible hasta restituir el volumen original. a) Determine la
temperatura final b) Determine el trabajo neto de los dos
procesos. c) Calcule la variación de entropía
sufrida por el gas. Tomamos como base de cálculo 50 moles
de gas, que en las condiciones iniciales ocupan V1 = 1 m3. Dato:
R = 8,314 kJ/(K?kmol) La presión inicial se obtiene
aplicando la ecuación del gas ideal Proceso
adiabático: (Gp:) 1 (Gp:) 2 (Gp:) 3 T2 = T3 = 332.8 K P2 =
2P1 Proceso isotermo: T2 = T3 = 332.8 K PROBLEMA 5 Trabajo
asociado con los procesos: Cambios de entropía. En la
etapa adiabática reversible no hay intercambio de calor,
por tanto la variación de entropía es nula. Etapa
isoterma. (Gp:) La energía interna de un gas ideal es
sólo función de la temperatura ADIABÁTICA
ISOTERMA

12 Un gas ideal de coeficiente adiabático ? sufre una
transformación politrópica de índice k entre
las condiciones (V1, P1) y (V2, P2). Determine el calor cedido o
ganado por el gas en dicho proceso. (Gp:) V (Gp:) P
Politrópica (Gp:) 1 (Gp:) 2 I. Trabajo asociado con el
proceso politrópico: II. Consideremos el proceso
politrópico como parte de un ciclo: 1?2 Politrópica
2?3 Isobara 3?1 Isocora (Gp:) 3 III. Cálculo de trabajo y
calor en la etapa isobara 2?3 Sea n el número de moles de
gas y cp y cV los calores específicos molares a
presión y volumen constante. IV. Cálculo de calor
en la etapa isocora 3?1 (el trabajo es nulo) (Gp:) V. La
variación de energía interna (Gp:) para cualquier
ciclo completo ha de ser nula. (Gp:) Gas ideal: PROBLEMA 6

13 Un gas ideal de coeficiente adiabático ? sufre una
transformación politrópica de índice k entre
las condiciones (V1, P1) y (V2, P2). Determine el calor cedido o
ganado por el gas en dicho proceso. VI. Tengamos en cuenta las
siguientes consideraciones: Relación de Mayer: Coeficiente
adiabático: (Gp:) 0 Caso especial: cuando el proceso es
adiabático k = ? y entonces (Sustituyendo calores
específicos en función de ?) (Sustituyendo V3, P3
por V1 y P2 respectivamente) (Reordenando términos)
(Sacando factor común) PROBLEMA 6 (Continuación)
Cuestión adicional: Compruebe que en función de las
temperaturas el calor absorbido o cedido por el gas ideal en el
proceso politrópico es Esta deducción es
válida para ? ? 1 (cuando ? = 1 la transformación
es isoterma).

14 Considere un transformación politrópica
reversible de un gas ideal entre las condiciones iniciales (v1,
p1) y finales (v2, p2), donde v está dado en m3/mol y p en
Pa. El gas ideal tiene un coeficiente adiabático ? y el
proceso politrópico un índice de politropía
k. Sabiendo que el calor intercambiado por el gas en dicho
proceso está dado por deduzca el calor intercambiado por
dicho gas cuando: A) Sufre una transformación
isobárica reversible. B) Sufre una transformación
isocórica reversible. PROBLEMA 7 A) Transformación
isobárica reversible. Escribimos el calor intercambiado en
función de la temperatura empleando la ecuación del
gas ideal En una transformación isobárica k = 0,
por lo tanto Según la relación de Mayer y la
definición de coeficiente adiabático como
función de los calores específicos B)
Transformación isocórica reversible. En una
transformación isocórica k ? ? , por lo tanto

15 Politrópica índice k (Gp:) 1 (Gp:) 2
Cálculo de la variación de entropía en el
proceso 1?2 a lo largo de una politrópica reversible
Trazamos una adiabática reversible que pase por 2.
Después trazamos una isoterma reversible que pase por 1.
(Gp:) 3 La adiabática y la isoterma se cortan en 3. Al
tratarse de un ciclo tenemos: Adiabática Isoterma (Gp:)
Proceso 2?3: Se trata de una adiabática reversible, por
tanto ?qad =0 en todos los puntos de la trayectoria y en
consecuencia La variación de entropía
específica molar en una etapa infinitesimal de un proceso
termodinámico está dada por Proceso 3?1: Es una
isoterma, por lo tanto donde cada s representa le entropía
específica molar (kJ/K?mol) de la etapa. (El calor
asociado a un proceso isotermo es igual al trabajo del mismo)
Variación de entropía en el proceso
politrópico 1?2: Por tanto, el cálculo de la
variación de entropía del proceso
politrópico reversible se reduce en realidad a calcular
las coordenadas del punto 3, donde se cortan la adiabática
y la isoterma. Calcule la variación de entropía de
un gas ideal de índice adiabático ? = 1.4 asociada
a un proceso politrópico reversible de índice k = 3
entre las condiciones iniciales v1 = 0.023 m3/mol, p1 = 1.80 bar
y un volumen específico final v2 = 0.025 m3/mol. (Gp:) P
(Gp:) v PROBLEMA 8 Dato: R = 8,314 kJ/(K?kmol)

16 (Gp:) Datos iniciales coloreados Calcule la variación
de entropía de un gas ideal de índice
adiabático ? = 1.4 asociada a un proceso
politrópico reversible de índice k = 3 entre las
condiciones iniciales v1 = 0.023 m3/mol, p1 = 1.80 bar y un
volumen específico final v2 = 0.025 m3/mol. PROBLEMA 8
(Continuación) Punto inicial (1). Conocemos volumen
específico y presión, calculamos temperatura
Además del volumen especifico necesario, calcularemos
todas las coordenadas desconocidas del ciclo de tres etapas.
Punto final (2). Ecuación politrópica
Ecuación de estado: Punto (3) Adiabática Isoterma
T3 = T1 (isoterma) Entropía específica del proceso
politrópico 1?2 (Gp:) Politrópica índice k
(Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) Adiabática (Gp:) Isoterma
(Gp:) P (Gp:) v Dato: R = 8,314 kJ/(K?kmol)

17 (Gp:) P (Gp:) v (Gp:) 1 (Gp:) 2 (Gp:) 3 Isoterma 300 K
PROBLEMA 9 Un gas ideal de coeficiente adiabático ? =1.4
describe un ciclo termodinámico formado por las siguientes
etapas reversibles: 1. Etapa isobara a 1.8 bar, desde una
temperatura de 300 K hasta que su volumen específico molar
es 0.08 m3/mol. 2. Expansión politrópica de
índice k = 3.5, hasta que su temperatura es 300 K. 3.
Compresión isotérmica hasta restablecer las
condiciones iniciales. Determine: A) Las coordenadas p, v, T de
cada punto notable del ciclo. B) Trabajo y calor en cada etapa y
rendimiento del ciclo. C) La variación de entropía
del gas en cada etapa del ciclo. Ciclo de potencia Isobara
Politrópica k = 3.5 A) Coordenadas P, v, T Ecuación
de estado: Cálculo del punto 3 (Gp:) Politrópica:
(Gp:) Isoterma: Dato: R = 8,314 kJ/(K?kmol)

18 B) Trabajo y calor en cada etapa y rendimiento del ciclo.
(Gp:) P (bar) (Gp:) v (m3/mol) (Gp:) 1 (Gp:) 2 (Gp:) 3 Etapa 1?2,
isobárica k = 0 Etapa 2?3, politrópica k = 3.5 a?
inicial, b? final Etapa 3?1, isoterma 300 K Cálculos
(calor y trabajo) (Gp:) Rendimiento: (Gp:) Trabajo neto (Gp:)
Calor aportado PROBLEMA 9 (Continuación)

19 (Gp:) a (Gp:) b (Gp:) c (Gp:) v (Gp:) p C) Variación de
entropía del gas en cada etapa del ciclo. Calculamos para
una politrópica en función de temperaturas y
volúmenes. Punto inicial ? a Punto final ? b Método
1. Usando el resultado del problema 8 (Recuerde que c es un punto
que no está en la politrópica) (Gp:)
Ecuación de estado: Método 2. Integrando el
intercambio de energía en forma de calor en un proceso
politrópico elemental. (Gp:) Expresamos este cociente en
una forma más adecuada PROBLEMA 9
(Continuación)

20 C) Variación de entropía del gas en cada etapa
del ciclo (continuación). (Gp:) P (bar) (Gp:) v (m3/mol)
(Gp:) 1 (Gp:) 2 (Gp:) 3 Isobara R = 8,314 J/(K?mol)
Politrópica Isoterma PROBLEMA 9
(Continuación)

21 Un ciclo frigorífico reversible de Carnot se emplea
para mantener a -18º C el congelador de un
frigorífico instalado en un local donde la temperatura es
20º C. Como fluido de trabajo de este ciclo
termodinámico se emplean 0.2 moles de un gas ideal de
coeficiente adiabático ? = 1.40. Los
vólúmenes máximo y mínimo del gas
durante el ciclo son 2 litros y 5 litros. Se pide: A) Calcule la
presión al comienzo e la expansión isoterma y el
volumen al final de la compresión adiabática. B)
Calcule el trabajo necesario para extraer 1 kJ del foco
frío. C) Calcule el trabajo que debe aportarse por ciclo
para mantener el frigorífico en funcionamiento. D) La
variación de entropía del gas en la etapa isoterma
a baja temperatura. Dato: R = 8,314 kJ/(K?kmol) PROBLEMA 10 (Gp:)
V (litros) (Gp:) P (bar) (Gp:) ADIABÁTICA (Gp:)
ADIABÁTICA (Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) 4 Cálculo
de las presiones (conocidos los volúmenes) (Gp:) Ciclo de
refrigeración Expansión adiabática 3 ? 4
Compresión isoterma 2 ? 3 Expansión isoterma 4 ? 1
El fluido de trabajo toma calor del foco frío El fluido de
trabajo cede calor al foco caliente Compresión
adiabática 1 ? 2 (Gp:) Datos: tenemos los siguientes datos
de temperatura y volumen: Cálculo de los volúmenes
V2 y V4:

22 (Gp:) V (litros) (Gp:) P (bar) (Gp:) ADIABÁTICA (Gp:)
ADIABÁTICA (Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) 4 (Gp:) Ciclo de
refrigeración (Gp:) Expansión adiabática 3 ?
4 (Gp:) Compresión isoterma 2 ? 3 (Gp:) Expansión
isoterma 4 ? 1 (Gp:) El fluido de trabajo toma calor del foco
frío (Gp:) El fluido de trabajo cede calor al foco
caliente (Gp:) Compresión adiabática 1 ? 2 (Gp:) V
(litros) (Gp:) P (bar) La presión al comienzo de la
expansión isoterma es: Expansión isoterma: 4?1 El
volumen al final de la compresión adiabática es:
Compresión adiabática: 1?2 Apartado A) PROBLEMA 10
(Continuación) A) Calcule la presión al comienzo e
la expansión isoterma y el volumen al final de la
compresión adiabática.

23 (Gp:) 1 (Gp:) 2 (Gp:) 3 (Gp:) 4 (Gp:) ADIABÁTICA (Gp:)
ADIABÁTICA (Gp:) Ciclo de refrigeración (Gp:)
Volumen (litros) (Gp:) Presión (bar) B) Calcule el trabajo
necesario para extraer 1 kJ del foco frío. C) Calcule el
trabajo que debe aportarse por ciclo para mantener el
frigorífico en funcionamiento. D) La variación de
entropía del gas en la etapa isoterma a baja temperatura.
PROBLEMA 10 (Continuación) Balance de energía en un
ciclo: (Gp:) Eficiencia Eficiencia reversible (Gp:) Significado:
? representa la energía extraída del foco
frío por cada unidad de trabajo aportada al ciclo. Por
tanto el trabajo necesario para extraer 1 kJ del foco frío
es: Trabajo en las etapas isotermas Trabajo neto (en un ciclo)
Comentario: los trabajos asociados a las etapas
adiabáticas no cuentan, por ser iguales y de signos
opuestos Para calcular la variación de entropía de
la etapa isoterma 4?1 es necesario determinar el calor
intercambiado en ella. Como en cualquier proceso a temperatura
constante la variación de energía interna de un gas
ideal es nula, se verifica que
