
3era Ley La tercera ley se generó en 1923 por Lewis y
Randall. Su base experimental surgió del estudio de las
propiedades de materiales a muy bajas temperaturas, en particular
de la capacidad calorífica. Todas las ecuaciones que hemos
usado tratan con incrementos en las funciones
termodinámicas –por ejemplo DU, DH o DS. Mencionamos
que sólo podemos medir los valores relativos de U o H. por
ejemplo: El valor de la energía a T = 0 es una constante
desconocida. La tercera ley nos permite medir valores absolutos
de la entropía para cualquier sustancia.

Entropía a 0 Kelvin Más aún que la 1ª.
o 2ª ley, la 3ª ley está íntimamente
relacionada con la cuantización de la energía y la
teoría cinética del calor. No discutiremos ahora la
aproximación estadística de la entropía
(Boltzmann). Por ahora diremos solamente que un incremento en la
entropía está asociado con un aumento en el
desorden del sistema (la entropía aumenta al subir la
temperatura, aumenta al mezclar, en la fusión de
sólidos, en la vaporización de líquidos). En
realidad la entropía está asociada con el grado de
organización de un sistema. imagen La experiencia nos dice
que la entropía de una sustancia tiende a un mínimo
cuando T?0, de tal forma que Cp/T se mantendrá en un valor
finito. A alguna temperatura lo suficientemente baja, la
energía térmica disponible es pequeña que
todos los modos de movimiento se vuelven “inactivos”
y la capacidad calorífica se aproxima a 0

0 0 0.1 0.3 Cpm/(J/K) Cpm/(J/K) T /K (T /K)3 3 6 9 1000 2000 Cp
de KCl vs (a) T; vs (b) T3 (a) (b) 0.5 1.0

3era Ley La evidencia experimental también muestra que la
entropía de todas las sustancias cristalinas puras se
acerca al mismo límite que la capacidad calorífica:
S0 cuando T?0 La 3ª Ley expresa que la entropía de
todos los sustancias perfectamente cristalinas y puras es la
misma a T=0; a esta única constante, S0, se le da el valor
de cero

Entropía de la 3ª ley Dado que la entropía de
una sustancia es cero a 0 K, la entropía a cualquiera otra
temperatura se puede calcular con la ecuación: tomando en
cuenta las discontinuidades en la capacidad calorífica
durante los cambios de fase. Este cálculo normalmente se
hace por integración numérica o gráfica de
los datos de capacidad calorífica. En la práctica
la capacidad calorífica no puede medirse por debajo de 1
K. La zona entre 0 y la menor temperatura lograda se llena con la
teoría: Debye mostró que la capacidad
calorífica a bajas temperaturas está dada por: Cpm
= aT3, en donde a es una constante característica de cada
sustancia.

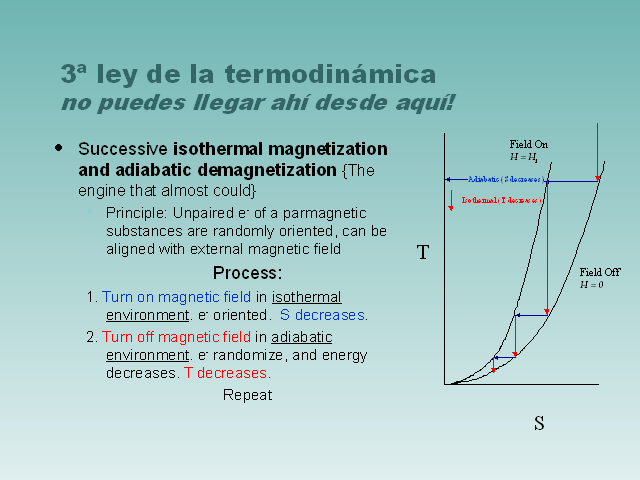
3ª ley de la termodinámicano puedes llegar ahí
desde aquí! Successive isothermal magnetization and
adiabatic demagnetization {The engine that almost could}
Principle: Unpaired e- of a parmagnetic substances are randomly
oriented, can be aligned with external magnetic field Process: 1.
Turn on magnetic field in isothermal environment. e- oriented. S
decreases. 2. Turn off magnetic field in adiabatic environment.
e- randomize, and energy decreases. T decreases. Repeat (Gp:)
Adiabatic (S decreases) (Gp:) Isothermal (T decreases) (Gp:) S
(Gp:) T (Gp:) Field Off H = 0 (Gp:) Field On H = H1

3rd Law of ThermodynamicsYou can’t get there from here!
Temperature can be successively reduced Each temperature
increment gets smaller and smaller as temperature gets lower and
lower In limit as number of steps ® 8, T ® 0K
Unfortunately, you can never reach the limit! 3rd Law (alternate
statement): It is impossible by any procedure, no matter how
idealized to reduce the temperature of any system to absolute
zero in a finite number of operations

3rd Law Entropies Entropies reported on the basis that S(0) = 0
are 3rd Law entropies If substance is in standard state these are
expressed Sø(T) Standard reaction entropy (DrSø) is
analogous to standard reaction enthalpy (DrHø) Sum of std.
entropies of products -Sum of std. entropies of reactants
Appropriate stoichiometric factors used