
1 Átomos y elementos 1 El experimento de Rutherford E.
Rutherford y su discípulo Geiger lanzaron rayos
“alfa” contra una delgada lámina de oro y
analizaron el resultado. (Gp:) Pantalla de centelleo (Gp:) Fuente
de partículas ? (Gp:) Lámina de oro Comprobaron que
sólo unas pocas partículas sufrían
desviación o eran devueltas. (Gp:) Átomos de oro
(Gp:) Partículas ?

1 Átomos y elementos 2 Modelo atómico nuclear
Rutherford propuso un modelo de átomo que explicaba los
resultados de su experiencia, el modelo atómico nuclear.
El átomo está constituido por un núcleo
central que concentra la carga positiva y casi toda la masa del
átomo. En la corteza están los electrones, con
carga negativa, girando en órbitas concéntricas
alrededor del núcleo. El tamaño del núcleo
es muy pequeño en comparación con el tamaño
de todo el átomo, y además, entre el núcleo
y la corteza hay espacio vacío. (Gp:) Electrón
(Gp:) Núcleo
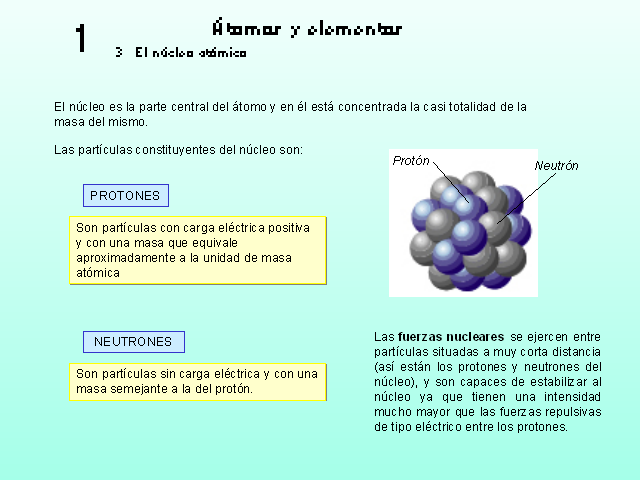
1 Átomos y elementos 3 El núcleo atómico El
núcleo es la parte central del átomo y en él
está concentrada la casi totalidad de la masa del mismo.
Son partículas con carga eléctrica positiva y con
una masa que equivale aproximadamente a la unidad de masa
atómica (Gp:) Protón (Gp:) Neutrón PROTONES
NEUTRONES Son partículas sin carga eléctrica y con
una masa semejante a la del protón. Las fuerzas nucleares
se ejercen entre partículas situadas a muy corta distancia
(así están los protones y neutrones del
núcleo), y son capaces de estabilizar al núcleo ya
que tienen una intensidad mucho mayor que las fuerzas repulsivas
de tipo eléctrico entre los protones. Las
partículas constituyentes del núcleo son:

Es la suma del número de protones y el número de
neutrones que tiene un átomo. Es el número de
protones que tiene un átomo (coincide con el número
de electrones si el átomo es neutro) 1 Átomos y
elementos 4 Número atómico y número
másico Para definir la estructura de un átomo se
utilizan dos conceptos: EL NÚMERO ATÓMICO (Z) EL
NÚMERO MÁSICO (A) (Gp:) X (Gp:) A (Gp:) Z Estos
números se representan a la izquierda del símbolo
químico del elemento X. Los átomos del mismo
elemento (con igual número atómico) y distinto
número másico reciben el nombre de isótopos.
Protio Deuterio Tritio (Gp:) ISÓTOPOS DE
HIDRÓGENO

1 Átomos y elementos 5 El modelo atómico de Bohr En
1913 Niels Bohr propuso un nuevo modelo para el átomo de
hidrógeno en forma de postulados. Los electrones giran en
órbitas circulares en torno al núcleo debido a la
atracción eléctrica protón-electrón.
El electrón sólo puede ocupar determinadas
órbitas o niveles energéticos. Estos niveles se
designan como n = 1, 2, 3… El electrón,
moviéndose en su órbita no pierde energía.
Si pasa de una órbita externa a otra interna desprende
energía. Para la transición contraria la absorbe.
Energía (Gp:) Electrón (Gp:) Núcleo (Gp:)
Órbitas n =1 n =2

1 Átomos y elementos 6 La corteza atómica
Actualmente se habla de probabilidades y “nube
electrónica” para describir la corteza
atómica. Se ha ampliado el número de niveles
energéticos considerando subniveles dentro de cada nivel,
donde cabe un número determinado de electrones. NIVEL DE
ENERGÍA SUBNIVELES n=1 n=2 n=3 n=4 1s 2s 2p 3s 3p 3d 4s 4p
4d 4f Nº de electrones en cada subnivel (Gp:) 2 (Gp:) 6
(Gp:) 10 (Gp:) 14 Un orbital es aquella región del espacio
donde hay más probabilidad de encontrar al
electrón. Los cuatro tipos de orbitales se designan con
las letras s, p, d, y f.

1 Átomos y elementos 7 Forma de algunos orbitales
NÚCLEO Orbital S Orbital D Orbital P

1 Átomos y elementos 8 Configuración
electrónica (Gp:) Elemento (Gp:) Configuración
electrónica Litio Sodio Potasio Rubidio 1s2 2s1 1s2 2s2
2p6 3s1 1s2 2s2 2p6 3s2 3p6 4s1 1s2 2s2 3s2 3p6 4s2 3d10 4p6 5s1
En los átomos con varios electrones, los electrones llenan
los subniveles empezando por los de menor energía y
siguiendo un orden creciente de energía, hasta que cada
uno de ellos se completa. Observa que el subnivel 3d se llena
después del 4s a pesar de pertenecer a un nivel inferior.
La expresión de la distribución de los electrones
de un átomo en subniveles se denomina configuración
electrónica.

1 Átomos y elementos 9 El sistema periódico:
periodos y grupos Tras sucesivos intentos de clasificación
de los elementos químicos, estos han quedado ordenados
según sus propiedades y su estructura atómica. En
un periodo, cada elemento tiene un protón y un
electrón más que el anterior Los elementos de
propiedades químicas parecidas se colocan en un grupo o
columna. PERIODO ALCALINOTÉRREOS 1 2 3 4 5 6 7 ALCALINOS
TÉRREOS CARBONOIDEOS NITROGENEIDEOS ANFÍGENOS
HALÓGENOS GASES NOBLES METALES DE TRANSICIÓN
EXTERNA LANTÁNIDOS ACTÍNIDOS METALES DE
TRANSICIÓN INTERNA

1 Átomos y elementos 10 El sistema periódico:
metales, semimetales y no metales

1 Átomos y elementos 11 El sistema periódico (Gp:)
58 Ce 140,12 Cerio (Gp:) Lantánidos 6 (Gp:) 71 Lu 174,97
Lutecio (Gp:) 70 Yb 173,04 Iterbio (Gp:) 69 Tm 168,93 Tulio (Gp:)
67 Ho 164,93 Holmio (Gp:) 66 Dy 162,50 Disprosio (Gp:) 68 Er
167,26 Erbio (Gp:) 65 Tb 158,93 Terbio (Gp:) 63 Eu 151,96 Europio
(Gp:) 62 Sm 150,35 Samario (Gp:) 64 Gd 157,25 Gadolinio (Gp:) 61
Pm (145) Promecio (Gp:) 59 Pr 140,91 Praseodimio (Gp:) 60 Nd
144,24 Neodimio (Gp:) 90 Th 232,04 Torio (Gp:) 103 Lr (260)
Laurencio (Gp:) 102 No (255) Nobelio (Gp:) 101 Md (258)
Mendelevio (Gp:) 99 Es (254) Einstenio (Gp:) 98 Cf (251)
Californio (Gp:) 100 Fm (257) Fermio (Gp:) 97 Bk (247) Berquelio
(Gp:) 95 Am 20,18(243) Americio (Gp:) 94 Pu (244) Plutonio (Gp:)
96 Cm (247) Curio (Gp:) 93 Np 237 Neptunio (Gp:) 91 Pa (231)
Protoactinio (Gp:) 92 U 238,03 Uranio (Gp:) Actínidos 7
(Gp:) 17 Cl 35,45 Cloro (Gp:) 53 I 126,90 Yodo (Gp:) 85 At (210)
Astato (Gp:) 9 F 18,99 Flúor (Gp:) 35 Br 79,90 Bromo (Gp:)
18 Ar 39,95 Argón (Gp:) 54 Xe 131,30 Xenón (Gp:) 86
Rn (222) Radón (Gp:) 10 Ne 20,18 Neón (Gp:) 2 He
4,003 Helio (Gp:) 36 Kr 83,80 Criptón (Gp:) 14 Si 28,09
Silicio (Gp:) 6 C 12,01 Carbono (Gp:) 50 Sn 118,69 Estaño
(Gp:) 82 Pb 207,19 Plomo (Gp:) 32 Ge 72,59 Germanio (Gp:) 12 Mg
24,31 Magnesio (Gp:) 4 Be 9,01 Berilio (Gp:) 88 Ra (226) Radio
(Gp:) 38 Sr 87,62 Estroncio (Gp:) 56 Ba 137,33 Bario (Gp:) 20 Ca
40,08 Calcio (Gp:) 11 Na 22,99 Sodio (Gp:) 3 Li 6,94 Litio (Gp:)
87 Fr (223) Francio (Gp:) 37 Rb 85,47 Rubidio (Gp:) 55 Cs 132,91
Cesio (Gp:) 19 K 39,10 Potasio (Gp:) 89 Ac (227) Actinio (Gp:) 39
Y 88,91 Itrio (Gp:) 57 La 138,91 Lantano (Gp:) 21 Sc 44,96
Escandio (Gp:) 109 Mt (266) Meitnerio (Gp:) 108 Hs (265) Hassio
(Gp:) 106 Sg (263) Seaborgio (Gp:) 105 Db (262) Dubnio (Gp:) 107
Bh (262) Bohrio (Gp:) 104 Rf (261) Rutherfordio (Gp:) 48 Cd
112,40 Cadmio (Gp:) 80 Hg 200,59 Mercurio (Gp:) 46 Pd 106,4
Paladio (Gp:) 78 Pt 195,09 Platino (Gp:) 45 Rh 102,91 Rodio (Gp:)
77 Ir 192,22 Iridio (Gp:) 47 Ag 107,87 Plata (Gp:) 79 Au 196,97
Oro (Gp:) 44 Ru 101,07 Rutenio (Gp:) 76 Os 190,2 Osmio (Gp:) 42
Mo 95,94 Molibdeno (Gp:) 74 W 183,85 Wolframio (Gp:) 41 Nb 92,91
Niobio (Gp:) 73 Ta 180,95 Tántalo (Gp:) 43 Tc (97)
Tecnecio (Gp:) 75 Re 186,21 Renio (Gp:) 40 Zr 91,22 Circonio
(Gp:) 72 Hf 178,49 Hafnio (Gp:) 30 Zn 65,38 Zinc (Gp:) 28 Ni
58,70 Niquel (Gp:) 27 Co 58,70 Cobalto (Gp:) 29 Cu 63,55 Cobre
(Gp:) 26 Fe 55,85 Hierro (Gp:) 24 Cr 54,94 Cromo (Gp:) 23 V 50,94
Vanadio (Gp:) 25 Mn 54,94 Manganeso (Gp:) 22 Ti 20,18 Titanio
(Gp:) 15 P 30,97 Fósforo (Gp:) 7 N 14,01 Nitrógeno
(Gp:) 51 Sb 121,75 Antimonio (Gp:) 83 Bi 208,98 Bismuto (Gp:) 33
As 74,92 Arsénico (Gp:) 16 S 32,07 Azufre (Gp:) 84 Po
(209) Polonio (Gp:) 8 O 16,00 Oxígeno (Gp:) 34 Se 78,96
Selenio (Gp:) 52 Te 127,60 Telurio (Gp:) 13 Al 26,98 Aluminio
(Gp:) 5 B 10,81 Boro (Gp:) 49 In 114,82 Indio (Gp:) 81 Tl 204,37
Talio (Gp:) 31 Ga 69,72 Galio (Gp:) Metales (Gp:) No metales
(Gp:) 4 (Gp:) 3 (Gp:) 2 (Gp:) 7 (Gp:) 5 (Gp:) 6 (Gp:) 1 (Gp:) 17
(Gp:) 16 (Gp:) 18 (Gp:) 15 (Gp:) 13 (Gp:) 14 (Gp:) 12 (Gp:) 10
(Gp:) 9 (Gp:) 11 (Gp:) 8 (Gp:) 6 (Gp:) 5 (Gp:) 7 (Gp:) 4 (Gp:) 2
(Gp:) 1 (Gp:) 3 (Gp:) (Gp:) VII A (Gp:) VI A (Gp:) Gases nobles
(Gp:) V A (Gp:) III A (Gp:) IV A (Gp:) II B (Gp:) I B (Gp:) VI B
(Gp:) V B (Gp:) VII B (Gp:) IV B (Gp:) II A (Gp:) I A (Gp:) III B
(Gp:) VIII (Gp:) Periodo (Gp:) Grupo (Gp:) 1 H 1,008
Hidrógeno (Gp:) Nombre (Gp:) Masa atómica (Gp:)
Número atómico (Gp:) Símbolo (Gp:) Negro –
sólido Azul – líquido Rojo – gas Violeta –
artificial (Gp:) Metales Semimetales No metales Inertes

1 Átomos y elementos 12 Estructura electrónica El
número que indica el periodo nos informa del número
de niveles o capas electrónicas del elemento.
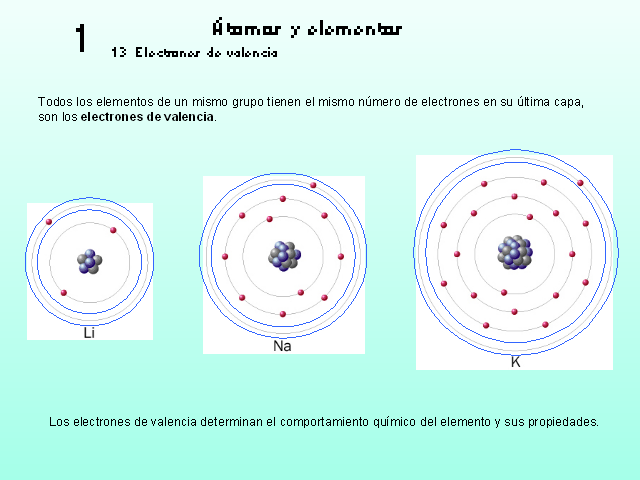
1 Átomos y elementos 13 Electrones de valencia Todos los
elementos de un mismo grupo tienen el mismo número de
electrones en su última capa, son los electrones de
valencia. Los electrones de valencia determinan el comportamiento
químico del elemento y sus propiedades.

1 Átomos y elementos 14 Propiedades periódicas de
los elementos: tamaño de los átomos Para comparar
el tamaño de los átomos de los elementos
químicos, relacionamos entre sí a aquellos que
forman parte de un mismo grupo y también a los que
están en el mismo periodo. En general, dentro de un grupo
el tamaño de los átomos aumenta al descender en el
grupo . (Gp:) – (Gp:) + (Gp:) – (Gp:) + En un mismo
período, el mayor volumen corresponde a los elementos
alcalinos, y disminuye paulatinamente al avanzar en el
período hasta llegar a los halógenos. Los
electrones de valencia están en el mismo nivel mientras
que el número de protones aumenta y estos electrones
serán atraídos por el núcleo con mayor
fuerza. El número de capas aumenta y los electrones se
encuentran cada vez más alejados del núcleo.

1 Átomos y elementos 15 Propiedades periódicas de
los elementos: electronegatividad La electronegatividad es la
capacidad que tienen los átomos de atraer electrones
cuando se unen con otros átomos. En un mismo grupo la
electronegatividad aumenta hacia arriba. (Gp:) – (Gp:) +
(Gp:) – (Gp:) + Dentro de un mismo período, la
electronegatividad aumenta hacia la derecha. El nivel
energético es el mismo pero aumenta la carga del
núcleo. Disminuyen los niveles energéticos y la
atracción por los electrones es mayor.

1 Átomos y elementos 16 Propiedades periódicas de
los elementos: reactividad La reactividad química es la
tendencia que tiene un elemento a reaccionar con otros . En un
grupo la reactividad química de los metales aumenta hacia
abajo. (Gp:) – (Gp:) + (Gp:) – (Gp:) + En un
período la reactividad de los metales aumenta de derecha a
izquierda. La reactividad de los no metales aumenta de abajo a
arriba en los grupos y de izquierda a derecha en los
períodos. (Gp:) – (Gp:) + (Gp:) –
