Objetivos
Explicar lo que significa un diagrama de
niveles y subniveles de energía
Reconocer y analizar la forma o tipos de
orbitales
Analizar el significado físico de
los números cuanticos
Elaborar la distribución
electrónica de un elemento, conociendo su número
atómico
Ilustrar la aplicación de la
regla de Moller, Hund, Paulí, y la Teoría de
Lewis en la asignación de electrones en el
átomo.
IV.- MOTIVACIÓN– Dibujan y realizan
ejercicios de algunas congifuraciones electrónicas,
indicando el número de electrones por niveles y
subniveles. Identifican los tipos de orbitales atómicos y
representan los electrones en los niveles de
energía.
Realizan ejercicios de aplicación de las reglas
de Moeller y Hund. Determinan los números cuanticos de un
elemento cualquiera. Aplican el principio de exclusión de
Paulí en la distribución electrónica de los
átomos.
V.- ADQUISICIÓN Y
RETENCIÓN.-
La nube
electrónica
Es el espacio o zona que rodea el núcleo
atómico, donde se encuentran los electrones en
movimiento, ubicados en regiones denominados reempes u
orbítales.

Electrones.- Son partículas elementales de
carga negativa que se hallan en rápido movimiento en la
nube electrónica, girando alrededor del núcleo y
sobre su propio eje. Fue descubierta por J.J Thomson. Los
electrones se comportan como partículas y como
ondas. La carga eléctrica es de 1,602 x 10 -19
Coulumb, igual a la del protón, pero de signo contrario.
Su masa es de 9.11 x 10 -31 Kg.
Configuración
electrónica
Los electrones que posee un átomo ocupan
diferentes posiciones alrededor del núcleo en:
a).- Niveles de energía
b).- Subniveles de energía
a).- NIVELES DE ENERGIA.- En 1913 Niels Bhor fue
el que dio el concepto de niveles de energía y dijo
"Es la región en la nube electrónica donde se
hallan los electrones girando en orbitas, sin ganar ni perder
energía".
Niveles Letras | K | L | M | N | O | P | Q | R |
Numero Quántico Principal(n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
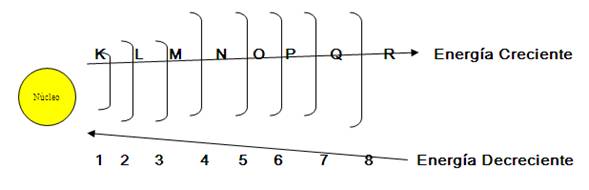
Nota.- Los niveles de energía se
representan con letras mayúsculas y números. Cada
nivel de energía aloja un número determinado de
electrones hasta el cuarto nivel se denomina regla de
Rydberg
REGLA DE RYDBERG.- "El máximo de
electrones que puede contener un determinado nivel es igual al
doble del cuadrado del numero cuantico secundario(n) contando a
partir del mas cercano al núcleo"
Formula : 2n2
NIVEL (n) | Regla de rydberg | N° Max de | |
K(1) | 2 x 12 | 2 | |
L(2) | 2 x 22 | 8 | |
M(3) | 2 x 32 | 18 | |
N(4) | 2 x 42 | 32 | |
O(5) | 32 | ||
P(6) | 18 | ||
Q(7) | 8 | ||
R(8) | 2 | ||
ORBITALES O REEMPE.- Son regiones del espacio en
la nube electrónica donde es máxima la probabilidad
de encontrar un electrón. Como no se puede conocer con
exactitud la posición y trayectoria de os electrones, solo
nos conformamos con tener una idea bastante aproximada de la
REGIÓN ESPACIO ENERGÉTICO DE MANIFESTACIÓN
PROBABILÍSTICA ELECTRÓNICA
Región
Espacio
Energético
Manifestación
Probabilística
Electrónica
EJERCICIOS.- Realiza la distribución
electrónica del elemento N° 30 (z) y grafica su
estructura electrónica.

EJERCICIOS.- Hacer la distribución
electrónica de los siguientes elementos, He, Li, B, C, N,
O, Ne, Na, Al, Si, S, K, Ca, Cr, Mn.
Ejemplo:

b).-SUBNIVELES DE ENERGIA.- Son regiones
pequeñas donde se localizan los electrones. Se representa
con las letras: s,p,d,f
Se les denomina como numero cuantico
secundario
Letras | s | p | d | f |
Números | 0 | 1 | 2 | 3 |
s = sharp (neto, nítido)
p = principal
d = Difusa
f = Fundamental
Sub nivel | nombre | l | N° electrones | N° orbitales | N° orbitales | |||||
s | sharp | 0 | 1 o 2 | 1 | un orbital s | |||||
p | principal | 1 | 1,2,…6 | 2 | tres orbitales p | |||||
d | difusa | 2 | 1,2,…..10 | 3 | Cinco orbitales d | |||||
f | fundamental | 3 | 1,2…..14 | 4 | Siete orbitales f | |||||
NUMEROS CUANTICOS

NUMEROS CUANTICOS.- Se les conoce también
como los parámetros quánticos. Caracterizan al
movimiento de los electrones en las inmediaciones del
núcleo atómico.
Los parámetro quánticos son: n(Principal),
l(Secundario) , m(magnético) y s (Spin)
1.- Numero quántico principal(n).-
Determina el nivel energético principal del
electrón. Nos da la idea de distancia entre
electrón y núcleo. Tienen los siguientes valores
enteros y positivos:
n=
1,2,3,4,5,6,7…..
A medida que aumenta el numero quántico principal
mas alto será el nivel de energía del
electrón.
2.- Número quántico Secundario o
azimutal (l).- Determina el subnivel de energía, e
indica la forma de la nube electrónica u orbital alrededor
del núcleo. Los numero quánticos secundarios de
designan con letras.
l = s.p.d.f
Pueden tener lo valores de 0,1,2,3,…
Los valores de "l" dependen de "n"
n= 1 l = 0 —-s
n = 2 l = 0,1—-s,p
n = 3 l = 0,1,2,3 —— s,p,d,
n = 4 l = 0,1,2,3,4….. s,p,d,f
3.- Numero quántico magnético.-
(m).- Representa la orientación de los orbitales
electrónico en el espacio. El numero de orientaciones que
puede presentar el orbital esta dado por los valores que pueden
tomar "m"
m = …..-2.-1, 0 +1, +2
…..
4.- Numero quántico spin (s).- Describe la
orientación del giro del electrón. Puede tener los
valores de
s = – ½ + ½
ORBITALES ATOMICOS.- Es la región donde
existe la posibilidad de encontrar un electrón. Un orbital
debe tener como máximo dos electrones con spin opuesto,
sobre su propio eje,
REGLA DE HUND o PRINCIPIO DE MAXIMA MULTIPLICIDAD
.- Determina la distribución de electrones en
orbitales. "Al distribuir electrones en orbitales del
mismo subnivel, primero se ubica un electrón en cada
orbital y luego de ser posible se procede a
aparearlo"
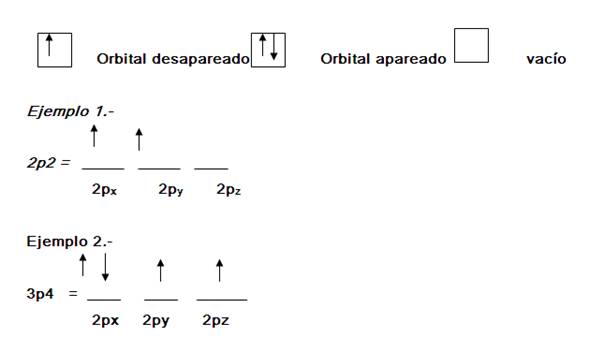
EJERCICIO.- ¿Cuántos orbitales
llenos y semillenos tienen el átomo del Nitrógeno
(z=7) en su estado fundamental?

Dos orbitales llenos
Tres orbitales semillenos
FORMAS Y TIPOS DE ORBITALES.- No todos los
orbitales tienen la misma forma, ni tamaño ni volumen,
sino que difieren con el subnivel (l) y nivel(n) respectivamente.
Tendremos orbitales tipo s, orbitales tipo p, orbitales tipo d, y
orbitales tipo f
TIPOS DE ORBITALES
1.- Orbitales tipo "s"
2.- Orbitales tipo "p"
3.- Orbitales tipo "d"
4.- Orbitales tipo "f"
a).- Orbitales tipo s:.-Son aquellas que
corresponden al subnivel s, es decir l = 0. En cada
subnivel s. existe un solo orbital tipo s cuya forma es
esférica.


b).- Orbitales tipo p:. Son aquellos que
corresponde al subnivel p , es decir l=1 de acuerdo a su
orientación en el espacio , pueden ser de tres clases Px,
Py, y Pz, cuya representación cuantica es (-1, 0 +1)
respectivamente y tienen la forma de dos trompos unidos por la
púas
c).- Orbitales tipo d y f.- Le corresponde al
orbital d 5 orbitales y al f le corresponde 7
orbitales. Debido a que esta forma de representar es muy
dificultosa y por carecer de importancia para nuestro
propósito no lo vamos a graficar
CONFIGURACION ELECTRONICA.- Es la
representación simbólica de la distribución
de los electrones en la nube electrónica, en orden de
menor a mayor energía relativa.
REGLA DE MOELLER O DEL SERRUCHO.- Sirve para
obtener distribuciones electrónicas de los elementos
químicos. Esta nueva regla cumple con la tabla
periódica actual en bloques de Seaborg que
contiene hasta 118 elementos químicos
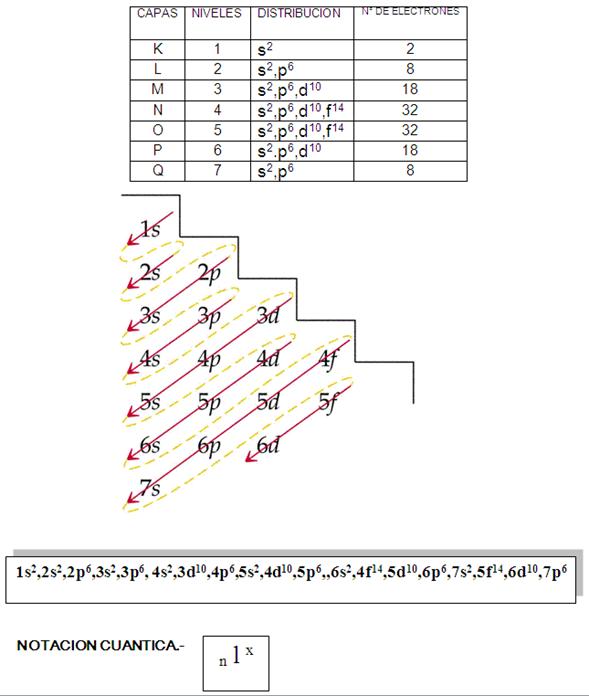
n = Numero cuántico principal
(1,2,3,4,5,6,7…)
l = Numero quántico secundario
(0,1,2,3…)
x = Numero de electrones
Ejemplos:
1.- Hacer la distribución electrónica
de;
EJERCICIOS.-
VI.- ACTIVIDADES.-
1.- ¿Que demostró Thomson?

Autor:
Enviado por:
Pablo Turmero
