
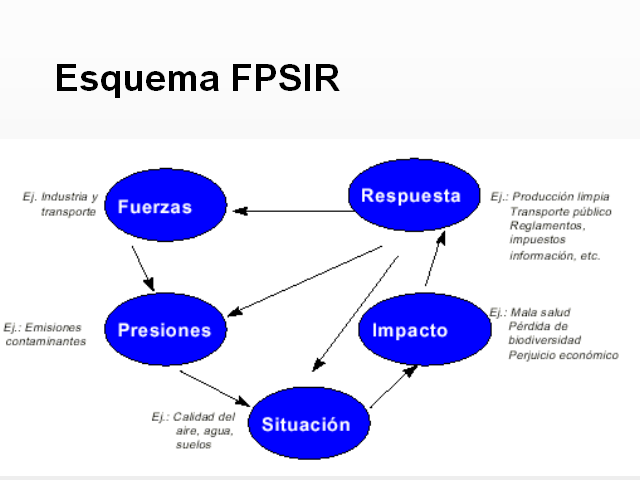
Esquema FPSIR

Control de Fuentes Fijas
Dos líneas de actuación
Modificaciones en el proceso de producción para impedir o minimizar las emisiones.
Uso de técnicas que nos ayuden a eliminar la contaminación producida. En este último caso se debe de tener en cuenta siempre que hacer con los residuos,

A la hora de eliminar la contaminación debemos tener en cuenta si la contaminación es gaseosa o por partículas. En el primer caso existen cuatro categorías: absorción, adsorción, condensación, incineración
Absorción: Retención de contaminantes mediante su absorción por un absorbente húmedo o una disolución que circula contracorriente del contaminante. El tratamiento puede ser físico (disolución) o químico (reacción) o ambos
Adsorción: Retención de contaminantes sobre sólidos por fenómenos de tensión superficial. La eficacia del método depende del sistema sólido-gas que intervengan. En cualquier caso se requiere adsorbentes de elevada porosidad y área superficial. Cuando el adsorbente se satura se hace necesaria su sustitución.

Condensación: Se permite que el gas condense sobre un fluido finamente dividido en pequeñas gotitas o mediante intercambiadores de calor.
Incineración: Se le añade combustible a los gases de salida, o se le hace pasar a través de un lecho catalítico, para terminar de realizar la combustión (conversión a CO2 y H2O) de los gases nocivos.

Elementos a tener en cuenta
Eficiencia de captación
Los límites de emisión vienen fijados frecuentemente por las normas regulatorias de emisión. Suponed por ejemplo que una chimenea emite, sin control, 1800 mg /m3. Mientras que las normas regulatorias solo permiten 90 mg/m3, ¿ Cual debe de ser la eficiencia de captación ?
La eficiencia de captación se diseña para unas condiciones muy particulares de funcionamiento del sistema de captación si cambian estas, su eficacia puede variar enormemente.

Pérdidas de carga. Normalmente la introducción de un sistema de control de la contaminación introduce pérdidas de carga (pérdida de presión) en el flujo de salida de gases y/o partículas. A veces es necesario instalar ciertos aparatos para aumentar la presión a la salida del sistema de captación
Coste del sistema. Obviamente se debe de instalar aquellos sistemas que logren alcanzar eficiencia de colección elevadas al mínimo coste posible

Procesos de adsorción

Adsorción: proceso mediante el cual se produce un fraccionamiento selectivo de una cierta sustancia desde la fase gaseosa o la fase líquida a un substrato sólido. Esto es, mediante el proceso de adsorción se traspasa materia desde una corriente gaseosa o líquida a una superficie de un sólido. El sólido sobre el que se produce la adsorción se denomina adsorbente o también sustrato y la sustancia que se trata de eliminar de la corriente se denomina adsorbato
Absorción
Adsorción

Existen dos tipos de adsorción: La adsorción física o fisiadsorción y la adsorción química o quimiadsorción.
En el proceso de adsorción física entra en juego un tipo de fuerza a escala molecular llamada fuerza Dispersiva de London (que es una fuerza tipo Van der Waals) entre las moléculas del sólido y las moléculas del gas que queremos eliminar, de tal forma que esta fuerza es lo suficientemente intensa como para retener sobre la superficie del sólido dicha sustancia frente al resto de fuerzas que tratan de mantenerla en la corriente gaseosa. En el proceso de adsorción se libera la energía cinética que llevaba el adsorbato, de tal forma que este proceso es exotérmico. La energía liberada es este proceso es del orden de 2-20 kJ/mol. En la adsorción física, las fuerzas London son más intensas si las moléculas del adsorbente y el adsorbato tienen la misma polaridad. Una característica importante de la adsorción física es que la naturaleza química del adsorbato permanece inalterada
Por lo tanto, el proceso es reversible y se puede recuperar la sustancia, generalmente aumentando la temperatura. En este tipo de procesos la temperatura es un factor clave. Un aumento de esta conduce por lo general a una desorción

En la adsorción química o quimiadsorción se produce un enlace químico entre el adsorbato y el adsorbente, esto es se produce un intercambio de electrones entre al adsorbente y el adsorbato. Este enlace es mucho mas fuerte que el que se produce en la fisiadsorción. Se libera mucha más energía, del orden de 20 a 400 kJ/mol. El proceso de quimiadsorción por lo general altera el adsorbato y el adsorbente y es irreversible. Cuando la adsorción química varía con la temperatura se habla de adsorción activada y cuando el proceso de adsorción ocurre muy rápidamente se habla de adsorción química no activada

Obviamente para que se produzca la adsorción se debe de poner en contacto el sólido con el gas o líquido, de tal forma que cuanto mayor sea la superficie de contacto mayor es el proceso de adsorción. Se ha de emplear sustratos con una gran superficie por unidad de masa, esto es, se han de emplear substancias muy porosas. Un ejemplo muy común es el carbón activado donde se han logrado formar carbones activados con una razón área/masa de 105 a 106 m2/kg.

Materiales adsorbentes
Carbón activado (Hidrocarburos, disolventes)
Silica gel (Vapor de agua)
Alúmina activada
Zeolitas o tamices moleculares (se controla muy bien el tamaño del poro. A mayor molécula mayor tamaño)
La efectividad viene determinada por
Naturaleza química
Superficie específica (m2/kg)
Distribución del tamaño de poro
Tamaño de la partícula


Por lo general, en la adsorción física, los adsorbatos con moléculas polares prefieren a los adsorbentes con moléculas polares y los adsorbatos con moléculas no polares prefieren a los adsorbentes con moléculas no polares. Puesto que que el vapor de agua está presente en una buena parte de las salidas de gases, el uso de un adsorbente polar nos llevaría a que se saturase rápidamente de agua y no nos adsorbería al contaminante. De los adsorbentes no polares el carbón activado es de los más utilizados

Como se mide la adsorción
Isotermas de adsorción de Freundlich:
máxima cantidad que el adsorbente puede retener a una temperatura y presión parcial dados
X: masa de adsorbato/masa de adsorbente
Ce: presión parcial del adsorbato

El ciclo de adsorción

Factores que afectan a la adsorción
La temperatura
La presión
La velocidad del flujo
Contaminación por partículas
Humedad

Estrategia de adsorción

Usos de la adsorción
Recuperación de disolventes orgánicos
Tratamiento de malos olores
Tratamiento de vapores tóxicos

Combustión

Mediante este proceso se añade una cierta cantidad de calor al material combustible (hasta que alcanza su punto de ignición) para que se produzca la oxidación de los compuestos reducidos del carbono con la subsiguiente liberación de energía. Se libera la energía que en su momento se empleó en reducir el CO2 atmosférico cuando se formó la materia orgánica empleando como fuente de energía la energía solar. En el proceso intervienen tres componentes
El combustible (líquido, sólido, gaseoso)
El oxidante (oxígeno)
El diluyente (Nitrógeno)
Obteniendo como productos
Productos orgánicos oxidados, CO2 y H2O
Productos oxidados de otras substancias presentes en el combustible
Productos residuales parcialmente oxidados tales como hidrocarbonos no quemados, CO
Diluyentes, Nitrógeno y oxigeno no utilizado
El proceso de combustión

CxHy + bO2 + b (79/21) N2 —-> xCO2 + (y/2) H2O + b (79/21) N2
2b=2x+y/2
Por cada mol de fuel, aparecen x+y/2+b(79/21) moles de productos. El calor generado se emplea en calentar estos productos.
La reacción química genérica que teóricamente (forma estequiométrica) tiene lugar es (se supone que el combustible es un hidrocarburo)
Es usual que la anterior reacción ocurran con un exceso de aire, para asegurarnos que todo el combustible es oxidado. Sea e el exceso de aire (aire utilizado/aire teórico). La reacción la podemos escribir
CxHy + e[bO2 + b (79/21) N2]—-> xCO2 + (y/2) H2O +(e-1)bO2+e b (79/21) N2

Se parametriza la relación entre el combustible y la cantidad de aire que se añade mediante la razón
O bien como función del número de moles
Si la reacción transcurre en modo estequiométrico tenemos una razón estequiométrica. El cociente entre la razón real y la estequiométrica se denomina factor lambda l.

Si l es mayor que 1 se dice que la mezcla es pobre en combustible o rica en aire. Si l es menor que 1 se dice que es rica en combustible o pobre en aire
La cantidad de CO2 y H2O que se obtiene depende de la razón H/C en el combustible y la razón lambda. La razón H/C va de 4 (metano) a 0.2 en la mayoría de los combustibles empleados.

1 BTU (British thermal unit)= 252.2 calorías

Ejercicio: Un carbón bituminoso se quema con un 23% de exceso de oxígeno. El análisis final de carbón muestra la siguiente proporción (en masa) C- 63.5%, H2 – 4.07%, S- 1.53%, O2 – 7.46%, N2, 1.28%, H2O- 15.0%, cenizas, 7,16%. Determinar la cantidad de aire que se debe de suministrar por cada 1000kg de combustible. Determinar la concentración de CO2, H2O, N2, O2 y SO2 en los gases de salida. Determinar la emisión de partículas en gr/m3 suponiendo que un 50% de estas salen a la atmósfera.
Constituyente masa M moles
C 63.50 12 5.29
H2 4.07 2 2.04
S 1.53 32 0.048
O2 7.46 32 0.233
N2 1.28 28 0.046
H2O 15.00 18 0.833
Ash 7.16
O2
5,29
2.04/2=1.02
0.048
-0.233
6.125
*1.23 = 7.53 moles
*(1+79/21) = 35.9

En los gases de salida tendremos:
Combustible Productos de combustión
CO2 5.29 – 5.29 O2
H2O 2.04 – 1.02 O2
SO2 0.048 – 0.048 O2
O2 + 0.233 O2
N2 0.046
H2O 0.833
Aire
O2 +7.53
N2 28.34
38.0 (húmedos)
35.13 (secos)
pV=nR+T; V = nR+T/p = 38.0*8.31*293/101325 =0.91 m3
Partículas
(7.16/2)/0.91 = 3.93gr/m3

La combustión incompleta del combustible puede dar lugar a la aparición de hidrocarburos no quemados.
La combustión incompleta del combustible da lugar, además del combustible que queda sin quemar, a la aparición de monóxido de carbono CO.
Así mismo, a las temperaturas alcanzadas en el interior de los cilindros se forma NO a partir del oxígeno y el nitrógeno del aire. La cantidad de este compuesto depende de la temperatura, la presión, tiempo de reacción y combustible presente.

Emisiones de VOC, CO y NO en función de la razón de mezcla

La figura anterior nos muestra que a factores l menor que la unidad, se produce una alta concentración de CO e hidrocarburos y una baja emisión de NO. Cerca de la razón estequiométrica se produce un mínimo de CO e hidrocarburos, pero un máximo de NO. A factores l mayores que la unidad se incrementan los hidrocarburos y disminuyen el CO y NO.
La conclusión que se puede obtener de los anteriores números es que variando únicamente la razón de mezcla no se puede disminuir a la vez el CO, el NO y los HC.

Factores que afectan a la combustión
Temperatura: La velocidad a la que los materiales combustibles son oxidados dependen fuertemente de la temperatura de trabajo del incinerador. En general un aumento de la temperatura produce un aumento de la velocidad de oxidación. Se debe de alcanzar por lo menos la temperatura de ignición de las substancias que queremos eliminar. Como una mayor temperatura puede significar más combustible y por tanto mayor coste se debe de evaluar muy bien la cantidad de combustible que hay que añadir (es posible que el material a oxidar contribuya también a generar calor, ahorrando combustible)

Tiempo de residencia: Para que se produzca la combustión completa de además de alcanzar la temperatura apropiada se debe de mantener un tiempo mínimo a esa temperatura de tal forma que todas las substancias nocivas sean eliminadas. El tiempo de residencia es función de la geometría de la cámara de combustión y del flujo de paso de la corriente gaseosa por dicha cámara. El tiempo de residencia depende obviamente de la temperatura.
Factores que afectan a la combustión

Factores que afectan a la combustión
Turbulencia: Para que se produzca una buena combustión es necesario que exista una buena mezcla entre el oxígeno y el combustible, si no ocurre esto, es posible que parte del combustible no sea oxidado y salga al exterior. Así mismo es necesario que toda la mezcla combustible alcance la temperatura de ignición. La corriente de gases de desecho se pueden calentar de dos maneras
Por contacto directo con la llama del combustible auxiliar.
Mezclándolos con los gases generados en el proceso de combustión, corriente debajo de la llama.
Aunque el contacto directo con la llama es el método más rápido de alcanzar altas temperaturas a veces es contraproducente porque se puede producir un efecto de dilución al añadir una mezcla más fría y disminuir la temperatura de la llama.

Factores que afectan a la combustión
Oxígeno: Obviamente puesto que el proceso de combustión necesita oxígeno, uno de los ingredientes fundamentales es dicho gas. Hay que mantaner por tanto un aporte mínimo de gas. Al menos el que corresponde a la relación estequiométrica
Temperatura de la llama como función de la razón de mezcla


Incineradores

Eliminación de hidrocarburos y otros compuestos orgánicos
Eliminación de otros compuestos, Cl, S, F
Eliminación de partículas combustibles
Eliminación de sustancias peligrosas

Industrias/emisiones

ESTA PRESENTACIÓN CONTIENE MAS DIAPOSITIVAS DISPONIBLES EN LA VERSIÓN DE DESCARGA
