- Argentometria
- Procedimiento para establecer wl punto de equivalencia
- Metodo de Volhard
- Metodo de Fajans
- Valoración con cloruro de sodio
- Calculo del gasto teórico
- Determinación de cloruros
- Técnica
- Aplicación de las volumetrías de precipitación

Los métodos de precipitación se basan en reacciones que van acompañados de la formación de algunos compuestos difícilmente solubles. Las reacciones en donde ocurren reacciones de precipitación no son tan numerosas en los análisis volumétricos como aquellas en donde se presentan reacciones Redox o acido base.
Se puede representar mediante una reacción general de la siguiente manera:


Argentometria
La argentometria es un método de analisi por precipitación
Que se basa en las reacciones de precipitación de sales de plata muy poco solubles. Se emplean para realizar determinaciones de haluros.
Su reacción general se puede representar por :

Donde:

Procedimiento para establecer wl punto de equivalencia
Existen los siguientes métodos:
1. Método de enturbiamiento
Se añade el titularte a solución problema por analizar hasta que no se forme más precipitado. Se compara luego esta titulación con una muestra patrón que tiene igual intensidad de enturbiamiento.
Ejemplo:

2. Método con empleo de indicadores
En los métodos de titulación con AgNO3 se usan con mayor frecuencia los siguientes métodos:
a) Solución de cromato de potasio (K2 CrO 4)
Se basa en la capacidad del CrO4 = de dar con Ag+ un precipitado pardo rojizo de Ag2CrO4 que en ciertas condiciones comienza a depositarse solo después de que los iones Cl- que se determinan, sean prácticamente precipitados por completo como AgCl.
Toma el nombre de método de mohr. Se aplica este método para determinar la plata, los cloruros y bromuros.
b) Solución de sulfato férrico – amoniaco
El empleo de Fe+3 como indicador se basa sobre su capacidad de dar con SCN- iones complejos solubles en agua de un intenso color rojo;

Al mismo tiempo, el Ag+ forma con SCN- la sal AgSCN difícilmente soluble. Esto permite titular soluciones de sales de plata con una solución patrón de NH4, SCN(o SCNK) en presencia de un indicador, una solución de sal de hierro (III), por ejemplo, de alumbre amoniaco NH4Fe(SO4)2. 12H20 . se llama método de Volhard.
3. Indicadores de absorción
Los indicadores de adsorción son colorantes orgánicos aniónicos. La acción de estos indicadores es debida a que la adsorción del indicador se produce al alcanzar el punto de equivalencia y durante el proceso de adsorción ocurre un cambio en el indicador que lo transforma en una sustancia de color diferente. El cambio de color en estos indicadores se debe a una deformación de sus capas electrónicas que tiene lugar cuando un ion entra dentro del campo eléctrico de un ion vecino de carga opuesta.
Ejemplos de indicadores:
– La diclorofluresceína es adsorbida sobre el AgCl, pasando a la disolución iones Cl-. Cuando se añade AgNO3 a una disolución neutra de cloruro que contiene una pequeña cantidad de fluoresceínas, el punto de equivalencia de la reacción se pone de manifiesto por un cambio de color de amarillo a rosado. Cuando se deja sedimentar el precipitado se observa que es de color rosa, mientras que la disolución es casi incolora.

Método de mohr
El método de mohr se caracteriza porque emplea como reactivo indicador al ion cromato. La primera aparición del precipitado rojizo de cromato de plata se toma como punto final de la titulación .este método se utiliza frecuentemente para la determinación de cloruros en forma de cloruro de plata ya que el reactivo valorante es el nitrato de plata estandarizado .
Este método consiste en titular cloruros con nitrato de plata en presencia de ion cromato. La reacción de titulación es la siguiente:

El cloruro de plata (1x 10-5 mol / litro) es menos soluble que el cromato de plata (8.4x 10-5 mol/litro).Cuando los iones plata se adicionan a una solución de cloruros y un poca concentración de iones cromato, el cloruro de plata se precipitara primero, cada precipitado comienza a formarse solo después que su producto de solubilidad sea superado. La magnitud de productos de solubilidad del cloruro de plata es Kps = 1.82×1010 y para alcalizarla hace falta que la concentración de Ag+ en la solución sea igual a:

La reacción en el punto final está dada cuando se forma el precipitado rojizo de cromato de plata:

La concentración de iones plata necesaria para comenzar la precipitación de cromato de plata se calcula de la misma manera que el caso anterior (Kps del Ag2CrO4 = 1.1×10-12)
[Ag+]2 [CrO4=] = Kps = 1.1 x 10-12
De aquí que:

En estas relaciones se supone que la solución de cloruro de sodio es 0.01 M y que la de cromato es 10-2M .De esta manera que, el producto de solubilidad del cloruro de plata se obtiene antes que el cromato de plata. Entonces se tiene que el cromato de plata no se formara hasta que la concentración de ion plata aumente lo suficiente para que exceda la Kps del cromato de plata.
La titulación de Mohr es aplicable solo para soluciones cuyo pH es neutro o débilmente alcalino (pH 6 a 10).en soluciones acidas la concentración de ion cromato disminuye mucho, ya que el cromato acido está en equilibrio con el dicromato.

La disminución de la concentración de ion cromato provoca que se necesite adicional un gran exceso de iones plata para que ocurra la precipitación del cromato de plata y esto conduce a grandes errores. Normalmente se utiliza una concentración de cromato de 0.005 a 0.01M.el error que se puede tener se puede corregir determinando un blanco.
Por otra parte, si se alcanza fuertemente el medio de la solución se corre el riesgo que el ion plata precipita como oxido de plata.

Si la solución, analizada presenta reacción acida, se le neutraliza con bórax o bicarbonato de sodio. Si es básica se neutraliza con ácido acético o sulfúrico.
Otra condición para aplicar este método es que debe estar ausentes en la solución iones como el bario, plomo, o bismuto que forman precipitados con el indicador cromato. Así mismo, interfieren algunos iones que forman precipitados con el ion plata, tales como los fosfatos, arseniatos, y los oxalatos.
El método de Mohr se aplica satisfactoriamente para titilar cloruros, bromuros y cianuros, pero no funciona para yoduros, o tiocianatos.
Metodo de Volhard
La titulación de volhard es realmente un procedimiento para determinar plata. Para determinar cloruros se requiere efectuar una titulación por retroceso. Primero se precipita el ion cloruro con un exceso conocido de una solución estándar de AgNO.
Reacción de titulación
 Cr + Ag (en exceso) AgCl(s) exceso Ag reacción de titulación
Cr + Ag (en exceso) AgCl(s) exceso Ag reacción de titulación
Se separa el AgCl y el exceso de Ag se titula con una solución standard de KSCN en presencia de Ion Fe
Reacción de retrovaloración
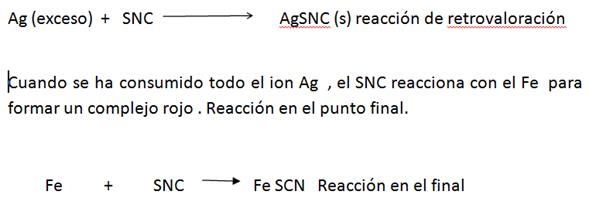
La aparición del color rojo indica el punto final. Al conocer la cantidad de SNC que fue necesaria para la titulación por retroceso, se puede saber qué cantidad de Ag quedo sin reaccionar después de la reacción con Cl-. Puesto que se conoce la cantidad total de Ag, puede calcularse la cantidad de este consumida el CT
Un problema relacionado con la determinación de cloruros proviene del hecho de que la solubilidad del cloruro de plata es mayor que la del tiocianato de plata. En consecuencia, cuando el precipitado de cloruro de plata está en contacto con una solución que contiene un exceso de iones tiocianato , tiende a ocurrir la reacción.

Para evitar que esto ocurra , se utiliza dos técnicas:
a) Una consiste en separar el AgCl por filtración y solo titular el Ag en el filtrado.
b) La otra , más simple , consiste en agitar con el AgCl precipitado algunos milímetros de nitrobenceno, antes de la titulación por retroceso. El nitrobenceno recubre el cloruro de plata y lo aísla felizmente del ataque por SNC-. Los iones bromuros , e ioduros , cuyas sales de plata son menos solubles que el AgSCN , pueden titularse por el método de Volhard sin aislar el precipitado de haluro de plata.
Metodo de Fajans
Se utiliza un indicador de absorción, se denomina indicadores de absorción aquellas sustancias que comunican un color distinto a la superficie de un precipitado, de tal manera que la aparición de una coloración en la superficie del precipitado indica el punto final.
Los indicadores de absorción usuales son colorantes anicónicos, atraídas por las partículas de precipitado cargadas positivamente que se producen justo después del punto equivalente. La absorción del colorante con carga negativa en la superficie cargada positivamente modifica el color de esta sustancia. El cambio de color señala el punto final de titulación.
La reacción estequiometrica de titulación es simplemente una precipitación del halogenuro de plata, la reacción en el punto final se lleva a cabo entre la plata (Y) y el anión colorido de un indicador.

REQUISITOS PARA UNA VOLUMETRIA DE PRECIPITACION
El reactivo colorante o el precipitado debe cumplir los siguientes requisitos:
1. Se debe obtener un precipitado en un estado de dispersión lo mayor posible, es decir, debe obtenerse y mantenerse un coloide.
2. El precipitado tiene que absorber fuertemente a sus iones.
3. El colorante tiene que ser requerido con intensidad por los iones absorbidos primariamente.
4. La mayoría de indicadores son ácidos débiles, por lo que la concentración del anión del colorante depende del pH de la solución que lo contiene; lo que implica que estos indicadores solamente se pueden emplear en soluciones que no sean demasiados acidas.
El indicador más comúnmente utilizado para la titulación, de AgCl es la inflorescencia, este indicador es verde amarillento en solución pero se vuele rosa cuando se absorbe en AgCl.
PREPARACION DE LA SOLUCION N/10 DE NITRATO DE PLATA:
El AgNO3 es un reactivo categoría pro-análisis tiene una pureza no menor de 99.99% por lo que se puede preparar una solución por pesada directa .su peso equivalente es:

Teóricamente se debe pesar 16.989 g. de AgNO3 previamente desecada en una estufa a 150°C .En la práctica se pesa 17 g. se disuelve con H2O destilada Y se lleva a una fiola de 1 litro, se diluye, enrasa y homogeniza .se guarda en frasco color caramelo para protegerlo de la luz y evitar su descomposición.
Valoración con cloruro de sodio
El NaCl tiene una pureza de 99.99% -100% por eso es un excelente patrón primario. La técnica de valoración es la siguiente: Se pesa exactamente 0.1000g. De cloruro de sodio, se disuelve con agua destilar y se diluye a aproximadamente a 60 ml; se agrega 1 ml de la solución de cromato de potaio al 5 % y luego se precede a titular con la solución de nitrato de plata por valorar. Suponer un gasto de nitrato de 17 ml. Determinar el factor de corrección y dela verdadera normalidad de la solución.
Calculo del gasto teórico

Datos:
P.E. NaCl = 58.46 g.
Peso tomada = 0.1 g.
Gasto teórico = 17.105 ml.
Gasto practico = 17
Factor de corrección =  1.006
1.006
La normalidad exacta es:
N =
También se puede calcular su verdadera normalidad :
N = 1.0061 x 0.1 meq x ml = 0.1006 meq/ml.
Determinación de cloruros

El método usual para determinar cloruros es el método mohr.se titula el cloruro con una solución standard de nitrato de plata en medio neutro o débilmente alcalino (pH 6.5 a 10 ) dando un precipitado blanco de cloruro de plata que precipita cuantitativamente de acuerdo a la siguiente reacción :
 Ag+ + Cl – Agcl reacción de titulación
Ag+ + Cl – Agcl reacción de titulación
Cuando la precipitación del cloruro termina, el primer exceso del titulante reacciona con el cromato para formar un precipitado rojo de cromato de plata.

2Ag+ CrO4-2 Ag2CrO 4 Reacción en el punto final.
Pardo rojo
Es necesario agregar un ligero exceso de AgNO3 para que se forme suficiente Ag2CrO y destaque entre el precipitado blanco y la solución amarilla de cromato.
Técnica
1. Preparación de la muestra :
Medir una cantidad adecuada de muestra o solución problema, ajustar el pH de la solución entre 6.5 a 10
2. Titulación :
Se titula con la solución de AgNo3 hasta que el indicador se torne de un color naranja o anaranjado débil, que indica el punto final de la reacción
La concentración del indicador cromato, el punto final se alcanza antes del punto de equivalencia si se añade muy poco cromato se alcanza el punto final después.
Se suele determinar un "blanco" para corregir el volumen efectivo gastado en la situación . se agrega el mismo volumen del indicador , del volumen total de la valoración y una pequeña porción de CaCO 3 . Es te volumen se restan del volumen gastado en la determinación de cloruros.
Aplicación de las volumetrías de precipitación
Los principales métodos volumétricos por precipitación y sus aplicaciones son:
METODOS VOLUMETRICOS DE PRECIPITACION:
ELEMENTOS O COMPONENTES A DETERMINAR | REACTIVO PRECIPITANTE (TITULANTE) | PRODUCT8O INSOLUBLE | INDICACION PUNTO FINAL |
Zn | K4(Fe(CN)6)2 | K2Zn3(Fe(CN)6)2 | Definilamina |
In,Ga | K4(Fe(CN)6) | M4(Fe(CN)6) | Electro analítico |
Hg (II) | K4(Fe(CN)6) | Hg4(Fe(CN)6) | Electro analítico |
Cl- + Br | Hg2 ((NO)3)2 | Hg2 Cl2 Hg2 Br2 | Difenilcabazona |
Fe (CN)6 -3 | Hg2 (NO)3)2 | KHg2 Fe (CN)6 | Electrometrico |
I- | HgCl2 | HgI2 | Todo- almidon |
SO 4 -2 | Pb (NO3)2 | PbSO4 | EritiosinaB |
Pb | (NH4)6 Mo7 O2 4H2O | PbMoO | Tanino (externo) |
METODOS VOLUMETRICOS
PRECIPITACION ARGENTRIMETRICOS
COMPONENTES POR ANALIZAR | PUNTO FINAL | NOTAS |
AS | Volhard | |
I-, CON, SCN- | ||
CO | Volhard | Separar previamente |
C | La sal de plata | |
C2 O | ||
B | Mohr | |
B | Indicador absorción | Color rosado |
(dicloruro fluoreccionos) | Valoracion con A | |
Acidos grasos, mercaptanos | Electroanalitico |
Dedicatoria:
Dedico primordialmente a nuestros padre por hacer nos estudiar y hace posible que no nos falte nada, también damos gracias al Dr. Jorge Valdeiglesia Jara por enseñarnos y compartir todos sus conocimientos a todos nuestros compañeros
Autor:
EDITH MAMANI YUCA
SABY KATTERY RODRIGUEZ TITO
DEYSI MAMANI BENIQUE
RUTH PAMELA QUISPE CONDORI
ROXANA HUAMÁN HANCO
Juliaca – puno
- 2015

 , Br
, Br CrO
CrO
 C
C
 PO
PO
 C
C
 C
C