
Introducción
Celda para medidas potenciométricas
Potencial de celda
Electrodos de referencia
Potencial de unión líquida
Electrodos indicadores
6.1. Electrodos indicadores metálicos
6.2. Electrodos indicadores de membrana (ISE)
7. Electrodo de membrana de vidrio para medir pH
Electrodo de membrana líquida
Electrodo de membrana cristalina
Instrumentación
Aplicaciones
Aplicaciones al análisis de alimentos
1
CONTENIDOS

2
Los métodos electroanalíticos están basados en las propiedades eléctricas de una disolución de analito cuando forma parte de una celda electroquímica.
Los métodos potenciométricos de análisis se basan en las medidas del potencial de celdas electroquímicas en ausencia de corrientes apreciables.
Las técnicas potenciométricas se utilizan:
Para la detección de los puntos finales en los métodos volumétricos de análisis.
Para determinar las concentraciones de los iones por medida directa del potencial de un electrodo de membrana selectiva de iones. Tales electrodos están relativamente libres de interferencias y proporcionan un medio rápido y conveniente para estimaciones cuantitativas de numerosos aniones y cationes importantes.
El equipo requerido para los métodos potenciométricos es sencillo y económico e incluye un electrodo de referencia, un electrodo indicador y un dispositivo para la medida del potencial.
1. Introducción

3
2. Celdas para medidas potenciométricas
Los valores absolutos de potencial para semiceldas individuales no se pueden cuantificar en el laboratorio.
Sólo es posible la medida experimental de potenciales de celda relativos.
Una celda típica para el análisis potenciométrico se puede representar como:
electrodo de referencia | puente salino | disolución de analito | electrodo indicador
Eref
Ej
Eind

4
El electrodo de referencia:
Es una semicelda cuyo potencial de electrodo Eref se conoce con exactitud y es independiente de la concentración del analito u otros iones en la disolución de estudio.
Por convenio, el electrodo de referencia siempre se considera como el de la izquierda en las medidas potenciométricas.
El electrodo indicador
Es el que se sumerge en la disolución del analito, adquiere un potencial Eind que depende de la actividad del propio analito.
Muchos electrodos indicadores que se emplean en potenciometría son selectivos en su respuesta (electrodos selectivos de iones, ESI)
2. Celdas para medidas potenciométricas

5
Puente salino:
Es el tercer componente de la celda potenciométrica.
Impide que los componentes de la disolución de analito se mezclen con los del electrodo de referencia.
En la superficie de contacto de cada extremo del puente salino se desarrolla un potencial de unión líquida, Ej.
El KCl es un electrolito para el puente salino casi ideal, ya que la movilidad de los iones K+ y Cl- es prácticamente idéntica. Por tanto, el potencial neto a través del puente salino Ej se reduce a unos pocos milivoltios.
En los métodos electroanalíticos, el potencial de unión es suficientemente pequeño para no tenerse en cuenta.
El potencial de unión y su incertidumbre pueden ser factores que limiten la exactitud y precisión de la medida.
2. Celdas para medidas potenciométricas

6
El potencial de la celda potenciométrica viene dado por la ecuación:
El primer término de la ecuación, Eind, contiene la información que se busca: la concentración del analito.
Para la determinación potenciométrica de un analito debe medirse el potencial de celda, corregirlo respecto de los potenciales de referencia y de unión, y calcular la concentración del analito a partir del potencial del electrodo indicador.
La calibración apropiada del sistema de electrodos es la única forma de determinar la concentración del analito en disoluciones de concentración desconocida.
3. Potencial de celda potenciométrica
Ecelda = Eind – Eref + Ej

7
Características de un electrodo de referencia ideal:
Su potencial :
se conoce con exactitud
es constante
es insensible a la composición de la disolución del analito.
Debe ser resistente y fácil de montar
Los más utilizados son:
Electrodo de calomelanos saturado (ECS)
Electrodo de Ag / AgCl
4. Electrodos de referencia

8
Un electrodo de referencia de calomelanos se representa esquemáticamente como:
Hg / Hg2Cl2 (sat),KCl (x M) //
donde x es la concentración molar del cloruro de potasio en la disolución.
Las concentraciones de KCI empleadas habitualmente en los electrodos de referencia de calomelanos son 0,1 M; 1 M y saturada (casi 4,6 M).
El electrodo de calomelanos saturado (ECS) es el más empleado dada su fácil preparación.
El potencial del ECS es de 0,2444 V a 25°C.
Electrodo de referencia de calomelanos
La reacción del electrodo en las semiceldas de calomelanos es:
Hg2Cl2 (s) + 2 e- ? 2 Hg(l) + 2Cl-
4. Electrodos de referencia

9
Electrodo de referencia de calomelanos
Consiste en dos tubos concéntricos:
Un tubo exterior, de 5-15 cm de longitud y 0,5-1 cm de diámetro, que contiene KCl saturado.
Un tubo interno que contiene una pasta de mercurio/cloruro de mercurio (I) en cloruro de potasio saturado, que se conecta con la disolución saturada de cloruro de potasio del tubo externo a través de un pequeño orificio.
En la pasta se introduce un electrodo de metal inerte.
El contacto con la disolución de analito se produce a través de un tapón poroso, sellado en el extremo del tubo externo
Electrodo de calomelanos saturado
Tapón poroso
KCl Sat
Tubo interno con pasta de Hg, Hg2Cl2 y KClsat
orificio
Contacto eléctrico
Puente salino
Fig. 1
4. Electrodos de referencia

10
Este electrodo de referencia consiste en un electrodo de plata metálica sumergido en una disolución saturada en cloruro de potasio y cloruro de plata. Representación esquemática:
Ag | AgCl (sat), KCI (x M) II
El potencial de electrodo está determinado por la semirreacción:
El potencial de este electrodo cuando la disolución de KCl es saturada, E Ag/AgCl es 0,199 V a 25ºC.
Electrodo de referencia de plata/cloruro de plata
AgCl(sat) + e- ? Ag(s) + Cl-
4. Electrodos de referencia

11
Consiste en un tubo exterior de 5-15 cm de longitud y 0,5-1 cm de diámetro que contiene un alambre de plata recubierto con una capa de cloruro de plata; este alambre está sumergido en una disolución de cloruro de potasio saturada con cloruro de plata.
El electrodo es semejante en apariencia externa y en forma al electrodo de calomelanos
Para ambos tipos de electrodos se utilizan uniones similares.
Electrodo de referencia de plata/cloruro de plata
Electrodo de referencia Ag/AgCl comercial
Contacto eléctrico
Alambre de Ag, AgCl(S) , KCl(sat)
KCl(sat)
4. Electrodos de referencia
12
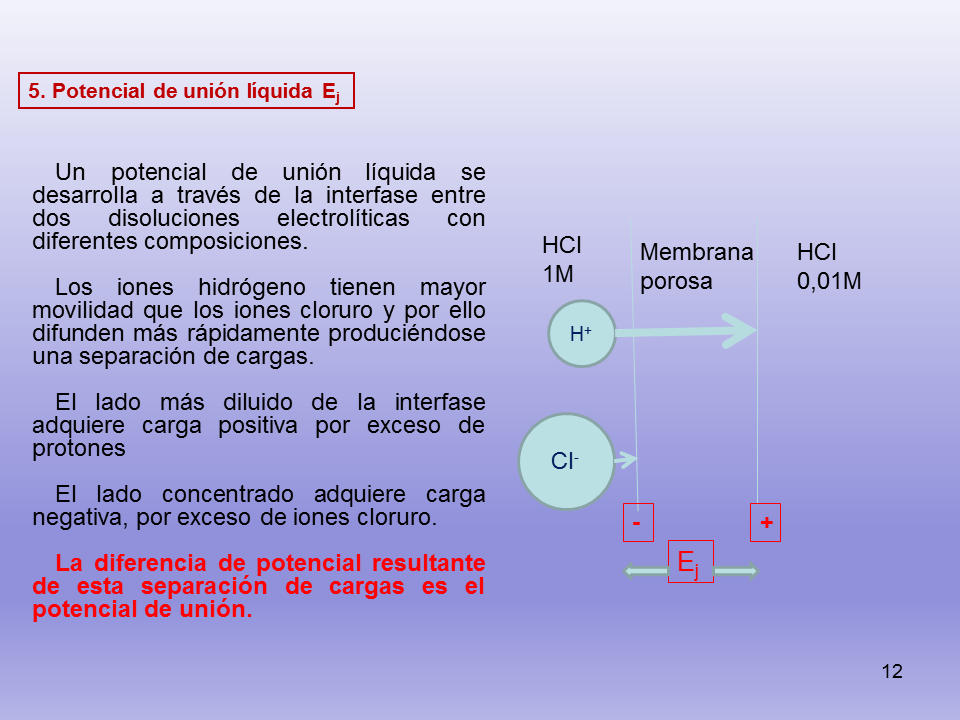
Un potencial de unión líquida se desarrolla a través de la interfase entre dos disoluciones electrolíticas con diferentes composiciones.
Los iones hidrógeno tienen mayor movilidad que los iones cloruro y por ello difunden más rápidamente produciéndose una separación de cargas.
El lado más diluido de la interfase adquiere carga positiva por exceso de protones
El lado concentrado adquiere carga negativa, por exceso de iones cloruro.
La diferencia de potencial resultante de esta separación de cargas es el potencial de unión.
5. Potencial de unión líquida Ej
Membrana porosa
HCl 1M
HCl 0,01M
H+
Cl-
Ej
–
+

13
Características de un electrodo indicador ideal:
Su potencial:
Depende fundamentalmente de la actividad, concentración, del analito en la muestra.
Responde de manera rápida y reproducible a los cambios de concentración de un ión analito (o un grupo de iones analitos).
No hay un electrodo indicador que sea absolutamente específico en su respuesta
Hay electrodos indicadores que son selectivos (ESI, ISE)
Los electrodos indicadores son de dos tipos:
metálicos
de membrana
6. Electrodos indicadores

14
6.1 Electrodos indicadores metálicos
Los electrodos indicadores metálicos se dividen en
electrodos de primera especie,
electrodos de segunda especie,
electrodos redox inertes.
Un electrodo de primera especie es un electrodo metálico puro (Cu, Zn, Ag), que está en equilibrio directo con su catión en la disolución.
En su superficie se produce la reacción:
Xn+(ac) + n e- ? X(s)
El potencial Eind de este electrodo viene dado por la ecuación de Nernst
donde Eind es el potencial del electrodo metálico y aXn+ es la actividad del ion (o, en una disolución diluida, aproximadamente su concentración molar [Xn+]).
No son selectivos y por ello actualmente no se suelen usar en potenciometría
6.1 Electrodos indicadores metálicos de primera especie, Xn+ / X
Página siguiente  |
