Indice
1. Pila
de combustible
2. Pilas Primarias
3. Pilas Secundarias
4. Pilas Solares
Mecanismo electroquímico en el cual la
energía de una reacción química se convierte
directamente en electricidad. A
diferencia de la pila eléctrica o batería, una pila
de combustible no se acaba ni necesita ser recargada; funciona
mientras el combustible y el oxidante le sean suministrados desde
fuera de la pila.
Una pila de combustible consiste en un ánodo en el que se
inyecta el combustible —comúnmente hidrógeno,
amoníaco o hidracina— y un cátodo en el que
se introduce un oxidante —normalmente aire u oxígeno. Los dos electrodos de una pila de
combustible están separados por un electrólito
iónico conductor. En el caso de una pila de combustible de
hidrógeno-oxígeno
con un electrólito de hidróxido de metal alcalino,
la reacción del ánodo es 2H2 + 4OH- → 4H 2O +
4e- y la reacción del cátodo es O2 + 2H2O + 4e-
→ 4OH-. Los electrones generados en el ánodo se
mueven por un circuito externo que contiene la carga y pasan al
cátodo. Los iones OH- generados en el cátodo son
conducidos por el electrólito al ánodo, donde se
combinan con el hidrógeno y forman agua. El
voltaje de la pila de combustible en este caso es de unos 1,2 V
pero disminuye conforme aumenta la carga. El agua
producida en el ánodo debe ser extraída
continuamente para evitar que inunde la pila. Las pilas de
combustible de hidrógeno-oxígeno que utilizan
membranas de intercambio iónico o electrólitos de
ácido fosfórico fueron utilizadas en los programas
espaciales Gemini y Apolo respectivamente. Las de
ácido fosfórico tienen un uso limitado en las
instalaciones
eléctricas generadoras de energía.
Actualmente se están desarrollando las pilas de
combustible con electrólitos de carbonato fundido. El
electrólito es sólido a temperatura
ambiente, pero
a la temperatura de
operación (650 a 800 °C), es un líquido
con iones carbonato conductores. Este sistema tiene la
ventaja de utilizar monóxido de carbono como
combustible, por lo que pueden utilizarse como combustible
mezclas de
monóxido de carbono e
hidrógeno como las que se producen en un gasificador de
carbón.
También se están desarrollando pilas de combustible
que emplean dióxido de circonio sólido como
electrólito. Estas pilas se llaman pilas de combustible de
óxido sólido. El dióxido de circonio se
convierte en un conductor iónico a unos 1.000 °C.
Los combustibles más adecuados son el hidrógeno, el
monóxido de carbono y el metano, y al cátodo se le
suministra aire u
oxígeno. La elevada temperatura de operación de las
pilas de combustible de óxido sólido permite el uso
directo de metano, un combustible que no requiere catalizadores
costosos de platino sobre el ánodo. Las pilas de
combustible de óxido sólido tienen la ventaja de
ser relativamente insensibles a los contaminantes del
combustible, como los compuestos de azufre y nitrógeno que
empeoran el rendimiento de otros sistemas de
combustible.
La temperatura relativamente elevada de operación de las
pilas de combustible de carbonato fundido y óxido
sólido facilitan la eliminación en forma de vapor
del agua producida
por la reacción. En las pilas de combustible de baja
temperatura se deben tomar medidas para eliminar el agua
líquida de la cámara del ánodo.
2. Pilas Primarias
La pila primaria más común es la pila
Leclanché o pila seca, inventada por el químico
francés Georges Leclanché en la década de
1860. La pila seca que se utiliza hoy es muy similar al invento
original. El electrólito es una pasta consistente en una
mezcla de cloruro de amonio y cloruro de cinc. El electrodo
negativo es de cinc, igual que el recipiente de la pila, y el
electrodo positivo es una varilla de carbono rodeada por una
mezcla de carbono y dióxido de manganeso. Esta pila
produce una fuerza
electromotriz de unos 1,5 voltios.
Otra pila primaria muy utilizada es la pila de cinc-óxido
de mercurio, conocida normalmente como batería de
mercurio. Puede tener forma de disco pequeño y se utiliza
en audífonos, células
fotoeléctricas y relojes de pulsera eléctricos. El
electrodo negativo es de cinc, el electrodo positivo de
óxido de mercurio y el electrólito es una
disolución de hidróxido de potasio. La
batería de mercurio produce 1,34 V,
aproximadamente.
La pila de combustible es otro tipo de pila primaria. Se
diferencia de las demás en que los productos
químicos no están dentro de la pila, sino que se
suministran desde fuera.
El acumulador o pila secundaria, que puede recargarse
invirtiendo la reacción química, fue
inventado en 1859 por el físico francés Gaston
Planté. La pila de Planté era una batería de
plomo y ácido, y es la que más se utiliza en la
actualidad. Esta batería, que contiene de tres a seis
pilas conectadas en serie, se usa en automóviles,
camiones, aviones y otros vehículos. Su ventaja principal
es que puede producir una corriente
eléctrica suficiente para arrancar un motor; sin
embargo, se agota rápidamente. El electrólito es
una disolución diluida de ácido sulfúrico,
el electrodo negativo es de plomo y el electrodo positivo de
dióxido de plomo. En funcionamiento, el electrodo negativo
de plomo se disocia en electrones libres e iones positivos de
plomo. Los electrones se mueven por el circuito eléctrico
externo y los iones positivos de plomo reaccionan con los iones
sulfato del electrólito para formar sulfato de plomo.
Cuando los electrones vuelven a entrar en la pila por el
electrodo positivo de dióxido de plomo, se produce otra
reacción química. El dióxido de plomo
reacciona con los iones hidrógeno del electrólito y
con los electrones formando agua e iones plomo; estos
últimos se liberarán en el electrólito
produciendo nuevamente sulfato de plomo.
Un acumulador de plomo y ácido se agota porque el
ácido sulfúrico se transforma gradualmente en agua
y en sulfato de plomo. Al recargar la pila, las reacciones
químicas descritas anteriormente se invierten hasta
que los productos
químicos vuelven a su condición original. Una
batería de plomo y ácido tiene una vida útil
de unos cuatro años. Produce unos 2 V por pila.
Recientemente, se han desarrollado baterías de plomo para
aplicaciones especiales con una vida útil de 50 a 70
años.
Otra pila secundaria muy utilizada es la pila alcalina o
batería de níquel y hierro, ideada
por el inventor estadounidense Thomas Edison en torno a 1900. El
principio de funcionamiento es el mismo que en la pila de
ácido y plomo, pero aquí el electrodo negativo es
de hierro, el
electrodo positivo es de óxido de níquel y el
electrólito es una disolución de hidróxido
de potasio. La pila de níquel y hierro tiene la desventaja
de desprender gas
hidrógeno durante la carga. Esta batería se usa
principalmente en la industria
pesada. La batería de Edison tiene una vida útil de
unos diez años y produce 1,15 V, aproximadamente.
Otra pila alcalina similar a la batería de Edison es la
pila de níquel y cadmio o batería de cadmio, en la
que el electrodo de hierro se sustituye por uno de cadmio.
Produce también 1,15 V y su vida útil es de unos 25
años.
Las pilas solares producen electricidad por
un proceso de
conversión fotoeléctrica. La fuente de electricidad
es una sustancia semiconductora fotosensible, como un cristal de
silicio al que se le han añadido impurezas. Cuando la
luz incide
contra el cristal, los electrones se liberan de la superficie de
éste y se dirigen a la superficie opuesta. Allí se
recogen como corriente
eléctrica. Las pilas solares tienen una vida muy larga
y se utilizan sobre todo en los aviones, como fuente de
electricidad para el equipo de a bordo.
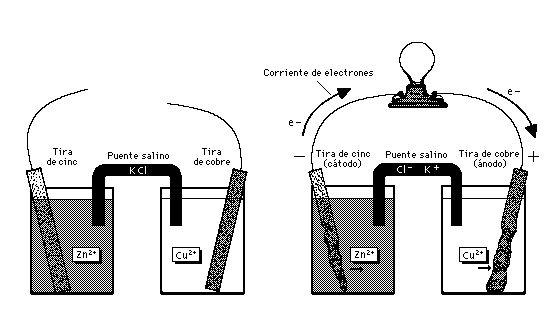
Una pila voltaica aprovecha la electricidad de una
reacción química espontánea para encender
una bombilla (foco). Las tiras de cinc y cobre, dentro
de disoluciones de ácido sulfúrico diluido y
sulfato de cobre
respectivamente, actúan como electrodos. El puente salino
(en este caso cloruro de potasio) permite a los electrones fluir
entre las cubetas sin que se mezclen las disoluciones. Cuando el
circuito entre los dos sistemas se
completa (como se muestra a la
derecha), la reacción genera una corriente
eléctrica. Obsérvese que el metal de la tira de
cinc se consume (oxidación) y la tira desaparece. La tira
de cobre crece al reaccionar los electrones con la
disolución de sulfato de cobre para producir metal
adicional (reducción). Si se sustituye la bombilla por una
batería la reacción se invertirá, creando
una célula
electrolítica.
Ejemplo
Autor:
Frost Loco