Indice
1.
Introducción
2. Descubrimiento de los
oncogenes
3. Genes implicados en el
cáncer
4. Participación de los factores
del crecimiento y productos oncogénicos en la
proliferación celular
5. Activacion de los
oncogenes
6. La
Telomerasa
7. El ciclo celular en la
carcinogenesis
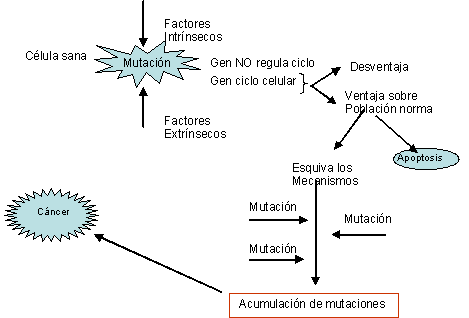
Aunque el cáncer
ha sido una enfermedad inescrutable durante mucho tiempo, la
semilla del conocimiento
se plantó en 1911 cuando PEYTON RUS descubrió que
un filtrado libre de células
procedente de ciertos sarcomas de pollo podía causar
nuevos tumores cuando se inoculaba a animales sanos,
sugiriendo así la posible etiología vírica
de determinadas neoplasias. Su idea se acogió con general
escepticismo, pero su trabajo fue reconocido con el premio Nobel
56 años después.
Las técnicas
de biología
molecular permiten examinar directamente el papel de las
alteraciones del DNA y explorar la naturaleza del
daño causado. Todo un conjunto de avances ha permitido
llegar a afirmar que el cáncer es fundamentalmente una
enfermedad genética
(que procede de distintas alteraciones: mutaciones recesivas,
dominantes, reacoplamientos de DNA, mutaciones puntuales, etc.,
que pueden alterar la expresión o la función
bioquímica
de los genes afectados).
Hay que destacar, sin embargo, que el cáncer no es una
enfermedad hereditaria en la gran mayoría de los casos.
Las alteraciones genéticas asociadas a tumores son casi
siempre de tipo somático, es decir, se adquieren durante
la vida del individuo y no por herencia, esto es
que el cáncer es una enfermed genética pero
generalmente no hereditaria es decir que el tumor se debe a la
expansión clonal de una sola célula
progenitora que ha sufrido una lesión genética
(así pues los tumores son monoclonales). Esta clonalidad
es valorada muy fácilmente en mujeres heterocigotos para
los marcadores polimorfos ligados al cromosoma X, como la enzima
Glucosa 6 fosfato deshidrogenasa (G6PD) o por polimorfismos con
el cromosoma X.
2. Descubrimiento de los
oncogenes
La historia del descubrimiento
de los oncogenes está ligada con la de la
identificación del agente viral que causa el llamado
sarcoma de Rous en las aves. Hace
cerca de 80 años el patólogo Francis Peyton Rous
decidió inyectar a docenas de gallinas con el filtrado que
obtuvo al tamizar, a través de una malla muy fina, una
suspensión de células de un tumor obtenido por
autopsia de una gallina de la misma raza. Con este procedimiento
logró reproducir el tumor y sospechó que el agente
causal debería ser de menor tamaño que las
células y que las bacterias, por
lo que podría corresponder a un virus, aunque no
lo designó así sino como un agente tumoral. Cabe
mencionar que el doctor Rous recibió el premio Nobel de
Medicina por sus
descubrimientos en 1966.
Más recientemente el doctor J. Michael Bishop, galardonado
en 1989 también con el Premio Nobel de Medicina,
informó que el gen v-src, el cual permite al virus
causante del sarcoma de Rous inducir el tumor, también
está contenido en las células normales no tan
sólo de la gallina sino de algunos vertebrados, incluyendo
al ser humano. Logró este descubrimiento gracias al
empleo de las
nuevas
tecnologías de la llamada ingeniería
genética, que permitieron, en primer lugar, copiar al
gen v-src mediante una enzima que puede generar una
versión de ADN a partir de
la hebra de ARN del genoma viral (transcriptasa reversa). El
siguiente paso consistió en multiplicar el número
de copias del gen v-src, marcándolas con un isótopo
radioactivo para poder seguir
su destino. Finalmente las puso en contacto con el ADN
desnaturalizado (separado en sus dos hebras) extraído de
los distintos tipos celulares. Esto trajo como resultado la
formación de algunas cadenas híbridas (que
contenían una hebra de ADN marcado, la copiada del genoma
viral, y otra sin marcar, proveniente de la célula
donadora), que revelaron zonas de homología y descubrieron
la misma secuencia en las células normales.
El estudio de la secuencia de nucleótidos del gen src
permitió, además, descubrir que, por su organización (presencia de secuencias
conocidas como exones e intrones típicas de los genes
animales pero no virales), ese gen no pertenecía al virus,
sino que debió ser arrastrado por éste
después de unirse y desprenderse del material
genético de alguna célula hospedera (Figura 7).
Más aún, sus homólogos en las células
normales resultaron ser genes activos y fue
también el grupo del
doctor Bishop quien descubrió la proteína
codificada por el gen src (llamado c-src porque corresponde a la
versión celular de ese gen), a la que denominaron
pp60c-src, y que, sorprendentemente, resultó ser una
proteína fuertemente unida a la superficie interior de la
membrana celular y capaz de fosforilar a las tirosinas.
Incorporación del oncogén src al genoma
viral.
Hoy se sabe que en las células cancerosas que contienen
activo el oncogén c-src: está presente una
proteína pp60c-src a la que, curiosamente, le falta, en un
sitio peculiar, una tirosina, que en su versión normal es
fosforilada, como mecanismo para bloquear la propia actividad
fosforilante de la proteína pp60c-src. Tal parece ser la
explicación por la cual esa proteína está
permanentemente funcionando e introduciendo grupos fosfato en
otras proteínas,
en el caso de las células tumorales.
3. Genes implicados en
el cáncer
Hoy se conocen tres grupos de genes de gran relevancia
en el proceso
canceroso.
Los oncogenes, cuya expresión o activación anormal
o excesiva en la célula puede conducir a la
transformación cancerosa; se originan por diversos
mecanismos a partir de genes celulares normales conocidos como
protooncogenes.
El segundo tipo corresponde a los denominados genes supresores
del cáncer u oncosupresores o antioncogenes u oncogenes
recesivos, cuya expresión normal inhibe el desarrollo del
fenotipo canceroso. La inactivación o deleción de
ambos alelos puede conducir a la célula a la
transformación neoplásica, es decir, el tumor
sólo se manifiesta cuando ambos alelos están
alterados. Un ejemplo es el descrito con el retinoblastoma. Este
tumor ha sido clásicamente considerado como el prototipo
de cáncer humano que se transmite por herencia autosómica dominante, por fallo de
oncogenes supresores o antioncogenes.
El tercer tipo de genes, denominados moduladores, determinan
propiedades como la invasividad, la metastatización o la
capacidad de generar una respuesta inmune. El fenotipo
metastásico es independiente del tumorigénico. En
este grupo se incluyen los metastogenes, que potencian o aumentan
el fenotipo metastásico, los genes supresores de
metástasis, que pueden inhibir la metastatización,
y los que modifican la inmunogenicidad de las células
tumorales.
En general los protooncogenes pueden pasar a
oncogénicos mediante la transducción retroviral
(v-oncs) o por influencias que alteren su comportamientos in sito
transformándolos en oncogenes celulares (c-oncs) dando dos
interrogantes, la primera acerca de las funciones de los
productos de
los oncogenes y la segunda como es que protooncogenes
"civilizados" se convierten en "enemigos internos"
Productos proteicos de los oncogenes
Estas proteínas se llaman oncoproteínas se
diferencia de los productos normales de los oncogenes:
- Las oncoproteínas carecen de algunos elementos
reguladores importantes. - Su producción por las células
transformadas no depende de sus factores de crecimiento u otras
señales externas.
En condiciones fisiológicas la
proliferación celular pasa por los siguientes
pasos:
- Unión de un factor de crecimiento a su
receptor específico existente en la membrana
celular. - Activación transitoria y limitada del receptor
del factor de y crecimiento que, a su vez. activa a varias
proteínas transductoras de señales existentes en
la capa interna de la membrana plasmática. - Transmisión por el citosol de la señal
transducida hasta que llega al núcleo transportada por
segundos mensajeros, - Inducción y activación de los factores
reguladores de núcleos que inician la
transcripción de! DNA, - Paso de la célula al ciclo celular, por el que
progresa hasta que se produce su división.
De acuerdo a esto es posible clasificarlos según
el papel que desempeñan
Ejemplos de oncogenes vinculados con el control | ||
Oncogen | Actividad bioquímica | Probable función |
erb-B | Tirosina cinasa | Receptor en la superficie celular |
fms | Tirosina cinasa | Receptor en la superficie celular |
neu | Tirosina cinasa | Receptor en la superficie celular (aún no |
ros | Tirosina cinasa | Receptor en la superficie celular (aún no |
sis | Factor de crecimiento FCP | Señal |
(subunidad B) | ||
src | Tirosina cinasa | ¿Transducción de |
abl | Tirosina cinasa | ¿Transducción de |
ras | ¿Proteína G? | ¿Transducción de |
fos | ¿? | ¿Efector de la división |
myc | ¿? | ¿Efector de la división |
myb | ¿? | ¿Efector de la división |
GENES SUPRESORES DE TUMORES Y TUMORES | ||
Gen supresor | Síndrome | Tumores asociados |
Rb1 | Retinoblastoma | Retinoblastoma, osteosarcoma |
p53 | Li-Fraumeni | Sarcoma, cáncer de mama, gliomas |
APC | Poliposis adenomatosa familiar | Adenoma y adenocarcinoma de colon |
WT-1 | Tumor de Wilms | Nefroblastoma |
NF-1 | Neurofibromatosis 1 | Neurofibromas, sarcomas, gliomas |
NF-2 | Neurofibromatosis 2 | Schwannomas, meningiomas |
VHL | von Hippel-Lindau | Cáncer renal, feocromocitoma, |
BRCA-1 | Cáncer mamario | Cáncer de mama |
BRCA-2 | familiar | |
TSC-2 | Esclerosis tuberosa | Angiomiolipoma, gliomas, rabdomioma |
p16 | Melanoma familiar | Melanoma, cáncer de |
4. Participación de los factores del
crecimiento y productos oncogénicos en la
proliferación celular
En esta figura se puede observar cómo el factor
de crecimiento transformante de tipo beta (FCT- ß) al
unirse a su receptor, activa la expresión del
oncogén c-sis, el cual determina la síntesis
del factor de crecimiento plaquetario (FCP). Este factor, a su
vez, se une a su receptor e induce la activación de la
fosfolipasa C, probablemente a través de una
proteína G (¿p-21 codificada por el oncogén
ras?). La fosfolipasa rompe al fosfatidil inositol difosfato
(FID) liberando al inositol trifosfato (IF3) y al diacilglicerol
(DAG), lo cual conduce a la activación de la
proteína cinasa C, a la formación de ácido
araquidónico y prostaglandinas. La prostaglandina E se une
a un receptor e induce la síntesis del adenosín
monofosfato cíclico y la activación del
oncogén rnyc, todo lo cual provoca la síntesis de
proteínas, del ADN y la división celular, junto con
la reorganización de las proteínas del
citoesqueleto (actina y vinculina), bajo la influencia del
incremento del calcio citoplásmico y de la
elevación del pH
intracelular. Por su parte, el oncogén erb-B determina la
síntesis del dominio interno
del receptor del factor de crecimiento epidérmico, el cual
es regulado por la acción fosforilante de la
proteína C inducida Por FCP.
Factores de crecimiento
Existen varios factores de crecimiento polipeptídicos que
estimulan la proliferación de las células normales
y se sospecha que muchos de ellos intervienen en el origen del
tumor. Las mutaciones de los genes que codifican los factores de
crecimiento pueden convertirlos en oncogénicos. Así
sucede con el protooncogen c-sis, que codifica la cadena β
del factor de crecimiento derivado de las plaquetas
(FDGV.platelel-derived growth factor). Este oncogen se
descubrió primero como oncogen viral contenido en v-sis.
Posteriormente se comprobó que varios tumores humanos,
sobre todo astrocitomas y osteosarcomas, producen PDGF.
Además, parece que el mismo tumor expresa también
receptores para el propio PDGF, sometiéndose a una
estimulación autocrina. Aunque se considera que el bucle
autocrino es un elemento importante en la patogenia de varias
neoplasias, en la mayoría de los casos el gen del factor
de crecimiento no esta alterado ni mutado. Por el contrario, lo
mas frecuente es que los productos de otros oncogenes, por
ejemplo ras (situado a lo largo de la vía de
transducción de señales), induzcan una
expresión excesiva de los genes de los factores de
crecimiento, forzando a las células a secretar grandes
cantidades de factores de crecimiento, tales como el factor
transformador de crecimiento α (TGF-α),
que estα relacionado con el factor de crecimiento
epidιrmico (EGF, epidermal growth factor) y que
induce la proliferación uniéndose al receptor de
aquél. En los carcinomas que expresan niveles elevados de
receptores del EGF suele detectarse TGF-α.
Ademαs de c-sis en varios tumores gastrointestinales y
mamarios hay activaciσn de un grupo de
oncogenes relacionados entre sí (hst-1 y hst-2) que
codifican proteínas homologas a los factores de
crecimiento de los fibroblastos (FGF); los melanomas humanos
expresan bFGF, un miembro de la familia de
los factores de crecimiento de los fibroblastos que sin embargo,
no es expresado por los melanocitos normales. Los carcinomas de
células pequeñas del pulmón producen
péptidos similares a la bombesina que estimulan su
proliferación.
Receptores de los factores de crecimiento
En el siguiente grupo en la cadena de la transducción de
la señal intervienen los receptores de los factores de
crecimiento; no resulta, pues varios de los oncogenes
descubiertos codifiquen algunos de estos receptores. Para
comprender la forma en que la mutación afecta a la
función de los mismos, debe recordarse que varios
receptores de los factores de crecimiento son proteínas
transmembrana con un ligando de unión situado fuera de la
célula y un dominio intracitoplasmático formado por
tirosina cinasa. En las formas normales de estos receptores, la
actividad cinasa sufre una activación transitoria cuando
el receptor capta a su factor de crecimiento específico, a
lo que sigue rápidamente la dimerización del
receptor y la fosforilación por la tirosina de varios
sustratos que forman parte de la cascada de la mitosis. Las
versiones oncogénicas de estos receptores sufren
dimerización y activación persistentes sin
necesidad de unirse al factor de crecimiento correspondiente. De
esta forma, el receptor mutante libera hacia la célula
continuas señales que estimulan la mitosis.
En los tumores humanos, la activación de los factores de
crecimiento se produce a través de varios mecanismos,
entre los que se encuentran mutaciones, reordenamientos de los
genes o su expresión excesiva. El protooncogen ret, un
receptor de tirosina cinasa, puede servir como ejemplo de la
conversión oncogénica a través de mutaciones
y reordenamientos de genes. La proteína ret es un receptor
para el factor neurotrófico derivado de la línea
celular glial, expresado normalmente por las células
neuroendocrinas, como las células C parafoliculares del
tiroides, las de la médula suprarrenal y las precursoras
de las células paraliroideas, En las MEN tipos 2A y 2B y
en los carcinomas medulares del tiroides familiares (Capitulo
26), se encuentran mutaciones puntuales de! protooncogen
reí que se transmiten de forma autosómica
dominante. En la MEN 2A, las mutaciones puntuales del dominio
extracelular provocan la dimerización y activación
constitutivas, mientras que en la MEN 2B, las mutaciones
puntuales del dominio catalítico citoplásmico
provocan la activación del receptor. En lodos estos
tumores familiares, las personas afectadas heredan la
mutación reí en la línea germinal. Por e!
contrario, los carcinomas papilares esporádicos del
tiroides se asocian a reordenamientos somáticos del gen
ret. En estos rumores, el dominio de la tirosina cinasa del gen
ret se yuxtapone a uno de cuatro genes compañeros
distintos. Los genes fusionados codifican proteínas
híbridas en las que el dominio de tirosina cinasa
está activado de forma constitutiva, lo que hace que, para
la célula, es como si el receptor ret estuviese siendo
activado continuamente por su ligando correspondiente. Las
conversiones oncogénicas por mutaciones y reordenamientos
afectan también a otros genes que codifican receptores de
factores de crecimiento. En las leucemias mieloides se han
detectado mutaciones puntuales que activan a c-fms, el gen que
codifica al receptor del factor estimulador de tas colonias 1
(CSF-1). En algunas leucemias mielomonociticas crónicas
que contienen la translocación 1(13;9) la totalidad del
dominio citoplasmico del receptor de PDGF se fusiona con un
segmento del factor de transcripción de la familia ETS, con
la consiguiente dimerización permanente del receptor de
PDGF.
Mucho más frecuente que las mutaciones de estos
protooncogenes es la expresión excesiva de formas normales
de receptores de factores de crecimiento. Los que se afectan con
mayor frecuencia son tres miembros de la familia de receptores
del EGF8. En hasta el 80 % de los carcinomas
epidermoides del pulmón y, con menos frecuencia, en los
carcinomas de la vejiga urinaria, el apáralo
gastrointestinal y los astrocitomas, se produce una
expresión excesiva de la forma normal de c-erb B1, el gen
del receptor del EGF. En algunos casos, el aumento de la
expresión del receptor provoca la amplificación del
gen. En la mayoría de los casos restantes, se desconoce la
base molecular que justifica el aumento de la expresión
del receptor. Por el contrario, el gen c-erb B2 (también
llamado c-neu), el segundo miembro de la familia de receptores
del EGF se halla amplificado en un alto porcentaje de
adenocarcinomas humanos de la mama, el ovario, el pulmón,
el estómago y las glándulas salivales. En los
cánceres de mama también se observa
sobreexpresión de un tercer miembro de la familia de
receptores del EGF, c-erb B3. Podría sospecharse que los
tumores que muestran una expresión excesiva de los
receptores de factores de crecimiento, por ejemplo de c-erb B2,
deberían ser muy sensibles a los efectos estimulantes del
crecimiento de una pequeña cantidad de los factores
implicados, lo que tos haría más agresivos. La
observación de que la existencia de
concentraciones elevadas de proteína c-erb B2 en las
células del cáncer de mama es una señal de
mal pronóstico respalda esta hipótesis.
Proteínas de transducción de
Señales
Se han encontrado varios ejemplos de oncoproteínas con
funciones similares a las de las proteínas
citoplásmicas normales que intervienen en la
transducción de señales. La mayoría de estas
proteínas se encuentran estratégicamente situadas
en la parle interna de la membrana plasmática, donde
reciben las señales procedentes del exterior de la
célula (por ejemplo mediante la activación de los
receptores de factores de crecimiento) y las transmiten al
núcleo celular. Bioquímicamente, las
proteínas de transducción de señales son
heterogéneas. El ejemplo mejor conocido y estudiado de una
oncoproteína de transducción de señales es
la familia ras de las proteínas de unión trifosfato
de guanina .(OTP)
.El descubrimiento inicial de las proteínas ras se hizo en
forma de oncogenes virales. Alrededor del 10 al 20 % de todos los
tumores humanos contienen versiones muladas de proteínas
ras9. En algunos (por ejemplo carcinomas de colon,
páncreas y tiroides), la incidencia de la mutación
ras es incluso superior. La mutación del gen ras es la
anomalía más frecuente de los oncogenes dominantes,
identificada en los tumores humanos. Varios estudios indican que
ras desempeña un papel importante en la mitogénesis
inducida por los factores de crecimiento. Por ejemplo, el bloqueo
de la función de ras mediante microinyección de
anticuerpos específicos interrumpe la respuesta
proliferativa a EGF, PUCF y CSF-1. Las proteínas ras
normales están unidas a la parte citoplásmica de !a
membrana celular, y oscilan atrás y adelante entre una
forma activada de transmisión de señales y un
estado
inactivo y quiecente. En este último estado, las
proteínas ras captan difosfato de guanosina (GDP); cuando
la célula es estimulada por los factores de crecimiento o
por otras interacciones entre ligandos y receptores, ras se
activa intercambiando GDP por GTP. La activación de ras
provoca, a su vez, la excitación de la vía MAP
cinasa mediante el reclutamiento
de la preoteína raf-1 existente en el citosol. Las MAP
cinasas activadas tienen como dianas a factores nucleares de
transcripción, por lo que estimulan la mitogénesis.
En las células normales, el estado
activado de transmisión de señales de la
proteína ras es transitorio porque su actividad
intrínseca GTPasa hidroliza GTP y la conviene en GDP, lo
que hace que ras recupere su estado quiescente.
El hecho de que el ciclo de la proteína ras sea ordenado
depende de dos reacciones: el intercambio de nucleótidos
(GDP por GTP) que activa la proteína ras, y la
hidrólisis de GTP, que convierte a la forma activa de ras
ligada a GTP en una forma inactiva ligada a GDP10.11.
Esos dos procesos
están regulados enzimáticamente. Durante la
activación de ras, la separación de GDP y sus
sustitución por GTP está catalizada por una familia
de proteínas liberadoras del nucleótido guanina,
que proceden de la parte cilosólica de los receptores de
factor de crecimiento activados por las proteínas de
adaptación, De mucha mayor importancia es que las
proteínas activadoras de la GTPasa (GAP) determinan una
espectacular aceleración de la actividad GTPasa
intrínseca de las proteínas ras normales. Estas
proteínas, de distribución muy amplia, se unen a ras
activo y aumentan su actividad GTPasa más de 1000 veces,
provocando una hidrólisis rápida de GTP a GDP, con
la consiguiente interrupción de la transmisión de
las señales, De esta forma, las GAP actúan como
«frenos» que evitan una actividad no controlada de
ras. Parece que la respuesta a esta acción de frenado de
las GAP se tambalea cuando las mutaciones afectan al gen ras. Las
proteínas ras mutantes se unen a las GAP, pero esta
unión no va acompañada de la actividad de la
GTPasa. Por tanto, las proteínas mutantes quedan
"atrapadas" en su forma excitada, unida a GTP lo que a su vez
causa una activación patológica de la v(a de
señalización de la actividad mitógena. El
hecho de que una mutación incapacitante de la
neurofibromina (NF-1) una proteína activadora de la
GPTasa, se asocie también a las neoplasias subraya la
importancia de la activación de la GPTasa en el control
del crecimiento normal.
Estudios recientes han revelado que, junto a su función en
la transducción de señales de activación
iniciadas por factores de crecimiento, ras interviene
también en la regulación del ciclo celular. Como se
describirá más adelante, el paso de las
células de la fase G0 a la fase S está
modulado por una serie de proteínas llamadas ciclinas y
cinasas dependientes de la ciclina (CDK). Según parece,
ras controla el nivel de CDK a través de mecanismos
aún desconocidos .
Para bloquear la actividad de ras alterada, los investigadores
han aprovechado el hecho de que, para recibir señales de
activación procedentes de los receptores de factores de
crecimiento, ras debe permanecer fijado a la parte interna de la
membrana celular, cerca del dominio citoplásmico de dichos
receptores. Este anclaje se efectúa mediante la
unión de un grupo lipídico isoprenilo a la
molécula de ras a través de la intervención
de la enzima farnesil transferasa. La porción farnesil es
la que establece el puente entre ras y la membrana
lipídica. Los inhibidores de la farnesil transferasa
pueden incapacitar a ras, impidiendo que se sitúe en su
ubicación normal.
Además de ras. existen otras tirosina cinasas no asociadas
a receptores que intervienen en las vías de
transducción de señales, Las formas mutantes de las
tirosinas cinasas no asociadas a receptores y que han adquirido
potencial de transformación suelen encontrarse como v-oncs
en retrovirus de animales (ejemplos: v-abl. v-src, v-fyn, v-fes y
muchos otros).
Proteínas nucleares de transcripción
Las señales de las vías de transducción
ingresan al núcleo y entran en contacto con diferentes
genes que responden a ellas. La replicación del DNA y la
división celular es regulado por una familia de genes
cuyos productos se encuentran en el núcleo, donde
controlan la transcripción de los genes relacionados con
el crecimiento. Los factores de transcripción contienen
secuencias específicas de aminoácidos o motivas que
les permiten unirse a! DNA o dimerizar sus enlaces. Entre estos
motivos se encuentran la hélice-asa-hélice,
cremallera de leucina, los dedos de cinc y los homeodominios de
cinc. Muchas de estas proteínas se unen al DNA en lugares
específicos, desde los que pueden activar o inhibir la
transcripción de genes adyacentes.
En el núcleo se ha localizado un lote completo de
oncoproteínas, entre ellas los productos de los oncogenes
myc, myh, jim y fos. De ellos, el gen myc es el que con mayor
frecuencia está implicado en los tumores humanos, lo que
justifica una breve revisión de su función. El
protooncogen c-myc se expresa en prácticamente todas las
células eucarióticas y pertenece a los genes de
respuesta de crecimiento precoz e inmediata, genes que se activan
rápidamente cuando las células en reposo reciben la
señal que promueve su división. Tras un aumento
transitorio del mRNA del c-myc, la expresión vuelve a
descender a sus valores
iniciales. Los experimentos en
tos que la inhibición específica de la
expresión de c-myc por oligonucleótidos
contrasentido evita que la célula pase a la fase S
subrayan la importancia de este gen en la proliferación
celular.
No se conocen por completo las bases moleculares de la
función de c-myr en la replicación celular, pero
sí se han dilucidado algunos principios. Tras
la traducción, la proteína c-myc pasa
rápidamente al núcleo. Bien antes o bien
después de su transporte
hasta el núcleo, la proteína forma un
heterodímero con otra proteína, llamada max. El
heterodímero myc-max se une a secuencias
específicas del DNA (llamadas zonas E)
convirtiéndose en un potente activador. Las mutaciones que
alteran la capacidad myi: para unirse al DNA o a max abolen su
actividad oncogénica. Además de formar un
heterodímero con myc, la proteína max puede formar
heterodímero sin actividad para la transcripción,
además, max, otro miembro de la superfamifia myc de
reguladores de la transcripción, también puede
unirse a max para formar un dímero. El heterodímero
mad-max actúa como represor de la transcripción.
Por tanto, lo que parece deducirse es que el grado de
activación de la transcripción por c-myc depende no
sólo de los niveles de proteína myc, sino
también de la abundancia y disponibilidad de
proteínas max y mad. En este complejo, el
heterodímero myc-max favorece la proliferación,
mientras que mad-max inhibe el crecimienlo celular.
Página siguiente  |
