Indice
1.
Practica 1
2. Práctica No.
2
3. Práctica No. 3
4. Practica No. 4
Objetivos
El alumno:
1.- Conocerá las reglas básicas de higiene y de
seguridad que se
deben observar en un laboratorio de quimica.
2.- Conocerá el material básico del laboratorio, su
manejo y las precauciones que se deben tener al utilizado.
3.- Identificará algunas de las sustancias químicas
empleadas comúnmente, sus usos y precauciones.
Introducción
El laboratorio de química es el lugar donde se comprueba
la validez de los principios
químicos. Es fundamental para ello contar con el material
adecuado y realizar análisis químicos confiables. Este
úhlmo aspecto implica, entre otras cosas, conocer las
características de los reactivos utilizados
en el experimento.
Un laboratorio de química no es un sitio peligroso si el
experimentador es prudente y sigue todas tas instrucciones con el
mayor cuidado posible.
Es importante no tratar de realizar experimentos por
si solos, sin tener la aprobación del instructor.
La mayor parte de las sustancias químicas con las que se
trabaja en el laboratorio son tóxicas, debido a ello,
nunca deberá ingerirse alguna de ellas, a menos que el
profesor aconseje hacerlo.
En ocasiones, es necesario reconocer una sustancia por su olor.
La manera adecuada de hacedo consiste en ventilar, con la mano,
hacia la nariz un poco del vapor de la sustancia y aspirar
indirectamente (nunca Inhalar directamente del recipiente).
Muchas sustancias producen vapores nocivos para la salud o son explosivas. Esta
Información se puede conocer a partir de la
etiqueta que acompaña al recipiente que contiene a la
sustancia. Es por ello fundamental leer la etiqueta antes de
utilizar el reactivo.
En caso de heridas, quemaduras con llama o salpicaduras de
sustancias caústicas, se debe acudir inmediatamente con el
profesor y, si el caso lo amerita, se debe consultar al
médico.
Se debe tener cuidado con los bordes agudos del material de
vidrio, si se
detectan algunos, se deberán redondear con la flama del
mechero o con una lima.
Se recomienda el uso de bata cuando se trabaje en el
laboratorio.
Debido a la alta peligrosidad de los reactivos, está
prohibido estrictamente introducir alimentos al
laboratorio.
Cuando la sesión experimental haya finalizado, el alumno
deberá limpiar su lugar de trabajo y se deberá
cerciorar de que las llaves del gas y del
agua queden
cerradas.
Antes de salir del laboratorio, el alumno deberá lavarse
las manos.
Desarrollo
Actividad 1.
El profesor indicará los puntos más importantes del
reglamento de higiene y
seguridad que se deben observar en el laboratorio de
química.
Actividad 2.
El profesor mostrará a los alumnos el mataríal
más común que se utiliza en el laboratorio de
química, señalando sus usos y las precauciones que
hay que tener durante su manejo.
Actividad 3.
El profesor mostrará algunos reactivos de uso común
en el laboratorio, señalando sus características,
usos y cuidados que se
deben tener al utilizados.
Cuestionario
1.- Indique el nombre del material de laboratorio que
podría emplearse para:
a) Medir volúmenes.
b) Mezclar reactivos en fase líquida o en
solución.
c) Efectuar reacciones de neutralización.
2.- Investigue las características del vidrio pyrex que
normalmente se utiliza en la fabricación del material de
vidrio en el laboratorio.
3.- Mencione algunas otras medidas de seguridad, diferentes a las
indicadas por el profesor y que, desde su punto de vista, son
también importantes en el trabajo de
laboratorio.
4.- Indique en qué tipo de recipientes se deben almacenar
soluciones:
a) Muy básicas.
b) Inestables a la luz.
S.- Elija un reactivo específico de los mencionados por el
profesor durante la sesión y anote la información
que contiene la etiqueta que acompaña al
recipiente.
Bibliografia
1.- Garzón, G.G. Fundamentos de Química general,
211 ed., MeGraw-Hili, México, 1
986.
2.- Brown, T.L., Lemay, H.E. y Bursten, B.E. Quirnica. La Ciencia
Central, Prenties & Ha¡¡, México,
1991.
3.- Ocampo, G.A. et al. Prácticas de Química 1-2.
Publicaciones Cultura¡, primera
reirnpresíón, México, 1983.
Ley de la conservación de la materia
Objetivos
El alumno comprobará experimentalmente la ley de la
conservación de la materia.
Introducción
Los primeros experimentos cuantitativos que demostraron la ley de
la conservación de la materia se atribuyen al famoso
científico francés Jaseph Antoine Laurent Lavoisier
(1743- 1794). Sus más célebres experimentos fueron
en la esfera de la combustión. En sus tiempos se explicaba la
combustión con base en la teoría
del flogisto, según la cual todas las sustancias
inflamables contenían una sustancia llamada
flogísto, la cual se desprendía durante el proceso de la
combustión. Sin embargo, cuando Lavoisier usó sus
delicadas balanzas encontró que la sustancia poseía
una masa mayor después de dicho proceso, lo cual refutaba
la teoría del flogisto.
De acuerdo con sus resultados experimentales, Lavoisier
estableció varias conclusiones. En primer lugar,
reconoció claramente la falsedad de la teoría del
flogisto sobre la combustión y declaró que
ésta es la unión del oxígeno
con la sustancia que arde. En segundo lugar, demostró
claramente su teoría de la indestructibilidad o
conservación de la materia, la cual expresa que la
sustancia puede combinarse o alterarse en las reacciones, pero no
puede desvanecerse en la nada ni crearse de la nada. Esta
teoría se convirtió en la base de las ecuaciones y
fórmulas de la química moderna.
Biografía de Lavoiser
Lavoisier nació en París el 26 de agosto de 1743.
De familia
acomodada, se dedicó simultáneamente al cultivo de
la política y
de la ciencia.
Miembro de la Ferme générale, principal organismo
de recaudación de impuestos,
accedió posteriormente al cargo de inspector general de
fabricación de pólvora.
Las primeras investigaciones
científicas de Lavoisier se centraron en la
determinación de las variaciones de peso sufridas por los
cuerpos al ser quemados. Comprobó asimismo que esta
diferencia se debía a un gas, del mismo aspecto del
aire
atmosférico, al que bautizó con el nombre de
oxígeno. En 1777 fue capaz de descomponer aire en
oxígeno y nitrógeno y volver a formarlo nuevamente
a partir de estos elementos, con lo que su aseveración se
demostró.
Como apoyo a su trabajo experimental, definió la materia
como un ente susceptible de ser pesado, concepto que
desarrolló paralelamente a un perfeccionamiento de la
balanza. Enunció asimismo la ley de conservación de
la masa en las reacciones, fundamental en la historia de la
química, e identificó la noción de elemento
como aquella sustancia que no podía descomponerse por la
acción de procesos
químicos. Realizó las primeras medidas
calorimétricas y estudió, junto a Pierre-Simon
Laplace, la respiración animal como un resultado de
fenómenos de combustión interna de los tejidos bajo la
acción del oxígeno.
En su obra Traité élémentaire de chimie
(1789; Tratado elemental de química), propuso la
utilización de una nomenclatura
química sistemática y racional y acabó con
las teorías
flogicistas de la combustión metálica (el flogisto
era un hipotético principio inflamable contenido en todas
las sustancias combustibles) que consideraban la cal, y no el
metal, como sustancia básica de la misma.
Lavoisier ocupó el cargo de diputado suplente en los
Estados Generales de 1789, tras la revolución
francesa, y, sucesivamente, fue nombrado miembro de la
comisión de pesas y medidas y secretario del tesoro. En
esta época escribió un tratado sobre economía y distribución de la riqueza.
En 1793, la Convención Nacional, gobierno de la
revolución, decretó la
detención de los recaudadores generales, entre los que se
encontraba Lavoisier. Condenado a muerte, fue
guillotinado en París el 8 de mayo de 1794.
Material Y Equipo
1 — Una balanza analítica o semianalítica.
2.- Dos matraces erlenmeyer de 250 ml.
3.- Una probeta de 100 ml.
4.- Un vaso de precipitados de 25 ml.
5.- Un mortero con pistilo.
6.- Dos globos.
Reactivos
1.- Una tableta de alka-seltzer.
Aspirina 0.325g
Bicarbonato de sodio 1.700g
Ácido Cítrico 1.000g
Pastilla (sólido).
Reacciona con el agua de
forma exotérmica y lo que se libera es CO2.
2.- Bicarbonato de sodio.
Na2CO3 Compuesto formado por carbono,
oxígeno y sodio. Polvo (sólido).
3.- Ácido clorhídrico al 4% (aprox.).
Diluido. Líquido.
4.- Agua destilada.
H2O No conduce la energía
eléctrica. Líquido.
Hipótesis
Se comprueba la ley de la conservación de la materia, las
masas permanecen constantes después de los
experimentos.
Desarrollo
Actividad 1.
El profesor verificará que los alumnos posean los
conocimientos teóricos necesarios para la
realización de la práctica.
Actividad 2.
A) coloque en un matraz erlenmeyer 20 ml de agua destilada y 20
ml de ácido clorhídrico, empleando la probeta.
b) En el mortero triture con el pistilo una tableta de
alka-seltzer. A continuación vierta el polvo en el
interior de un globo, teniendo cuidado de que no quede en las
paredes exteriores del mismo.
e) Embone la boca del globo con la del matraz erlenmeyer,
asegurándose de que no caiga alka-seltzer dentro del
matraz. Determine la masa de todo el sistema.
d) Levante el globo para que el alka-seltzer caiga dentro del
matraz y espere a que la reacción que se produce
finalice.
e) Determine nuevamente la masa de todo el sistema.
9 Determine el diámetro del globo inflado.
Actividad 3.
a) Coloque en un matraz erlenmeyer 20 ml de HCI, empleando la
probeta.
b) Coloque en el interior del globo 1,5 g aproximadamente de
NaHCO3, teniendo cuidado de que no quede en las
paredes exteriores del mismo.
e) Repita los pasos c) a f) mencionados en la actividad
2


Cuestionario
1.- Investigue cuál es la sustancia o sustancias que se
utilizan en la fabricación del alka – seltzer.
Aspirina 0.325g
Bicarbonato de sodio 1.700g
Ácido Cítrico 1.000g
2.- Con los resultados obtenidos complete la tabla
siguiente.
Actividad | Masa inicial del | Masa final del |
2 | 152.40 | 152.09 |
3 | 159.71 | 159.28 |
3.- De acuerdo con los datos de la tabla
anterior, ¿se cumple la ley de la conservación de
la materia en ambas actividades?.
R= No.
4.- Si la respuesta anterior fue negativa, analice si la fuerza de
flotación es un factor que influyó en los
experimentos. Si es así, considérela en sus
cálculos pata verificar la ley de la conservación
de la materia.
R= La fuerza de flotación sí influye.
5.- Escriba las ecuaciones químicas de las reacciones que
se llevaron a cabo en ambas actividades.
Discusión
La diferencia entre las masas iniciales y finales es causada por
el efecto de flotación que se genera cuando el gas
producido en la reacción desplaza aire atmosférico
al inflarse el globo.
Conclusión
Se comprueba la ley de la conservación de la materia. La
materia no se crea ni se destruye, solo se transforma. La masa
permanece constante pero el peso no. Se percibe la diferencia
entre masa y peso.
Bibliografia
1.- Mortimer, E.C. Quimica. Grupo
Editorial lberoamericana,1983.
2.- Greene, J.E. 100 Grandes Científicos. Diana,
México, 1981.
3.- Chang, R. Quírnica. Me Graw-Hill, México,
1994.
Rendimiento de una reacción química
Objetivos
El alumno:
1.- Comprenderá el concepto de reactivo limitante y de
reactivo en exceso en una reacción química.
2.- Determinará las cantidades estequiométriras de
los reactivos que se requieren para producir una determinada
cantidad de productos.
3.- Determinará el rendimiento porcentual de una
reacción química.
Introducción
Para interpretar una reacción de manera cuantitativa, es
necesario aplicar los conocimientos de masa molares y mol.
En una reacción química donde intervienen dos
reactivos, la sustancia que se consume completamente recibe el
nombre de reactivo limitante, porque es el que determina la
cantidad de producto que
se forma. El otro reactivo se conoce corno reactivo en
exceso.
La estequiometría es el estudio cuantitativo
de reactivos y productos en una reacción
química.
Para determinar cuál es el reactivo limitante en una
reacción química dada, es necesario conocer la
ecuación estequiométrica, así como las
cantidades teóricas que se requieren de los reactivos para
generar determinado producto.
El método
más común por el cual se establece la cantidad de
reactivo y producto es el método de mol, significa que los
coeficientes estequimétricos en una ecuación
química se pueden interpretar como el número de
moles de cada sustancia.
Por otra parte, la cantidad de producto que se forma
cuando el reactivo limitante ha reaccionado totalmente, se
denomina rendimiento teórico. El rendimiento
teórico es el máximo que se puede obtener. La
cantidad de producto que realmente se obtiene en una
reacción se llama rendimiento real. El rendimiento
teórico es mayor que el rendimiento real, ya que en este
último se pueden originar pérdidas de producto
durante el desarrollo del
experimento.
Sin embargo, es más común en una reacción
química determinar el porcentaje de rendimiento de cierto
producto, mediante la expresión siguiente:
%porcentaje de rendimiento = (rendimiento real / rendimiento
teórico) x 100%

Material Y Equipo

1.- Dos soportes universales.
2.- Una balanza semianalítica.
![]()
3.- Una probeta de 100 ml,
![]()
![]()
4.- Un anillo metálico,
5.- Una jeringa de plástico
de 5 mi con aguja.
6.- Una pinza de tres dedos.
7.- Un recipiente de plástico.

8.- Un tubo de ensayo con
tapón de hule horadado.
9.- Tubo de vidrio.
10.- Manguera de hule.
 REACTIVOS
REACTIVOS
1.- Ácido clorídrico, 1 M.
Diluido. Líquido.
2.- Cinc metálico.
- El reactivo limitante, que es el que se encuentra en
menor cantidad, en el caso de esta reacción es el
cinc. - Por lo tanto el reactivo en exceso será el
ácido clorhídrico. - Debido a imperfecciones con el material el porcentaje
del rendimiento debe ser menor. Es muy difícil conseguir
el 100%.
Actividad 1.
El profesor verificará que los alumnos posean los
conocimientos teóricos necesarios para la
realización de la práctica.
Actividad 2.
a) Coloque 0.1 g de Zn metálico en el tubo de ensayo.
b) Introduzca un tramo de tubo de vidrio al tapón de hule
horadado, de tal manera que lo atraviese (precaución:
utilice una franela para realizar tal operación), Adapte
el tapón, con el tubo de vidrio, al tubo de ensayo.
c) Llene el recipiente de plástico con agua hasta las tres
cuartas partes de su capacidad, aproximadamente.
d) Lleno la probeta con agua hasta el ras o inviértala
para sumergirla en el agua de¡ recipiente de
plástico. Utilice el anillo metálico para apoyar la
probeta.
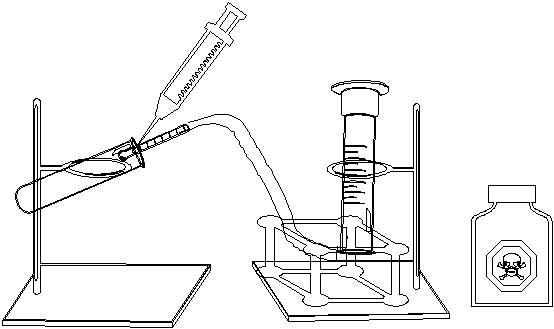
e) Inserte un tramo de manguera de hule el tubo de vidrio,
acoplado al tapón, e introduzca el otro extremo de la
manguera a la probeta invertida. El dispositivo experimental se
muestra a
continuación.
f)Coloque 5 ml de ácido clorhídrico en la jeringa
(precaución: el ácido clorhídrico genera
gases
tóxicos) y perfore con la aguja el tapón que sella
el tubo. Oprima el émbolo para añadir el
ácido al cinc metálico. Espere a que la
reacción finalice.
g) Mida y anote el volumen de gas
que se recolectó en la probeta.
Cuestionario
1 — Escriba la ecuación química que se lleva a
cabo entre el cinc metálico y el ácido
clorhídrico.
Zn+HCl ![]() ZnCl2+H2
ZnCl2+H2 ![]()
Zn+2HCl ![]() ZnCl2+H2
ZnCl2+H2 ![]()
2.- Indique mediante los cálculos necesarios
cuál es el reactivo limitante y cuál es el reactivo
en exceso.
El reactivo limitante es el Zn.
3.- Determine la masa teórica de hidrógeno que
debería obtenerse en la reacción.
R =(PV)/latinQ=(0.77105263+0.046)/(0.082*295) =
1.466243117*10-3
4.- Determine la masa real de
hidrógeno que se obtiene, Considere que el
hidrógeno se comporta como un gas ideal.
R =(PV)/latinQ=(0.77105263+0.046)/(0.082*295) =
1.466243117*10-3*1.000797*2=2.95585149*10-3
5.-
Calcule el rendimiento porcentual del
hidrógeno.
Discusión
Si coincide con la hipótesis el reactivo limitante. Y el
porcentaje de rendimiento es menor a 100%.
Conclusión
Definitivamente la cantidad de reactivo limitante depende la
cantidad de producto terminado. El rendimiento de cualquier
reacción depende así mismo de factores variables
tales como exactitud en medidas, buen estado de los
reactivos así como su concentración.
Bibliografía
1.- Br,own, T.L., Lemay, H.E, y Bursten, B,E. Química. La
Ciencia Central. Prentice-Hali, México, 1991.
2.- Russeli, J.B. y Larena, A. Quíffiíca.
MeGra@N-Hili, México, 1990.
3.- Chang, R. Química. MoGraw-Hill, México,
1994.
Valoración Ácido-Base-
Objetivos el
Alumno:
1.- Conocerá y aplicará el método
volumétrico para realizar una titulación
ácido-base.
2.- Determinará el punto de equivalencia de una
reacción ácido-base, mediante el uso de una
disolución indicadora.
3.- Justificará mediante los resultados obtenidos
la validez de la reacción química que se establece
entre un ácido fuerte y una base fuerte.
Introducción
Desde los albores de la química experimenta¡, los
científicos se dieron cuenta de que algunas sustancias,
llamadas ácidos,
tienen un sabor agrio y pueden clisolver los metales activos como el
hierro y el
cine. los
ácidos también ocasionan que ciertos tintes
vegetales como el tornasol cambien de color.
En forma semejante, las bases tienen propiedades
características, como su sabor amargo y su
sensación resbalosa al tacto. Las bases presentan, corno
los ácidos, la característica de que cambian la
coloración de ciertas sustancias vegetales.
La técnica de titulación ácido-base consiste
en emplear un ácido de concentración conocida para
valorar una base de concentración desconocida o viceversa.
Para determinar el punto final (o de equivalencia) de la
reacción se pueden utilizar indicadores
colorimétrícos o potenciómetros.
En esta práctica se utilizará una disolución
de fenolftaleína como indicador del fín de la
reacción, y se trabajará con un ácido y una
base fuertes.
Material y equipo
1.- Un soporte con varilla.
2.- Una pinza doble para burota.
3.- Una burote de vidrio de 50 ml.
4.- Un matraz erlenmeyer de 250 ml.
5.- Una parrilla de agitación.
6.- Un agitador magnético.
7.- Un embudo de filtración,
8.- Dos pipetas volumétricas: una de 20 ml., y otra de 10
ml.
9.- Una perilla de hule.
10.- Papel pH.
1 1.- Un vaso de precipitados de 100 ml.
Reactivos
1.- Agua destilada.
2.- Disolución de fenolftaleírta.
3.- Hidróxido de sodio, 0. 1 M.
4.- Ácido clorhídrico, 0.1 M.
Desarrollo actividad 1.
El profesor verificará que los alumnos posean los
conocimientos teóricos necesarios para la
realización de la práctica.
Actividad 2.
a) Verifique que la llave de la bureta esté cerrada.
Víerta en ella disolución de hidróxido de
sodío (precaución: el hidróxido de sodio es
caústica, Sí le cae en las manos, lávese con
agua en abundancia), empleando el embudo de filtración.
Cuando haya adicioado 20 6 30 ml., coloque un vaso de
precipitados limpio debajo de la punta de la bureta y abra la
llave completamente hasta que se hayan desalojado,
aproximadamente, 10 ml. de la solución de hidróxido
de sodio. Cierre la llave de la bureta. La operación
anterior es con el objeto de eliminar las burbujas de aire que
hayan quedado ocluidas en la misma, durante su llenado. A
continuación lleno la burela con más
disolución de NAOH hasta la marca de 0
ml.
b) Coloque la bureta en la pinza doble, la cual ya estará
previamente fija en la varilla del soporte.
c) Vierta 30 mi de la solución de ácido
clorhídrica (tenga precaución durante su manejo, es
tóxico e irritante), utilizando las pipetas, en un matraz
erlenmeyer. lnclíne el Matraz ligeramente y deje resbalar
la barrita de agitación por las paredes.
d) Coloque el matraz edenmeyer sobre la parrilla de
agitación, colocando entre ésta y aquél una
hoja blanca. La hoja se coloca con el objeto de observar mejor el
cambio de
color del indicador,
e) Coloque la bureta de tal manera que la punta de ésta
quede en el interior del matraz y a 1 cm abajo, apropirnadamente,
de la boca del mismo.
f) Añada de dos a tres gotas de la disolución de
fenolftaleína al ácido clorhídrico contenido
en el matraz edenmeyer.
g) Encienda la parrilla. Verifique que el botón de
calentarniento esté Inactivo, y dé vuelta al
botón de agitación hasta que la barrita
magnética gire a una velocidad
moderada.
h) Abra la llave de la bureta para adicionar la solución,
de hidróxido de sodio. Se recomienda no abrida totalmente,
ya que de esta manera se tiene un mejor control sobre el
volumen de sosa adicionado.
i) Un buen indicio de que el punto de equivalencia está
cercano, consiste en que cuando la solución de
hidróxido de sodio se pone en contacto con la del
ácido clorhídrico, la coloracíón rosa
no desaparece tan rápidamente como al principio de la
titulación. Es aconsejable en este momento disminuir la
rapidez de goteo, para que en el momento en que la
disolución del matraz adquiera un color rosa muy tenue,
pero persistente, se cierre la llave de la bureta.
j) Anote el volumen de hidróxido de sodio que se
utilizó en la valoración.
k) Introduzca un pedazo de papel pH en la disolución del
matraz erienrneyer, y anote el valor que
tiene, mediante la escala de pH.
Asimismo, tome los valores de
pH, tanto para la solución del hidróxido de sodio
como para ¡a del ácido
clorhídrico.
Cuestionario
1.- Defina el concepto de un ácido y de una base
según las teorías de-
a) Arrhenius.
b) Bconsted-Lowry.
2.- Describa brevemente cómo prepararía-
a) 250 mi de disolución de hidróxido de sodio, 0. 1
M, a partir de sosa caústica en lentejas.
b) 250 mi de disolución de ácido
clorhídrico, 0. 1M, a partir de ácido
clorhídrico comercial (37.8 % en masa, densidad = 1.19
glcm).
3.- Escriba la ecuación química de la
reacción que se establece entre el hidróxido de
sodio y el ácido clorhídrico.
4.- Con base en la ecuación química anterior y el
volumen de hidróxido de sodio que se utilizó en la
valoración, determine el volumen de ácido
clorhídrico necesario para la neutralización de la
sosa caústica.
5.- Llene la tabla siguiente.
Disolución PH experimental PH teórico
NAOH, 0. 1 M
HCI, 0. 1 M
NAOH, 0. 1M + HCI, 1
6.- Investigue qué es la fenoiftaleína, y a que se
debe que en medio ácido posea cierta coloración,
mientras que en medio básico posea otra.
Bibliografía
1.- Mortimer, E.C. Química. Grupo Edftorial
lberoarnérica, 1983.
2.- Chang, R. Química. MeGraw-Hili, México,
1994.
3.- Brown, T.L., LeMay, H.E. y Bursten, B.E. Química. La
Ciencia Central. Prentice & Ha¡¡, México,
1991.
Autor:
Iván Escalona M.
Ocupación: Estudiante
Materia: Ingeniería de
Medición
Estudios de Preparatoria: Centro Escolar Atoyac (Incorporado a la
U.N.A.M.)
Estudios Universitarios: Unidad Profesional Interdisciplinaria de
Ingeniería y Ciencias
sociales y Administrativas (UPIICSA) del Instituto
Politécnico Nacional (I.P.N.)
Ciudad de Origen: México, Distrito Federal
