Indice
1.
Introducción
2. Definición de enlace
químico.
4. Fórmulas de lewis para
moléculas e iones poliatómicos.
5. Geometría electrónica y
molecular.
6. Teoría de enlace de
valencia.
7. Estado de la
materia
8. Glosario
9. Conclusión
10. Bibliografía
Las propiedades de las sustancias están
determinadas en parte por los enlaces
químicos que mantienen unidos a los átomos.
Cuando los átomos interactúan para formar un
enlace
químico, solo entra en contacto sus regiones
más externas.
En la mayor parte de las moléculas los átomos
están enlazados por uniones covalentes. La mayoría
de los enlaces iónicos se obtienen de la
purificación de minerales que
contienen al compuesto.
Las estructuras
que se utilizan para representar los compuestos covalentes se
denominan Estructura de
Lewis, en dicha estructura solo se muestran los electrones de
valencia.
La tendendencia de los átomos en las moléculas a
tener ocho electrones en su capa de valencia se conoce como Regla
del Octeto, formulada por el mismo Lewis.
También hablaremos sobre la electronegatividad, el
concepto
relativo, en el sentido de que la electronegatividad de un
elemento solo se puede medir respecto de la de otros elementos.
Sabemos por varios experimentos que
las moléculas tienen estructuras definidas; esto es, los
átomos de una molécula tienen posiciones definidas
relativas uno con el otro en un espacio de tres dimensiones, es
de aquí donde sale el estudio experimental denominado El
Momento Dipolo.
El modelo de
repulsión de pares de electrones de la capa de valencia
basado en las estructuras de Lewis, es un método
bastante sencillo y directo para predecir las geométricas
moleculares.
La mecánica cuántica posee dos teorías: teoría
del enlace de valencia y la teoría de orbítales
moleculares, ambas emplean los métodos de
la mecánica cuántica pero hacen diferentes
suposiciones y simplificaciones.
2. Definición de enlace
químico.
Se define como la fuerza de
unión que existe entre dos átomos, cualquiera que
sea su naturaleza,
debido a la transferencia total o parcial de electrones para
adquirir ambos la configuración electrónica estable correspondiente a los
gases inerte;
es decir, el enlace es el proceso por el
cual se unen átomos iguales o diferentes para adquirir la
configuración electrónica estable de los gases
inertes y formar moléculas estables.
Enlace iónico:
El enlace iónico: fuerza electrostática que mantiene unidos a los
iones en un compuesto iónico.
Características del enlace
iónico.
- Se rompe con facilidad obteniéndose los iones
que lo forman, generalmente basta disolver la
sustancia. - Las substancias con enlaces iónicos son
solubles en solventes polares.
Formación de los compuestos iónicos.
Resulta de las interacciones electrostáticas entre iones,
que a menudo resulta de la transferencia neta de uno o más
electrones de un átomo o
grupo de
átomos a otro, es decir, es la atracción de iones
con carga opuesta (cationes y aniones) en grandes números
para formar un sólido. Ejemplo: un átomo de sodio
(Na) fácilmente puede perder un electrón para
formar el catión sodio, que se representa como
Na+, un átomo de cloro puede ganar un
electrón para formar el ion cloruro Cl -, Se
dice que el cloruro de sodio (NaCl), la sal común de mesa
es un compuesto iónico porque está formado por
cationes y aniones. El Na+ es el catión y el Cl
– es el anión.
NaCl
Enlace Covalente:
Enlace covalente: enlace en el que dos átomos comparten
dos electrones.
Características del enlace
covalente.
- Es muy fuerte y se rompe con dificultad.
- Si la diferencia de electronegatividades entre los 2
átomos es marcada, tenemos un enlace polar y se
favorecerá la solubilidad de la sustancia en solventes
polares. Ejemplo: un enlace O-H - Si la diferencia de electronegatividades es poca,
tenemos un enlace no polar y se favorecerá la
solubilidad de la sustancia en solventes no polares. Ejemplo:
un enlace C-H o C-C
Tipos de enlaces covalentes.
Los átomos pueden formar distintos enlaces covalentes: En
un enlace sencillo, dos átomos se unen por medio de un par
de electrones. En muchos compuestos se formar enlaces
múltiples, es decir, enlaces formados cuando dos
átomos comparten dos o más pares de electrones. Si
dos átomos comparten dos pares de electrones, el enlace
covalente se denomina enlace doble. Un triple enlace surge cuando
dos átomos comparten tres pares de electrones.
Formación de los enlaces covalentes. Se forma cuando dos
átomos comparten uno o más pares de electrones.
Este tipo de enlace ocurre cuando la diferencia de
electronegatividades entre los elementos (átomos) es cero
o relativamente pequeña.
El enlace covalente se representa con una línea recta que
une a los 2 átomos, por ejemplo:
O-H
Veamos un caso simple de enlace covalente, la reacción de
dos átomos de hidrógeno para formar una
molécula H2. Un átomo aislado de
hidrógeno tiene la configuración electrónica
del estado
fundamental 1s1, con la densidad de
probabilidad
para este único electrón esféricamente
distribuida en torno al
núcleo del hidrógeno (figura a).

Cuando dos átomos de hidrógeno se acercan
uno a otro, el electrón de cada átomo de
hidrógeno es atraído por el núcleo del otro
átomo de hidrógeno tanto por su propio
núcleo (figura b).

Si estos dos electrones tienen espines opuestos de forma
que pueden ocupar la misma región (orbital), ambos
electrones pueden ocupar preferencialmente la región entre
los dos núcleos. Porque son atraídos por ambos
núcleos. (figura c):

Los electrones son compartidos entre los dos
átomos de hidrógeno, y se forma un enlace covalente
simple. Decimos que los orbítales 1s se solapan,
así que ambos electrones ahora están en los
orbítales de los dos átomos de hidrógeno.
Mientras más se aproximan los átomos, más
cierto es esto. En este sentido, cada átomo de
hidrógeno ahora tiene la configuración del helio
1s2.
Otros pares de átomos no metálicos comparten pares
electrónicos para formar enlaces covalentes. El resultado
de esta compartición es que cada átomo consigue una
configuración electrónica más estable
(frecuentemente la misma que la del gas noble
más próximo).
Enlaces covalentes polares y no polares:
Los enlaces covalentes pueden ser polares y no polares. En un
enlace no polar tal como el de la molécula de
hidrógeno, H2, el par electrónico es
igualmente compartido entre los dos núcleos de
hidrógeno. Ambos átomos de hidrógeno tienen
la misma electronegatividad (tendencia de un átomo a
atraer los electrones hacia sí en un enlace
químico), es decir que los electrones compartidos
están igualmente atraídos por ambos núcleos
de hidrógeno y por tanto pasan iguales tiempos cerca de
cada núcleo. En este enlace covalente no polar, la
densidad electrónica es simétrica con respecto a un
plano perpendicular a la línea entre los dos
núcleos. Esto es cierto para todas las moléculas
diatómicas homonucleares, tales como H2,
O2, N2, F2 Y Cl2,
porque los dos átomos idénticos tienen
electronegatividades idénticas. Por lo que podemos decir:
los enlaces covalentes en todas las moléculas
diatómicas homonucleares deben ser no polares.
Un enlace covalente polar, tal como el fluoruro de
hidrógeno los pares electrónicos están
compartidos desigualmente. El enlace H-F tiene algún grado
de polaridad ya que H y F no son átomos idénticos y
por lo tanto no atraen igualmente a los electrones. La
electronegatividad del hidrógeno es 2,1 y la del fluor es
de 4,0, claramente el átomo F con su mayor
electronegatividad, atrae el par electrónico compartido
mucho más fuertemente que H. La distribución asimétrica de la
densidad electrónica está distorsionada en la
dirección del átomo más
electronegativo F. Este pequeño desplazamiento de densidad
electrónica deja a H algo positivo. El HF se considera una
molécula diatómica heteronuclear, ya que contiene dos clases de átomo.
Momentos bipolares. La polaridad de una molécula la
indicamos por su momento dipolar, que mide la separación
de cargas en la molécula. El momento dipolar,
se define como el producto de la
carga Q y la distancia r entre las cargas:
Q x r
Para mantener la neutralidad eléctrica, las cargas en
ambos extremos de una molécula diatómica
eléctricamente neutra deben ser iguales en magnitud y de
signo opuesto. Sin embargo en la ecuación Q se
refiere solo a la magnitud de la carga y no a su signo, por lo
que siempre es positiva. Los momentos dipolo
generalmente se expresan en unidades Debye (D), así
denominadas en honor de Peter Debye. El factor de
conversión es:
1 D = 3,33 x 10-30 C m
(Donde C es Coulomb y m es metro)
Un momento dipolar se mide colocando una muestra de la
sustancia entre dos placas y aplicando un voltaje. Esto produce
un pequeño desplazamiento de la densidad
electrónica de cualquier molécula, así que
el voltaje aplicado disminuye ligeramente. Sin embargo las
moléculas diatómicas que contienen enlaces polares,
tales como HF, HCl, y CO, tienden a orientarse en el campo
eléctrico. Esto hace que el voltaje medido entre las
placas disminuya más marcadamente para estas sustancias, y
así decimos que estas moléculas son polares.
Moléculas tales como F2 o N2 no se
reorientan, así que el cambio de
voltaje entre las placas es ligero; decimos que estas
moléculas son no polares. Generalmente, cuando las
diferencias de electronegatividades en las moléculas
diatómicas aumentan, los momentos dipolares medidos
aumentan.
Los momentos dipolares asociados con enlaces individuales
sólo pueden medirse en moléculas diatómicas
simples. Más que pares seleccionados de átomos, lo
que se sujeta a medición son moléculas enteras.
Los valores
medidos de momentos dipolares reflejan las polaridades globales
de las moléculas. Para las moléculas
poliatómica son el resultado de todos los dipolos de
enlace de las moléculas.
El momento dipolo de una molécula formada por tres o mas
átomos está determinado tanto por la polaridad de
sus enlaces como por su geometría.
La presencia de enlaces polares no necesariamente significa que
la molécula presente un momento dipolo. Por ejemplo el
dióxido de carbono
(CO2) es una molécula triatómica, por lo
que su geometría puede ser lineal o angular. Cuando la
molécula es lineal; no tiene momento dipolo y, cuando la
molécula es angular; tiene un momento dipolo. En este
caso, el momento dipolo de la molécula completa es la
resultante de los dos momentos de enlace, es decir, de los
momentos dipolos individuales de los enlaces C = O. el momento de
enlace es una cantidad vectorial, lo que significa que tiene
tanto magnitud como dirección. El momento dipolo medido es
igual a la suma vectorial de los momentos de enlaces.

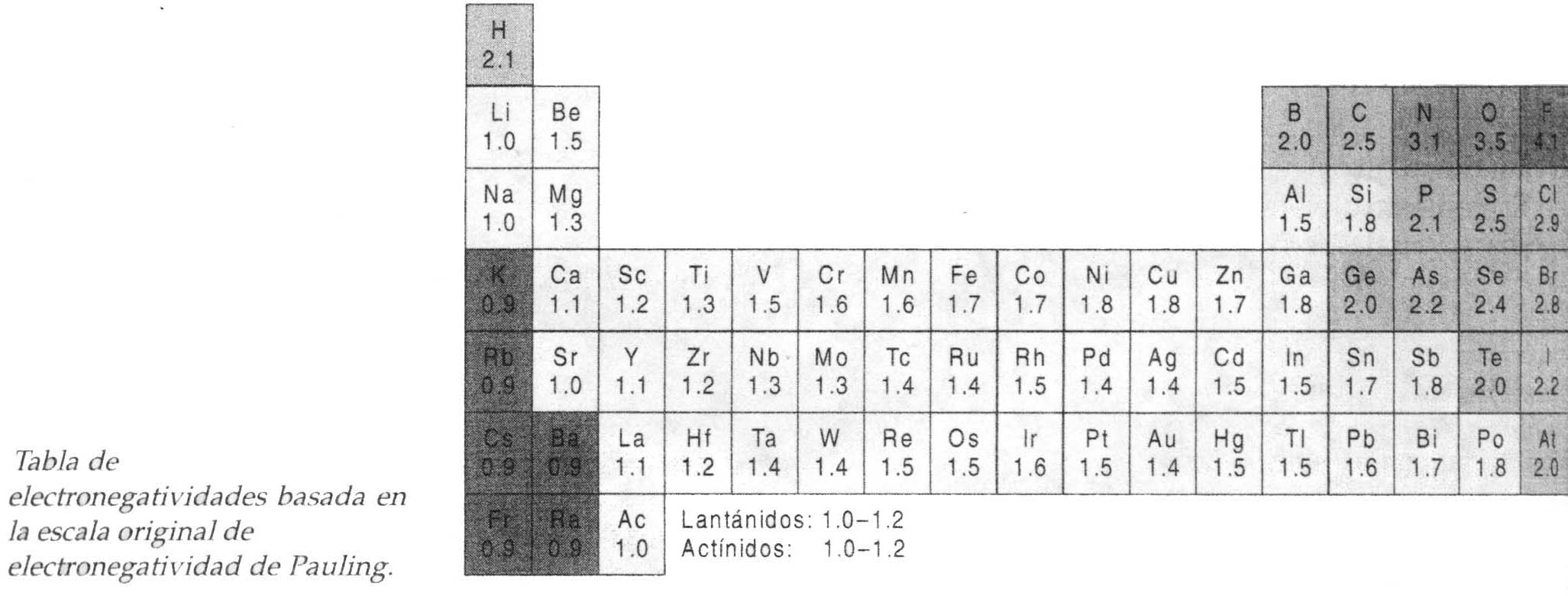
3. Predicción del tipo de enlace usando
la escala de
electronegatividad de Pauling.
La escala más usada para medir
electronegatividades se basa en una desarrollada por Linus
Pauling. El observó que cuando se combinan los
átomos de diferentes electronegatividades, sus enlaces son
más fuertes de lo esperado. Se cree que son dos los
factores que contribuyen a la fuerza del enlace. Uno de ellos es
el enlace covalente entre los átomos. El otro es la
unión adicional producida por una atracción entre
los extremos opuestamente cargados del enlace dipolo. La fuerza
extra del enlace se atribuyó entonces a la unión
adicional y Pauling utilizó este concepto para desarrollar
su tabla de electronegatividades.
Cuando se tenga algún interés en
conocer algo acerca de la polaridad de un enlace, tal vez dicho
interés se base en la diferencia de las
electronegatividades entre los dos átomos unidos por el
enlace. Si la diferencia es pequeña, el enlace será
relativamente no polar, pero si es grande, el enlace será
polar. Si la diferencia en la electronegatividad es muy grande,
el par de electrones se concentrará casi en forma
exclusiva alrededor del átomo más electronegativo y
el enlace será iónico. Se ve por consiguiente, que
el grado del carácter
iónico del enlace, según sea medido por la cantidad
por la carga soportada de los átomos en cada extremo
podrá variar desde cero hasta un 100%, dependiendo de las
electronegatividades de los átomos unidos.
Por ultimo, vale la pena tomar nota de las tendencias de
electronegatividad dentro de la tabla
periódica. Se observará que los elementos
más electronegativos se encuentran en la parte superior
derecha de la tabla; los menos electronegativos se encuentran en
la parte inferior izquierda. Esto consiste con las tendencias de
la energía de ionización (El) y de la afinidad
electrónica (AE). Es también consistente con las
observaciones realizadas en donde los átomos procedentes
de los extremos opuestos de la tabla —litio y flúor,
por ejemplo— forman enlaces que son esencialmente
iónicos y que átomos como el carbono y el oxígeno
forman enlaces covalentes que sólo son poco
polares.
4. Fórmulas de Lewis para
moléculas e iones poliatómicos.
Las formulas de Lewis las usamos para mostrar los
electrones de valencia en dos moléculas simples. Una
molécula de agua puede
representarse por uno de los siguientes diagramas.

Una molécula de H2O tiene dos pares
electrónicos compartidos, es decir, dos enlaces covalentes
simples. El átomo O tiene dos pares no compartidos:
En las formulas de guiones, un par de electrones compartidos se
indican por un guión. En el dióxido de carbono
(CO2) hay dos dobles enlaces, y su formula de Lewis
es:
![]()
Una molécula de dióxido de carbono
(CO2) tiene cuatro pares electrónicos
compartidos, es decir, dos dobles enlaces. El átomo
central (C) no tienes pares sin compartir.
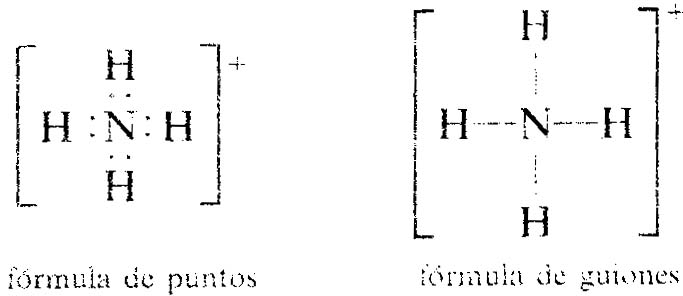
Los enlaces covalentes en un ion poliatómico pueden
representarse de la misma forma. La formula Lewis para el ion
amonio, NH4, muestra solo ocho electrones, aunque el
átomo N tiene cinco electrones en su capa de valencia y
cada átomo H tiene uno, con un total de cinco más
cuatro (1) igual nueve electrones. El ion
NH4+, con una carga de 1+,
tienen un electrón menos que los átomo
originales.
Describir formulas de Lewis es un método de
contar los electrones que es útil para la primera
aproximación para sugerir esquemas de enlaces. Es
importante saber que las formulas de puntos de Lewis solo
muestran el número de electrones de valencia, el
número y las clases de enlaces y el orden en que
están conectados los átomos. No intentan mostrar
las formas tridimensionales de las moléculas e iones
poliatómicos.
Regla del Octeto. Limitaciones de
la regla del octeto para la formula de Lewis.
Regla de octeto. Se basa en que un átomo diferente del
hidrógeno tienden a formar enlaces hasta que se rodea de
ocho electrones de valencia, es decir, un enlace covalente se
forma cuando no hay suficientes electrones para que cada
átomo individual tenga el octeto completo. Al compartir
electrones en un enlace covalente, los átomos individuales
pueden completar sus octetos.
La regla del octeto funciona principalmente para los elementos
del segundo periodo de la tabla periódica. Estos elementos
solo tienen subniveles 2s 2p, los cuales pueden contener un total
de ocho electrones. Cuando un átomo de uno de estos
elementos forman un compuesto covalente, pueden obtener la
configuración electrónica de gas noble [Ne] al
compartir electrones con otros átomos del mismo
compuesto.
Limitaciones del las reglas de octeto para las formulas
de Lewis.
Las formulas de Lewis normalmente no se escriben para compuestos
que contienen metales de
transición d y f. los metales de transición d y f
utilizan en el enlace orbítales s y p.
1.- La mayoría de los compuestos covalentes del berilio,
Be. Debido a que Be contiene solo dos electrones en la capa de
valencia, habitualmente forma solo dos enlaces covalentes cuando
se enlaza con otros dos átomos. Por lo tanto se usa cuatro
electrones como el número necesario para Be en la etapa 2,
en la etapa 5 y 6 se usa solo dos pares de electrones para
Be.
2.- La mayoría de los compuestos covalentes de los
elementos del Grupo IIIA, especialmente boro, B. Estos elementos
contienen solo tres electrones en la capa de valencia, así
que a menudo forman tres enlaces covalentes cuando se enlazan a
otros tres átomos. Por lo tanto, se usa seis electrones
como el número necesario para los elementos IIIA contiene
solo tres electrones en la etapa 2; y en las etapas 5 y 6 se usa
solo tres pares de electrones para los elementos IIIA.
3.- Los compuestos o iones que contienen un número impar
de electrones ejemplos son NO, con 11 electrones en la capa de
valencia, y NO2, con 17 electrones en la capa de
valencia.
4.- Compuestos o iones en los que el elemento central necesita
más de ocho electrones en la capa de valencia para
mantener todos los electrones disponibles, D. cuando uno se
encuentra con esto, se añaden las reglas extra a las
etapas 4 y 6.
Etapa 4a: si C, el numero de electrones compartidos, es menor que
el número necesario para enlazar todos los átomos
al átomo central, entonces C se aumenta el número
de electrones necesario.
Etapa 6a: si C debe aumentarse en la etapa 4a, entonces los
octetos de todos los átomos podrían satisfacerse
antes de que todos los electrones D hayan sido añadidos.
Colocar los electrones extra sobre el elemento central.
Muchas veces que violan las reglas del octeto son muy reactivas
por ejemplo, los compuestos que contienen átomos con solo
cuatro electrones de valencia (limitación 1 de arriba) o
seis electrones de valencia (limitación 2 de arriba)
frecuentemente reaccionan con otras especies que suministran
pares electrónicos. Compuestos como estos que aceptan un
par de electrones para compartir se denominan ácido de
Lewis: una base le Lewis es una especie que puede disponer de un
par de electrones para compartir. Las moléculas con un
número impar de electrones a menudo se dimerizan (combinan
en pares) para dar productos que
sí satisfacen la regla de octeto, ejemplos son la
dimerización del NO para formar N2O2
y del NO2 para formar
N2O4.
5.
Geometría electrónica y
molecular.
Geometría molecular.
Es la distribución tridimensional de los átomos de
una molécula. La geometría de una molécula
influye en sus propiedades físicas y químicas, como
el punto de fusión,
punto ebullición, la densidad y el tipo de reacción
en que puede participar.
La geometría alrededor de un átomo central dado de
una molécula, es aquella que hace mínima la
repulsión de los pares de electrones, los usados para
formar enlaces y los no usados que quedan como pares libres
alrededor de cada átomo en la molécula.
Para comprender cabalmente este principio, se debe saber que la
estructura electrónica de moléculas en base a la
configuración de octetos, necesariamente deja en libertad pares
de electrones. Obviamente, estos pares, ubicados alrededor de un
átomo que se considere central, deben situarse de manera
que la repulsión electrostática entre dos pares,
sea mínima. Así, lo primero es hacer un balance
electrónico de la molécula en base a octetos, luego
decidir cual átomo se considera central para luego
analizar que pasa con los pares de electrones alrededor de
éste. Los ejemplos de moléculas que se presentan a
continuación, cubren prácticamente todas las
posibilidades geométricas posibles de alcanzar.

BeCl2 La idea aquí es que los pares de
electrones en los enlaces y los pares solitarios de un
átomo, se posicionen lo más alejados posibles. Como
ejemplos comencemos con la molécula BeCl2 que
tiene la estructura de Lewis señalada. Nótese que
hay dos pares de electrones alrededor de Be, de modo que para que
estos se encuentren lo más alejados posibles,
formarán un ángulo de 180° entre sí,
generando así la máxima separación entre los
pares de electrones. Esto nos genera la estructura lineal para
BeCl2.
BeH2 Este caso es similar al anterior, es lineal, no
quedan e- libres, todos en los enlaces y produce una
conformación lineal
CO2 Recordar que C (1s22s2
2p2), contiene 4 e- en la capa de valencia que
corresponden los seleccionados en la figura, todos se comparten
para formar los octetos alrededor de cada átomo, no
permanecen pares de cargas libres y la molécula es
lineal.

BF3 La estructura de Lewis para esta
molécula, es la que se presenta a la izquierda.
Aquí el B no presenta pares solitarios sin ocupar y solo
está rodeado por tres pares de electrones que forman
enlaces. Es una molécula deficiente en electrones.
La agrupación de los F a su alrededor a 120° hace
mínima la repulsión, por lo que la geometría
molecular es la que se muestra, plana formando 120°, un
triángulo equilátero.
NH3 Se predice la estructura del NH3 mediante pasos a seguir
durante el procedimiento
referidos a la figura de la izquierda
PASO 1 Escribir la estructura de Lewis (octeto). Obsérvese
que nada se ha establecido aún sobre la verdadera
geometría.
PASO 2 Contar los pares electrónicos y reagruparlos para
minimizar la repulsión. Esta molécula presenta 4
pares de electrones y lo mejor que se puede lograr es una
redistribución tetraédrica.

PASO 3 Se Ubica los átomos H en sus posiciones,
los tres compartiendo pares de electrones como se muestra a
continuación
PASO 4 Se Nombra la estructura de la molécula,
basándose en la posición de los átomos.
Colocando los pares electrónicos determina la estructura y
que la geometría se basa en los átomos. Es
incorrecto afirmar que NH3 es tetraédrico.
Realmente, posee una agrupación tetraédrica de sus
pares electrónicos, pero su geometría, es una
pirámide trigonal.
Hasta el momento hemos tomado casos en que 2, 3 y 4 pares de
electrones se ubican alrededor de un átomo del centro. Sin
embargo, esto puede ocurrir con 5 y 6 pares de electrones
también de modo que conviene mostrar la forma que todos se
agrupan alrededor de un átomo, con el fin de lograr la
mínima repulsión entre ellos. La Tabla a
continuación muestra todos estos casos.


Este esquema lo ocuparemos ahora para deducir la
geometría de algunas moléculas típicas.
XeF4 Debido a que los gases nobles presentan una
estructura de capas de valencia s p completamente ocupadas,
siempre se pensó que eran químicamente inactivos.
Así, por muchos años se le consideró gases
inertes hasta que en 1960 varios compuestos de Kr, de Xe y de Rn
fueron sintetizados. Un ejemplo es el compuesto XeF4
cuya estructura de Lewis se muestra a la derecha.
Nótese que el átomo Xe se encuentra rodeado por
seis pares de electrones, en total 12 electrones que exige que la
forma adquirida por estos sea octaédrica, como se ve en la
figura que acompaña.

La estructura geométrica dependerá de
cómo se estos pares solitarios y los enlaces se ubiquen.
Las posibilidades son como las que se señala para los
casos a , b a la derecha y, obviamente, debemos decidir
cuál de estas dos formas geométricas es la
correcta.
En el caso a, estos pares solitarios se encuentran a 90°
entre sí en cambio, en b están separados por
180° y esta es la geometría más correcta para
evitar la repulsión de los pares de electrones
solitarios.
La geometría experimental coincide con este análisis, muestra los 4 F ocupando el plano
ecuatorial. Así, XeF4 es cuadrado plano con el
Xe en el centro molecular
Estructuras geométricas de H2O,
NH3, CH4.
Vamos a comparar ahora lo que se logra con las moléculas
señaladas, puesto que todas poseen un átomo central
con 4 pares electrónicos de los cuales, el metano los
ocupa totalmente y las otras en forma parcial. Lo que se logra
es

y se ve claramente que la existencia de pares
electrónicos libres disminuyen el ángulo de la
estructura pseudo-tetraédrica en estas
moléculas.
Enlaces múltiples en VSEPR
Hasta el momento nuestro tratamiento considera sólo
moléculas con enlaces simples. Para saber como manejar la
situación en moléculas con enlaces dobles, triples
etc, tomemos la estructura del ion
NO3- para el que se requiere
escribir tres estructuras resonantes


Además, el ion NO3- se sabe
que es planar con ángulos de enlace de 120° y esta
estructura planar es la que se espera para tres pares de
electrones solitarios alrededor del átomo central. Esto
significa que un doble enlace debe contarse como un par solitario
efectivo en la descripción de la geometría
molecular. En realidad, esta bien que sea así porque
disponer " dos pares solitarios " en un enlace doble, " los
obliga a no ser independientes"
En VSEPR, enlaces múltiples cuentan como un par solitario
efectivo
Moléculas que no contienen un átomo
central.
Para ilustrar estos casos, usemos la molécula METANOL, la
estructura de Lewis se muestra a la derecha y donde se observa
que no hay un átomo central, definido sino que el C y el O
forman parte del centro molecular.
La geometría se puede predecir investigando previamente
como se ordenan los pares solitarios alrededor de cada uno de los
átomos participantes, que no son de los extremos, esto es,
C y O
Nótese que hay 4 pares solitarios de electrones alrededor
del carbono, que lo obligan a adoptar una forma
tetraédrico. Alrededor de éste, se ubican 3
átomos H y el átomo O que proviene del grupo
OH.
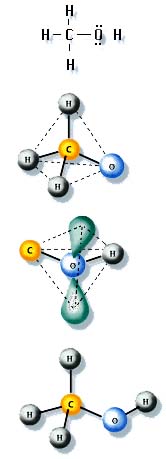
Ahora bien, recordemos que el átomo O en el
H2O dispone de 2 pares solitarios sin compartir, que
hacen que adopten una geometría angular. En la
molécula metanol, una posición del agua está
ocupada por el átomo C del CH3 pero preservando
la forma angular, como lo muestra la figura a la derecha.
La geometría final se logra conocer juntando ambas formas
desarrolladas para cada fragmento y se observa claramente que el
H del grupo OH no es lineal respecto a la línea de
unión C-O sino que forma un ángulo muy parecido al
que corresponde al agua. La última la figura a la
izquierda nos entrega la forma final que debe adoptar el Metanol,
con un entorno tetraédrico alrededor del átomo C y
una forma angular alrededor del átomo O.

I-3 : ion azida. La estructura
electrónica de Lewis para este ion es la que aparece en la
figura a la izquierda. Allí podemos observar que, si bien
no existen enlaces múltiples, el átomo central
acomoda en total 10 e 's ocupando orbitales atómicos d
superiores. en todo caso, como átomo central maneja 5
pares de electrones de los cuales, 2 forman los enlaces y los
otros tres deben agruparse de modo que la repulsión
electrónica sea mínima.
La estructura a describe el caso en que dos de los pares
solitarios salen perpendicular al plano formado por los
átomos y formando un ángulo de 90° con el
tercer par solitario (en el plano de los tres átomos de
Iodo).
La estructura b produce otra agrupación de los pares
solitarios, que también forman 90° entre sí y
finalmente, la figura c ubica los tres pares solitarios formando
120° entre sí logrando la mínima
repulsión.
La geometría c es la que corresponde al resultado
experimental y la molécula I-3 es
lineal.
Geometría electrónica: Se refiere a la
ordenación geométrica de los electrones de valencia
alrededor del átomo central.
Geometría molecular: Se refiere a la ordenación de
los átomos o núcleos en el espacio, no de los pares
de electrones.
6.
Teoría de enlace de valencia.
La teoría de enlace de valencia es una
teoría aproximada para explicar el enlace por par de
electrones o covalente con la mecánica
cuántica.
Teoría básica.
De acuerdo con la teoría sobre enlace valencia, se forma
un enlace entre dos átomos cuando se satisfacen las
condiciones siguientes:
- Un orbital de en un átomo viene a ocupar una
porción de la misma región del espacio que ocupa
un orbital del otro átomo. Se dice que los dos
orbítales se traslapan. Esto se explica ya que a medida
que el orbital de un átomo se traslapa con el otro, los
electrones en orbítales comienzan a moverse alrededor de
ambos átomos. Debido a que los electrones a ambos
núcleos a la vez, jalan juntos a los átomos. La
fuerza del enlace depende de la cantidad de traslape; mientras
mayor sea la sobreposición mayor será la fuerza
de la unión. - El número total de electrones en ambos
orbítales no es mayor a dos. Lo dos orbítales no
pueden contener más de dos electrones, porque en una
región dada del espacio solo pueden estar dos electrones
(esto ocurre siempre y cuando si los espines de los electrones
son opuestos).
A medida que el orbital de un átomo se traslapa
con el orbital de otro, los electrones en los orbítales
empiezan a moverse alrededor de ambos átomos. Debido a que
los electrones son atraídos a ambos núcleos a la
vez, jalan juntos a los átomos. La fuerza del enlace
depende de la cantidad de traslape; mientras mayor sea la
sobreposición mayor será la fuerza de la
unión. Los dos orbítales no pueden contener mas de
dos electrones, porque en una región dada del espacio solo
pueden estar dos electrones (y eso solamente si los espines de
los electrones son opuestos).
Importancia del enlace
químico.
El enlace es la unión entre los átomos de un
compuesto. La unión o enlace entre los átomos tiene
su origen en la estructura electrónica de los mismos. La
actividad química de los
elementos radica en su tendencia a adquirir, mediante su
unión con otros átomos, la configuración de
gas noble (ocho electrones en la capa más externa, salvo
el helio que sólo tiene dos), que es muy estable. Es
corriente distinguir tres tipos principales de enlaces
químicos: iónico, covalente y metálico.
Aunque dichos enlaces tienen propiedades bien definidas, la
clasificación no es rigurosa, existiendo una
transición gradual de uno a otro, lo que permite
considerar tipos de enlace intermedios. Gracias a estos enlaces
se forman los compuestos químicos, por ejemplo la sal.
La sal común es una sustancia bien conocida. Es utilizada
para conservar y aderezar alimentos.
Nuestra sangre posee casi
la misma proporción de sal que el agua del
mar, y es fundamental para mantener muchas de nuestras funciones
vitales. Está formada por un no metal, el cloro y un metal
alcalino, el sodio. Ambos en estado puro son extremadamente
peligrosos para el hombre, sin
embargo, forman juntas una sustancia, la sal común, que es
inocua en pequeñas cantidades. Se dice por tanto que han
formado un compuesto químico, una sustancia muy diferente
de los elementos que la componen.
Muchas de las sustancias que conocemos están formadas por
uniones de distintos elementos. El azúcar,
por ejemplo, está formado por oxígeno,
hidrógeno y carbono. Estos átomos que pierden o
ganan electrones para unirse se transforman en iones,
átomos con carga eléctrica. Estos iones se unen
para formar compuestos químicos, y la forma de unirse
entre ellos se realiza mediante enlaces
químicos.
Todas las sustancias pueden existir, al menos en
principio, en los tres estados: sólido, líquido y
gaseoso. Como muestra la siguiente figura:
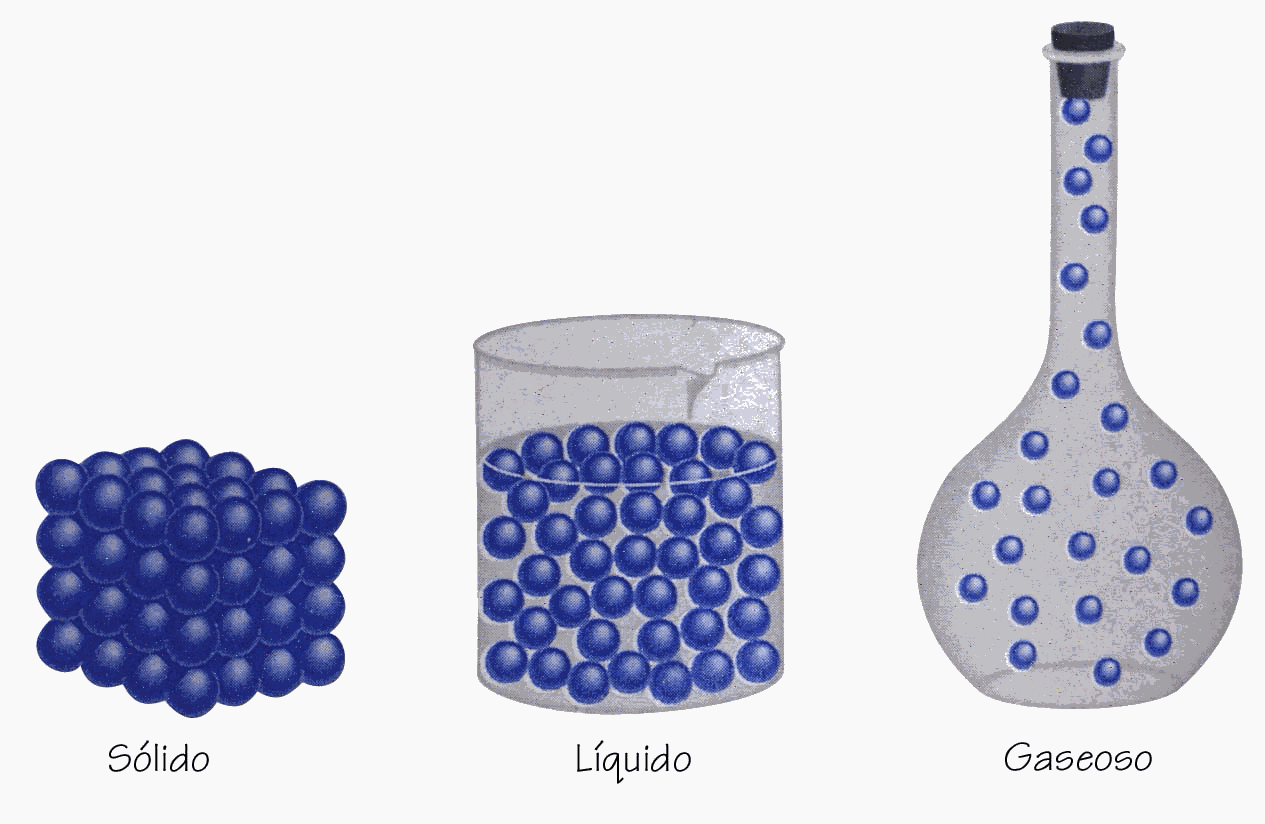
En un sólido, las moléculas se mantienen
unidas en forma organizada con poca libertad de movimiento. En
un líquido las moléculas están unida, pero
no en una posición tan rígida y se puede mover
libremente. En un gas, las moléculas están
separadas por distancias que son grandes en comparación
con el tamaño de las moléculas.
Los tres estados de la materia pueden
ser convertibles entre ellos sin que cambie la composición
de la sustancia. Un sólido (por ejemplo el hielo) se
fundirá por calentamiento y formará un
líquido (agua). (La temperatura a
la cual se da esta transición de denomina punto de
fusión). El calentamiento anterior convertirá el
líquido en un gas. (Esta conversión se lleva a cabo
en el punto de ebullición del líquido.) por otro
lado el enfriamiento de un gas lo condensará para formar
un líquido. Cuando el líquido se enfría aun
más se congelará y se formará un
sólido.
El plasma es considerado como el cuarto estado de la materia,
pues su presencia en el universo es
muy abundante. Se trata de una masa gaseosa fuertemente ionizada
en la cual, como consecuencia de temperaturas extremadamente
elevadas, los átomos se han visto despojados de su
envoltura de electrones y coexisten con los núcleos
atómicos en un estado de agitación intensa. Las
estrellas, durante una parte importante de su vida, están
constituidas por grandes masas de plasma. Debido a la violencia de
los choques entre núcleos, en tales condiciones se
producen reacciones de síntesis
de núcleos nuevos con una considerable liberación
de energía. El Sol es
esencialmente una enorme esfera de plasma.
- Capa de valencia. Capa electrónica externa de
un átomo que contiene los electrones que participan en
el enlace. - Electrones de valencia. Electrones externos de un
átomo, los cuales son los implicados en el enlace
químico. - Catión. Ion cargado positivamente que se forma
por la remoción de electrones de átomos ó
moléculas. - Anión: Ion cargado negativamente que se forma
por la adición de electrones a átomos o
moléculas. - Enlace sigma, . Enlace covalente formado por
orbítales que se traslapan por los extremos: su densidad
electrónica está concentrada entre los
núcleos de los átomos que se unen. - Enlace pi, enlace covalente
formado por el traslape lateral de los orbítales; su
densidad electrónica se concentra arriba y abajo del
plano de los núcleos de los átomos que
están unidos. - Carga formal. La carga sobre un átomo en una
molécula o ion enlazado covalentemente; los electrones
enlazantes se cuentan como si estuvieran igualmente compartidos
entre los dos átomos enlazados. - Resonancia. Concepto según el cual son
necesarias dos o más formulas de Lewis equivalentes para
la misma disposición de átomos (estructura de
resonancia) para describir el enlace en una molécula o
ion. - Geometría iónica. Es la
disposición de los átomos (no de pares
electrónicos, no compartidos) sobre el átomo
ce3ntral de un ion poliatómico. - Hibridación: termino que se utiliza para
explicar las mezclas de
los orbítales atómicos en un átomo
(generalmente el átomo central) para generar un conjunto
de orbítales híbridos. - Orbítales Híbridos: son
orbítales atómicos que se que se obtienen cuando
dos o más orbítales no equivalentes, del mismo
átomo, se combinan preparándose para la
formación del enlace covalente. - Orbítales moleculares. Orbítales
producto de las interacciones de los orbítales
atómicos de los átomos que se unen. - Solapamientos de Orbítales. Interacción
de orbítales de átomos diferentes en la misma
región del espacio. - Plana Trigonal. Ocurre si hay tres pares de
electrones en la capa de valencia de un átomo, el cual
tienden a estar acomodados en un plano, dirigidos hacia los
vértices de un triángulo de lados iguales
(triángulo equilátero), las regiones del espacio
ocupadas por pares electrónicos están dirigidas a
ángulos de 120º uno al otro. - Plana Cuadrada. Termino usado para describir las
moléculas e iones poliatómicas que poseen un
átomo en el centro y cuatro átomos en las
esquinas de un cuadrado. - Plasma. Mezcla de iones y electrones, como en una
descarga eléctrica. En ocasiones el plasma se ha
considerado el cuarto estado de la materia. - Hielo cuántico. El hielo cuántico es un
estado en el que la materia está tan próxima al
cero absoluto (0 ºK) que el movimiento atómico
disminuye: Todos los núcleos se colapsan en un
"superátomo" alrededor del cual giran todos los
electrones. Se ha considerado el quinto estado de la
materia.
9. Conclusión
Un enlace iónico es una fuerza de
atracción enérgica que mantienen unidos los iones.
Dicho enlace se puede formar entre dos átomos por la
transferencia de electrones de la capa de valencia del otro. Los
cationes monoatómicos de los elementos tienen cargas
iguales al número de grupos.
Un enlace covalente es una energía fuerza de
atracción que mantiene unidos a dos átomos por la
comparición de sus electrones enlazantes son
atraídos simultáneamente hacia ambos núcleos
atómicos y pasan una parte del tiempo cerca de
un átomo y otra parte del tiempo cerca del otro. Sin un
par de electrones no es compartido igualmente, el enlace es
polar. Esta polaridad es el resultado de la diferencia que hay en
las electronegatividades de los átomos para atraer hacia
ellos los electrones enlazantes.
La regla del octeto predice que los átomos forman
suficientes enlaces covalentes para rodearse de ocho electrones
cada uno. Existen excepciones para la regla del octeto, en
particular para los compuestos covalentes de berilio, para los
elementos del grupo 3A y para los elementos del tercer periodo y
subsecuentes de la tabla periódica.
Linus Pauling desarrolló un método para determinar
las electronegatividades relativas de la mayoría de los
elementos. Esta propiedad
(electronegatividad) permite distinguir el enlace covalente polar
del enlace covalente no polar.
Las formulas de Lewis son representaciones sencillas de los
electrones de la capa de valencia de los átomos en las
moléculas y los iones. se pueden aplicar reglas sencillas
para dibujar estas formulas. Aunque los átomos de la
formula de Lewis satisfacen con frecuencia la regla del octeto,
no son poco comunes las excepciones a esta regla. Se pueden
obtener las formulas de Lewis al seguir las reglas para la
escritura, el
concepto de Carga formal con frecuencia ayudara a decidir cual de
las varias formulas de Lewis da la mejor descripción de
una molécula o ion.
La Geometría molecular se refiere a la ordenación
de los átomos o núcleos en el espacio, no de los
pares de electrones y la Geometría electrónica se
refiere a la ordenación geométrica de los
electrones de valencia alrededor del átomo central.
La teoría de enlace de valencia, es una de las
aplicaciones de la mecánica cuántica en el cual se
forman orbítales híbridos mediante la
combinación y reacomodo de los orbítales de un
mismo átomo. Todos los orbítales híbridos
tienen la misma energía y densidad electrónica y el
número de orbítales híbridos es igual al
número de orbítales atómicos puros que se
combinan.
La materia presenta tres estados líquido, que son
líquido, sólido y gaseoso (aunque se habla de un
cuarto y quinto elemento; plasma y hielo cuántico
respectivamente).
BROWN, T. L., H.E. Y BURSTEN, B.E. (1993) .
Química la ciencia
central. México:
Prentice-Hail. Hispanoamericana. Quinta Edición.
Chang, Raymond. (1998). Química. México:
McGraw-Hill. Sexta Edición.
Ebbing, Darrell D. (1996). Química General. México.
McGraw-Hill. Quinta edición
Whitten, K. W., Davis R.E. y Peck, M. L. (1998). Química
General. España:
McGraw-Hill. Quinta edición
Petrucci, R. H. (1977). Química general. México:
Fondo Educativo Interamericano
Páginas Wed:
www.monografías.com
www.encarta.msn.com
www.lafacu.com
Autor:
Laya Crispina

