Cetoacidosis
diabética
- Factores
precipitantes - Diagnóstico
- Diagnóstico
diferencial - Criterios de ingreso en
UCI - Tratamiento
- Tratamiento de las
alteraciones electrolíticas - Tratamiento
adjunto - Complicaciones
- Bibliografía
La cetoacidosis diabética (CAD) representa una de
las más serias complicaciones metabólicas agudas de
la diabetes mellitus
causada por un déficit relativo o absoluto de insulina, y
un incremento concomitante de las hormonas
contrainsulares. Se caracteriza por un marcado disturbio
catabólico en el metabolismo de
los carbohidratos,
las proteínas
y los lípidos,
presentándose clásicamente con la tríada:
hiperglicemia, cetosis y acidosis.
Esta emergencia hiperglicémica constituye una
causa importante de morbilidad y mortalidad entre los pacientes
diabéticos a pesar de los avances significativos en
el
conocimiento de su fisiopatología y a los acuerdos
más uniformes sobre su diagnóstico y tratamiento.
Ocurre con una frecuencia de 4 a 8 casos por cada 1 000
diabéticos por año; del 20% al 30% de los episodios
se producen en los que debutan con la enfermedad. Se presenta con
mayor frecuencia en los diabéticos tipo I y en los
adultos, típicamente entre los más jóvenes
(28 a 38 años), sin que exista predilección por
algún sexo.
Desde su descripción original en 1886 por Dreschfeld
hasta el descubrimiento de la insulina en 1922, la tasa de
mortalidad por esta complicación era cercana al 100%,
constituyendo en aquel momento la primera causa de muerte entre
los diabéticos. En 1932 la tasa disminuyó a 29% y
actualmente se estima la mortalidad entre 2% y 14%;
ensombreciéndose el pronóstico en pacientes con
edades extremas y con la presencia de signos como el coma y la
hipotensión.
En gestantes la tasa de mortalidad fetal es tan alta
como 30%, la que asciende hasta 60% en pacientes con CAD en
coma.
Debido a que un episodio de CAD requiere habitualmente
la hospitalización, con frecuencia en una unidad de
cuidados intensivos (UCI), se encarecen significativamente los
costos por esta
causa, llegándose a estimar en más de un
billón de dólares por año en los EE
UU.
En los últimos años el perfil del paciente
cetoacidótico se ha modificado, no solo por su menor
frecuencia, sino porque su gravedad es menos extrema. Estos
cambios traducen un indiscutible progreso en el nivel educativo
de los pacientes y en la calidad
médica de la asistencia primaria.
Los factores precipitantes más comunes por orden
de frecuencia son: (1) la infección (30% a 39%), (2) la
omisión o la
administración de una dosis inadecuada de insulina
(21% a 49%) y (3) la diabetes de debut
(20% a 30%). Otros factores incluyen: el infarto agudo de
miocardio, la enfermedad cerebrovascular, la pancreatitis aguda,
las drogas (el
alcohol, los
esteroides, las tiacidas, los simpaticomiméticos y
los b
-bloqueadores), el trauma, la cirugía y el embarazo. En
2% al 10% de los casos no es posible identificar el evento
precipitante.
Las infecciones más frecuentes son la
neumonía y la infección urinaria, que se presentan
en 30% a 50% de los casos.
Las causas de omisión de las dosis de insulina
son los factores sicológicos, que incluyen el miedo a la
ganancia de peso con la mejoría del control
metabólico, el miedo a la hipoglucemia, la rebelión
a la autoridad y el
estrés de
las enfermedades
crónicas, así como un pobre cumplimiento del
tratamiento.
De manera general, los desórdenes
metabólicos de la CAD resultan de una reducción de
la concentración circulante efectiva de insulina, asociada
con una elevación concomitante de las hormonas
contrainsulares del estrés
(glucagón, catecolamina, cortisol y hormona del
crecimiento). El déficit insulínico puede ser
absoluto, o relativo a un exceso de hormonas contra-reguladoras.
También contribuye al estado
hiperglicémico una disminución en la actividad de
la insulina y una resistencia
parcial a ella al disminuir la utilización
periférica de la glucosa.
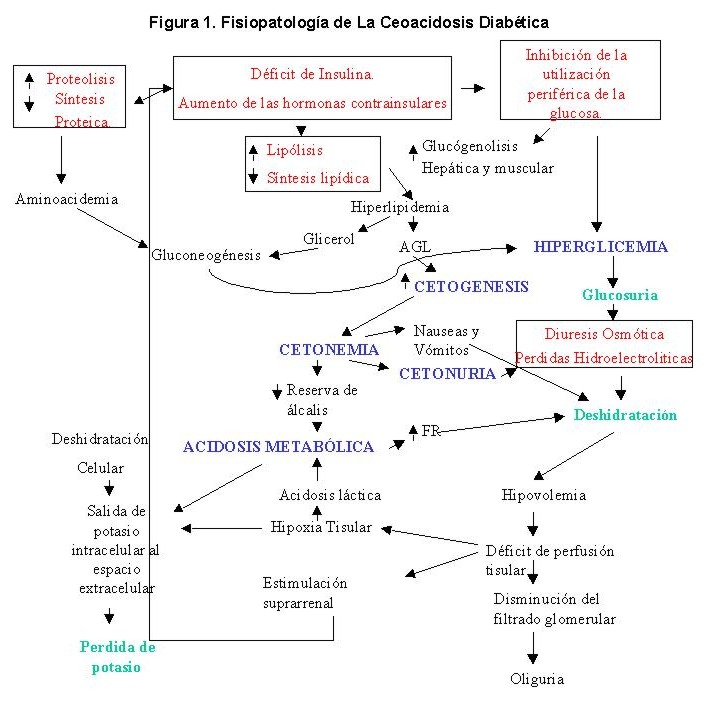
La producción de cuerpos cetónicos en
la CAD es el resultado de la combinación del
déficit de insulina con el aumento de las hormonas
contrarreguladoras.
La insulina inhibe la lipasa que cataboliza a los
triglicéridos y estimula la proteinlipasa, lo que favorece
el almacenamiento de
los triglicérido (TG) transportados en las
lipoproteínas de muy baja densidad;
además, inhibe la producción de prostanglandinas (PG)
I2 y E2 en el tejido adiposo, que provocan
vasodilatación y promueven la liberación de
ácidos
grasos libres (AGL), a la circulación
sistémica.
A la vez las catecolaminas, especialmente la epinefrina,
estimulan la lipasa del tejido adiposo, lo que trae como
consecuencia que los TG se metabolicen a glicerol y AGL. El
glicerol es utilizado en el hígado y el
riñón como sustrato para la gluconeogénesis,
mientras que los AGL sirven de precursores a los
cetoácidos.
En el hígado los AGL son oxidados a cuerpos
cetónicos en un proceso
estimulado principalmente por el glucagón, pues los altos
niveles de este último inhiben la acetil CoA carboxilasa
que bloquea la conversión de piruvato a acetil CoA, que a
su vez produce disminución en los niveles de malonil CoA.
Esta última inhibe la carnitin-palmitoil-transferasa-1
(CPT-1), necesaria para el transporte de
los AGL al interior de las mitocondrias donde son oxidados hasta
cetoácidos; o sea, que el incremento de la actividad de la
CPT-1 por disminución de los niveles de malonil CoA es
responsable de la cetogénesis.
- Metabolismo proteico
La ausencia de insulina, sola o en combinación
con un aumento de las hormonas contrarreguladoras, incrementa la
proteolisis, lo que produce aminoácidos que sirven de
substrato para la gluconeogénesis.
- Metabolismo hidroelectrolítico y
acidobásico
Como consecuencia de la hiperglicemia se produce
glucosuria al superarse el umbral renal de reabsorción de
la glucosa (aproximadamente de 240 mg/dL), lo que determina la
aparición de diuresis osmótica y pérdida de
agua y
electrólitos que puede llegar a la hipovolemia y esta, a
su vez, disminución del filtrado glomerular con lo que se
exacerba aun más la hiperglicemia y la cetonemia al
disminuir su eliminación. Por otro lado la
deshidratación refuerza los mecanismos patogénicos
cetoacidóticos al incrementar la liberación de
hormonas contrainsulares.
Producto de la diuresis osmótica se produce un
déficit de líquidos de aproximadamente 100 mL/kg de
peso corporal, asociado a un déficit de 7 a 10 mmol de
Na+, de 5 a 7 mmol de Cl- y de 5 a 10 mmol
de K+ por cada kilogramo de peso.
El déficit de insulina per se puede contribuir
también a las pérdidas renales de agua y
electrólitos, ya que ella estimula la reabsorción
de sal y agua en el túbulo proximal y de los fosfatos en
el túbulo distal. Otros mecanismos que conducen a las
pérdidas hídricas y de electrólitos son la
hiperventilación y los vómitos.
La hiperglicemia aumenta la tonicidad plasmática
ocasionando deshidratación celular, por salida del agua de
las células al
espacio intravascular, acompañada de potasio y fosfatos,
lo que acentúa la acidosis y el catabolismo proteico
intracelular; además, la entrada de potasio a la célula
se ve entorpecida por la insulinopenia. Esto explica el hecho de
que a pesar de las pérdidas urinarias de potasio y de su
déficit corporal, muchos pacientes presentan en la
evaluación inicial el potasio sérico
normal o alto.
Los cetoácidos (acetona, ácido
acetoacético y ácido b -hidroxibutírico), son ácidos
fuertes que se encuentran completamente disociados al pH
fisiológico, lo que ocasiona con su aumento la
aparición de una acidosis metabólica con brecha
aniónica incrementada. La cetonuria produce
pérdidas electrolíticas adicionales.
La acetona, producto de la
descarboxilación espontánea del ácido
acético, se acumula en sangre y se
elimina lentamente por la respiración y aunque no es responsable del
descenso del pH, sí
lo es del olor característico (a manzanas) del aire espirado (la
acetona es un anestésico para el SNC, pero la causa del
coma en la CAD se desconoce).
La Figura 1 resume la fisiopatología de la
CAD.
|
- Interrogatorio y examen
físico
Aunque los síntomas de una diabetes mellitus
pobremente controlada pueden estar presentes desde varios
días antes, las alteraciones metabólicas
típicas de la CAD usualmente se desarrollan
rápidamente (generalmente en menos de 24
horas).
El cuadro clínico incluye una historia de poliuria,
polidipsia, pérdida de peso, nauseas, vómitos y
disminución del apetito. Esta anorexia
relativa reviste importancia ya que es la primera
manifestación del paso de la hiperglicemia simple a la
cetosis. En el adulto ocasionalmente aparece dolor abdominal (es
más común en los niños),
que puede simular un abdomen agudo quirúrgico; la causa de
este dolor no esta del todo elucidada y se atribuye a
deshidratación del tejido muscular, dilatación
gástrica y a un íleo paralítico (secundario
a los trastornos electrolíticos y a la acidosis
metabólica). Otra teoría
lo relaciona con alteraciones de las PG.
El diagnóstico del abdomen agudo
metabólico solo se puede admitir cuando no exista otra
causa razonable de dolor abdominal, el pH es bajo y los
síntomas mejoran con la corrección de la acidosis;
pues si no ocurre mejoría del dolor, deben descartarse
otras posibilidades diagnósticas como la trombosis
mesentérica y la pancreatitis aguda (secundaria a una
hipertrigliceridemia grave que puede acompañar a la
CAD).
Las alteraciones del estado de
conciencia,
principalmente el letargo y la somnolencia, son frecuentemente de
aparición más tardía y pueden progresar al
coma en el paciente no tratado. Un número pequeño
de casos se presenta en coma. Otros síntomas incluyen:
debilidad general, astenia y cansancio fácil.
La exploración física muestra signos de
deshidratación (pérdida de la turgencia de la
piel, mucosas
secas, taquicardia e hipotensión) que pueden llegar al
shock hipovolémico. Se puede ver un patrón
respiratorio característico (respiración de Kussmaul) con respiraciones
profundas, regulares y lentas y percibirse un olor típico,
a manzanas podridas, en el aire espirado. La
respiración de Kussmaul aparece cuando el pH es inferior a
7,20–7,10, por tanto constituye el signo clínico que
aparece cuando el paciente ha pasado de un estado de cetosis a
uno de cetoacidosis. Cuando el pH es muy bajo (£ 6,9) puede desaparecer por
afectación del centro bulbar, lo que constituye un signo
de mal pronóstico.
Aunque la infección es un factor desencadenante
común para la CAD, los pacientes pueden estar
normotérmicos e incluso hipotérmicos debido a la
presencia de una vasodilatación periférica
importante secundaria a los altos niveles circulantes de PG. La
presencia de hipotermia es un signo de mal
pronóstico.
- Exámenes complementarios
Cuando se sospecha una CAD los exámenes
complementarios deben incluir: hemogasometria arterial, glicemia,
cetonemia y cetonuria, ionograma (con cálculo de
brecha aniónica y de sodio corregido), creatinina y
osmolaridad (total y efectiva).
Adicionalmente deben realizarse hemograma completo con
diferencial, parcial de orina, urocultivo, Rx de tórax,
ECG y test de embarazo
cuando estén indicados para identificar el factor
precipitante.
Los criterios diagnósticos más ampliamente
utilizados para la CAD son:
- Glicemia > 250 mg/dL (13,9 mmol/dL)
- pH arterial < 7,30
- Bicarbonato sérico < 15 mmol/L
- Grado moderado de cetonemia y cetonuria
Sin embargo, está justificado un
diagnóstico presuntivo a la cabecera del lecho del
paciente ante un individuo deshidratado, con respiración
profunda y rápida que presenta glucosuria, cetonuria y
cetonemia.
La glicemia suele encontrarse en un rango entre 300 y
800 mg/dL (16,7 a 44,4 mmol/L), y los valores
superiores a los 1 000 mg/dL (55,5 mmol/L) son excepcionales.
Puede ser normal o estar mínimamente elevada en el 15% de
los pacientes con CAD (< 300 mg/dL o 16,7 mmol/L)
principalmente en los sujetos alcohólicos o en los que
reciben insulina.
La valoración de la cetonuria y cetonemia se
realiza usualmente mediante la reacción con nitroprusiato,
la cual provee una estimación semicuantitativa de los
niveles de ácido acetoacético y acetona, aunque
pudiera subestimarse la severidad de la CAD al no reconocerse la
presencia del ácido b -hidroxibutírico (principal
cetoácido en la CAD). Si es posible la medición directa de este ácido,
disponible en muchos hospitales, es preferible para establecer el
diagnóstico de CAD (niveles > 3 mmol/L).
La proporción plasmática normal entre el
ácido b
hidroxibutírico y el acetoacético es de 3:1
alcanzando a veces una proporción de 8:1 en la
CAD.
La acumulación de cetoácidos produce
usualmente una acidosis metabólica con incremento de la
brecha aniónica. Esta última tiene un valor normal
de 12 ± 4 mmol/L, pero si el laboratorio
utiliza electrodos específicos para determinar
Na+ y Cl-, entonces se considera normal el
rango de 7 a 9 mmol/L. (el Cuadro 1 muestra las
formulas usadas en los cálculos de
laboratorios).
En el momento del ingreso las concentraciones
séricas de sodio normalmente están disminuidas
debido al flujo osmótico de agua del espacio intracelular
al extracelular producido por la hiperglicemia, por lo que para
valorar la severidad del déficit de sodio y agua se debe
calcular la corrección para el sodio (Cuadro
1).
Las concentraciones séricas de potasio usualmente
están elevadas debido al movimiento del
potasio intracelular al espacio extracelular causado por la
acidemia, la hipertonicidad y la deficiencia de insulina. Debe
monitorizarse estrechamente porque con el tratamiento su valor cae
rápidamente (niveles iniciales < 4,5 mmol/L indican una
intensa depleción y la necesidad de tratamiento
rápido y una estrecha monitorización cardiovascular
ya que el tratamiento puede disminuirlo aun más y causar
arritmias cardíacas).
Es necesario recordar que en la CAD puede apreciarse una
hiperlipidemia severa que puede falsear los resultados de la
glicemia y la natremia (apareciendo una seudo hipo- o
normoglicemia y una seudohiponatremia) y hacer que el plasma se
vea lechoso.
El pH y la concentración de bicarbonato en plasma
están usualmente disminuidos y no son excepcionales cifras
de bicarbonato < 3 mmol/L y pH < 6,8. La intensidad de la
acidosis guarda relación con el tiempo
transcurrido entre los primeros síntomas y el momento de
la asistencia; por lo que cuando el tiempo
transcurrido es corto, el pH puede estar moderadamente descendido
aunque el descenso del bicarbonato sea importante (CAD
parcialmente compensada), pero si este periodo es prolongado, se
consume todo el bicarbonato disponible lo que disminuye
notablemente el pH (CAD descompensada).
Cuadro 1. Fórmulas |
Brecha aniónica = Na+ – Valor normal: 12 ± 4 mmol/L Sodio corregido: Añadir al Na+ medido 1,6 Osmolaridad sérica:
2 [Na+ sérico medido (mmol/L)] ó 2 [Na+ sérico medido (mmol/L)] Valor Normal: 290 ± 5 mOsm/L
2 [Na+ sérico medido (mmol/L)] Valor normal: 285 ± 5 mOsm/L |
En algunos casos el diagnóstico de CAD puede
confundirse por la coexistencia de otros desórdenes
acidobásicos. El pH puede ser normal o incluso elevado
dependiendo del grado de compensación respiratoria o de la
presencia de una alcalosis metabólica causada por
vómitos frecuentes o por el uso de
diuréticos.
En raras ocasiones, y con una constelación
parecida a la CAD, los diabéticos insulinodependientes
pueden presentar una situación clínica aguda
caracterizada por vómitos importantes,
deshidratación moderada o ligera, hiperglicemia ligera y
alcalosis metabólica con cetonuria marcada. Este estado se
denomina cetoalcalosis diabética y no es aceptado por
muchos como una entidad aislada, sino como una cetoacidosis
diabética asociada a una alcalosis metabólica
debida a los vómitos, la ingesta de álcalis o de
ambos.
Es de señalar que el bicarbonato desciende
habitualmente en igual grado en que aumenta la brecha
aniónica. Algunos sujetos pueden presentar una "acidosis
metabólica hiperclorémica sin una brecha
aniónica significativamente alta, lo que puede presentarse
durante la fase de recuperación.
Los pacientes con CAD que están en coma tienen
una osmolaridad plasmática alrededor de 330 mOsm/L, y si
esta es menor, debe buscarse otra causa del trastorno de la
conciencia.
La mayoría de los pacientes se presentan con
leucocitosis por lo que este dato es rara vez de utilidad en la
investigación etiológica del
proceso.
La creatinina medida por un método
colorimétrico, puede estar falsamente elevada como
resultado de la interferencia del ácido
acetoacético.
Es característica la elevación de la
amilasa sérica, aunque es raro que la CAD se asocie con
pancreatitis. Se debe medir la lipasa sérica para el
diagnóstico diferencial, aunque esta también puede
estar elevada.
No todos los pacientes con cetoacidosis tienen una CAD.
La cetosis de ayuno y la alcohólica (CAA) se pueden
diferenciar por el interrogatorio y el examen físico
asociados a los niveles de glicemia, que varían de una
hiperglicemia ligera (rara vez > 250 mg/dL – 13,9
mmol/L) a la hipoglucemia. La CAA puede causar una acidosis
intensa, sin embargo, los niveles de bicarbonato en la cetosis de
ayuno rara vez están por debajo de 18 mmol/L.
La CAD debe distinguirse de otras causas de acidosis
metabólica con incremento del hiato aniónico, lo
que incluye la insuficiencia renal crónica, la acidosis
láctica y la ingestión de drogas como
los salicilatos, el metanol, el etilenglicol y el
paraldehido.
La mayoría de los pacientes admitidos con el
diagnóstico de CAD tienen una acidosis metabólica
ligera, con niveles elevados de glicemia y cuerpos
cetónicos, muchos están alertas y pueden manejarse
en el departamento de emergencias y pasar, de ser necesario, a
una sala general. Por otro lado los pacientes con una CAD severa
típicamente presentan un nivel de bicarbonato inferior a
10 mmol/L y / o un pH , 7,0, con una osmolaridad sérica
total mayor de 330 mOsm/kg y, usualmente, alteraciones de
conciencia y deben ser tratados en una
UCI.
Se sugiere clasificar a los pacientes con CAD
según su severidad (Tabla 1), lo que facilita su manejo
terapéutico.
Tabla 1. | |||||
| Ligera | Moderada | Severa | CHO | Estado mixto |
Glicemia | >250 mg/dL (13,9 mmol/L) | >250 mg/dL (13,9 mmol/L) | >250 mg/dL (13,9 mmol/L) | >600 mg/dL (33,3 mmol/L) | >600 mg/dL (33,3 mmol/L) |
pH arterial | 7,25 – 7,30 | 7,0 – 7,24 | < 7,0 | > 7,3 | < 7,3 |
Bicarbonato | 15 – 18 | 10 – 15 | < 10 | > 15 | < 15 |
Brecha aniónica | > 10 | > 12 | > 12 | < 12 | >10 |
Estado de conciencia | Alerta | Alerta / somnoliento | Estupor / Coma | Estupor / Coma | Estupor / Coma |
Cetonemia / cetonuria | ++ | ++ | ++ | + | ++ |
Osmolaridad efectiva | Variable | Variable | Variable | > 320 | > 320 |
Se ingresan en la UCI aquellos pacientes con CAD severa
y aquellos que estén bajo las circunstancias
siguientes:
- Inestabilidad hemodinámica
- Necesidad de proteger la vía
aérea - Obnubilación / Coma
- Imposibilidad de administrar una infusión de
insulina en sala abierta - Necesidad de monitorización frecuente (cada 1
– 2 horas)
Las metas terapéuticas para el tratamiento de la
CAD consisten en: 1) mejorar el volumen
circulante y la perfusión hística, 2) disminuir la
hiperglicemia, la hipercetonemia y la osmolaridad
plasmática, 3) corregir los trastornos
electrolíticos e 4) identificar y tratar el evento
precipitante.
Los tres elementos terapéuticos principales son:
1) la fluidoterapia, 2) el tratamiento insulínico y 3) la
reposición electrolítica.
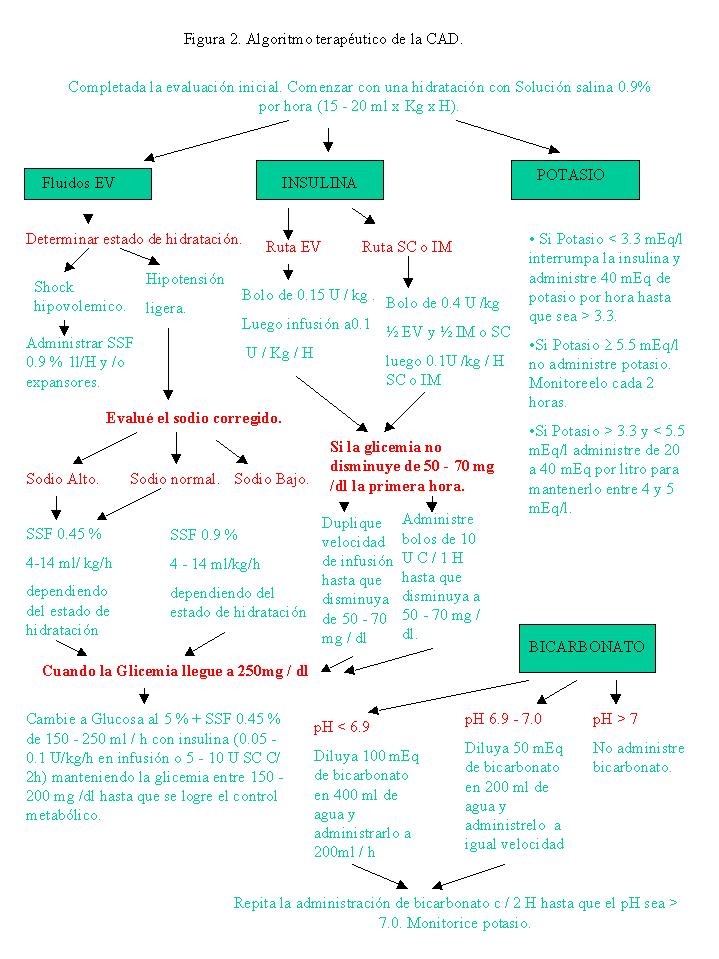
- Fluidoterapia
Debido a que un paciente con una CAD esta
invariablemente deshidratado con un déficit importante de
sodio y cloro y que la hipovolemia puede contribuir a la
producción de acidosis láctica, así como a
una disminución en el aclaramiento plasmático de
ácidos orgánicos e inorgánicos y de la
glucosa (contribuyendo a la hiperglicemia y a la hipercetonemia)
y si es significativa y causa hipoperfusión
periférica produce resistencia a la
acción de la insulina (al estimular la liberación
de hormonas contrainsulares), la reposición del
déficit hidroelectrolítico es de primera prioridad.
Este déficit está determinado por la
duración de la hiperglicemia, el nivel de función
renal y la ingestión por el paciente de solutos y agua.
Puede estimarse mediante las reglas reflejadas en la tabla 2, a
menos que el paciente sufra una neuropatía con
afectación de los reflejos cardiovasculares:
Tabla 2 | ||
Manifestación | Déficit en el volumen extracelular | Volumen para la |
Incremento del pulso con el ortostatismo sin | ± 10% | ± 2 L |
Hipotensión ortostática (Disminución TA > 15/10 | 15% a 20% | ± 3 a 4 L |
Hipotensión supina | > 20% | > 4 L |
El estado de hidratación también puede
estimarse calculando el sodio corregido y la osmolaridad
sérica total y efectiva pues una concentración del
sodio corregido > 140 mmol/L y una osmolaridad sérica
total calculada > 340 mOsm/L están asociadas con una
gran pérdida de agua.
El déficit en litros de agua corporal total (ACT)
puede calcularse mediante las formulas:
ACT = 0,6 x peso (kg) x [1 – (140 /
Sodio sérico corregido)]
ACT = 0,6 x peso (kg) x [(Sodio
sérico corregido / 140) – 1]
La meta inicial en el tratamiento de
rehidratación es la repleción del volumen del
espacio extracelular para restaurar el volumen intravascular, lo
que mejora la perfusión, disminuye los niveles de hormonas
contrainsulares y la hiperglicemia, y aumenta la sensibilidad a
la insulina.
La solución inicial de elección es la
solución salina isotónica al 0,9%, aun en pacientes
con marcada hipertonicidad, y particularmente en aquellos con
evidencias de déficit marcado de sodio; pues esta
solución es hipotónica con respecto al
líquido extracelular del paciente y permanece limitada a
este compartimiento.
La velocidad
inicial de infusión será de 15 a 20 ml/kg de peso
durante la primera hora (aproximadamente 1 a 2 litros en el
adulto) en ausencia de compromiso cardiovascular,
disminuyéndose la velocidad
entre 4 a 14 ml/kg de peso ((250 a 1 000 ml / hora) en
dependencia del estado de hidratación, hemodinámico
y del ritmo diurético. Si la hipotensión es severa,
con evidencias clínicas de hipoperfusión, y no
responde a los cristaloides; debe considerarse el uso de coloides
y de realizar una monitorización hemodinámica
invasora. Cuando se estabiliza la TA y el ritmo diurético
es adecuado, se cambia a solución salina al 0,45% con
igual velocidad de infusión (esta conducta
también se sigue si aparece hipernatremia). Esta
solución tiene una composición similar a los
líquidos perdidos con la diuresis osmótica, lo que
permite una reposición gradual del déficit tanto
del compartimiento líquido extracelular como del
intracelular. La cantidad promedio de líquido a
administrar durante las primeras 6 a 8 horas es de 5
litros.
La dextrosa debe añadirse a los líquidos
administrados cuando la glicemia descienda de 250 mg/dL (13,9
mmol/L), lo que permite continuar la administración de insulina hasta que se
controle la cetogénesis y evita una corrección
rápida de la hiperglicemia; que puede estar asociada al
desarrollo de
edema cerebral.
Se sugiere que los cambios en la osmolaridad
sérica no excedan los 3 mOsm/kg de agua/hora.
En pacientes con compromiso renal o cardiovascular, la
monitorización de la osmolaridad sérica y la
valoración frecuente del estado cardiovascular, renal y de
la conciencia, debe realizarse durante la reposición
hídrica para evitar una sobrecarga de volumen
iatrogénica, que puede ser causante de edema pulmonar y
acidosis metabólica hiperclorémica.
Un elemento importante a monitorizar durante el
tratamiento hídrico son las pérdidas urinarias, ya
que a medida que disminuyen las concentraciones de glucosa y de
cetoácidos disminuye la diuresis osmótica, lo que
permite reducir la velocidad de las infusiones endovenosas, lo
que a su vez reduce el riesgo de retener
un exceso de agua libre que puede contribuir al desarrollo de
edema cerebral, particularmente en los niños.
La duración de la reposición de los
fluidos endovenosos es de aproximadamente 48 horas, en
dependencia de la respuesta clínica
- Tratamiento insulínico
La hiperglicemia, la cetosis y la acidosis que se
producen durante la CAD mejoran con el tratamiento
insulínico al inhibirse la gluconeogénesis, la
síntesis hepática de
cetoácidos y la lipólisis en el tejido adiposo. Su
inicio está contraindicado en el paciente con
hipotensión e hiperglicemia severa hasta que la TA se
estabilice con la
administración de líquidos, con lo que se evita
precipitar el colapso vascular debido al movimiento de
líquido del espacio extracelular al intracelular por
caída rápida de los niveles de glicemia como
resultado de la administración de insulina. De igual manera
debe evitarse en el paciente hipopotasémico (< 3,3
mmol/L) hasta que se inicie la reposición de potasio, para
evitar un agravamiento de la hipopotasemia secundaria al
movimiento del potasio al espacio intracelular por la
acción de la insulina. En general, se recomienda iniciar
la administración de insulina una hora después de
comenzar la fluidoterapia, momento en el que ya tenemos el
resultado del ionograma (permite descartar la hipopotasemia) y se
ha infundido un litro de solución salina
isotónica.
A menos que el paciente tenga una CAD ligera, la
infusión endovenosa continua de insulina regular
constituye el tratamiento de elección (diluyendo la
insulina en solución salina al 0,9% en una
proporción aproximada de 1 U/ml). Se sugiere dar un bolo
endovenoso inicial de 0,15 U/kg de peso (aunque algunos lo
consideran opcional debido a lo breve de la vida media de la
insulina por esta vía) y continuar con una infusión
de 0,1 U/kg/por hora (5 a 7 U/hora) con lo que se logran niveles
séricos de insulina cercanos a lo fisiológicos
(100 m U/ml).
Esta dosis usualmente produce una disminución gradual de
los niveles de glicemia a un ritmo de 50 a 75 mg/dL (2,8 a 4,2
mmol/L) por hora; pero si esta disminución no se produce,
debe evaluarse el estado de
hidratación y si éste es aceptable, se
duplicará la velocidad de la infusión cada hora
hasta que se alcance ese ritmo de descenso. La glicemia no debe
disminuir a una velocidad mayor de 100 mg/dL (5,6 mmol/L) por
hora, ya que su corrección rápida incrementa los
riesgos de que se
produzca edema cerebral. Cuando la glicemia alcanza el valor de
250 mg/dL (13,9 mmol/L) debe disminuirse la velocidad de la
infusión a 0,05 a 0,1 U/kg por hora (3 a 6 U/hora) y se
añadirá dextrosa a los líquidos de
hidratación ajustándose la velocidad de
infusión y la concentración de la glucosa para
mantener los niveles de glicemia sobre este valor, hasta que la
cetoacidosis se resuelva.
Usualmente la cetonemia demora más tiempo en
resolverse que la hiperglicemia, pues se estima que para que el
bicarbonato y el pH alcancen los niveles control (15
mmol/L y 7,3), generalmente se requiere el doble del tiempo que
para que la glicemia alcance los 200 mg/dL (11,1 mmol/L). Durante
el tratamiento el ácido b -hidroxibutírico disminuye
transformándose en ácido acetoacético, lo
cual puede hacer creer al médico que la cetonemia empeora
cuando se monitoriza con los métodos
convencionales (recordar que estos métodos no
determinan el ácido b -hidroxibutírico); y es por eso que los
niveles de cetonemia y cetonuria no se deben utilizar para
evaluar la efectividad de la respuesta terapéutica y solo
para el diagnóstico y para comprobar su total
resolución.
El paciente con alteración de la conciencia y
osmolaridad elevada requiere aproximadamente el mismo
número de horas para normalizar el sensorio que el
requerido para normalizar el bicarbonato y el pH. En este caso se
pretende mantener la glicemia alrededor de 300 mg/dL (16,7
mmol/L) hasta que el paciente esté alerta y
orientado.
En un paciente con una CAD ligera se puede administrar
la insulina regular por vía SC o IM cada una hora ya que
tienen igual tasa de absorción, aunque es menos dolorosa
la primera; y resultan tan efectivas como la vía EV en la
reducción de la glicemia y la cetonemia. En estos caso se
debe administrar una dosis inicial de 0,4 a 0,6 U/kg de peso
fraccionándola en dos y administrando ½ de la dosis
por vía EV para lograr un efecto inmediato, y el resto por
vía SC o IM; continuando con una dosis de 0,1 U/kg/hora SC
o IM.
El tratamiento insulínico no debe descontinuarse
hasta que la acidosis y la cetonemia mejoren significativamente y
la brecha aniónica se normalice o esté cercana a lo
normal. La continuación del tratamiento por
aproximadamente 7 horas después de alcanzar la
normoglicemia permite usualmente la resolución completa de
la cetoacidosis.
Una vez controlado el episodio de CAD y el paciente sea
capaz de alimentarse por vía oral se pasará a un
régimen insulínico de multidosis basado en el
tratamiento previo, o si es un diabético de debut la dosis
total de insulina se calculará a 0,6 a 0,7 U/kg por
día modificándose según la glicemia (Tabla
3).
Debido a lo breve de la vida media de la insulina cuando
se administra por vía EV (7 a 8 minutos) y a que el inicio
de su acción cuando se administra por vía SC es de
30 a 45 minutos (si es regular) y de 2 a 3 horas (si es de
acción intermedia), es importante que se mantenga la
infusión hasta que se estime que estén actuando
para evitar una rápida caída de la
concentración sérica de insulina que ocasione una
recaída de la CAD (la infusión no debe suspenderse
hasta, por lo menos, una hora después del cambio en la
vía de administración). Lo mismo ocurre tras
cualquier omisión del tratamiento durante las primeras 24
horas.
Tabla 3. Dosis de insulina a | ||
Glucosa (mg/dL) | Glucosa (mmol/L) | Insulina (unidades) |
< 150 | < 8,3 | Ninguna |
150 a 200 | 8,3 a 11,1 | 5 |
201 a 250 | 11,1 a 13,8 | 10 |
251 a 300 | 13,8 a 16,6 | 15 |
> 300 | > 16,6 | 20 |
Tratamiento de las alteraciones
electrolíticas
- Potasio
El potasio es el electrólito que más se
pierde durante la CAD con un déficit total en un rango de
300 a 1 000 mmol/L que se sigue acentuando durante el tratamiento
hasta que se logra controlar la diuresis osmótica. A pesar
de esta depleción no es raro que el paciente se presente
con una hiperpotasemia de ligera a moderada; pero sus
concentraciones séricas disminuyen a consecuencia del
tratamiento insulínico, la corrección de la
acidosis y la expansión de volumen. Es por ello que
el desarrollo de una hipopotasemia severa constituye el trastorno
electrolítico más grave que ocurre durante el
tratamiento. Para prevenirlo se deben reponer las pérdidas
teniendo como meta alcanzar una concentración
sérica entre 4 y 5 mmol/L. La cantidad de potasio a
administrar dependerá de sus niveles séricos (Tabla
4). Se recomienda administrar un tercio de la dosis en forma de
fosfato para evitar un exceso de cloruros y prevenir una
hipofosfatemia severa. En la mayoría de los casos el
comienzo de la reposición puede retardarse 2 horas,
utilizando como guía las determinaciones séricas
horarias. En los pacientes con un potasio sérico < 4,5
mmol/L la reposición debe iniciarse tan pronto como la
diuresis sea suficiente. La cantidad total que se repone en las
primeras 24 horas es, por lo común, de unos 200 a 300
mmol/L recomendándose mantener un aporte oral
suplementario, por lo menos durante una semana para corregir el
total de las pérdidas.
Tabla 4. Cantidad de potasio | |
Nivel inicial de | Dosis de |
> 5 mmol/L | Ninguna |
4 a 5 mmol/L | 20 mmol/L |
3 a 4 mmol/L | 30 – 40 mmol/L |
< 3 mmol/L | 40 – 60 mmol/L |
El tratamiento insulínico no debe iniciarse hasta
no conocerse los niveles séricos de potasio y se
pospondrá hasta que sus valores sean
mayores de 3,3 mmol/L para evitar las arritmias, la parada
cardiaca y la debilidad de los músculos respiratorios (los
pacientes que en le momento de la admisión tengan un
potasio normal o bajo se estima que tienen un déficit
total mucho mayor). El potasio no se añadirá al
primer litro de solución salina, usado para mejorar la
volemia, ya que el uso de potasio sin insulina en un paciente
hiperpotasémico puede incrementar peligrosamente las
concentraciones extracelulares de potasio y precipitar arritmias
mortales.
Inicialmente se realizará ionograma cada 1 o 2
horas, ya que los cambios más importantes en las
concentraciones de potasio se producen en las primeras horas del
tratamiento, continuándose luego cada 4 a 6 horas en
dependencia de la situación clínica. Se recomienda
la monitorización electrocardiográfica de los
pacientes con hipopotasemia en el momento del ingreso y en
aquellos con una arritmia diferente a la taquicardia
sinusal.
- Fosfato
El fosfato es una sustancia primordialmente intracelular
que al igual que el potasio es desplazado al espacio extracelular
en respuesta a la hiperglicemia y a la hiperosmolaridad, a la vez
que se producen pérdidas importantes por la diuresis
osmótica (aproximadamente de 1 mOsm/kg de peso). Su
re-entrada a las células
con el tratamiento insulínico produce una
disminución significativa de sus concentraciones
séricas.
Los efectos adversos derivados de la hipofosfatemia
severa (< 1 mg/dL) incluyen la depresión
respiratoria, debilidad de los músculos
esqueléticos, anemia hemolítica y depresión
cardiaca. Teóricamente la reposición de fosfato
debe prevenir estas complicaciones y adicionalmente
aumentarían los 2,3 difosfoglicéridos que
están disminuidos en la CAD, lo que debe mejorar la
oxigenación hística. La reducción de los
niveles de fosfato junto al efecto inhibidor que tiene la
acidosis sobre la glucólisis, determina una
disminución del contenido intraeritrocitario de la enzima
2,3-difosfogliceromutasa (2,3-DPG); cuyo déficit es
responsable, junto con la posible hipotermia y la hemoglobina
glucosilada elevada, del aumento de la afinidad de la hemoglobina
por el oxígeno
(desplazamiento de la curva de disociación hacia la
izquierda) y, en consecuencia, de una menor oxigenación
hística. Este efecto está compensado por la propia
acidosis, que desplaza la curva en sentido contrario, de modo que
el efecto resultante es un aporte normal de oxígeno
a los tejidos. Durante
el tratamiento, no obstante, la corrección del pH suele
ser rápida, mientras que las concentraciones bajas de
2,3-DPG tardan varios días en normalizarse, de modo que
puede alterarse de nuevo la oxigenación hística;
sin embargo, hasta ahora los estudios controlados y aleatorizados
no han podido demostrar beneficios con la reposición
rutinaria de este electrólito, pudiendo aparecer efectos
adversos derivados de este tratamiento como hipocalcemia, tetania
y calcificaciones hísticas metastáticas.
La reposición de fosfato, por tanto, debe
limitarse a pacientes con fosfato sérico < 1 mg/dL y en
aquellos con hipofosfatemia moderada e hipoxia concomitante,
anemia o compromiso cardiorrespiratorio.
- Magnesio y calcio
También están disminuidos en la CAD. Si
los niveles de magnesio son menores de 1,8 mmol/L o existe
tetania se debe administrar 5 g de sulfato de magnesio en 500 ml
de solución salina al 0,45% en 5 horas. La hipocalcemia
sintomática se trata con 1 a 2 g de gluconato de calcio EV
(10 a 20 ml de una solución al 10%) en un período
de 10 minutos.
- Bicarbonato
La administración de insulina inhibe la
lipólisis y la producción de cetoácidos,
promoviendo su metabolismo.
Ya que los protones se consumen durante el metabolismo de los
cetoácidos, se favorece la regeneración del
bicarbonato y esto permite una corrección parcial de la
acidosis metabólica.
Varios estudios prospectivos han fallado en demostrar
cambios en la evolución clínica, la morbilidad y
la mortalidad con la administración de bicarbonato,
además de que el tratamiento con bicarbonato acarrea
riesgos como
irritación local, hipopotasemia, desvía la curva de
disociación de la hemoglobina a la izquierda y puede
provocar alcalosis por sobrecorrección.
Si la acidosis es severa (pH < 7,0) se puede utilizar
para contrarrestar los posibles efectos hemodinámicos
adversos de una acidosis intensa que incluyen el inotropismo
negativo y la vasodilatación periférica junto a la
depresión del SNC y una mayor resistencia a la
insulina.
Se recomienda en el adulto, administrar 200 ml por hora
de una solución de 400 ml de agua para inyección
con 100 mmol de bicarbonato de sodio si el pH es < 6,9; si el
pH está entre 6,9 a 7,0 la solución se prepara con
solo 50 moles de bicarbonato y se administra a igual velocidad.
Con un pH > 7,0 no se recomienda administrar
bicarbonato.
Debe monitorizarse el pH venoso cada 2 horas hasta que
sea mayor de 7,0. El tratamiento puede repetirse cada 2 horas si
es necesario vigilando los nivele séricos de potasio
durante el tratamiento por el riesgo de
alcalosis hipopotasémica. Se sugiere administrar un
suplemento de 20 mmol de potasio cada vez que se infunda
bicarbonato.
Se ajustará acorde a la situación
clínica específica, lo que incluye el uso de
antibióticos de amplio espectro para el tratamiento de la
infección o de heparina de bajo peso molecular para
prevenir la enfermedad tromboembólica.
La identificación y el tratamiento de factor
precipitante de la CAD es imperativo.
La figura 2 resume el algoritmo
terapéutico propuesto para el manejo de la CAD en el
adulto.
- Monitorización
Se necesita de una monitorización estrecha debido
a los cambios hidroelectrolíticos que se producen durante
la atención de un paciente con CAD y a las
complicaciones potenciales derivadas del
tratamiento, por lo que muchos pacientes con cuadros graves deben
ingresarse en una UCI.
La glicemia debe monitorizarse a la hora de iniciado el
tratamiento y una hora después de realizar cualquier
cambio en la
dosis de insulina; cada dos horas después de dos
seguimientos horarios y si el descenso se mantiene en un ritmo
adecuado después de dos nuevos chequeos se evalúa
cada 4 horas. Esto permite identificar a los pacientes con
insulinoresistencia y ajustar esta terapéutica, controlar
la velocidad de descenso de la glicemia y decidir el momento de
introducción de soluciones
glucosadas para evitar la hipoglucemia mientras se
continúa con el tratamiento insulínico hasta que se
controle la cetoacidosis.
|
Los electrólitos y el pH venoso (mucho más
fácil de obtener y menos doloroso, usualmente 0,03 menor
que el pH arterial) junto con la brecha aniónica (estos
dos últimos para definir la resolución de la
acidosis) se valoran cada 2 a 6 horas en dependencia de la
respuesta clínica, recomendándose realizarlos cada
2 horas hasta que el potasio y el bicarbonato se normalicen y
luego cada 4 ó 6 horas hasta la completa
recuperación.
La urea, la creatinina y el ácido úrico se
evalúan cada 6 horas.
En pacientes con una situación
hemodinámica inestable o en los que presentan problemas
cardiovasculares, la monitorización invasora de
parámetros hemodinámicos puede ser útil para
el manejo óptimo de los líquidos.
Debe realizarse un estricto balance hidromineral por lo
que resulta necesario controlar de forma precisa todos y cada uno
de los ingresos y
egresos del paciente.
En la figura 3 se muestran los elementos a monitorizar
durante el tratamiento de la CAD.
Los criterios de resolución de la CAD se resumen
en la tabla 5
Tabla 5. Criterios de | |
Glicemia | < 200 mg/dL (11,1 |
CO3H- | ³ 18 mmol/L |
pH venoso | > 7,3 |
Brecha aniónica | £ 12 mmol/L |
La medida de los cetoácidos por los
métodos habituales no se recomienda como elemento para
evaluar la respuesta a la terapéutica ya que no nos
permiten evaluar las concentraciones del ácido
b
-hidroxibutírico, por lo que se debe cuantificar
este último (valor normal < 1,5 mmol/L) en los
pacientes con acidosis metabólica prolongada, con
desórdenes ácido básicos mixtos o con la
asociación de diabetes y acidosis
láctica.
Un aspecto adicional de la monitorización es la
evaluación continua de los factores
precipitantes conocidos de la CAD, por lo que se recomienda
repetir una exploración completa en aquellos pacientes que
no respondan al tratamiento estándar con bajas dosis de
insulina, haciendo énfasis en la búsqueda de los
sitios de infección habitualmente no investigados, como
abscesos en mamas y región peri-rectal, cervicitis,
prostatitis, ulcera de decúbito; además debe
realizarse un screening urinario para drogas y
descartar un infarto agudo del miocardio silente. Resulta
conveniente recordar que en los momentos iniciales una
neumonía puede no ser reconocida, pues la intensa
deshidratación reducir la detección de los
crepitantes a la auscultación y disminuir la
condensación radiológica.
|
Las complicaciones más comunes de la CAD
incluyen: 1) hipoglucemia: debida a un tratamiento exagerado con
insulina, 2) hipopotasemia: causada por la administración
de insulina y el tratamiento con bicarbonato de la acidosis y 3)
hiperglicemia: secundaria a un tratamiento insulínico
insuficiente (las dos primeras se han reducido significativamente
con el uso de dosis bajas de insulina).
Frecuentemente los pacientes que se recuperan de una CAD
desarrollan una hipercloremia causada por el uso excesivo de
solución salina isotónica, lo que puede llevar a
una acidosis metabólica con brecha aniónica normal.
Estas anormalidades bioquímicas son transitorias,
autolimitadas y sin ningún significado clínico;
excepto en los pacientes con insuficiencia renal aguda o con
oliguria extrema. Se corrige gradualmente en 24 a 48
horas.
El edema cerebral es una complicación rara pero
casi siempre fatal. El asintomático no es raro entre
niños y adultos jóvenes, mientras que resulta
extremadamente raro el desarrollo de síntomas en el
adulto. Entre los niños ocurre entre un 0,7 a un 1% de los
casos con CAD, principalmente entre los que debutan con la
enfermedad y aparece generalmente entre las 2 y 24 horas
después de iniciado el tratamiento. Su
fisiopatología es poco comprendida, creyéndose que
está relacionada al menos parcialmente, con los "osmoles
idiógenos". Clínicamente se caracteriza por
deterioro del nivel de conciencia y cefalea, pueden aparecer
convulsiones, cambios pulmonares, bradicardia y parada
respiratoria (los síntomas y signos progresan como si se
produjera una herniación). Algunos pacientes tienen signos
premonitorios (cefalea de aparición brusca o
disminución rápida del nivel de conciencia), pero
en otros la manifestación inicial es la parada
respiratoria. La mortalidad es elevada (> 70%). Se han
utilizado la hiperventilación, los esteroides y el
manitol, pero suelen ser ineficaces tras la parada
respiratoria.
La aparición de hipoxemia y del síndrome
de distress respiratorio agudo, ambos raros, están
relacionados con un mal manejo de los líquidos; lo que
también pueden precipitar una insuficiencia cardiaca
congestiva.
La CAD es un estado de hipercoagulabilidad,
predisponente a la aparición de complicaciones
tromboembólicas por factores como la deshidratación
y la inmovilidad que favorecen el éstasis, la
hipercoagulabilidad y el daño endotelial.
La dilatación gástrica aguda aunque
infrecuente puede estar presente.
Cuadro 2. Complicaciones de |
|
|
|
|
|
|
|
|
|
|
- Wagner A, Risse A, Brill HL et al. Therapy of severe
diabetic ketoacidosis. Diabetes Care 1999,22:674 –
677, - Delaney MF, Zisman A, Kettyle WM. Diabetic
ketoacidosis and hyperosmolar nonketotic syndrome. Endocrinol
Metab Clin North Am 2000; 29(4): 683–705 - Kitabchi AE, Wall BM. Management of diabetic
ketoacidosis. Am Fam Physic 1999; 60: 455
–464 - Umpierrel GE, Khajavi M, Kitabchi AE. Review:
Diabetic ketoacidosis and hyperglycemic hyperosmolar nonketotic
syndrome. Am J Med Sci 1996; 311:225–233 - Kitabchi AE, Wall BM. Diabetic ketoacidosis. Med Clin
North Am 1995; 79(1): 9–37 - Rucker DW. Diabetic ketoacidosis. Medicine Journal
2001; 2(4) - American Diabetes Association. Hyperglycemic crises
in patients with diabetes mellitus. Diabetes Care 2001; 24
(Suppl 1): S83– S90 - Magee MF, Bhatt BA. Management of descompensated
diabetes. Diabetic ketoacidosis and hyperglycemic hyperosmolar
syndrome. Critical Care Clinics 2001; 17(1):
75–106 - Kitabchi AE, Umpierrel GE, Murphy MB, Barrett EJ,
Kreisberg RA, Malone JI, Wall BM. Management of hyperglycemic
crises in patients with diabetes (technical review). Diabetes
Care 2001; 24(1): 131–153 - Garber AJ. Diabetes Mellitus. In: Stein JH (Editor in
Chief). Internal Medicine. Fourth Edition. Mosby;
1994,1391–1424, - Pallárdo Sánchez LF. Alteraciones del
metabolismo de los hidratos de carbono. En
Teixidor RJ, Guardia MJ. Medicina
Interna. MASSON SA. 1997, - Dagas Ruiz D. Complicaciones agudas de la diabetes
mellitus. En: Principios de
urgencias, emergencias y cuidados críticos.
SAMIUC. - Complicaciones agudas de la diabetes mellitus. En:
Farreras Rozman. Medicina
Interna. 14 edición 2000 Ed. Harcourt. - Cetoacidosis diabetica. En Manual Merk.
10ma ed. Ediciones Harcourt. 1999 - Dinneen ST. Diabetic ketoacidosis. In: Conn’s
current therapy. WB Saunders Company, 1998, - Laffel L. Sick–day management in type 1
diabetes. Endocrinol Metab Clin North Am 2000; 29 (4):
707–723 - Laffel L. Ketone bodies: a review of phisiology,
pathophisiology and application of monitoring to diabetes.
Diabetes Metab Res Rev 1999; 15 (6): 412–426 - American Diabetes Association: tests for glycemia.
Diabetes Care 2000; 23: 580–582
Autor:
Dra. Nadia Labaut Arevalo
Especialista de I Grado en Medicina Interna.
Diplomado en Cuidados Intensivos y Emergencias
Medicas.Unidad de Cuidados Intensivos Hospital Provincial Clinico
Quirurgico Docente " Saturnino Lora ". Santiago de Cuba.
Dr. Eduardo Márquez Capote
Especialista de I Grado en Medicina Interna.
Especialista de II Grado en Cuidados Intensivos y
Emergencias Medicas. Unidad de Cuidados Intensivos Hospital
Provincial Clinico Quirurgico Docente "Saturnino Lora
".
Dra. Oneiris Cobas Martin
Especialista de I Grado en Anestesiologia y
Reanimacion.
Diplomado en Cuidados Intensivos y Emergencias Medicas.
Unidad de Cuidados Intensivos Hospital General
Santiago.