- Características
generales - Factores que influyen en la
obtención de una buena imagen - Usos
- Fluorocromos
El Microscopio
confocal, es un microscopio óptico que incorpora dos
diafragmas:
– un diafragma de iluminación localizado tras la fuente
luminosa denominado Pinhole de Excitación, cuya
utilidad es
eliminar la luz proveniente
de planos superiores e inferiores al plano focal, aumentando con
ello la claridad y resolución de la imagen; y
– un diafragma de detección, de tamaño variable
situado delante del fotodetector, denominado Pinhole de
Emisión
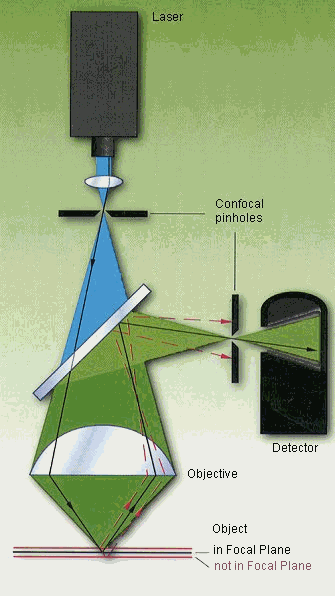
Manuel Reina , Univ. deBarcelona (http://www.ub.es/biocel/wbc/images/fluorescencia/clsm.jpg)

- Alta precisión y velocidad en
el barrido - Pinhole continuamente
variable - Resolución hasta los 2048 x 2048
pixeles - Controles independientes del PMT,
amplificadores, filtros y configuraciones. - Un detector y un pinhole por
canal - Un filtro optoacústico para el control de
cada láser - Disminución del ruido
- Escaneos seriados para la realización
del objeto en 3D - USOS:
- expresión y localización de
moléculas en 2 o 3 dimensiones permitiendo
reconstrucciones tridimensionales, tanto en cultivos celulares
como tejidos
histológicos; - estudios de colocalización de
proteínas u otro tipo de
moléculas; - transporte intracelular,
endocitosis; - medidas de concentraciones de iones
intracelulares; - desarrollo y expresión
génica; - hibridación in situ con sondas
fluorescentes; - FLUOROCROMOS2:
Los fluorocromos son sustancias que
tienen la propiedad de
emitir un fotón de una longitud de onda determinada cuando
captan (son exitados) por un fotón incidente de una
longitud de onda
característica.
Uno de los problemas de
la utilización de fluorocromos en microscopía de
fluorescencia es la pérdida de ésta debido a las
grandes intensidades de luz empleadas. Las muestras empleadas en
esta técnica no pueden observadas durante largos periodos
de tiempo debido
a la desaparición de la fluorescencia ('fluorescence
fading'). Se han desarrollado métodos
que permiten reducir este efecto, entre ellos destacan
:
- el uso de reactivos protectores de la
fluorescencia ('antifading
reagents') - el uso de fluorocromos con poco
'fading' - el empleo de
luz de excitación de menor
intensidad - la reducción de la
concentración de oxígeno en el
especimen - el direccionamiento del 100% de la luz
hacia el dispositivo de registro
(cámara, película,…) para reducir al
máximo el tiempo de exposición. - el empleo de mecanismos de medición de la exposición
óptima (automática) para reducir la
iluminación al
máximo.
Los reactivos 'antifading' son
moléculas que aportan al fluorocromo aquellos electrones
que ha perdido por la emisión fluorescente. Se trata de
moléculas donadoras de electrones que deben encontrarse
para ser efectivas en estrecha vecindad a las moléculas de
fluorocromo.
Los reactivos antifading más
empleados son los siguientes :
- p-phenylenediamine. Es el reactivo
más efectivo para la conservación de la
fluorescencia de la fluoresceína (FITC). También
efectivo para la rodamina. Se emplea al 0.1% en glicerol/PBS.
El reactivo se tiñe de blanco cuando se expone a la luz.
Se ha de conservar en la oscuridad. El contacto con la piel es
extremadamente peligroso. - DABCO
(1,4-diazabiccyclo-2,2,2-octane). Muy efectivo para la
fluoresceína, aunque menor que la p-phenylenediamine. Es
menos sensible a la luz y es mucho menos
tóxico. - n-propyl galeate. Es el agente
más efectivo para la rodamina, aunque también es
efectivo para la fluoresceína. Se emplea al 0.1% en
glicerol/PBS. - 2-mercaptoethylamine. Se emplea para
la observación de cromosomas y
muestras de DNA teñinas con ioduro de propidio (PI),
naranja de acridina (AO) o cromomysin A3. Se emplea al 0.1 mM
en Tris-EDTA. - Colorantes más utilizados
– Rangos de
emisión:
Table of Fluorochromes (And possible use | |||
Probe | Ex (nm) | Em (nm) | Notes |
Hydroxycoumarin | 325 | 386 | Succinimidyl ester |
Aminocoumarin (AMCA) | 350 | 445 | Succinimidyl ester |
Methoxycoumarin | 360 | 410 | Succinimidyl ester |
R-Phycoerythrin (PE) | 480;565 | 578 | |
Fluorescein | 495 | 519 | FITC |
Alexa 350 | 350 | 450 | |
Alexa 430 | 430 | 530 | |
Alexa 488 | 488 | 519 | |
Alexa 568 | 568 | 610 | |
Alexa 594 | 594 | 610 | |
BODIPY-FL | 503 | 512 | |
Rhodamine (TRITC) | 547 | 572 | |
Texas Red | 589 | 615 | Sulfonyl chloride |
Cy2 | 488 | 515 | |
Cy3 | 512;552 | 565,615 | |
Cy5 | 625;650 | 670 | |
Cy7 | 743 | 767 | |
X-Rhodamine | 570 | 576 | XRITC |
Tetramethylrhodamine | 550 | 590 | |
Lissamine Rhodamine B | 570 | 590 | |
PerCP | 490 | 675 | Peridinin chlorphyll |
Allophycocyanin (APC) | 650 | 660 | |
PE-Cy5 conjugates | 480;565;650 | 670 | Tri-Color, |
PE-Cy7 conjugates | 480;565;743 | 767 | |
Red 613 | 480;565 | 613 | PE-Texas Red |
TruRed | 490,675 | 695 | PerCP-Cy5.5 conjugate |
Cascade Blue | 375;400 | 423 | Hydrazide |
Lucifer yellow | 425 | 528 | |
APC-Cy7 conjugates | 650;755 | 767 | |
Nucleic acid | |||
Hoechst 33342 | 343 | 483 | DNA (fixed cells) |
DAPI | 345 | 455 | DNA (fixed cells) |
Hoechst 33258 | 345 | 478 | DNA (for live and fixed |
SYBR green | 488 | 509 | DNA |
Propidium Iodide + RNAse | 536 | 617 | DNA only |
TO-PRO-3 | 642 | 661 | DNA |
Mithramycin, Chromomycin | 445 | 575 | |
Thiazole Orange | 453 | 480 | |
SYTO 13 | 488 | 509 | DNA+RNA; For live Cells. |
SYBR+A59r green | 488 | 509 | |
Ethidium Bromide | 493 | 620 | DNA/RNA |
Acridine Orange | 503 | 530/640 | DNA/RNA |
TOTO-1, TO-PRO-1 | 509 | 533 | Vital stain DNA/RNA |
Propidium Iodide (PI) | 536 | 617 | DNA/RNA |
TOTO-3 | 642 | 661 | |
SYTO 59 | 640 | 660 | DNA+RNA for Live Cells |
Cell function | |||
Indo-1 | 361/330 | 490/405 | AM ester. Low/High Ca++, |
Fluo-3 | 506 | 526 | AM ester. pH > |
2'7'Dichorodihydrofluorescein | 505 | 535 | Oxidized form |
Dihydrorhodamine 123 | 505 | 534 | Oxidized form. Light catalyzes |
Calcein | 496 | 517 | pH > 5 |
Monochlorobimane | 380 | 461 | Glutathione probe |
SNARF | 548;579 | 587/635 | pH 6/9 |
Fluorescent Proteins (expression | |||
GFP Y66F | 360 | 508 | |
GFP Y66H | 360 | 442 | |
GFP Y66W | 436 | 485 | |
Wild Type GFP | 396,475 | 508,503 | |
GFP S65A | 471 | 504 | |
GFP S65L | 484 | 510 | |
GFP S65T | 488 | 511 | |
ECFP | 479 | 475 | |
EYFP | 484 | 540 | |
DsRed | 488 | 600 | |
- Presentación del Dr. Santa Coloma – Web page Carl
Zeiss - Material docente diseñado y elaborado por Manuel
Reina – Univ. de Barcelona - Centro Nacional de Biotecnologia (CNB – CSIC),
Madrid –
España
MARIANA PUCCIARELLI
