- Agente
etiológico - Patogenia
- Patología
- Inmunidad
- Manifestaciones
clínicas - Diagnóstico
- Tratamiento
- Epidemiología
- Antecedentes de ensayos in
vitro - Antecedentes de ensayos in
vivo - Referencias
La trichomonosis es una forma común de vaginitis
que afecta tanto a adolescentes
como a adultos, causada por un parásito unicelular llamado
Trichomonas vaginalis, el cual fue descrito por primera vez en
1836 por el francés Donné, quien lo encontró
en secreciones vaginales y uretrales. Posteriormente Hoehne en
1916, comprobó que era el agente etiológico de una
infección vaginal específica. Hasta ahora se
desconoce en que forma el parásito ingresó al
organismo humano por vez primera. A diferencia de las infecciones
por hongos la
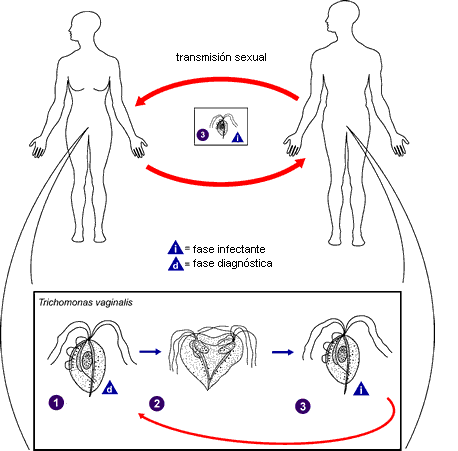
trichomonosis se transmite a través de las relaciones
sexuales, de modo que se considera una infección de
transmisión sexual (ITS) (Roin, 2001).
Escario, Guillen, Martínez & Contreras,
(1986) refieren que se relaciona trichomonosis a cáncer
cervical, enfermedad inflamatoria pelviana atípica,
esterilidad, a una predisposición a infección con
VIH debido a la acumulación local de linfocitos y
macrófagos. La infección en mujeres embarazadas
provoca un mayor riesgo a la
ruptura prematura de las membranas de la placenta, infantes con
bajo peso al nacer, además de infecciones
postquirúrgicas del tracto reproductor. Según la
OMS se tiene un estimado anual de 180 000 000 de personas
afectadas en el planeta (LLop, Valdéz-Dapena & Zuazo,
2001).
Costamagna & Figueroa (2001) refieren que T.
vaginalis es un protozoo de forma ovoide o piriforme que mide de
7 – 30 µm de longitud y de 5 – 15 de ancho. El
trofozoito se caracteriza por presentar cuatro flagelos
dispuestos de dos en dos en la parte anterior, y un flagelo
recurrente que forma la membrana ondulante, que no llega a la
parte posterior del cuerpo (Alderete, Benchimolb, Lehkera &
Croucha, 2002). El flagelo libre y la membrana ondulante le
confieren al parásito la motilidad espasmódica
característica (Petrin, Delgaty, Bhatt & Garber, 1998)
(Figura # 1).
Figura # 1. T. vaginalis observada por
Microscopía Electrónica de Barrido (MEB). Flagelo (F)
emergiendo de la región anterior; membrana ondulante
(MO) (Costamagna & Figueroa, 2001).

Los quistes no existen observándose solo el estado de
trofozoitos, sin embargo aunque carece de formas de resistencia, la
quitina asociada a estructuras de
superficie le permiten sobrevivir en condiciones ácidas
(pH 4.0-4.5).
De esta manera T. vaginalis vive en el moco vaginal y en la
secreción ventral de la mujer,
además vive en la uretra, próstata y
epidídimo del hombre y se
multiplica por fisión binaria longitudinal (Figura # 2)
(Alderete et al., 2002).
Figura # 2. Ciclo biológico de T.
vaginalis (Alderete et al., 2002).
![]() Trofozoitos en secreciones vaginales,
Trofozoitos en secreciones vaginales,
prostáticas y en orina.
![]() Multiplicación por fisión binaria
Multiplicación por fisión binaria
longitudinal
![]() Trofozoito en vagina y en orificio de la
Trofozoito en vagina y en orificio de la
uretra.
La célula
presenta un núcleo grande, ovalado, excéntrico y
localizado en el extremo anterior, un citoplasma rico en carbohidratos,
con gran número de vacuolas (incluyendo liposomas)
(Alderete, 2002; Costamagna, 2001; LLop, 2001).
T. vaginalis no posee mitocondrias, pero sí
hidrogenosomas, que son organelos sin ADN formados por
3 gránulos cromáticos (Alderete et al., 2002).
Algunos investigadores sugieren que el hidrogenosoma es una
modificación de la mitocondria, otros sugieren que ambos
provienen de un organelo común (véase, por ejemplo,
Cavalier, 1987; Gunderson, 1995). Brown, Upcroft JA, Edwards
& Upcroft P (1998) plantean que este protozoo es anaerobio
microaerotolerante, presentando el sistema
enzimático de la piruvato ferredoxina oxidoreductasa
(PFO), reemplazando la piruvato deshidrogenasa de organismos
aerobios. Esta vía metabólica activa drogas como
los 5-nitroimidazoles y ha sido encontrada en bacterias
anaerobias susceptibles al Metronidazol, pero no en otras
eucariotas por lo que se considera a T. vaginalis como eucariota
primitivo (Upcroft JA & Upcroft P, 1999). Los requerimientos
energéticos los provee la transformación de
glucosa a
glicerol y a succinato en el citoplasma, seguido por la ulterior
conversión de piruvato y malato a hidrógeno y acetato, en los hidrogenosomas
(Muller, 1993, 1998).
En estudios de la ultraestructura de T. vaginalis
utilizando técnicas
como Microscopía Electrónica de Barrido (MEB) y
Microscopía Electrónica de Transmisión
(MET), se ha observado que posee numerosos hidrogenosomas
alineados debajo de la membrana ondulante y a lo largo del
axostilo, mostrando importantes depósitos
electrón-denso a modo de opérculo en cada uno. Al
MET su citoplasma no muestra
mitocondrias. Se ha demostrado además que utiliza los
fenómenos de micropinocitosis asociados con
vesículas con cubierta como mecanismo habitual de endo y
exocitosis selectiva, mientras que para partículas mayores
la fagocitosis es frecuentemente vista. Con referencia al
citoesqueleto, los microtúbulos que recorren el
parásito son numerosos, conformando estructuras diversas
(Costamagna et al., 2001) (Figura # 3).
Figura # 3. Ultraestructura de T. vaginalis
observadas con MET. En la región posterior del
citoplasma, el núcleo (N); hidrogenosomas (H).
También se observan gránulos de glicógeno
y vacuolas (Costamagna et al., 2001).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
El cariotipo de T. vaginalis ha sido descrito como
haploide con 6 cromosomas y
diploide con 12 cromosomas (Drmota, 1997; Yuh, Liu &
Shaio1997).
Este parásito carece de vías
metabólicas para sintetizar ácidos
grasos, fosfolípidos y esteroles por lo que utiliza
fuentes
exógenas. Las purinas y pirimidinas entran a la célula
por medio de transportadores (Beach, Holz, Singh, & Lindmark
1990, 1991).
El protozoo T. vaginalis cuando está vivo tiene
un movimiento
característico, se desplaza sobre su eje mayor a medida
que progresa lentamente, pero, por lo general no se mueve
rápidamente de uno a otro sitio. Cuando dicho
parásito está muriendo, o degenerando, su cuerpo
puede volverse más o menos amiboideo; mientras que si
está sano tienen el cuerpo en forma de pera con su extremo
anterior redondeado y el posterior más puntiagudo. Carece
de cistostoma visible y al parecer se alimenta únicamente
de nutrientes en solución (Lapage, 1975).
Engbring & Alderete (1998) refieren que T. vaginalis
posee una elevada especificidad para unirse solamente a las
células
epiteliales de la mucosa del tracto genitourinario; proceso
mediado por proteasas que se encuentran en la superficie del
parásito y que son determinantes en el establecimiento de
la infección así como de la patogenicidad del
mismo. Una vez implantado el microorganismo
en la vagina, es capaz de obtener nutrientes a partir de las
bacterias y leucocitos presentes en el medio además de
destruir las células del hospedero. El ataque del
parásito a la célula hospedera es un prerrequisito
para el establecimiento de la infección, tal que el
organismo pueda vencer la constante secreción de la vagina
(Alderete, Lehker & Arroyo, 1995). Residuos de
azúcares, en particular alfa-D-manosa y
N-acetilglucosamina, presente en el parásito, están
involucradas en el proceso de ataque de T. vaginalis a la
célula epitelial del hospedero por lo que remover estos
azúcares de la superficie de la célula
parásita previene del ataque y con ello el daño de
las células epiteliales (Mihaghani & Warton,
1998).
González, Lázaro, Espinosa, Anaya &
Martínez (1995) han explorado efecto citopático in
vitro de T. vaginalis en células epiteliales mediante la
interacción de trofozoitos de dos cepas
virulentas (GT-10 y GT-3) con una monocapa de células MDCK
revelando que los parásitos producen severos daños
en la monocapa de células en 30 min, y una rápida
disminución de la resistencia transepitelial. Las
observaciones microscópicas demostraron que en el lugar de
contacto del parásito con las células epiteliales,
T. vaginalis forma grumos, así como canales o
interdigitaciones que permiten un acoplamiento de células
adyacentes y la inclusión de fragmentos
citoplasmáticos.
La examinación de la propiedad de
citoadherencia se ha llevado acabo usando células HELA
como modelo
experimental in vitro así como usando células
epiteliales vaginales (VECs), el blanco o diana de T. vaginalis
in vivo (Alderete et al., 1995). El microscopio
electrónico reveló que los parásitos
crecidos in vitro teniendo una forma globular típica son
transformados rápidamente en paren finos, planos y
células amiboideas, en el contacto con las células
epiteliales vaginales, maximizando el área de
adhesión a la superficie de la VECs, no
encontrándose esta transformación para T. vaginalis
interactuando con células HELA (Arroyo, González,
Martínez & Alderete, 1993).
Varios autores han sugerido que una señal de
virulencia puede estar dada por la capacidad de T. vaginalis de
cambiar de forma redondeada a forma amiboidea y en otros estudios
se ha mostrado que este parásito en su forma amiboidea
contiene una densa red de microfilamentos en el
lugar de contacto con la célula epitelial (Honigberg,
1978; Rasmussen, Nielsen, Lind & Rhodes, 1986). Existen
evidencias
recientes de que la capa de microfibrillas del extoplasma en la
zona de adhesión de la forma amiboidea del
parásito, está compuesta fundamentalmente por
microfilamentos de actina; además se ha revelado en la
región de ataque con superficie de VECs, la presencia de
interdigitaciones y un espacio intercelular de 2-10 nm (Bastos
& Benchimol, 1998; Brugerolle, Brcheux & Coffe,
1996).
Figura # 4. Conformación ovoide de T.
vaginalis observada por MEB. Flagelo (F) y membrana ondulante
(MO) (Costamagna et al., 2001).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Arroyo & Alderete (1995); Krieger, Ravdin & Rein
(1985) utilizaron un potente inhibidor de los microfilamentos,
cito D, permitió observar una significativa
inhibición de la citopatogenicidad del parásito en
un cultivo de tejido; no siendo tóxico además para
T. vaginalis ni inhibiendo su motilidad. La función de
estos microfilamentos puede ser importante en la adherencia
inicial del parásito y en los eventos
citolíticos posteriores.
Se han realizado investigaciones
con el objetivo de
identificar y caracterizar factores de virulencia, adhesinas y
proteinasas, del protozoario flagelado T. vaginalis, y la
participación de estos factores de virulencia en el
desarrollo de
la enfermedad que produce, además de los mecanismos de
regulación de la expresión genética
de estas moléculas por factores ambientales como el
hierro y el
zinc, presentes selectivamente en el aparato urogenital de
mujeres y hombres, respectivamente. Se han identificado y
caracterizado una cisteín proteinasa de 30 kDa (CP30),
como la proteinasa necesaria para que se lleve a cabo la
adhesión del parásito a su célula blanco en
la vagina y ectocérvix. Según Mendoza et al. (2000)
la CP30 se encuentra localizada en la superficie del
parásito, es capaz de reconocer y unirse a la superficie
de las células epiteliales de la vagina y del
cérvix, degrada diferentes proteínas
presentes en el microambiente vaginal, fibronectina,
colágeno IV y hemoglobina. Además, la CP30 es
inmunogénica en pacientes con Trichomonosis y se le
encuentra en las secreciones vaginales. Curiosamente, la CP30 se
regula negativamente por altas concentraciones de hierro,
mientras que las adhesinas se regulan positivamente por las
mismas concentraciones de hierro (Arroyo, Engbring, &
Alderete, 1992). Además, se ha identificado y
caracterizado una cisteín proteinasa de 65 kDa (CP65) como
una de las moléculas que participan en la citotoxicidad
del parásito a la célula blanco. Esta proteinasa se
encuentra en la superficie de T. vaginalis, se une a la
superficie de las células del epitelio cervico-vaginal, se
activa en los rangos de pH encontrados en la vagina de pacientes
con trichomonosis, degrada fibronectina y colageno IV y es
inmunogénica en mujeres infectadas (Alvarez et al., 2000).
También esta cisteín proteinasa se regula
negativamente por altas concentraciones de hierro. Recientemente
se ha identificado y caracterizado como una nueva adhesina de T.
vaginalis a una proteína de 120 kDa inducible por altas
concentraciones de hierro, AP120. Esta proteína comparte
algunas de las propiedades de las adhesinas (AP65, AP51, AP33 y
AP23) previamente descritas y caracterizadas. De ahí que
el aislamiento y caracterización de los genes de las
moléculas previamente descritas, CP30, CP65 y AP120,
ayudará a entender el mecanismo de regulación por
hierro de la expresión de estos factores de virulencia de
T. vaginalis (Alderete et al., 1995; Mendoza et al.,
2002).
Como T. vaginalis carece de la propiedad para sintetizar
lípidos,
los eritrocitos pueden ser una fuente de ácidos grasos
para el parásito. En adición, el hierro es un
importante nutriente que puede ser adquirido por la vía de
la lisis de los eritrocitos. Inhibidores de las cistein
proteinasas (CPs) reducen la lisis de los eritrocitos lo que
sugiere que CPs pueden ser un factor lítico involucrado en
la hemólisis (Dailey, Chang & Alderete,
1990).
T. vaginalis no puede vivir naturalmente sin estrecha
asociación con el tejido vaginal. Pocos días
después de la llegada a la vagina, los parásitos
proliferan y provocan degeneración y descamación
del epitelio vaginal, con infiltración leucocitaria y
aumento de las secreciones vaginales (Llop et al.,
2001).
En los casos típicos el pH normal de la vagina
(3.8-4.4) se hace más alcalino, disminuyen los
depósitos de glucógeno de la mucosa, especialmente
en las capas superficiales. Los procesos
fisiológicos de destrucción celular aportan el
glucógeno necesario para el crecimiento del bacilo de
Döderlein, que se encarga de metabolizar el mismo y excretar
ácido láctico, proceso mediante el cuál se
mantiene el medio ácido normal de la vagina. En ausencia
de los depósitos normales de glucógeno la cantidad
de este microorganismo disminuye y en casos severos pueden ser
eliminados alterándose la protección
fisiológica que ofrece la acidez vaginal estimulando el
crecimiento de T. vaginalis y otros microorganismos (Wolfang,
Willett & Amos 1983).
Rein (1995) señala que los microorganismos se
observan en grupos y debajo
de ellos se encuentran ulceraciones epiteliales superficiales.
Hay proliferación y una doble cresta característica
que forman los capilares de la mucosa, microhemorragias e
infiltración de la submucosa por neutrófilos. Las
paredes vaginales casi siempre están eritematosas y pueden
mostrar hemorragias petequiales que en casos graves pueden tener
apariencia granular denominado comúnmente como
‘’strawberry cérvix’’ (Stein,
1994).
El orificio uretral, las glándulas vestibulares y
el clítoris se observan intensamente inflamados. Cuando la
infección aguda cambia al estado
crónico, se produce una atenuación de los
síntomas, las secreciones pierden su aspecto purulento
debido a la disminución del número de
parásitos y leucocitos, al aumento de las células
epiteliales y al establecimiento de una flora bacteriana mixta.
Se requiere un gran número de parásitos para causar
síntomas. Un pequeño número puede ser
encontrado en una paciente sin síntomas con un pH vaginal
normal y una flora vaginal normal, lo que puede ser interpretado
como un estado de portador.
Este protozoo afecta más a las mujeres debido a
cambios hormonales y a que durante la menstruación el
parásito aprovecha el hierro existente en el flujo
sanguíneo que le permite aumentar su capacidad de
adherencia a tejidos. En los
períodos en que no hay menstruación las
concentraciones de hierro son reducidas, lo que provoca que el
protozoo tenga movilidad y busque alimentarse. Esto obliga a este
parásito a adaptarse a las condiciones ambientales
cambiantes de la vagina para permanecer en ella.
Respecto a lo que sucede en el organismo del hombre
infectado, las concentraciones de zinc contenidas en su semen
tienen capacidad trichomonicida que destruye al protozoario. En
varones con niveles bajos de zinc, el parásito vive en
estado latente convirtiéndolos en portadores de la
enfermedad.
A su vez, las mujeres en gravidez y enfermas de
trichomonosis tienen un embarazo de
alto riesgo, con partos prematuros y bebés que nacen con
bajo peso. Esta enfermedad no manifiesta secuelas, como en el
caso de la sífilis,
que puede causar ceguera. Sin embargo, un niño que nace de
menor peso corre el riesgo de tener repercusiones en su
desarrollo inicial al ser más susceptible a otros
padecimientos (Tricomoniasis, 2001).
La enfermedad no confiere una inmunidad importante, y la
repetición de esta es común. Sin embargo en
animales de
experimentación se han encontrados niveles altos de
resistencia. Los anticuerpos (Ac) séricos han sido
detectados en las infecciones humanas; pero no hay
correlación entre el nivel de Ac y la resistencia a la
reinfección. Se han detectado IgA antitrichomonas en
¾ partes de las mujeres con trichomonosis aguda; pero
también en la mitad de aquellas que no tienen la
infección. La enfermedad no es más grave en
aquellos pacientes inmunodeprimidos (Rein, 1995).
- Mecanismos de evasión del sistema
inmune
Petrin et al. (1998) señalan que la habilidad de
evadir el sistema inmune del hospedero es un importante aspecto
en la patogénesis. La invalidación del complemento
es una estrategia usada
por T. vaginalis. La resistencia al complemento degradando la
porción C3 es dependiente de concentraciones elevadas de
hierro donde se involucran las CPs del parásito (Alderete,
Provenzano & Lenker, 1995).
Este protozoo muestra la variación
fenotípica. Se han encontrado dos fenotipos diferentes en
la expresión de una glicoproteína altamente
inmunogénica (P270) y adhesinas (AP65, AP51, AP33, AP23),
siendo el fenotipo P270 negativo el único capaz de
expresar las adhesinas necesarias para adherirse (Alderete et
al., 1992; Alderete, 1988). En la glicoproteína P270 se ha
encontrado un epítope importante en la unión con el
anticuerpo, solo el fenotipo P270 negativo puede evadir el ataque
de los anticuerpos (Alderete, 1987; Dailey & Alderete, 1991).
Ha sido reportado además que numerosas CPs secretadas por
T. vaginalis degradan IgG, IgM e IgA (Provenzano & Alderete,
1995).
Los síntomas se desarrollan de 4 a 30 días
después de la infección; períodos de
incubación más cortos se relacionan con una
enfermedad más grave (Rein, 1995). La presencia de
síntomas es más frecuente e importante en el
sexo femenino.
En el hombre
provoca escasos o nulos síntomas. Las variadas formas
clínicas de la enfermedad dependen probablemente del
número y virulencia del parásito y de la
resistencia del hospedero. Se plantea que los síntomas son
mayores cuanto mayor es el número de parásitos y
cuanto más alcalino sea el pH vaginal. La importancia de
conocer el grupo de
individuos asintomáticos radica en que ellos actúan
como portadores ¨sanos¨ y pueden transmitir sexualmente
el parásito a otras personas (Llop et al.,
2001).
Botero & Restrepo (1992) son de la opinión
que la infección se puede presentar de tres formas:
vaginitis asintomática, vulvovaginitis aguda o
crónica y uretritis.
La manifestación clínica más
frecuente es la vulvovaginitis de evolución aguda o crónica, y el
signo o síntoma más común es la leucorrea,
que se presenta como una secreción de tipo purulenta y
espumosa. Esto se ha corroborado en estudios recientes de
prevalencia realizados en el departamento de Parasitología
del Instituto de Medicina
Tropical ¨Pedro Kourí ¨. La leucorrea
resultó ser el signo más frecuente en cinco grupos
de humanos en los que se incluyeron mujeres supuestamente sanas,
mujeres con patología de cuello uterino, mujeres
portadoras del SIDA, en
adolescentes y en parejas con trastornos de la fertilidad. La
leucorrea puede ser variable en cantidad, de color
amarillento, verdoso o gris inodora o de un olor fuerte. Otros
síntomas son el prurito vulvar, el ardor y la
irritación genital dolorosa, que puede llegar a provocar
intensa dispareunia (Llop et al., 2001).
A la especuloscopía se aprecia vagina en
empedrado y cérvix con aspecto de fresa, esto a causa de
la dilatación capilar y las hemorragias puntiformes;
generalmente el endocérvix no muestra afección y si
es así, se encuentra una cervicitis mucopurulenta; es
importante considerar que puede coexistir con una
infección por Chlamydia trachomatis y/o Neisseria
gonorrhoeae, que en toda circunstancia deberá
descartarse.
En el hombre la trichomonosis es a menudo
asintomática, o puede causar uretritis, prostatitis,
cistitis, epididimitis, esterilidad y a veces es responsable de
una irritación persistente (Llop et al., 2001).
Las manifestaciones clínicas no son confiables
para efectuar un diagnóstico exacto y la existencia de una
población asintomática hace que el
diagnóstico esté basado en la demostración
del parásito. El frotis directo simple del exudado vaginal
y la observación al microscopio de la motilidad
del protozoario (procedimiento
descrito por Donné en 1836) es el método
más empleado (Petrin et al., 1998). La sensibilidad de
esta técnica varía desde un 38 a un 82 % (Cann,
1974; Martin, Kaufman & Burns, 1963;). La paciente no se debe
aplicar duchas vaginales el día del examen. Durante la
toma de muestra con ayuda del espéculo no lubricado y
estéril se recolecta el flujo de las paredes vaginales y
del fondo del saco uterino con un hisopo también
estéril (Llop et al., 2001). Según Rein (1995) el
flujo colectado se agita en 1 mL de solución salina y una
gota de la suspensión resultante se transfiere al
portaobjetos, se le coloca cubreobjeto y se observa la
preparación en el microscopio óptico con objetivo
400 x. El material fresco debe ser examinado de inmediato,
reconociéndose al parásito por la forma y motilidad
espasmódica características. También se les
puede ver parasitando algunas células epiteliales,
usualmente en grumos (Núñez, 2001).
En el hombre un hisopado de la uretra anterior puede ser
examinado para ver la motilidad de los trofozoitos,
preferentemente por la mañana, antes de la micción
(53). También se puede observar el sedimento de
la primera orina matinal. Se ha planteado que estos procedimientos
carecen de sensibilidad diagnóstica. El cultivo in vitro a
partir de secreciones vaginales (en las mujeres) y de sedimento
urinario (en los hombres), es la prueba más sensible ya
que más del 97% son positivas cuando hay infección,
y detectan parásitos con inóculos tan
pequeños como 1-5 cel/mL (Llop et al., 2001; Rein, 1995).
Este método tiene la desventaja de requerir de 2-7
días de incubación, durante este período los
pacientes infectados pueden continuar transmitiendo la
infección (Moldwin, 1992; Roin, 2001).
Alderete et al. (2002) han descrito técnicas de
tinción con Giemsa o May-Grünwald-Giemsa y
Papanicolau, donde se observan estos parásitos de forma
alargada, aislados o agregados en forma de coronas parasitando
células epiteliales.
Se estiman 8 serotipos de T. vaginalis (Ackers, 1990).
Técnicas como aglutinación, fijación del
complemento, hemoaglutinación indirecta, difusión
en gel, anticuerpos fluorescentes etc, han sido usadas para
demostrar la presencia de anticuerpos antitrichomonas (Mathews
& Healy, 1983; Sibau, Bebb & Proctor, 1987; Teras Nigesen
Jaakmees, Roigas & Tompel, 1966).
La detección de antígenos usando anticuerpos monoclonales
promete ser un rápido método para el
diagnóstico de T. vaginalis (Petrin et al.,
1998).
El uso del PCR ayuda a detectar organismos no viables
así como células y secuencias en muestras
clínicas que presentan parcial
degradación.
Alderete et al. (2002) refieren que el tratamiento es
difícil dada la reinfestación constante. Se debe
tratar a la pareja, no sólo a la mujer. En
ésta hay que restaurar el pH ácido de la vagina ya
que T. vaginalis no vive en pH entre 3.8-4.4. Para ello se limpia
la vagina con agua y
jabón neutro (pueden usarse desinfectantes como el
ácido pícrico), así como realizar duchas con
una solución débil de ácido láctico
para restablecer la flora normal de la vagina.
- Metronidazol
El fármaco más utilizado en la actualidad
es el Metronidazol,
(1-(β-hidroxietil)-2-metil-5-nitroimidazol) descubierto en
la década del 50, cuando investigadores de los
laboratorios Rhône-Poulenc (Francia)
observaron que un derivado semisintético del
2-nitroimidazol (azomicina) aislado de Streptomyces en Japón
tenía actividad débil contra T. vaginalis y que fue
el punto de partida para la investigación de fármacos con
actividad contra protozoos
anaerobios (Vázquez, García, Pérez &
Palacio, 2001). Tiene actividad in vitro e in vivo
particularmente alta contra T. vaginalis y otros protozoarios. El
Metronidazol es un trichomonicida de acción
directa. El mecanismo de acción de los nitroimidazoles se
refleja en una toxicidad selectiva para los microorganismos
anaeróbicos o microaerófilos y para células
anóxicas e hipóxicas (Goodman LS & Gildman,
1994; Thompson, 2003).
Para explicar el mismo se puede dividir en 4 fases:
(Edwards, 1993; Müller, Robbie & Sweet,
1983).
1. Penetración del fármaco por
difusión pasiva a través de la pared celular del
protozoo que puede aumentar por el nivel de reducción
intracelular.
2. Reducción del grupo nitro a un intermediario
transitorio tóxico. El grupo nitro actúa como
aceptor de electrones provenientes de proteínas para el
transporte de
electrones como las ferrodoxinas en el caso de T. vaginalis,
desviándola de su ruta normal productora de energía
(Goodman & Gildman, 1994; Thompson, 2003).
3. Acción sobre el ADN del parásito.
Inhiben la síntesis y
degradan el ADN, siendo mayor cuanto más contenido de A+T
tiene el ADN, pues las roturas se producen entre estos residuos,
sobre todo en la timina, y liberan una mezcla de timina y
timidina fosfato. T. vaginalis tiene un contenido de A+T mayor
del 70%, por eso la mínima concentración letal
(CLM) está alrededor de 1 µg/ml (Vázquez et
al., 2001).
Estos hallazgos son consistentes con los efectos
antimicrobianos y mutagénicos del Metronidazol. Los dos
metabolitos principales que resultan de la oxidación de
las cadenas laterales, ambos tienen actividad antitrichomonas
(Goodman & Gildman, 1994; Thompson, 2003). (Figura #
5).
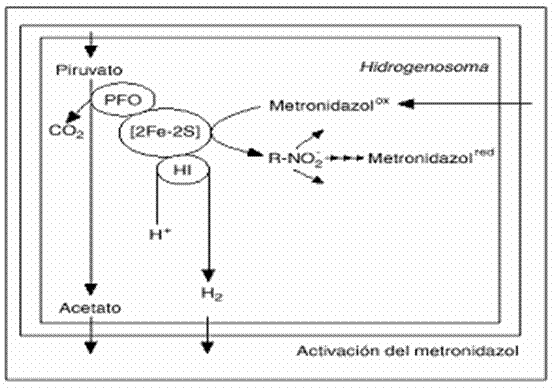
Figura # 5. Mecanismo de
acción de los nitroimidazoles. PFO: piruvato: ferredoxin
oxidoreductasa; [2Fe-2S]: Ferredoxina; HI: hidrogenasa; R-NO2-:
radicales libres (Vázquez et al., 2001).
Rein, (1995) opina que en el tratamiento de la
trichomonosis se han empleado varios esquemas de
dosificación. Una dosis única de 2g ha tenido una
efectividad del 85-92%. Empleando dosis de 250 mg tres veces al
día durante una semana se resuelven alrededor del 95% de
los casos y este es el régimen mas aceptado para adultos.
Estudios comparativos de tratamiento con Metronidazol oral e
intravaginal tienen como resultado que una dosis única de
Metronidazol intravaginal es inferior a una dosis única de
Metronidazol oral y no debe considerarse como una terapia
alternativa (Rosenstein, 1996).
Los efectos colaterales rara vez son tan graves como
para causar la interrupción del tratamiento siendo los
más comunes: cefalea, náuseas, sequedad de la
mucosa oral y sabor metálico. Ocasionalmente se presentan
vómitos,
diarrea y
malestar abdominal. Glositis y estomatitis pueden ocurrir durante
el tratamiento y se asocian con una superinfección por
Candida albicans en la vagina. También se han observado
efectos neurotóxicos por el Metronidazol. Tiene
además un efecto similar al Disulfiram por lo que
está contraindicado el consumo de
alcohol
(Goodman & Gildman, 1994). Las reacciones tipo Disulfiram
están relacionadas con la inhibición no competitiva
de la alcohol dehidrogenasa hepática, otros autores creen
que es mediado por el sistema nervioso
central (SNC) (Vázquez et al., 2001).
El Metronidazol es carcinogénico en roedores
después de dosis altas y prolongadas, también es
mutagénico para bacterias. Mas aún, la actividad
mutagénica está asociada con el principio activo y
con varios de sus metabolitos, los que se encuentran en la orina
de pacientes tratados con
dosis terapéuticas. Este medicamento atraviesa la placenta
y también se detecta en leche materna
a concentraciones equivalentes a las del suero (Goodman LS &
Gildman, 1994). De ahí la preocupación de su uso
sistémico en mujeres con T. vaginalis y particularmente
está contraindicado en embarazadas, máxime en el
primer trimestre.
- Resistencia al Metronidazol
El estudio de las cepas de laboratorio
resistentes, ha mostrado cuáles son los mecanismos de esta
resistencia que dependen de uno o más de los factores
siguientes:
1. Una actividad enzimática de PFO reducida
(Kulda, Vojtechowská, Tachezy, Demed & Kunzová,
1982).
2. Una conformación alterada del hidrogenosoma
(Townson, Boreham, Upcroft &, Upcroft, 1994).
3. Ferrodoxina con un potencial redox excepcional
(Yarlett N, Yarlett NC & Lloyd, 1985).
4. Una cantidad reducida de ferredoxina intracelular
(Meri, Jokiranta, & Suhonen, 2000)
En T. vaginalis sensibles, 2/3 del piruvato se oxidan en
el hidrogenosoma a acetato y 1/3 en el citosol a lactato y a
etanol en menor cantidad. En parásitos resistentes decrece
la oxidación en el hidrogenosoma y el 97% del piruvato es
oxidado a lactato en el citosol, esto significa que la
acción de estos compuestos es inhibida. En las cepas
resistentes las cantidades intracelulares están decrecidas
en un 50% y el nivel de transcripción del gen de
ferredoxina está reducido en un 40%-65% comparado con las
cepas sensibles (Vázquez et al., 2001).
En parásitos altamente resistentes al
Metronidazol no existe la enzima PFO. Se han encontrado
oxidorreductasas oxoacídicas alternativas que no reducen
aparentemente las ferrodoxinas ya caracterizadas y que son al
menos tan activas o más en líneas resistentes al
Metronidazol que en las cepas parentales sensibles. Estas
vías alternativas en estos protozoos se entienden
pobremente y puedan ser muy bien las dianas de los
5-nitroimidazoles altamente activos o
compuestos relacionados (Uprcroft, Campbell, Benakli, Upcroft
& Vanelle, 1999).
La dependencia de la manifestación de resistencia
con la presencia de oxígeno
fue confirmada por ensayo de
susceptibilidad llevada a cabo con una mezcla de gases
definidos de distinta concentración de oxígeno
(1-20%). Concentraciones de 5% de oxígeno mostró
ser el umbral requerido para la manifestación de
resistencia y los valores de
CLM aumentaron con el incremento de la concentración de
oxígeno (Kulda, Tachezy & Cerkasovova,
1993).
Kulda (1999) refiere que si bien la resistencia no es un
problema alarmante puede ser preocupante, ya que todos los
fármacos disponibles para su tratamiento son derivados
5-nitroimidazoles con el mismo mecanismo de acción, por lo
que se debería mantener bajo vigilancia este problema para
estimar su importancia clínica; además, evidencias
recientes apuntan a que la infección por T. vaginalis
puede incrementar el riesgo de transmisión del virus de la
inmunodeficiencia humana (VIH), lo que hará más
importante las pruebas de
sensibilidad en zonas geográficas donde las infecciones
son frecuentes y poco controladas como África (Sorvillo
& Kerndt, 1998).
- Opciones terapéuticas.
Actualmente existen pocas opciones terapéuticas
en estos pacientes cuando hay resistencias o
efectos secundarios al Metronidazol (Vázquez et al.,
2001).
Ornidazol: Se administra oralmente 4 comprimidos de
500 mg en una sola dosis para la infección aguda
ó 2 comprimidos diarios durante 5 días en las
formas crónicas (Botero & Restrepo,
1992).
Tinidazol: Se utiliza la dosis única de 4
comprimidos de 500 mg (Botero & Restrepo, 1992). Tiene un
grupo sulfona y se diferencia del Metronidazol por su mayor
solubilidad lipídica por lo que penetra más en
el líquido cefalorraquídeo (LCR) (80% frente a
42%), rápido inhibidor del ADN y mayor actividad in
vitro quizás debido a que difunde más
rápidamente en el interior de la célula. En la
clínica ambos compuestos tienen la misma actividad
frente a T. vaginalis (Vázquez et al.,
2001).
Secnidazol: Se aplica dosis única de 4
comprimidos de 500 mg, preferiblemente con comida (Botero
& Restrepo, 1992)
Policresuleno: Existe en el mercado en
diferentes formas farmacéuticas; como solución
al 1% se debe aplicar una ducha vaginal diaria durante siete
días. En forma de gel al 1.78 % se aplica una carga de
gel intravaginal todos los días antes de acostarse, al
igual que en el caso de los óvulos que contienen 0.09
mg de principio activo. Restablece y mantiene el pH
ácido de la cavidad vaginal, por sus propiedades
químicas, estimula el crecimiento del bacilo de
Döderlein, restituye la barrera fisiológica de
defensa y evita la proliferación de cándidas,
trichomonas o bacterias (Rosenstein, 1996).
Hemezol: En los casos de vaginitis y/o uretritis por
T. vaginalis o Gardnerella sp. se recomienda administrar de 1.5
-2g diarios durante siete días; ya sea en forma de
tabletas vía oral o inyectable, por vía
intramuscular o intravenosa (Rosenstein, 1996).
Fosfato de Clindamicina: Muy útil en el caso de
vaginosis bacteriana y vaginosis anaeróbica para lo cual
se dispone 40 mg del fármaco en un tubo y de siete
aplicadores desechables con capacidad para 5 g. El tratamiento
consiste en vaciar un aplicador lleno antes de acostarse
durante una semana (Rosenstein, 1996).
Nifuratel con Nistatina: Esta combinación
formulada en crema tiene acción trichomonicida,
bactericida y antimicótica. Se recomienda aplicar la
crema mediante el aplicador (8 g) en el interior de la vagina,
por la mañana y por la noche, durante 7 a 10
días. Está contraindicado en pacientes
hipersensibles a los componentes y en el alcoholismo
(Rosenstein, 1996).
Cotrimoxazol: Es trichomonicida in vitro
después de 48 horas con 100 mg/mL Waitz, Moss &
Weinstein, 1971). Se usa en forma de tabletas de 100mg (2
tabletas) diarias al acostarse durante 7 días con curas
entre el 48%-66% si se determina su eficacia por
cultivo (Schnell,1974). Experiencias sin publicar encuentran
menos de un 25% de curación y en un estudio más
reciente la curación sólo fue del 11% (Krieger
& Alderete, 1999). El papel del cotrimoxazol en el
tratamiento de la trichomonosis estaría reservado a
liberar los síntomas en el primer trimestre del embarazo
cuando no es posible usar Metronidazol (Vázquez et al.,
2001).
Furazolidona: La experiencia en su uso es corta pero
se ha aplicado en forma de 100 mg en 5 gramos de crema
intravaginal (Vázquez et al., 2001).
Paromomicina: Se usan cápsulas de sulfato de
paromomicina que se abren y el polvo es unido a una base de
crema hidrofílica a una dosis de 250 mg de paromomicina
por aplicador de 4 gramos. Se usa en una aplicación por
la noche durante 2 semanas (Nyirjesy, Sobel, Weitz, Leaman
& Gelone, 1998). El principal problema de la paromomicina
son las reacciones adversas en forma de ulceraciones vaginales
que suelen curar espontáneamente.
Sales de zinc: Gombosová, Demes & Valent
(1986) han informado de la muerte de
T. vaginalis por sales de zinc a concentraciones
fisiológicas. Vázquez et al. (2001) sugieren que
el zinc presente en el plasma seminal que pasa a través
de la uretra anterior puede ser importante en la
resolución espontánea de la uretritis
trichomonósica.
Espermicidas: Antonelli, Dile & Wright (1999) en
un estudio prospectivo se ha comparado la utilización de
2 g de Metronidazol con una curación del 93,3% frente al
nonoxinol-9 intravaginal con una curación del 15,4%, por
lo que no parece ser útil en el tratamiento de la
trichomonosis. El D-propanolol puede ser útil como
espermicida tópico y tiene actividad antitrichomonicida
in vitro (Farthing, Inge & Pearson, 1987) aunque no se ha
evaluado en ensayos
clínicos (Vázquez et al., 2001).
Vacunación con Lactobacillus acidophilus
inactivado: Se ha utilizado una vacuna (Gynatren;Cabot, Bukcs,
UK) en tres pacientes basada en "lactobacilos aberrantes"
muertos que se aislaron de mujeres con trichomonosis. La pauta
usada de la vacuna Solco-Trichovac de L. acidophilus fue de 3
inyecciones (0,5 mL)/IM cada 2 semanas. La curación
según algunos autores era del 84%-100%; pero otros no
han obtenido tan buenos resultados y parece tener un efecto
inmune no específico (Bonilla, Sánchez, Pellicer,
Guevara & Ziegler, 1983; Milovanovic, Crcic &
Stojkovic, 1983). Se creía que estas bacterias
compartían numerosos epítopes con T. vaginalis
por lo que el antisuero generado contra L. acidophilus
tenían inmunoprotección con la superficie del
parásito, estudios posteriores no lo mostraron
(Alderete, 1988; Gombosová et al., 1986). Debido a estos
problemas y
no haberse evaluado bien no se puede recomendar actualmente
esta vacuna (Krieger & Alderete, 1999).
Duchas de povidona yodada: Hay poca experiencia sobre
su utilidad; pero
debe evitarse en el embarazo debido a los niveles de yodo que
alcanza en suero y que pueden suprimir el desarrollo del
tiroides fetal (Wong, Wilson & Chew, 1990).
Sulfanilamida, hidroclorhidro de aminacrina y
alantoína: Se han empleado supositorios vaginales con
1,05 g de sulfanilamida, 14 mg de hidroclorhidro aminacrina y
140 mg de alantoina dos veces al día durante 7
días. Actualmente estos supositorios sólo
contienen la sulfanilamida pero el nivel de curación
únicamente llega al 18,6% (Rosenstein, 1986).
Nitazoxanida: Es un nuevo fármaco
antiparasitario de amplio espectro efectivo frente a un amplio
rango de protozoos, nematodos, cestodos y tremátodos,y
se ha usado para el tratamiento de criptosporidiosis y
Enterocytozoon bieneusi en pacientes con SIDA. Se está
ensayando en el tratamiento de trichomonosis (Bicart, Massip,
Linas & Datry, 2000; Mead, Eschenbanch, & Sobel, 1999;
Rossignol, Hidalgo, Feregrino, Higuera, Gómez, et al.,
1998).
Se han utilizado además la Cloroquina, Atebrina,
Acetarsona. Entre los antibióticos usados se encuentran la
Terramicina y Aureomicina.
Alderete et al. (2002) opina que la profilaxis se busca
en la higiene personal, en el
diagnóstico y tratamiento de parejas, y en medidas
preventivas generales contra las enfermedades
venéreas.
En la actualidad se han sintetizado nuevas
moléculas imidazólicas mono y bi-aciladas y
también compuestos láctamicos sustituídos
con cadenas laterales más hidrofóbicas que el
Metronidazol, lo que puede justificar que presenten una actividad
de hasta 50 veces superior (Upcroft et al., 1999), ya que el
lugar de activación del Metronidazol está
localizado en la membrana del protozoo donde se encuentra la
vía de transporte de electrones (Townson et al., 1994,
1996). Aún está por comprobar in vivo si este
incremento de hidrofobicidad potencia la
actividad de estos fármacos (Upcroft et al., 1999) y
también se ha visto resistencia cruzada entre
nitroimidazoles en T. vaginalis (Boreham, Smith & Shepherd,
1998; Upcroft JA & Upcroft P, 1993).
La trichomonosis tiene una distribución geográfica mundial. En
el adulto la infección se adquiere casi exclusivamente por
contacto sexual, pero ciertas infecciones no pueden explicarse de
esta forma. Algunos casos han sido resultado de
transmisión de la infección de mujer a mujer debido
al uso común de duchas vaginales, asientos de inodoros
contaminados o por vestimentas muy contaminadas.
Se plantea que el microorganismo puede sobrevivir 90
min. en una esponja húmeda, de 1 a 2 días en orina
estancada, varias horas en la secreción genital y en
toallas húmedas o ropa. La infección neonatal se ha
reportado hasta en un 5% de los niños
que nacen de madres infectadas. No obstante se considera que la
adquisición no venérea de T. vaginalis es rara y es
evidente que el mayor número de casos de trichomonosis
observados se debe a transmisión sexual. Es común
la infección simultánea con otras ITS, por lo
tanto, es imperativo que los pacientes con trichomonosis sean
evaluados para determinar la presencia de las mismas (Rein, 1995;
Wolfang et al., 1983).
La OMS ha estimado que 120-180 millones de personas se
infectan anualmente en el mundo.
En EEUU se infectan cada año un estimado de 5-8
millones de personas y de ellos un 50 % de casos son
asintomáticos (Hook, 1999; Petrin et al.,
1998).
En Nigeria el 37 % de las estudiantes femeninas de un
Instituto de educación
Superior, fue reportado recientemente con trichomonosis, lo
cual fue comparable con los datos de los
estudios en América
(Upcroft P &
Upcroft JA, 2001).
En la zona rural de Sudáfrica, el 65 % de las
mujeres embarazadas atendidas en consultas prenatales
padecían trichomonosis en el año 1981, en estudios
más recientes esta cifra oscila sobre el 41 %
(Wilkinson et al., 1999).
En México se
desconoce la magnitud relativa de la infección. Se ha
mencionado en años recientes un índice de 131.0 por
100 000 habitantes. La validez de los datos sobre la
distribución geográfica de la parasitosis es
relativa; se admite, sin embargo, que la frecuencia es mayor en
las fronteras, zonas turísticas y D.F (Alderete et al.,
2002).
Sagua et al. (1999) en Chile se han realizado numerosos
estudios para conocer aspectos
clínicos,epidemiológicos y del diagnóstico
de la tricomoniasis urogenital, estableciéndose una
prevalencia de 12,0 % en mujeres entre 30 y 50
años.
En la actualidad, el problema de control de la
enfermedad consiste en lograr el tratamiento simultáneo de
la pareja (o todos los involucrados), y programas de
educación
en la salud (Alderete
et al., 2002).
Antecedentes de
ensayos in vitro
En la actualidad se reporta el uso de diferentes
medios para el
cultivo de T. vaginalis, siendo el medio de Diamond TYI-S-33 uno
de los más usados (Diamond & Cunnick, 1991; Diamond, 1957;
Kostara, Carageorgiou, Varonos & Tzannetis, 1998). Este, además de
utilizarse para lograr aislamientos con fines
diagnósticos, se ha empleado con buenos resultados para
realizar ensayos in vitro de susceptibilidad a diversas drogas
(Kaneda, Torii, Tanaka & Aikawa, 1991). T. vaginalis posee una
temperatura
óptima de incubación de 37°C. Se conoce que el
crecimiento y supervivencia del microorganismo en el medio de
cultivo dependen del pH y densidad del
inóculo, además de ser determinante la
disponibilidad de nutrientes, con un límite de
supervivencia de aproximadamente 144 horas, siempre que no se le
añada medio fresco. Es importante señalar que el
microorganismo no debe permanecer suspendido en solución
salina fisiológica por más de 150 minutos, pues
esto produce un efecto progresivamente letal sobre el mismo
(Lapage,1975). En particular el suero es esencial para el
crecimiento de T. vaginalis pues la provee de lípidos,
ácidos grasos, aminoácidos y trazas de metales. El
hierro es también requerido para mantener niveles altos de
actividad de PFO (Petrin et al., 1998).
Según Escario et al. (1986) la
Concentración Inhibitoria Mínima (CIM) y la
Concentración Letal Mínima (CLM) son dos
índices básicos que se consideran para evaluar la
actividad in vitro de principios
activos contra bacterias y parásitos. Para ambas
determinaciones se estudia el efecto de la exposición
de los microorganismos a diferentes concentraciones de la
sustancia en un medio de cultivo óptimo para su
crecimiento. La CIM es la mínima concentración que
inhibe el crecimiento celular en un 100 % con relación a
un cultivo control no tratado. Por otro lado, la CLM es la
mínima concentración evaluada en la que no se
observan organismos viables después de 24 a 48 h de
incubación.
Andrews, Mylvaganam & Yule (1994) han determinado la
susceptibilidad de cepas de T. vaginalis resistentes y
susceptibles al Metronidazol frente a la bacitracina así
como a sales de bacitracina y zinc. La CLM fue definida como la
menor concentración de la droga en la
que se observaron cambios morfológicos y ausencia de
motilidad en los parásitos después de 24 horas de
exposición a la droga, obteniéndose un aumento de
la CLM para los compuestos mencionados en aquellas cepas
resistentes al Metronidazol.
Kaneda et al. (1991) han determinado el efecto in vitro
del sulfato de berberina sobre T.vaginalis en un rango de
concentraciones entre 0.01 – 1 mg/mL observándose efecto
solamente sobre los parásitos, en los grupos tratados con
1 mg/mL.
Mahmoud (2002) también determinó el efecto
de concentraciones de 10, 15, 30 y 60 µ/mol de deferoxamina
(DFO), un quelato del hierro clínicamente aprobado, en la
viabilidad y multiplicación de T. vaginalis en un cultivo
axénico con medio TYM. Se realizaron las determinaciones
con intervalos de 24 h. DFO mostró efecto letal sobre el
parásito con la concentración de 3 µ/mol
después de 48 h de incubación con la droga. Se
registró un potente efecto inhibitorio de la viabilidad y
multiplicación del parásito dependiente de la
concentración de la droga y el tiempo de
exposición. Es discutido el posible mecanismo de
acción del DFO contra T. vaginalis y su posible uso en el
tratamiento de la trichomonosis.
Antecedentes de ensayos in vivo
En la actualidad se han realizado muchos estudios para
utilizar modelos
animales en los experimentos con
T.vaginalis in vivo, lo que posibilita un mayor conocimiento y
comprensión de los mecanismos por los que transcurre la
infección. Hasta el momento, la mayor dificultad
está en la gran diferencia que existe entre la flora
vaginal de estos animales y la de la mujer así como las
variaciones que se producen durante el ciclo
menstrual femenino; proceso en el cual el microorganismo es
sometido a toda una serie de cambios producto de la
regulación hormonal, lo que sin dudas ejerce una
influencia decisiva en el establecimiento y desarrollo de la
infección (Andrews et al., 1994).
Se han realizado varios intentos para establecer la
infección de T. vaginalis con monos (Gardner et al.,
1987;Street, Taylor
& Hetherington
1983), curieles (Kazanowska, Kuczynska & Skrzypiec, 1983), hámsteres,
ratas (Honigberg, 1978; Jirovec & Petru, 1968), ratones (Cappuccinelli,
Lattes, Cagliani &
Ponzi, 1974; McGrory T & Garber, 1992; Meysick CK
& Garber, 1992) y
vacas (Cappuccinelli, 1974). Intentos anteriores para establecer
el crecimiento intravaginal demostraron que el tratamiento previo
de los animales con estrógenos es esencial para lograr la
infección (McGrory T & Garber, 1992; Meysick CK
& Garber, 1992).
Cuando se administró a las ratas diariamente estradiol
durante 3 días antes del sacrificio se obtuvo como
resultado que existe un incremento significativo de anticuerpos
IgA e IgG contra eritrocitos de carnero en las secreciones
uterinas mientras que hay una disminución en las
secreciones vaginales (Wira & Sandoe, 1987). En ratones hembras Balb/c
se utilizaron dosis de 0.05 µg/mL de Delestrogen (valerato
de estradiol 10 mg/mL) en inyección subcutánea, dos
días previos a la inoculación intravaginal con 5 X
105 mL de T. vaginalis en fase logarítmica
suspendidas en medio TYI-S-33 suplementado con 10% de suero y 33%
de agar (Meysick CK & Garber, 1992). Sin embargo ratones en
estado metaestro previo a la inoculación presentaron una
corta duración de la infección pues hay una intensa
flora y neutrófilos presentes, lo cual puede proteger
contra T. vaginalis (Wira & Sandoe, 1987). También se ha
utilizado una dosis de estradiol una semana previo a la
inoculación (McGrory T & Garber, 1992).
El predominio de L. acidophilus, especies
anaeróbicas y pH vaginal ácido en mujeres
prevé ser diferente al desarrollo microbiano en ratones
Balb/c los cuales presentan un porcentaje pequeño de L.
acidophilus, especies anaeróbicas y un pH neutro
(Wira &
Sandoe, 1987). Los rasgos de la interacción
parásito-hospedero en el ratón difieren
considerablemente de la infección en el tracto
genitourinario del humano; sin embargo estudios en otros animales
muestran la misma discrepancia.
En la trichomonosis crónica latente en la mujer
hay una gran reducción o una pérdida total de la
población de L. acidophilus. En un intento para manipular
los ratones a la paralela situación encontrada en la mujer
se establecieron L. acidophilus en la vagina de ratones Balb/c,
previo a la inoculación con T. vaginalis. Rangos de
infección en este grupo fueron comparados con un grupo
control de ratones quienes no fueron tratados con L. acidophilus
previo a la infección con T. vaginalis. Ambos grupos
fueron estrogenizados previamente y examinados por lavado vaginal
para establecer el estado del estro en el momento de la
inoculación. Los ratones preinoculados con L. acidophilus
mostraron estadísticamente un aumento significativo en la
duración de la infección con T. vaginalis comparado
con los ratones controles (McGrory T & Garber, 1992).
- Alderete, J. F. (1987). Trichomonas vaginalis NYH286
Phenotipic variation may be coordinated for a repertoire of
trichomonads surface immunogens. Infect Immun, 55,
1957-1962. - Alderete, J. F. (1988). Does lactobacilli vaccines
for trichomoniasis, Solco-Trichovac, induce antibody reactive
with Trichomonas vaginalis. Genitourin Med, 64,
118-123. - Alderete, J. F. (1988). Altrenating phenotypic
expressionof two classes of Trichomonas vaginalis surface
markers. Rev Infect Dis,10, 408-412. - Alderete, J. F., Arroyo, R., Dailey, D. C., Engbring,
J., Koshnan, M. A. & Lenker, M. W. (1992). Molecular analysis
of Trichomonas vaginalis surface protein repertoires. Mol Cell
Biol Hum Dis, 1, 173-202. - Alderete, F., Lehker, W. & Arroyo, R. (1995). The mechanisms
and molecules involved in cytoadherence and pathogenesis of
Trichomonas vaginalis. Parasitology Today,11(2),
70-4. - Alderete, J. F., O'Brien, J. L., Arroyo, R.,
Engbring, J. A., Musatovova, O., López O, et al. (1995).
Cloning and Molecular Characterization of Two AP65 Genes and
Adhesin Proteins Involved in Trichomonas vaginalis
Cytoadherence. Molec Microbiol, 17, 69. - Alderete, J. F., Provenzano, D. & Lenker, W. (1995). Iron
mediates Trichomonas vaginalis resístanse to complement
lysis. Microb Pathol,19, 93-103. - Alderete, J. F., Benchimolb, M., Lehkera, M.
W. &
Croucha, M. L. (2002). Mini review The complex
fibronectin–Trichomonas vaginalis interactions and
Trichomonosis [Versión eléctrónica].
Parasitol Int, 51, 285-292. - Alvarez, M. E., Avila, L. G., Becerril, C. G.,
Fattel, L. V., Ortega, J. L. & Arroyo, R. (2000). A novel
cysteine proteinase (CP65) of Trichomonas vaginalis involved in
cytotoxicity. Microb Path, 28, 193-202. - Andrews, J., Mylvaganam, H. & Yule, A. (1994).
Sensitivity of Trichomonas vaginalis, Trichomonas foetus and
Giardia intestinalis to bacitracin and its zinc salt in vitro.
R Soc Trop Med Hyg, 88, 704-6. - Antonelli, N. M., Diehl, S. J., Wright, J. W. (1999).
Intravaginal nonoxynol-9 versus oral metronidazole in the
treatment of trichomoniasis. Obstet Gynecol, Suplemento
4. - Arroyo, R., Engbring, J. & Alderete, J. F. (1992). Molecular
basis of host epithelial cell recognition by Trichomonas
vaginalis. Molec Microbiol, 6, 853. - Arroyo, R., González, R. A., Martínez,
P. A. &
Alderete, J. F. (1993). Signalling of Trichomonas
vaginalis for amoeboid transformation and adhesion synthesis
follows cytoadherence. Mol Microbiol, 7, 299-309. - Arroyo, R. & Alderete, J. F. (1995).Two Trichomonas
vaginalis Surface Proteinases Bind to Host Epithelial Cells and
are Related to Levels of Cytoadherence and Cytotoxicity. Arch
Med Res, 26, 279. - Bastos, M. F. & Benchimol, M. (1998). Observation of
membrane fusion on the interaction of Trichomonas vaginalis
with human vaginal epithelial cells. Parasitol Res, 84,
213-220. - Beach, D. H., Holz, G. G., Singh, B. N.
& Lindmark, D. G.
(1990). Fatty acid and sterol metabolism of cultured
Trichomonas vaginalis and Trichomonas foetus. Mol Biochem
Parasitol, 38, 175-190. - Beach, D. H, Holz, G. G., Singh, B. N, Lindmark, D.
G. (1991). Phospholipid metabolism of cultured Trichomonas
vaginalis and Trichomonas foetus. Mol Biochem Parasitol, 44,
97-108. - Bicart, A. S., Massip, P., Linas, M. D.
& Datry, A.
(2000). Successful treatment with nitazoxanide of
Enterocytozoon bieneusi microsporidiosis in a patient with
AIDS. Antimicrob Agents Chemother, 44, 167-168. - Bonilla, F. M., Sánchez, J. M., Pellices, A.,
Guevara, F. &
Ziegler, W. J. (1983). A vaccine against vaginal
trichomoniasis in humans. A temporary solution of the problem?.
Obstet Ginecol, 43, 777-789. - Boreham, P. F., Smith, N. C. & Shepherd, R. W. (1998).
Drug resistance and the treatment of giardiasis. En P.
Wallis &
B. Hammond (Eds.), Advances in Giardia research (pp. 201-
210). Canadá: University of Calgary Press,
Alberta. - Botero, D. & Restrepo, M. (1992). Parasitosis Humana.
(2a ed.). Colombia:
Medellín. - Brown, D. M., Upcroft, J. A., Edwards, M. R.
& Upcroft, P.
(1998). Anaerobic bacterial metabolism in the ancient eukaryote
Giardia duodenalis. Int J Parasitol, 28, 149-164. - Cann, J. S. (1974). Comparison of direct
microscopyand culturein the diagnosis of trichomoniasis. J
Vener Dis, 50, 450-452. - Cappuccinelli, P., Lattes, C., Cagliani, I.
& Ponzi, A. N.
(1974). Features of intravaginal Trichomonas vaginalis
infection in the mouse and
the effect of estrogen treatment and immunodepression. G
Batteriol Virol Immunol, 67, 31-40. - Cavalier, S. T. (1987). Eukariotes with no
mitochondria. Nature, 326, 332-333. - Costamagna, S. R. & Figueroa, M. P. (2001). On the
ultraestructure of Trichomonas vaginalis: cytoskeleton,
endocytosis and hidrogenosomes. Parasitología al
Día, 25(3), 100-108. - Dailey, D. C. & Alderete, J. F. (1991). The
Phenotypically variable surface surface protein of Trichomonas
vaginalis has a single, tandemly repeatad immunodominant
epitope. Infect Immun, 59, 2083-2088. - Diamond, L. (1957). The establishment of various
Trichomonads of animals and man in axenic cultures. J
Parasitol, 43, 488-90. - Diamond, L. & Cunnick, C. A. (1991). Serum-free,
Partly Defined Medium PDM-805 for axenic cultivation of
Entamoeba histolytica Schaudinn, 1903 and other Entomoeba. J
Protozool, 38(3), 211-6. - Drmota, T. (1997). Karyotype of Trichomonas
vaginalis. Eur J Protistol, 33, 131-135. - Edwards, D. I. (1993). Nitroimidazole drugs-action
and resistance mechanisms. I. Mechanisms of action. J
Antimicrob Chemothe, 31, 9-20. - Escario, A., Guillen, L., Martínez, R. &
Contreras, M. (1986). A new method for the in vitro screening
of Trichomonacides. Acta Universitatis Carolinae-Biologica, 30,
557-62. - Engbring, J. A. & Alderete, J. F. (1998).
Characterization of Trichomonas vaginalis AP33 adhesin and cell
surface interactive domains. Microbiol, 144,
3011-8. - Farthing, M. J., Inge, P. M. & Pearson, R. M.
(1987). Effect of D-propanolol on growth and motility of
flagellate protozoa. J Antimicrob Chemother, 20,
519-522. - Gardner, A., Culberson, E., Scimeca, M., Brady, G.,
Pindak, F. & Abee, R. (1987). Experimental genital
trichomoniasis in the squirrel monkeys (Saimiri sciureus).
Genitourin Med, 63, 188-91. - Gombosová, A., Demes, P. & Valent, M.
(1986). Immunotherapeutic effect of the lactobacillus
vaccine, Solco-Trichvac, in trichomoniasis is not mediated by
antibodies cross reacting with Trichomonas vaginalis.
Genitourin Med, 62, 107-110. - González, A. R., Lázaro, M. H.,
Espinosa, F. C., Anaya, V. & Martínez, A. P. (1995).
Trichomonas vaginalis: Ultrastructural bases of the cytopathic
effect. J Euk Microbiol, 42, 641-651. Extraído el 8 de
julio 2002, - Goodman, L. S. & Gildman, A. (1994). Las Bases
Farmacológicas de la Terapéutic. (3a
ed.). Ciudad de La Habana: Ed Revolucionaria. - Gunderson, J. G., Hinkle, D. L., Morrison, H. G.,
Stickel, D. A., Odelson, T. A, Nerad, M., et al. (1995).
Phylogeny of trichomonads inferred from small-subunit rRNA
sequences. J Eukaryot Microbiol, 42, 411-415. - Honigberg, B. M. (1978). Trichomonas of importance in
human medicine. En J. P. Kreir (Ed.), Parasitic protozoa. (pp.
275-454). New York, NY: Academic Press. - Hook, E. W. (1999). Trichomonas
vaginalis no longer a minor STD. Sex Transm Dis, 26,
288-389. - Hoosen, A. A., Ross, S. M., Mulla, M. J.
& Patel, M. (1981). The incidence of selected
vaginal infections among pregnant urban blacks. J S Afr Med,
59, 827-829. - Jirovec, O. & Petru, M. (1968). Trichomonas
vaginalis and Trichomoniasis. Adv Parasito,;6,
117-88. - Krieger, J. N. & Alderete, J. F. (1999).
Trichomonas vaginalis and trichomoniasis. En K. Holmes, P.
Sparling, P. Mardh, S. Lemon, W. Stamm, P. Piot, J. Wasserhelt
(Eds.). Sexually Transmitted Diseases (pp. 587-604). New York:
McGraw-Hill. - Kulda, J., Vojtechowská, M., Tachezy, J.,
Demed, P., Kunzová, E. (1982). Metronidazole resistance
of Trichomonas vaginalis as a cause of treatment failure in
trichomoniasis. J Vener Dis, 58, 394-399. - Kulda, J., Tachezy, J. & Cerkasovova A. (1993).
In vitro induced anaerobic resistance to metronidazole in
Trichomonas vaginalis. J Euk Microbiol, 40, 262-9. - Kulda, J. (1999). Trichomonads, hidrogenosomes and
drug resistance. Int J Parasitol, 29, 199-212. - Lapage, G. (1975). Parasitología Veterinaria
(3a ed.) México DF: Compañía
Editorial Continental, SA. - Llop, A. H, Valdes-Dapena, A. V. & Zuazo, J. L.
S. (2001). Trichomonas spp. En L. Rojas (Ed.), Microbiología y Parasitología
Médicas (pp. 39-43). Ciudad de La Habana: Editorial
Ciencias
Médicas. - Müller, M. (1993). The hydrogenosome. J Gen
Microbiol, 139, 2879-89. - Müller, M. (1998). Enzymes and compartmentation
of core energy metabolism of anaerobic protists a especial case
in the eukaryotic evolution. En G. Coombs, K. Vickerman, M.
Sleigh, A. Warren (Eds.), Evolutionary relationship among
protozoa (pp.108-132). London: Chapman and hall. - Mihaghani, A. & Warton, A. (1998). Involvement of
Trichomonas vaginalis surface – associated
Glycoconjugates in the parasite/target cell interaction. A
quantitative electron microscopy study. Parasitol Res, 84,
374-81. - Mendoza, M. R., Becerril, C. G., Fattel, L. V.,
Avila, L. G., Ruiz, M. E., Ortega J. L, et al (2000).
CP30: A Cysteine Proteinase Involved in Trichomonas vaginalis
Cytoadherence. Infect Immun, 68, 4907-4912. - Martin, R. D., Kaufman, R. H. & Burns, M. (1963).
Trichomonas vaginalis: a statistical evaluation of diagnostic
methods. Am J Obstet Gynecol, 87, 1024-1027. - Müller, M. (1983). Mode of action of
metronidazole an anaerobic bacteria and protozoa. Surgery, 993,
165-171. - Meri, T., Jokiranta, T. S., Suhonen,
L. & Meri, S. (2000). Resistance of Trichomonas
vaginalis to metronidazole: Report of the first three cases
from Finland and optimization of in vitro susceptibility
testing under various oxygen concentrations. J Clin Microbiol,
38, 763-767. - Milovanovic, R., Crcic, R. & Stojkovic, L.
(1983). Serological study with Solco-Trichovac, a vaccine
against Trichomonas vaginalis infection in women. Gynakol
Rundsch, 23, 39-45. - Mahmoud, M. S. (2002). Effect of the iron
chelator deferoxamine on Trichomonas vaginalis in vitro. J
Egypt Soc Parasitol, 32, 691-704. - Mead, P. B., Eschenbanch, D. A. & Sobel, J. D.
(1999). Update on managemente of vaginitis. Contemporary
OB/GYN, 44, 26-47. - McGrory, T. & Garber, E. (1992). Mouse
intravaginal infection with Trichomonas vaginalis and role of
Lactobacillus acidophilus in sustaining infection. Infect
Immun, 60, 2375-9. - Meysick, C. K. & Garber, E. (1992). Interactions
between Trichomonas vaginalis and vaginal flora in a mouse
model. J Parasitol, 78 (1), 157-60. - Mathews, H. M. & Healy, G. R. (1983). Evaluation
of two serological test for
Trichomonas vaginalis infection. J Clin Microbio, 17,
840-843. - Nyirjesy, P., Sobel, J. D., Weitz, M. V., Leaman, D.
J., Gelone, S. P. (1998). Difficult-to-treat trichomoniasis:
Results with paromomycin cream. Clin Infect Dis, 26,
968-988. - Provenzano, D. & Alderete, J. F. (1995). Análisis of human
immunoglobulin-degrading cysteine proteinases of Trichomonas
vaginalis. Infect Immun, 63, 3388-3395. - Petrin, D., Delgaty, K., Bhatt, R. & Garber, G.
(1998). Clinical and Microbiological Aspects of Trichomonas
vaginalis. Clin Microbiol Rev,1, 300-317. - Rein, M. F. (1995). Trichomoniasis. En R. Goldsmith,
D (Eds.), Parasitología y Medicina Tropical.
Santafé de Bogotá: El Manual
Moderno. - Robbie, M. O. & Sweet, R. L. (1983).
Metronidazole use in obstetrics and gynecology: A review. Am J
Obstet Gynecol, 145, 865-881. - Rosenstein, E. (1996). Diccionario
de Especialidades Farmacéuticas. (42 ed.). México
DF: PLM, S.A. - Roin, A. D. Tricomoniasis (Trichomoniasis). (2001,
Abril 12). Clinical Reference Systems.
Artículo2. Extraído el 6 Julio, 2003, de:
URL:http://www.personalmd.com/healthtopics/spa/trichomo.htm - Rasmussen, S. E., Nielsen, M. H., Lind, I. &
Rhodes, J. M. (1986). Morphological studies of the cytotoxicity
of Trichomonas vaginalis to normal human vaginal epithelial
cells in vitro. Genitourin Med, 62, 240-246. - Rossignol, J. F., Hidalgo, H., Feregrino, M.,
Higuera, F., Gomez, W. H., Romero, J. L., et al. (1998). A
double-blind placebo controlled study of nitazoxanide in the
treatment of cryptosporidial diarrhea in AIDS patients. Transc
R Soc Trop Med Hyg, 92, 663-666. - Sagua, H., Chiang, V., Varela, H., Neira, I.,
Bugueno, M., Contreras, C., et al. (1999). Tricomonosis en
adolescentes embarazadas de antofagasta, chile. Parasitol
día, 23(1), 9-14. - Sorvillo, F. & Kerndt, P. (1998). Trichomonas
vaginalis and amplification of HIV- 1 transmission. Lancet,
351, 213-214. - Schnell, J. D. (1974). The incidence of vaginal
candida and trichomonas infections and treatment of Trichomonas
vaginalis with clotrimozale. Postgrad Med J, 50,
79S-81S. - Street, A., Taylor, D. & Hetherington, M. (1983).
Infection of female squirrel monkeys (Saimiri sciureus) with
Trichomonas vaginalis as a model of trichomoniasis in women. Br
J Vener Dis, 59, 249-54. - Sibau, L., Bebb, D., Proctor, E. M. & Bowie, W.
R. (1987). Enzyme-linked immunosorbentassay for the diagnosis
of trichomoniasis in women. Sex Transm Dis,14,
216-220. - Townson, S. M., Upcroft, J. A. & Upcroft, P.
(1996). Characterization and purification of pyruvate:
ferredoxin oxidoreductase from Giardia duodenalis. Mol Biochem
Parasitol, 79, 183-193. - Townson, S. M., Boreham, P. F., Upcroft, P. &
Upcroft, J. A. (1994). Resistance to the nitroheterocyclic
drugs. Acta Trop, 56, 173-194. - Thompsom, P. L. M. (2003). Diccionario de
Especialidades Farmacéuticas (49 ed.). México:
Thompsom PLM. - Teras, J., Nigesen, U., Jaakmees, H., Roigas, E.
& Tompel, H. (1966). The agglutinogenic properties of
Trichomonas vaginalis in human organism. Wiad Parazytol,12,
370-377. - Upcroft, P. & Upcroft, J. A. (1999). Organization
and structure of the Giardia genome. Protist,150,
17-23. - Upcroft, P. & Upcroft, A. J.
(2001). Drug Targets and Mechanisms of Resistance in
the Anaerobic Protozoa. Clin Microbiol Rev, 14(1),
150-164. - Upcroft, A. J. & Upcroft, P.
(1993). Drug resistance and Giardia. Parasitol Today, 4,
187-190. - Upcroft, A. J., Campbell, R. A.,
Benakli, K., Upcroft, P. & Vanelle, P. (1999). Efficacy of
new 5-nitroimidazoles against metronidazole-susceptible
and–resistant Giardia, Trichomonas, and Entamoeba spp.
Antimicrob Agents Chemother, 43, 73-76. - Vázquez, F., García, M.
J., Pérez, F. & Palacio, V.
(2001). Trichomonas vaginalis: tratamiento y resistencia a
nitroimidazoles. Enf Inf Microbiol Clin. 19(3),
114-124. - Waitz, J. A, Moss, E. L. & Weinstein, M. J.
(1971). Chemotherapeutic evaluation of clotrimazole (Baby b
5097, 1 (o-chloro-diphenylbenzyl) imidazole). Appl Microbiol,
22, 891-898. - Wira, R. & Sandoe, P. (1987). Specific IgA and
IgG antibodies in the secretions of the female reproductive
tract: effects of immunization and estradiol on expression of
this response in vivo. J of Immun,138, 4159-64. - Wilkinson, D. S., Abdool Karim, S., Harrison,
A. M., Lurie, M., Colvin, C., Sturm, A. W. (1999).
Unrecognized sexually transmitted infections in rural South
African women: a hidden epidemic. Bull World Health Org,77,
22-28. - Wolfang, K. J., Willett, P. H. & Amos, B. (1983).
Zinsser Microbiología (7a ed.). (pp.
1327-29). Ciudad de La Habana: Editorial Científico
Técnica. - Wong, C. A., Wilson, D. & Chew, T. A. (1990).
Povidone-iodine in the treatment of metronidazole-resistant
Trichomonas vaginalis. Aust N Z J Obstet Gyn, 30,
169-171. - Yarlett, N., Yarlett, N. C. & Lloyd, D. (1985).
Ferrodoxin- dependent reduction of nitroimidazole derivates in
drug resistant and susceptible strains of Trichomonas
vaginalis. Biochem Pharmacol, 35, 1703-1708. - Yuh, Y. S., Liu, J. Y. & Shaio, M. F. (1997).
Chromosome number of Trichomonas vaginalis. J Parasitol, 83,
551-553.
Autores:
Machado YT*
López RP**
Meneses AM**.
Centro de Bioactivos Químicos. Universidad
Central Marta Abreu de las Villas. Santa Clara, Cuba.
*Lic. En Ciencias Farmacéuticas. MsC. En
Parasitología
** Dr. Medicina Veterinaria.
MsC. En Parasitología
