- La
entalpía - Calor específico y
capacidad calorífica - Calorimetría a volumen
constante - Calorimetría a
presión constante - Calor latente de
fusión - Calor de
sublimación - Calor de
vaporización - Curva de
calentamiento - Curva de
enfriamiento - Fuerzas
intermoleculares - Interacciones
Ion-Dipolo - Enlace Dipolo –
Dipolo - Fuerzas de dispersión de
London - Puentes de
hidrógeno - Bibliografía
Como sabemos una de las unidades de la medida del
calor es la
caloría, que se define como el calor que es necesario
aplicar a un gramo de agua, para que
su temperatura
aumente de 14,5°C a 15,5°C ó sea
1°C.
La caloría esta relacionada con otras unidades de
energía así:
1 caloría = 0,001 Kcal = 3,96 x
10-3 BTU = 4,186 Joul = 4,186 x 107
ergios
La Entalpía es la cantidad de energía
de un sistema
termodinámico que éste puede intercambiar con su
entorno. Por ejemplo, en una reacción química a presión
constante, el cambio de
entalpía del sistema es el calor absorbido o desprendido
en la reacción. En un cambio de fase, por ejemplo de
líquido a gas, el cambio de
entalpía del sistema es el calor latente, en este caso el
de vaporización. En un simple cambio de temperatura, el
cambio de entalpía por cada grado de variación
corresponde a la capacidad calorífica del sistema a
presión constante. El término de entalpía
fue acuñado por el físico alemán Rudolf J.E.
Clausius en 1850. Matemáticamente, la entalpía H es
igual a U + pV, donde U es la energía interna, p es la
presión y V es el volumen. H se
mide en julios.
H = U + pV
Cuando un sistema pasa desde unas condiciones iniciales
hasta otras finales, se mide el cambio de entalpía (
Δ H).
ΔH = Hf –
Hi
La entalpía recibe diferentes denominaciones
según el proceso,
así:
Entalpía de reacción, entalpía de
formación, entalpía de combustión, entalpía de
disolución, entalpía de enlace, etc; siendo las
más importantes:
ENTALPIA DE REACCIÓN:
Es el calor absorbido o desprendido durante una
reacción química, a presión
constante.
ENTALPÍA DE FORMACIÓN:
Es el calor necesario para formar una mol de una
sustancia, a presión constante y a partir de los elementos
que la constituyen.
Ejemplo:
H2 (g) + ½ O2 (g) = >
H2O + 68.3Kcal
Cuando se forma una mol de agua (18 g) a partir de
hidrógeno y oxígeno
se producen 68.3 Kcal, lo que se denomina entalpía de
formación del agua.
ENTALPÍA DE COMBUSTIÓN:
Es el calor liberado, a presión constante, cuando
se quema una mol de sustancia.
Ejemplo:
CH4 (g) + 2O2 (g) =>
2CO2 (g) + 2H2O (l) ΔH =
-212.8 Kcal
Lo que significa que cuando se queman 16 g de metano se
desprenden 212.8 Kcal.
Estas entalpías se determinan normalmente a
25°C y 1 atm. Para determinar la
entalpía estándar de formación de las
sustancias, se deben tener en cuenta las siguientes
consideraciones:
1. La entalpía estándar de
formación de los elementos puros, libres y tal como se
encuentran en su estado natural
es cero.
Por ejemplo:
H2 (g), O2 (g), N2 (g),
Cl2 (g), Na (s), etc, tienen
ΔHf25°
= 0, donde Δ
Hf25° es la
entalpía estandar de formación.
2. El carbono se
presenta a 25°C 1 atm de presión y en el estado
sólido, de varias formas: diamante, grafito,
antracita, hulla, coke, etc, pero su estado estandar se define
para el grafito, o sea
ΔHf25°
del grafito es igual a cero.
3. El azufre se presenta en dos estados
alotrópicos, el rombico y el monocíclico; su
entalpía estandar se define para el rombico o
sea
ΔHf25°
del rombico es igual a cero.
ENTALPÍA ESTÁNDAR de una
ecuación general:
![]()
Se calcula restando las entalpías
estándares de formación de los reactivos de las
entalpías estándares de formación de los
productos,
como se ilustra en la siguiente ecuación:
![]()
Según las teorías
que iniciaron el estudio de la calorimetría, el calor era
una especie de fluido muy sutil que se producía en las
combustiones y pasaba de unos cuerpos a otros, pudiendo
almacenarse en ellos en mayor o menor cantidad. Posteriormente,
se observó que, cuando se ejercía un trabajo
mecánico sobre un cuerpo (al frotarlo o golpearlo, por
ejemplo), aparecía calor; hecho que contradecía el
principio de conservación de la energía, ya que
desaparecía una energía en forma de trabajo
mecánico, además de que se observaba la
aparición de calor sin que hubiese habido
combustión alguna. Benjamin Thompson puso en evidencia
este hecho cuando dirigía unos trabajos de barrenado de
cañones observando que el agua de
refrigeración de los taladros se calentaba
durante el proceso. Para explicarlo, postuló la teoría
de que el calor era una forma de energía. Thompson no
consiguió demostrar que hubiese conservación de energía en el
proceso de transformación de trabajo en calor, debido a la
imprecisión en los aparatos de medidas que usó.
Posteriormente, Prescott Joule logró demostrarlo
experimentalmente, llegando a determinar la cantidad de calor que
se obtiene por cada unidad de trabajo que se consume, que es de
0,239 calorías por cada julio de trabajo que se transforma
íntegramente en calor.
La Calorimetría es la rama de la
termodinámica que mide la cantidad de
energía generada en procesos de
intercambio de calor. El calorímetro es el instrumento que
mide dicha energía. El tipo de calorímetro de uso
más extendido consiste en un envase cerrado y
perfectamente aislado con agua, un dispositivo para agitar y un
termómetro. Se coloca una fuente de calor
en el calorímetro, se agita el agua hasta lograr el
equilibrio, y
el aumento de temperatura se comprueba con el termómetro.
Si se conoce la capacidad calorífica del
calorímetro (que también puede medirse utilizando
una fuente corriente de calor), la cantidad de energía
liberada puede calcularse fácilmente. Cuando la fuente de
calor es un objeto caliente de temperatura conocida, el calor
específico y el calor latente pueden ir midiéndose
según se va enfriando el objeto.
CALOR ESPECÍFICO Y CAPACIDAD
CALORÍFICA
El calor específico (s) de una sustancia es la
cantidad de calor necesario para elevar un grado Celsius la
temperatura de un gramo de la sustancia. La capacidad
calorífica (C) de una sustancia es la cantidad de calor
necesario para elevar un grado Celsius la temperatura de una
cantidad determinada de sustancia. El calor específico es
una propiedad
intensiva, en tanto que la capacidad calorífica es una
propiedad extensiva. La relación entre la capacidad
calorífica y el calor específico de una sustancia
es:
C = ms
Donde m es la masa de la sustancia en gramos. Por
ejemplo el calor específico del agua es 4.184 J/g . °C
y la capacidad calorífica de 60 gramos de agua
es:
(60.0 g)(4.184 J/g . °C) = 251
J/°C
SUSTANCIA | CALOR ESPECÍFICO |
Aluminio | 0.900 |
Oro | 0.129 |
C(grafito) | 0.720 |
C(diamante) | 0.502 |
Cobre | 0.385 |
Hierro | 0.444 |
Mercurio | 0.139 |
Agua | 4.184 |
Etanol | 2.46 |
Tabla 1. Calor específico de
algunas sustancias
Si se conoce el calor específico y la
cantidad de una sustancia, entonces el cambio en la temperatura
de una muestra
(Δt) indicara la cantidad de calor (q) que se ha absorbido
o liberado en un proceso en particular. La ecuaciσn para
calcular el cambio de calor esta dad por:
![]()
![]()
donde m es la masa de la muestra y Δt es el cambio
de la temperatura:
![]()
El signo convencional de q es igual que para el cambio
de entalpía; que es positivo para procesos
endotérmicos y negativo para procesos
exotérmicos.
CALORIMETRÍA A VOLUMEN
CONSTANTE

Figura 1 diagrama de
bomba calorimétrica
Para medir el calor de combustión se coloca una masa
conocida de un compuesto en un recipiente de acero, denominado
bomba calorimétrica a volumen constante, que se llena con
oxígeno, a más o menos 30 atm de presión. La
bomba cerrada se sumerge en una cantidad conocida de agua. La
muestra se enciende eléctricamente y el calor producido
por la reacción de combustión se puede calcular con
exactitud al registrar el aumento en la temperatura del agua. El
calor liberado por la muestra es absorbido por el agua y por el
calorímetro. El diseño
especial de la bomba calorimétrica permite suponer que no
hay pérdida de calor (o de masa) hacia los alrededores
durante el tiempo en que
se hacen las mediciones.
Como consecuencia, se puede decir que la bomba
calorimétrica y el agua en que se sumerge constituyen un
sistema aislado. Debido a que no entra ni sale calor del sistema
durante el proceso, se puede escribir:
![]()
![]()
donde qagua, qbomba y
qreacción son los cambios de calor
del agua, de la bomba y de la reacción, respectivamente.
Así:
![]()
La cantidad qagua
se obtiene por:
![]()

El producto de la
masa de la bomba por su calor específico es la capacidad
calorífica de la bomba, que permanece constante para todos
los experimentos
efectuados en dicha bomba calorimétrica:
De aquí
![]()
![]()
Como es una bomba calorimétrica las reacciones
ocurren bajo condiciones de volumen constante y no de
presión constante, los cambios de calor no corresponden al
cambio de entalpía ΔH. Es posible
corregir las mediciones en los cambios de calor de forma que
correspondan a los valores de
ΔH, pero debido que la correcciσn es muy
pequeρa.
CALORIMETRÍA A PRESIÓN
CONSTANTE
Sabemos que DH se define como la cantidad de calor
transferida a presión constante,
(DH = qp), entonces un
calorímetro para medir ello tendrá el siguiente
esquema:

Figura 2 diagrama de un
calorímetro
El regulador de presión puede ser
simplemente un agujero que permita que la presión sea la
misma que la presión atmosférica Para aquellas
reacciones que se hacen en agua en disoluciones diluidas, el
calor específico de la disolución será
aproximadamente igual al del agua, esto es, 4.18 J g-1
K-1 El calor absorbido por una disolución
acuosa es igual al calor liberado por la reacción de los
solutos:
qdisolución =
-qrxn
Si la reacción libera calor, es una
reacción exotérmica y el DH es negativa. La
entalpía de los productos es menor que la de los
reactivos
DH =
Hproductos-Hreactivos
En un calorímetro con una disolución
acuosa, si la reacción de los solutos es
exotérmica, la disolución absorberá el calor
producido por la reacción y se observará un
incremento en la temperatura.
De manera que para una reacción
exotérmica:
- Los solutos tienen una entalpía final
menor después de la reacción (DH
negativa) - La disolución tiene una entalpía
final mayor después de la reacción (DH
positiva)
De manera que para determinar el valor de
DHrxn debemos invertir el signo de DHsoln
(es decir el valor medido)
El calor latente de fusión es
el calor absorbido en la fusión de 1 g de sustancia a
temperatura constante.
Los calores de fusión de las sustancias
son muy inferiores a sus calores de vaporización. Para el
hielo es igual a 79,7 calorías por
gramo.
La temperatura de fusión varia, aunque
muy poco, con la presión aplicada a la sustancia; en
general, en los sólidos más densos que el
líquido la temperatura de fusión aumenta al elevar
la presión, mientras que el caso contrario tal como el
hielo, la temperatura de fusión disminuye al elevar la
presión.
El calor de sublimación es la cantidad
de calor necesario para sublimar a temperatura constante 1 g de
sustancia en estado sólido.
El calor de sublimación de una sustancia
es igual a la suma del calor de fusión más el calor
de vaporización, ya que el paso directo de
sólido-vapor puede realizarse en las dos etapas
equivalentes sólido-liquido y
liquido-vapor.
Cuando un líquido se encuentra a la
temperatura de ebullición, para pasarlo a estado de vapor
hay necesidad de aplicarle una cantidad de calor adicional, para
romper las fuerzas atractivas intermoleculares, a este calor
necesario para evaporar cierta cantidad de sustancia se le conoce
con el nombre de calor de
vaporización.
El calor de vaporización se conoce como
calor latente de vaporización puesto que al aplicarlo, no
hay cambio en la temperatura del sistema.
![]()
donde m es la cantidad de sustancia a evaporar
y ΔHv es el calor de
vaporizaciσn.
CURVA DE
CALENTAMIENTO
Para ver el gráfico
seleccione la opción "Descargar" del menú
superior
Figura 3 Curva de
calentamiento
en la figura 3 se presenta la grafica de una curva de
calentamiento completa desde el estado sólido, hasta el
estado de vapor.
Supongamos que se tiene una sustancia en el estado
sólido en un tiempo to a una temperatura inicial Ti
(figura 3). Si empezamos a adicionar calor progresivamente, su
temperatura empieza a aumentar (calor sensible) hasta llegar a la
temperatura de fusión Tf en el tiempo
t1.
La cantidad de calor gastado entre to y t1
se calcula por la expresión:
![]()
donde:
Q1 = cantidad de calor en
calorías.
m = masa (gramos) de sustancia que se esta
calentando en el estado sólido.
Ces = es el calor específico de la
sustancia en el estado sólido (cal/g
°C)
Tf – Ti = Representa el cambio de
temperatura (ΔT) en ese intervalo.
Cuando la sustancia se encuentra a la temperatura
de fusión, hay necesidad de aplicarle calor latente de
fusión (ΔHfusiσn) para
convertirla en lνquido (intervalo t1 a
t2 ), el calor total de este intervalo depende de la
masa.
![]()
Cuando todo el sólido se haya transformado
en líquido (t2), al aplicar calor empieza
nuevamente a incrementarse la temperatura (calor sensible) hasta
el tiempo (t3), donde el líquido alcanza su
temperatura de ebullición.
El calor aplicado entre t2 y
t3 se calcula por la
expresión:
![]() ó
ó ![]()
Cel es el calor específico de la sustancia
en el estado líquido (cal/g °C)
Cuando la sustancia se encuentra en la temperatura
de ebullición, hay necesidad de aplicarle el calor latente
de vaporización (ΔHv) para convertirla en vapor
(intervalo t3 a t4).
El calor total de este intervalo depende de la
masa:
![]()
Cuando todo el líquido se halla
transformado en vapor (t4), al aplicarle calor empieza
de nuevo a incrementarse la temperatura (calor sensible) hasta el
tiempo final (t5) y la temperatura final (Tf). En el
lapso de tiempo t4 a t5 se aplico una
cantidad de calor que se calcula por la
expresión:
![]() ó
ó ![]()
donde Cev es el calor específico de la
sustancia en el estado de vapor (cal/g °C).
El calor total aplicado durante el proceso de
calentamiento es la suma de todos los calores o
sea:
![]()
Para ver el gráfico
seleccione la opción "Descargar" del menú
superior
En la figura 4 se presenta la gráfica de
una curva de enfriamiento completa, desde el estado de vapor,
pasando por el líquido, hasta el
sólido.
Supongamos que se tiene una sustancia en el
estado de vapor en un tiempo to a una temperatura inicial Ti
(figura 4). Si empezamos a extraer calor progresivamente, su
temperatura empieza a descender (calor sensible) hasta llegar a
la temperatura de licuefacción TL en el tiempo
t1.
La cantidad de calor extraído entre to y
t1 se calcula por la
expresión:
![]()
donde TL : es temperatura de
licuefacción e igual numéricamente a
Teb.
Cuando la sustancia se encuentra a la
temperatura de licuefacción, hay necesidad de extraerle el
calor latente de licuefacción (-ΔHL) para
convertirla en líquido (intervalo t1 a
t2 ), el calor total de este intervalo depende de la
masa.
![]()
Cuando todo el vapor se haya transformado en
líquido (t2), al extraer calor empieza
nuevamente a descender la temperatura (calor sensible) hasta el
tiempo (t3), alcanza la temperatura de
solidificación (Ts).
El calor aplicado entre t2 y
t3 se calcula por la
expresión:
![]()
Cuando la sustancia se encuentra en la
temperatura de solidificación, hay necesidad de extraerle
el calor latente de solidificación (-ΔHs)
para convertirla en sσlido(intervalo
t3 a
t4).
El calor total de este intervalo depende de la
masa:
![]()
Cuando todo el líquido se ha
transformado en sólido (t4), al extraerle calor
empieza de nuevo a descender la temperatura (calor sensible)
hasta el tiempo final (t5) alcanza la temperatura
final deseada Tf.
El calor en este intervalo se calcula por la
expresión:
![]()
El calor total extraído durante el
proceso de enfriamiento es la suma de todos los calores o
sea:
![]()
Las propiedades físicas de una
sustancia dependen de su estado físico.
El vapor de agua, el agua líquida y el hielo
tienen exactamente las mismas propiedades químicas,
pero sus propiedades físicas son considerablemente
diferentes.
El tipo de enlace de una sustancia
determina:
- Distancias y ángulos de enlace
- Energías de enlace
- Es decir sus propiedades químicas
Las fuerzas intermoleculares de una sustancia
determinan sus propiedades físicas
GASES
- Son una colección de moléculas muy
separadas entre sí, pues la energía
cinética de las moléculas es mayor que las
fuerzas atractivas entre las moléculas - La ausencia de cualquier fuerza
atractiva significativa entre las moléculas, les permite
expandirse hasta llenar el recipiente que lo
contiene - Si las fuerzas atractivas empiezan a ser
significativas, los gases
exhiben comportamiento diferente que al del gas
ideal
- Las fuerzas de atracción intermolecular son
suficientemente grandes como para mantener a las
moléculas cerca unas de otras - Los líquidos son más densos y menos
compresibles que los gases - Los líquidos tienen un volumen definido que es
independiente de la forma y tamaño del recipiente que
los contiene. - Las fuerzas atractivas no son suficientes como para
mantener a las moléculas vecinas en posición fija
y las moléculas se mueven. De manera que los
líquidos pueden vaciarse y asumen la forma del
recipiente.
- Las fuerzas intermoleculares entre moléculas
vecinas son ahora suficientemente grandes para mantenerlas en
posiciones fijas unas respecto a las otras - Los sólidos (como los líquidos) no son
compresibles debido a la ausencia de espacio entre las
moléculas vecinas - Si las moléculas en un sólido adoptan
un empaquetamiento ordenado, se dice que la estructura
de las moléculas es cristalina - Debido a la magnitud de las fuerzas intermoleculares
entre moléculas vecinas, los sólidos son
rígidos
Un examen de las propiedades de los diferentes estados
de la material, nos convence de que el estado de una sustancia
depende del balance entre la energía cinética de
las partículas individuales que componen a cada sustancia
(moléculas, iones o átomos) y las fuerzas
intermoleculares.
La Energía Cinética mantiene a las
moléculas en movimiento y
depende de la temperatura (está en función de
la temperatura) de la sustancia
Las fuerzas intermoleculares intentan mantener a
las moléculas juntas.
- Los gases tienen fuerzas moleculares más
débiles que los líquidos - Los líquidos tienen fuerzas moleculares
más débiles que los sólidos - Tanto los sólidos como los líquidos
tienen sus partículas muy cercanas unas a otras, por
ello les llamamos fases condensadas para distinguirlas
de los gases
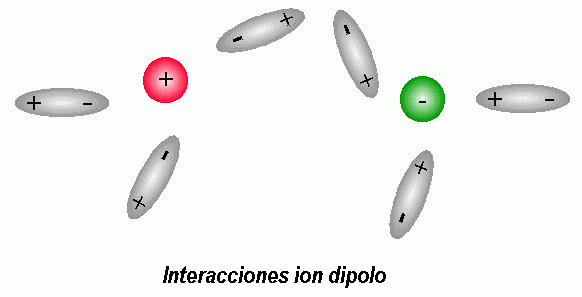
INTERACCIONES ION-DIPOLO
Se trata de una interacción entre un ion cargado y
una molécula polar (es decir un dipolo). Los
cationes se verán atraídos por el lado negativo de
un dipolo. Los aniones se verán atraídos por el
lado positivo de un dipolo.
La magnitud de la energía de esta interacción
depende de la carga del ion (Q ), el momento dipolo
de la molécula (m) y la distancia del centro del
ion al punto medio del dipolo (d )

Este tipo de interacciones tienen gran importancia al
estudiar el comportamiento de las disoluciones de sustancias
iónicas en disolventes polares (por ejemplo sal en
agua).
Ocurre cuando los átomos de una molécula
tienen diferencias de c, se polarizan, produciendo un
dipolo. Cuando dos dipolos
se avecindan, se atraen, dando como resultado un
enlace.
Si los átomos muy electronegativos se encuentran
unidos directamente a un H, también se formará un
dipolo. Estas interacciones se presentan entre las
moléculas neutras polares.
- Las moléculas polares se atraen entre
sí cuando la carga parcial positiva de una
molécula está cerca de la carga parcial negativa
de otra - Las moléculas polares deben de estar cerca
unas de otras para que la fuerza atractiva de la
interacción sea significativa - Las interacciones dipolo-dipolo son mucho
menores que las interacciones Ion-dipolo - Las fuerzas dipolo-dipolo crecen al
incrementarse la polaridad de una molécula.
Para ver el
gráfico seleccione la opción "Descargar" del
menú superior
Los puntos de ebullición de las moléculas
polares de masa parecida crecen al crecer el dipolo:
Sustancia | Masa molecular | Momento dipolo, | Punto de ebullición |
Propano | 44 | 0.1 | 231 |
Dimetil éter | 46 | 1.3 | 248 |
Cloruro de metilo | 50 | 2.0 | 249 |
Acetaldehído | 44 | 2.7 | 294 |
Acetonitrilo | 41 | 3.9 | 355 |
FUERZAS DE DISPERSIÓN
DE LONDON
No pareciera que las moléculas no-polares tengan
ninguna base física para tener
interacciones atractivas. Sin embargo, los gases de las
moléculas no-polares pueden licuarse, y esto indica que si
la energía cinética se reduce, existe algún
tipo de interacciones atractivas que predominan.
Fritz London (1930) sugiere que el
movimiento de los electrones en un átomo o
una molécula no polar puede dar como resultado un dipolo
transiente (transiente quiere decir que tiene tiempos de vida muy
cortos)
¿Cómo actúan las fuerzas de
dispersión de London?
El helio tiene 2 electrones consideremos que estos
electrones son partículas, la distribución promedio de los electrones
alrededor del núcleo es esféricamente
simétrica, los átomos no tienen dipolo y por tanto
su momento dipolo es cero; sin embargo, puede ocurrir que la
distribución de los electrones alrededor del núcleo
de cada átomo en un instante dado, no sea completamente
simétrica. Así puede pasar que: Ambos electrones
queden en el mismo lado del núcleo, esto dará como
resultado que en ese instante el átomo tenga un dipolo
aparente y por tanto un el momento dipolo sea diferente de cero,
es decir que haya un dipolo transiente. Un átomo vecino
que se encuentre cerca de este átomo, se verá
influido por este dipolo, los electrones de este átomo se
alejarán de la región negativa del dipolo, es
decir, debido a la repulsión electrónica, un dipolo temporal puede
inducir un dipolo similar en un átomo vecino, si este
está lo suficientemente cercano esto, causará que
los átomos vecinos se sientan atraídos unos a los
otros. A este fenómeno se le conoce con el nombre de
interacciones de dispersión de London (o simplemente
fuerzas de dispersión) Estas interacciones son
significativas únicamente cuando los átomos o
moléculas que lo presentan están muy cerca unas de
otras.
Para ver el
gráfico seleccione la opción "Descargar" del
menú superior
Puentes de hidrógeno, es la atracción
intermolecular e intramolecular resultante de la
interacción de dipolos donde participa el H. Esta
atracción es responsable de muchas de las propiedades
características del H2O, entre ellas
están:
- Tensión superficial
- puntos de fusión y ebullición
- viscosidad
- tensión superficial
- capacidad de la misma para disolver muchas clases de
sustancias.
Un átomo de hidrógeno en un enlace polar (por
ejemplo H-F, H-O o H-N) puede experimentar una fuerza atractiva
hacia una molécula polar o un ion vecino que cuenta con
pares electrónicos sin compartir, usualmente átomos
de F, O o N
A este tipo de interacción se le conoce con el
nombre de enlace de hidrógeno y en última instancia
no es más que una interacción del tipo
dipolo-dipolo
Un enlace entre un hidrógeno y un átomo
electronegativo como el F, O o N es muy polar:

Tomando en consideración que el átomo de H
no tiene electrones de core, entonces el lado del átomo
que está hacia afuera del dipolo es virtualmente un
núcleo desnudo la carga parcial positiva se verá
atraída a la carga parcial negativa de un átomo
electronegativo de una molécula cercana debido a que el
átomo de hidrógeno en un enlace polar tiene
deficiencia de electrones (particularmente en un lado, es decir,
el lado opuesto al enlace covalente polar), entonces, puede
acercarse mucho al átomo electronegativo de la
molécula vecina (el cual tiene carga parcial negativa) de
manera que puede interactuar fuertemente con él. Entre
más cerca pueda estar mayor será la
atracción electrostática
La energía de los enlaces de hidrógeno va
de alrededor de 4 kJ/mol a 25 kJ/mol, es decir, son más
débiles que los enlaces covalentes, pero, son mayores que
las interacciones dipolo-dipolo o las fuerzas de
dispersión. Este tipo de interacción tiene gran
importancia en la
organización de las moléculas biológicas
y su influencia es notable en la estructura de las proteínas
y los ácidos
nucleicos. El agua tiene una capacidad poco común para
formar una red de
enlaces de hidrógeno muy extensa. Como líquido, la
energía cinética de las moléculas previene
un arreglo ordenado extenso de los átomos de
hidrógeno, al enfriarse, las moléculas van
perdiendo energía cinética y esto permite que las
moléculas se vayan ordenando en un arreglo que maximiza
las interacciones atractivas de los enlaces de H.
Este arreglo de las moléculas tiene un volumen
mayor (es decir, es menos denso) que el agua líquida, de
manera que el agua se expande al congelarse. El arreglo de
moléculas de agua en el hielo normal tiene geometría hexagonal (es decir que
está compuesto de anillos con seis moléculas de
agua), lo cual es la base estructural de la forma hexagonal de
los copos de nieve.

Cada molécula de agua puede participar en cuatro
enlaces de H, es decir, uno con cada par de no enlace del
oxígeno y uno con cada átomo de
hidrógeno.
BABOR, Joseph. Química General Moderna.
Editorial Marín. Barcelona. Pág
75-80.
GARCIA, Arcesio. AUBAD, Aquilino. ZAPATA,
Rubén. Hacia La Química. Editorial Temis S.A.
Bogota-Colombia.
Pág 269-282.
CHANG, Raymond. Química Sexta edición. Editorial Mc Graw Hill. México.
Pág 209-222.
REALIZADO POR:
LUIS ALFONSO CHICA LLANES
ESTUDIANTE DE QUÍMICA
PURA
MARZO 2 DEL 2004
