Trabajo de
investigación
Desde los principios de la
era moderna de la química en el siglo
XIX, uno de los objetivos
importantes de las investigaciones
en química ha sido el descubrimiento y desarrollo de
materiales con
propiedades útiles. Los químicos han inventado
sustancias y también formas de procesar materiales
naturales para elaborar fibras, películas, recubrimientos,
adhesivos y sustancias con propiedades eléctricas,
magnéticas u ópticas especiales. Hoy en día
hemos ingresado en una nueva era en la que los avances de la
tecnología
dependen más que nunca del descubrimiento y desarrollo de
nuevos materiales útiles. He aquí algunos ejemplos
de cómo tales materiales afectarán todos los
aspectos de nuestra vida en el futuro cercano:
- Las pantallas planas sustituirán a los tubos
de rayos catódicos que actualmente se emplean en los
televisores y monitores de
computadora. - Dispositivos tan pequeños que por sus
dimensiones se miden en nanómetros almacenarán
enormes cantidades de información en un volumen muy
reducido. Tal almacenamiento de información de alta
densidad ya es
posible aunque todavía no está listo para un uso
generalizado. - La duración esperada de las prótesis
biológicas, como las articulaciones de rodilla y de cadera, se
prolongará, de los 10 años o menos que tienen
actualmente, a toda la vida del paciente. - Nuevos diseños de baterías y celdas de
combustible que harán posible el advenimiento del
automóvil eléctrico. - Convertidores catalíticos que reducirán
de forma más efectiva la
contaminación creada por los automóviles,
contribuirán a mejorar el ambiente con
un costo
menor.
En este trabajo se
explicaran algunas de las propiedades y aplicaciones de de los
mas importantes materiales que existen actualmente. . Nuestro
objetivo es
demostrar cómo podemos entender muchas propiedades
físicas o químicas especiales en términos de
los principios que hemos visto en capítulos anteriores.
Comprobaremos que las propiedades observables de los materiales
son el resultado de estructuras y
procesos en
los niveles atómico y molecular. Examinaremos cuatro
tipos: cristales líquidos, polímeros, materiales
cerámicos y películas finas, y un adicional llamado
Biomateriales.
Lamamos líquido a
una sustancia que fluye y toma la forma del recipiente que la
contiene; pero, por otra, a un cristal lo concebimos como
sustancia sólida y rígida. De modo que, al menos
intuitivamente, ¡un cristal es precisamente lo opuesto a un
líquido! Y sin embargo existen sustancias reales, los
cristales líquidos, que exhiben la dualidad
sólido-líquido, es decir, que,
simultáneamente, poseen propiedades de los
líquidos, fluidez y viscosidad, y
propiedades ópticas que se parecen de modo asombroso a las
de los cristales como, por ejemplo, poder reflejar
colores
diferentes dependiendo del ángulo bajo el cual se les
observe.
En los últimos treinta años se ha
descubierto que estas sustancias ocupan un lugar único en
la naturaleza.
Así, se sabe que los cristales líquidos
desempeñan un papel fundamental en los organismos vivos,
pues el DNA forma diversas fases líquido cristalinas;
también se les utiliza para fabricar dispositivos
electrónicos, como los indicadores
electro-ópticos que muestran letras y símbolos diversos en las calculadoras de
bolsillo o en las carátulas de los relojes
electrónicos modernos (Figura 20).
También han permitido fabricar pantallas de TV
extraordinariamente delgadas y hacen posible el desarrollo de
ventanas o cortinas que con sólo accionar un interruptor
se hacen transparentes o totalmente opacas (Figura 21).
Estos líquidos tan peculiares son también
esenciales para fabricar nuevos materiales, entre ellos fibras de
muy alta resistencia y son
de gran utilidad en la
recuperación del petróleo. Y la lista de las aplicaciones de
estos líquidos exóticos continúa creciendo
sin cesar… Pero antes de examinar con más detalle
cuáles son las propiedades de los cristales
líquidos que hacen posible estas aplicaciones, hagamos un
poco de historia.

Figura 20. Indicador numérico
electro-óptico fabricado con cristales
líquidos.
Los cristales
líquidos fueron descubiertos hace más de cien
años (1888) por el botánico austriaco F. Reinitzer,
quien encontró que algunos compuestos
orgánicos derivados del colesterol parecían
tener dos puntos de fusión.
Más específicamente, observó que al calentar
los cristales de estas sustancias a 145° C, el sólido
se transformaba en un líquido turbio; pero éste a
su vez, se convertía en un líquido totalmente claro
y transparente precisamente a 179° C. Reinitzer
también realizó el proceso
inverso y enfrió el líquido transparente observando
que exactamente a las mismas temperaturas anteriores
ocurrían las transformaciones opuestas. Como además
los cambios observados iban acompañados de
absorción o emisión de calor,
dependiendo de si la temperatura
aumentaba o disminuía y, asimismo, como el volumen del
sistema cambiaba
en forma abrupta, Reinitzer concluyó que la sustancia en
realidad exhibía dos cambios o transiciones de fase
sucesivas. Al poco tiempo de
estas primeras observaciones (1889), el cristalógrafo
alemán F. Lehmann descubrió que el líquido
turbio intermedio entre los cristales y el líquido
transparente poseía propiedades ópticas y una
estructura
molecular muy parecida a la de un cristal sólido, y
acuñó el nombre de cristal líquido.
Aun sin darse plena cuenta, lo que en realidad habían
descubierto era un nuevo estado de la
materia: las
fases intermedias o mesofases.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura
21. Ventana de cristal líquido con transparencia
controlable.
Sin embargo, a pesar de
que inicialmente los cristales líquidos despertaron gran
interés
y fueron muy estudiados durante el primer tercio de este siglo,
pronto fueron relegados a un rincón de la física y cayeron
rápidamente en el olvido subsistiendo sólo como
curiosidad de laboratorio.
Diversos factores contribuyeron a esta pérdida de
interés, uno de ellos fue el prejuicio,
fuertemente arraigado en el hombre
desde la remota antigüedad, según el cual las tres
nociones: gas,
líquido y sólido describen todas las
posibles fases de la materia. Esta actitud,
aún no superada en los años treinta de este siglo,
conlleva naturalmente un rechazo a la dualidad
sólido-líquido exhibida por los cristales
líquidos. En consecuencia no es de extrañar que la
aparente ambigüedad en el punto de fusión descubierta
por Reinitzer se atribuyera únicamente a la presencia de
"impurezas" en el sistema bajo estudio.
Otro factor preponderante fue el gran desarrollo logrado
en el segundo tercio de este siglo en otros campos de la ciencia
como la física de semiconductores,
la química de polímeros, la física
atómica o el espectacular desarrollo de la electrónica. Todos estos avances y la
entonces falta de aplicaciones prácticas de los cristales
líquidos, frenaron y eclipsaron su desarrollo. Pero,
paradójicamente, los mismos avances y, de manera especial
el proceso de miniaturización de los dispositivos
electrónicos, produjeron el renacimiento y
auge que los cristales líquidos tienen en nuestros
días. En efecto, en este afán de
miniaturización la electrónica pasó de los
bulbos a los transistores,
después a los microcircuitos y finalmente a los circuitos
integrados actuales.
Este proceso tuvo como consecuencia
importantísima la disminución de las potencias
consumidas y, por tanto, la reducción de las fuentes de
alimentación energética en aparatos
e indicadores electrónicos. Sin embargo, ocurrió
algo muy lógico pero que no se había anticipado: al
reducir tanto las dimensiones de los dispositivos
electrónicos ¡casi se perdió la
comunicación con ellos mismos! Cada vez era más
difícil transmitir —a bajo costo— la
información al hombre, pues
los diodos
semiconductores emisores de luz consumen
grandes corrientes eléctricas y los cinescopios de
televisión son demasiado grandes. Faltaba,
pues, un puente de comunicación entre lo muy pequeño y
el mundo macroscópico. Es entonces, a principios de los
años sesenta, cuando los cristales líquidos son
recordados y comienza su resurgimiento hasta convertirse en uno
de los campos más activos en la
investigación científica
interdisciplinaria con enormes posibilidades de aplicación
tecnológicas.
Pero, se preguntará el lector, ¿qué
propiedades físicas son las que hacen tan especiales a los
cristales líquidos? y, sobre todo, ¿es posible
entender estas propiedades en términos de las nociones
más familiares o intuitivas que tenemos de los
líquidos ordinarios o los cristales? Para contestar estas
preguntas es necesario examinar brevemente las
características de la estructura e interacción de las moléculas de un
cristal líquido.
Un cristal líquido fluye, se escurre y toma la
forma del recipiente que lo contiene, de la misma manera que lo
hace un líquido ordinario como, por ejemplo, el agua. Pero
a diferencia de ésta, cuyas moléculas son
relativamente simples y prácticamente esféricas,
las moléculas de un cristal líquido son, por lo
general, o muy alargadas en forma de barra o aplanadas en forma
de disco (Figura 22).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura
22. Las moléculas de cristal líquido tienen forma
de barras o discos.
Esta asimetría
molecular tiene una consecuencia muy importante, los
átomos dentro de la molécula se sitúan
preferentemente a lo largo del eje de la molécula o bien
en el plano definido por la molécula misma, dando lugar a
una estructura molecular complicada, según se ilustra en
la figura 23.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura
23. Nubes electrónicas: los enlaces entre los
átomos producen una distribución de carga complicada en las
moléculas.
Ahora bien, recordemos
que cada átomo
consta de un núcleo con carga eléctrica positiva
rodeado por una nube de electrones con carga eléctrica
negativa que compensa exactamente la del núcleo, de manera
que los átomos, y por tanto las moléculas, son
eléctricamente neutros. Esta disposición de los
núcleos y nubes electrónicas produce una
distribución de carga bastante compleja dentro de la
molécula (Figura 24).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura
24. (a) líneas de fuerza del
campo
eléctrico de un dipolo, (b) fuerzas de
atracción entre dipolos.
Pero esta
configuración no es estática,
sino que cambia cuando dos moléculas se acercan entre
sí. En efecto, cuando esto ocurre, las nubes
electrónicas son las primeras en entrar en contacto y se
repelen por tener cargas del mismo signo, de modo que a
distancias comparables con las dimensiones moleculares mismas,
las fuerzas intermoleculares son repulsivas y tienden a alejar a
las nubes electrónicas y en consecuencia a las
moléculas. Pero esta repulsión también
produce el desplazamiento relativo de las nubes
electrónicas con respecto a sus núcleos. Como esto
ocurre en cada átomo, en las moléculas alargadas el
efecto neto podemos describirlo imaginando que la presencia de
una molécula de cristal líquido produce una
distorsión en la distribución de carga
eléctrica de la otra molécula, de modo que la carga
positiva neta de los núcleos queda separada una cierta
distancia de una carga negativa de igual magnitud. Como es
sabido, a esta configuración de carga se le llama un
dipolo eléctrico y a la línea que une ambas
cargas se le llama eje del dipolo, que coincide entonces con el
eje largo de la molécula. Así que podemos concluir
que una molécula de cristal líquido induce la
formación de dipolos eléctricos en las
moléculas vecinas. Debe señalarse, sin embargo, que
es más fácil que la nube electrónica se
desplace con respecto al núcleo positivo a lo largo del
eje de la molécula que transversalmente a él
—a lo largo del eje corto— aunque esto último
también es posible dependiendo de la estructura molecular.
Ahora debemos averiguar a qué conduce esta
formación de dipolos en todo el cristal líquido.
Sabemos que cada configuración de cargas
eléctricas crea un campo eléctrico E en el espacio
que la rodea. La estructura espacial específica de cada
campo, es decir, cómo varia su magnitud con la
posición y cuál es su dirección en cada punto, es una propiedad de
cada configuración de carga, pero es precisamente a
través de este campo como cada configuración ejerce
fuerzas sobre otras cargas eléctricas. En el caso del
dipolo eléctrico la estructura de este campo está
representada por las líneas de fuerza que se
muestran en la figura 24 (a) y sus propiedades son tales que, si
en la región ocupada por este campo se coloca otro dipolo,
las fuerzas que el campo del primero produce fuerza a que los
dipolos se orienten como se muestra en la
figura 24 (b). Es decir, la mayor parte de los átomos de
una molécula trata de situarse al lado de los
átomos de otra, de modo que las cargas del mismo signo se
sitúen lo más cerca unas de otras. El resultado
neto es que así se genera una fuerza atractiva entre los
dipolos. Entonces, cuando dos moléculas de un cristal
líquido se encuentran separadas a distancias mayores que
sus dimensiones, las moléculas se atraen. Es claro que de
acuerdo con este modelo
simplificado de la interacción entre moléculas se
sigue que debe existir una distancia entre ellas para la cual las
fuerzas atractivas y repulsivas se equilibren y, en consecuencia,
la configuración relativa de las moléculas sea la
más estable y la más favorable desde el punto de
vista energético. Por lo tanto es de esperarse que las
moléculas de cristal líquido tiendan a adoptar esta
configuración manteniendo sus ejes dipolares o planos
característicos paralelos entre sí. Concluimos
entonces que, debido a la estructura de sus moléculas y en
especial debido a la asimetría de las mismas, un cristal
líquido adopta configuraciones altamente ordenadas. Aunque
el mecanismo de interacción molecular que hemos descrito
es básicamente el mismo que genera el orden en los
cristales sólidos. No debe olvidarse una diferencia
esencial entre ambos sistemas: en todo
momento los cristales líquidos permanecen en estado
líquido, lo cual implica que los centros de masa de sus
moléculas no forman una red periódica
sino que fluyen manteniendo el orden en la orientación
común de sus ejes moleculares.
De acuerdo con el tipo de arreglos moleculares que
pueden formar, Friedel (1922) clasificó los cristales
líquidos en tres grandes clases: nemáticos,
esmécticos y colestéricos. La fase nemática
exhibe orden en la orientación de sus moléculas y
al mismo tiempo desorden en la posición de sus centros de
masa. Las moléculas pueden moverse lateralmente, girar
alrededor del eje común o deslizarse paralelamente a
él (Figura 25).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura
25. La fase nemática exhibe orden de orientación,
pero desorden en la posición de los centros de masa
moleculares.
Podríamos comparar
este arreglo molecular con el de los cerillos dentro de una caja:
aunque pueden moverse, la presencia de los demás impone
restricciones a estos movimientos y tiende a mantenerlos
paralelos entre sí. De este modo, respecto a la
posición de sus centros de masa, un nemático se
comporta como un líquido ordinario y sus moléculas
se mueven caóticamente. En cambio difiere
totalmente de un líquido ordinario en que sus
moléculas se orientan y al moverse mantienen sus ejes
paralelos a una dirección común. Es preciso
señalar que, por supuesto, este orden nunca es perfecto,
sólo ocurre a temperaturas moderadas cuando las
variaciones térmicas no son tan intensas como para
destruir totalmente este orden de orientación. Recordemos
que ya desde las primeras observaciones de Reinitzer sabemos que
al calentar un cristal líquido éste se convierte en
un líquido ordinario. También es importante
mencionar que, además de la temperatura, otras
propiedades, como la densidad, son de gran importancia para
determinar el grado de orden o el tipo de fase líquido
cristalina que puede formarse. En efecto, cuando el número
de moléculas por unidad de volumen es elevado, o sea,
cuando la densidad es grande, las moléculas están
más cerca unas de otras y las interacciones repulsivas
entre ellas son más intensas, lo cual favorece la
aparición de orden tanto de orientación como de
posición en el cristal líquido. Sin embargo, estas
fluctuaciones térmicas producen defectos en la
orientación los cuales dan lugar a estructuras
microscópicas en forma de hilo que flotan en el
nemático o que se adhieren a la superficie del recipiente.
Precisamente esta característica fue el origen del nombre
nemático que en griego significa hilo.
En contraste con los nemáticos, que son la fase
más desordenada de los cristales líquidos, los
esmécticos constituyen la fase más ordenada.
Tienden a organizarse en capas planas paralelas entre sí,
como las hojas de un libro pero con
sus ejes moleculares perpendiculares a estos planos y paralelos
entre sí. Éste es, por ejemplo, el arreglo de las
moléculas en las capas superficiales de una pompa de
jabón y es el que le proporciona la cohesión
necesaria para formarse. De hecho, esméctico se deriva del
vocablo griego que designa una sustancia de propiedades similares
al jabón. Como en los nemáticos, las
moléculas de esméctico también pueden girar
alrededor de la dirección de orientación
común pero no pueden hacerlo fuera de la capa en que se
encuentran. En cada plano las moléculas pueden acomodarse
en filas con diferentes grados de orden de posición de sus
centros de masa. En el caso más ordenado se produce un
arreglo regular muy parecido al de la red de un sólido, en
el que hay orden y repetición en cada dirección
(Figura 26).

Figura 26. Un cristal
esméctico con orden de orientación de los ejes
moleculares y orden en la posición de sus centros de
masa.
En cambio, en el arreglo
más desordenado los centros de masa moleculares se mueven
caóticamente en cada plano, de modo que en este caso el
esméctico es nemático por planos (Figura 27). Debe
enfatizarse, sin embargo, que en cualquier caso el
esméctico es siempre fluido y las diferentes capas se
deslizan, en mayor o menor grado, unas sobre otras.

Figura 27. Capas de
esméctico en las que no existe orden de posición.
Se comportan como nemáticas en cada plano.
La tercera clase de
cristales líquidos posee una estructura molecular
característica de muchos compuestos que contienen
colesterol y por esta razón se le llama
colestérica. Como en los esmécticos, las
moléculas de colestérico también pueden
acomodarse en capas superpuestas, pero con una diferencia
crucial: los ejes moleculares se orientan en una dirección
paralela al plano mismo de las capas. Más aún, esta
dirección cambia ligeramente de capa a capa debido a la
peculiar estructura molecular de los colestéricos, y en
consecuencia el eje de orientación, al pasar de un plano a
otro, describe una trayectoria en forma de hélice, como se
indica en la figura 28.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura 28. La dirección de
orientación molecular en cada plano de colestérico
describe una trayectoria helicoidal (línea discontinua).
Hemos visto cómo la arquitectura
molecular de los cristales líquidos favorece, a
temperaturas y densidades moderadas, la aparición de una
dirección especial a lo largo de la cual se orientan las
moléculas alargadas y perpendicularmente a ella en las
moléculas en forma de disco. La peculiaridad de este tipo
de materiales es que la existencia de una dirección
preferida afecta el comportamiento
de los rayos luminosos en el material cambiando su intensidad,
color y
dirección de propagación. Por esta razón a
esta dirección especial se le llama el eje óptico
del material y es la causa de muchos fenómenos
ópticos importantes. Es necesario subrayar aquí que
la existencia del eje óptico es un fenómeno
colectivo que se da en forma espontánea en los cristales
líquidos. Así, por ejemplo, si un rayo de luz
blanca incide sobre el cristal líquido formando un
ángulo con el eje óptico puede transformarse en luz
de color al transmitirse a través del líquido pues
la velocidad de
la luz en el fluido depende de la dirección de
propagación respecto al eje óptico. Pero,
además de este cambio en el color, también puede
ocurrir que el rayo saliente se divida en dos rayos luminosos
cuyas intensidades relativas varíen dependiendo de la
dirección del rayo incidente con el eje óptico. A
este fenómeno se le llama birrefringencia.
Por otra parte, es bien conocido que los cristales
sólidos con ejes ópticos se usan en
múltiples aplicaciones tecnológicas en las que es
necesario dirigir los rayos luminosos en forma rápida y
precisa. Una aplicación muy conocida es la de los
polaroides o polarizadores, que sólo transmiten algunos de
los rayos luminosos que inciden sobre ellos y que se usan
ampliamente en la fotografía
en colores o para fabricar lentes que protejan los ojos de la luz
deslumbradora del Sol. Para entender mejor la función de
un polarizador recordemos que cada onda electromagnética
emitida por un sistema particular de cargas en movimiento,
consta de un campo eléctrico E y un campo
magnético H que oscilan transversalmente a la
dirección de propagación de la onda (Figura 29).
Aunque en cada onda el campo eléctrico está
orientado de modo preciso, en un rayo de luz compuesto de muchas
ondas emitidas
por diferentes sistemas de cargas a diferentes tiempos, no hay en
general una dirección —"polarización"—
bien determinada del campo eléctrico total. Cuando esto
ocurre se dice que la luz es natural o no polarizada.
Los polarizadores permiten, precisamente, convertir la
luz natural en polarizada al eliminar del rayo de luz todas
aquellas ondas cuya polarización no sea la requerida. Ya
que los cristales líquidos poseen eje óptico no es
de extrañar que también exhiban muchos de estos
fenómenos, los cuales son totalmente insólitos en
los líquidos ordinarios. Sin embargo, a diferencia de los
cristales sólidos los cristales líquidos presentan
una ventaja enorme: debido a la relativa debilidad de las fuerzas
de interacción molecular, la orientación del eje
óptico se puede variar con mayor facilidad. Existen
diversos métodos
para "manejar" el eje óptico de un cristal líquido,
todos ellos basados en la enorme capacidad de estos sistemas para
responder a la acción
de campos externos.

Figura 29. Onda
electromagnética propagándose en la
dirección de u. es la longitud de
onda.
El primer fenómeno
en el que se observó que el eje óptico cambia de
dirección bajo la acción de un campo
eléctrico es el ahora llamado efecto Freederiks
(1943), descubierto por el físico ruso del mismo nombre.
Este fenómeno se observa con mayor facilidad en un
nemático y, como veremos, constituye la base física
del funcionamiento de los indicadores electro-ópticos de
las carátulas de relojes y calculadoras
electrónicas modernas. Si un campo eléctrico
externo actúa sobre un nemático, interacciona con
los dipolos de sus moléculas y las hace girar de manera
tal que su eje largo tiende a colocarse paralelamente al campo
aplicado o en dirección perpendicular a él,
dependiendo de que el momento dipolar de la molécula
esté dirigido en la dirección de su eje largo o
corto, respectivamente. Pero ya hemos visto que en un
nemático todas las moléculas mantienen una misma
orientación debido a las características de su
interacción mutua; así que si una molécula
de nemático se reorienta bajo la acción de un campo
externo, las demás se reorientan también en la
misma dirección. Por lo tanto, basta con aplicar un campo
eléctrico pequeño para producir una
reorientación de todo el eje óptico del
nemático.
Un indicador electro-óptico consta
básicamente de una celda diminuta con los siguientes
elementos: una capa muy delgada (0.01-0.1 mm) de cristal
líquido, por lo general un nemático, colocado entre
dos placas de vidrio cada una
de las cuales está unida a un polarizador. Estas placas se
pulen de manera tal que la cohesión entre las
moléculas y las placas sólidas sea máxima,
lo cual se logra produciendo surcos en las placas de
aproximadamente las dimensiones de una molécula de
nemático. Así se consigue que las moléculas
que están en contacto con las placas se alineen con la
dirección de pulimento y, por las características
de las interacciones moleculares, todas las moléculas en
el espesor de la capa se alinean exactamente en la misma
dirección. Si bajo estas condiciones una placa se gira
noventa grados respecto a la otra —debido a que a grandes
distancias de las placas el influjo del vidrio sobre las
moléculas de nemático es menor que cerca de las
superficies sólidas— las moléculas, y por lo
tanto el eje óptico del cristal líquido, se
reorientan adquiriendo la configuración torcida que se
muestra en la figura 30.

Figura 30. Geometría torcida producida al girar las
placas de vidrio 90°.
Si entonces se ilumina la
celda con luz natural, ésta se polariza y al penetrar en
la celda su polarización sigue la configuración
torcida del eje óptico, de modo que al salir por la placa
inferior también habrá girado noventa grados. Pero
como el eje del polarizador inferior tiene precisamente esa
dirección, la luz atravesará el segundo
polarizador. Entonces, si debajo del polarizador inferior se
coloca un espejo, la luz podrá reflejarse nuevamente al
interior de la celda, atravesarla en sentido inverso y salir de
ella hasta llegar a los ojos de un observador que verá a
la celda perfectamente clara y transparente. Este proceso se
ilustra en la parte izquierda de la figura 31.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura 31. Elementos de una celda
de un indicador electro-óptico.
Para poder formar
cualquier cifra, letra o palabra en el indicador, es preciso
colocar dos electrodos entre las placas de vidrio de manera que,
al conectarlos a una pila, se produzca un campo eléctrico
en el nemático. Al efecto, el electrodo inferior se
construye de una sola pieza, mientras que el superior consta de
muchos electrodos más pequeños. Así, por
ejemplo, para formar cualquier cifra entre cero y nueve
sólo se requieren siete segmentos, cada uno de los cuales
puede conectarse o desconectarse a un circuito eléctrico
de acuerdo a las señales
que produzca un generador diminuto cuyo funcionamiento lo
controla un programa
especial. De esta manera es posible producir un campo
eléctrico únicamente sobre ciertas regiones de la
celda. En la parte derecha de la figura 31 se ilustra la
situación en que ha sido cerrado el circuito de manera que
los segmentos del electrodo superior que conforman el
número ocho se activen. De acuerdo con el efecto
Freederiks, el campo eléctrico en esta región de la
celda tiende a alinear las moléculas destruyendo la
configuración torcida que prevalecía en ausencia de
campo. Entonces, la luz polarizada que sale del primer
polarizador se transmite, por debajo de los segmentos de
electrodo asociados a la cifra ocho, por toda la capa de
nemático sin cambiar su polarización. Pero al
llegar al segundo polarizador, cuya dirección de
polarización es perpendicular a la polarización de
la luz, no podrá atravesarlo y entonces o se absorbe en el
líquido o se desvía en cualquiera otra
dirección. Como esta luz no llega al espejo, tampoco
alcanzará al observador y éste verá oscuros
los segmentos de la cifra ocho. El resultado final será
que el observador verá un ocho oscuro sobre un fondo claro
(Figura 32).
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura 32. Imagen
típica de un indicador digital
electro-óptico.
Éste es el
principio físico del funcionamiento de la gran
mayoría de los indicadores digitales usados en
calculadoras de bolsillo, videograbadoras, tableros de diversos
aparatos medidores o cuadrantes de sintonía. Es importante
señalar que los procesos comprendidos en los dispositivos
que acabamos de describir, ocurren rápidamente, por lo
común en una diezmilésima o cienmilésima de
segundo; así, en una fracción pequeña de
tiempo se puede mostrar en la pantalla toda una sucesión
de cifras o símbolos diversos. Más aún, como
las dimensiones de la celda son tan pequeñas, los problemas
usuales asociados con el manejo de los líquidos no se
presentan y las potencias consumidas en los circuitos de
la misma son muy pequeños; por ejemplo, una pila de 1.5
voltios basta para generar toda la energía requerida.
En las páginas anteriores hemos presentado un
esbozo de cómo son los cristales líquidos; resulta
evidente que es éste un campo interdisciplinario de gran
importancia, tanto científica como tecnológica.
Podemos mencionar que actualmente ya están a la venta televisores
miniatura a colores, con pantallas de gran definición,
fabricados con cristales líquidos. A juzgar por los logros
y aplicaciones espectaculares de los cristales líquidos
obtenidos en los últimos años, no cabe duda que el
futuro nos deparará sorpresas cada vez mayores y, al mismo
tiempo, nos brindará nuevos retos para comprender las
extraordinarias propiedades de estas fases intermedias de la
materia.
¿Qué son los polímeros
?
La materia esta formada por moléculas que pueden
ser de tamaño normal o maléculas gigantes llamadas
polímeros. Los polímeros se producen por la
unión de cientos de miles de moléculas
pequeñas denominadas monómeros que forman enormes
cadenas de las formas más diversas. Algunas parecen
fideos, otras tienen ramificaciones. algunas más se
asemejan a las escaleras de mano y otras son como redes tridimensionales.
Existen polímeros naturales de gran significación
comercial como el algodón, formado por fibras de celulosas.
La celulosa se
encuentra en la madera y en
los tallos de muchas plantas, y se
emplean para hecer telas y papel. La seda es otro polímero
natural muy apreciado y es una poliamida semejante al nylon. La
lana, proteína del pelo de las ovejas, es otro ejemplo. El
hule de los árboles
de hevea y de los arbustos de Guayule, son también
polímeroa naturales importantes. Sin embargo, la mayor
parte de los polímeros que usamos en nuestra vida diaria
son materiales sintéticos con propiedades y aplicaciones
variadas.
Lo que distingue a los polímeros de los
materiales constituídos por moléculas de
tamaño normal son sus propiedades mecánicas. En
general, los polímeros tienen una excelente resistencia
mecánica debido a que las grandes cadenas
poliméricas se atraen. Las fuerzas de atracción
intermoleculares dependen de la composición química
del polímero y pueden ser de varias clases.
Fuerzas de Van der
Waals.
También llamadas fuerzas de dispersión,
presentes en las moléculas de muy baja polaridad,
generalmente hidrocarburos.
Estas fuerzas provienen de dipolos transitorios: como resultado
de los movimientos de electrones, en cierto instante una una
porción de la molécula se vuelve ligeramente
negativa, mientras que en otra región aparece una carga
positiva equivalente. Así se forman dipolos
no-permanentes. Estos dipolos producen atracciones
electroestáticas muy débiles en las
moléculas de tamaño normal, pero en los
polímeros, formados por miles de estas pequeñas
moléculas, las fuerzas de atracción se multiplican
y llegan a ser enormes, como en el caso del
polietileno.
Hidrocarburo | Fórmula | Peso molecular | Densidad | T. de |
Metano | CH4 | 16 | gas | -182°C |
Etano | C2H6 | 30 | gas | -183 |
Propano | C3H8 | 44 | gas | -190 |
butano | C4H10 | 58 | gas | -138 |
Pentano | C5H12 | 72 | 0,63 | -130 |
Hexano | C6H14 | 86 | 0,66 | -95 |
Heptano | C7H16 | 100 | 0,68 | -91 |
Octano | C8H18 | 114 | 0,70 | -57 |
Nonano | C9H20 | 128 | 0,72 | -52 |
Decano | C10H22 | 142 | 0,73 | -30 |
Undecano | C11H24 | 156 | 0,74 | -25 |
Dodecano | C12H26 | 170 | 0,75 | -10 |
Pentadecano | C15H32 | 212 | 0,77 | 10 |
Eicosano | C20H42 | 283 | 0,79 | 37 |
Triacontano | C30H62 | 423 | 0,78 | 66 |
Polietileno | C2000H4002 | 28000 | 0,93 | 100 |
En la tabla 1.1 se observa como cambian la densidad y la
temperatura de fusión, al aumentar el número de
átomos de carbono en la
serie de lso hidrocarburos. Los compuestos más
pequeños son gases a la
temperatura ambiente. al aumentar progresivamente el
número de carbonos, los compuestos se vuelven
líquidos y luego sólidos, cada vez con mayor
densidad y mayor temperatura de fusión, hasta llegar a los
polietilenos con densidades que van de 0,92 a 0, 96 g /
cm3 y temperaturas de fusión entre 105 y
135° C.
Densidad y temperatura de fusión de
hidrocarburos.
Fuerzas de atracción.
Debidas a dipolos permanentes, como en el caso de los
poliésteres. Estas atracciones son mucho más
potentes y a ellas se debe la gran resistencia tensil de las
fibras de los poliésteres.
Enlaces de hidrógeno.
Como en las poliamidas (nylon).
Estas interacciones son tan fuertes, que una fibra
obtenida con estas poliamidas tiene resistencia tensil mayor que
la de una fibra de acero de igual
masa.
Otros polímeros.
Hay atracciones de tipo iónico que son las
más intensas:
Un ejemplo sería el copolímero
etileno-ácido acrílico, que al ser neutralizado con
la base M(OH)2, producirá la estructura
indicada. Estos materiales se llaman ionómeros y se usan,
por ejemplo, para hacer películas transparentes de alta
resistencia.
Tipo de enlace | Kcal / mol |
Van der Waals en CH4 | 2,4 |
Dipolos permanentes | 3 a 5 |
Enlaces hidrógeno | 5 a 12 |
Iónicos | mayores a 100 |
Energía requerida para romper cada
enlace.
La fuerza total de atracción entre las
moléculas del polímero, dependería del
número de las interacciones. Como máximo,
sería igual a la energía de enlace según la
tabla, multiplicada por el número de átomos de
carbono en el caso del polietileno o por el número de
carbonílicos C = O en los poliésteres, etc.. rara
vez se alcanza este valor
máximo, porque las cadenas de los polímeros no
pueden, por lo general, acomodarse con la perfección que
sería requerida.
Concepto y
clasificación.
Un polímero (del griego poly, muchos;
meros, parte, segmento) es una sustancia cuyas
moléculas son, por lo menos aproximadamente,
múltiplos de unidades de peso molecular bajo. La unidad de
bajo peso molecular es el monómero. Si el polímero
es rigurosamente uniforme en peso molecular y estructura
molecular, su grado de polimerización es indicado por un
numeral griego, según el número de unidades de
monómero que contiene; así, hablamos de
dímeros, trímeros, tetrámero,
pentámero y sucesivos. El término polímero
designa una combinación de un número no
especificado de unidades. De este modo, el trióximetileno,
es el trímero del formaldehído, por
ejemplo.
Si el número de unidades es muy grande, se usa
también la expresión gran polímero. Un
polímero no tiene la necesidad de constar de
moléculas individuales todas del mismo peso molecular, y
no es necesario que tengan todas la misma composición
química y la mismaestructura molecular. Hay
polímeros naturales como ciertas proteínas
globulares y policarbohidratos, cuyas moléculas
individuales tienen todas el mismo peso molecular y la misma
estructura molecular; pero la gran mayoría de los
polímeros sintéticos y naturales importantes son
mezclas de
componentes poliméricos homólogos. La
pequeña variabilidad en la composición
química y en la estructura molécular es el
resultado de la presencia de grupos finales,
ramas ocacionales, variaciones en la orientación de
unidades monómeras y la irregularidad en el orden en el
que se suceden los diferentes tipos de esas unidades en los
copolímeros. Estas variedades en general no suelen afectar
a las propiedades del producto
final, sin embargo, se ha descubierto que en ciertos casos hubo
variaciones en copolímeros y ciertos polímeros
cristalinos.
Homopolímeros y
copolímeros.
Los materiales como el polietileno, el PVC, el
polipropileno, y otros que contienen una sola unidad estructural,
se llaman homopolímeros. Los homopolímeros, a
demás, contienen cantidades menores de irregularidades en
los extremos de la cadena o en ramificaciones.
Por otro lado los copolímeros contienen varias
unidades estructurales, como es el caso de algunos muy
importantes en los que participa el estireno.
Estas combinaciones de monómeros se realizan para
modificar las propiedades de los polímeros y lograr nuevas
aplicaciones. Lo que se busca es que cada monómero imparta
una de sus propiedades al material final; así, por
ejemplo, en el ABS, el acrilonitrilo aporta su resistencia
química, el butadieno su flexibilidad y el estireno
imparte al material la rigidez que requiera la aplicación
particular.
Evidentemente al variar la proporciones de los
monómeros, las propiedades de los copolímeros van
variando también, de manera que el proceso de
copolimerización permite hasta cierto punto fabricar
polímeros a la medida.
No solo cambian las propiedades al variar las
proporciones de los monómeros, sino tambiuén al
variar su posición dentro de las cadenas. Así,
existen los siguientes tipos de copolímeros.
Las mezclas físicas de polímeros, que no
llevan uniones permanentes entre ellos, también
constituyen a la enorme versatilidad de los materiales
poliméricos. Son el equivalente a las aleaciones
metálicas.
En ocasiones se mezclan para mejorar alguna propiedad,
aunque generalmente a expensas de otra. Por ejemplo, el
óxido de polifenilo tiene excelente resistencia
térmica pero es muy dificil procesarlo. El poliestireno
tiene justamente las propiedades contrarias, de manera que al
mezclarlos se gana en facilidad de procedimiento,
aunque resulte un material que no resistirá temperaturas
muy altas.. Sin embargo en este caso hay un efecto
sinergístico, en el sentido en que la resistencia mecánica es mejor en algunos aspectos que a
la de cualquiera de los dos polímeros. Esto no es
frecuente, porque puede ocurrir únicamente cuando existe
perfecta compatibilidad ente los dos polímeros y por regla
general no la hay, así que en la mayoría de los
casos debe agregarse un tercer ingrediente para compatibilizar la
mezcla. Lo que se emplea casi siempre es un copolímero
injertado, o uno de bloque que contenga unidades estructurales de
los dos políméros.
Otras veces se mezcla simplemente para reducir el costo
de material.
En otros casos, pequeñas cantidades de un
polímero de alta calidad puede
mejorar la del otro, al grado de permitir una nueva
aplicación.
Copolímeros y Terpolímeros.
A continuación se citaran los
copolímeros y terpolímeros de mayor
aplicación en la industria:
SAN
Copolímero de estireno-acrilonitrilo en los que
el contenído de estireno varía entre 65 y 80 %.
Estos materiales tienen buena resistencia a los aceites
lubricantes, a las grasas y a las
gasolinas. Asimismo, tiene mejores propiedades de impacto,
tensión y flexión, que los homopolímeros del
estireno. Los copolímeros son transparentes, pero con un
ligero color amarillo que se vuelve más oscuro a medida
que aumenta el contenido en acrilonitrilo. Al mismo tiempo mejora
la resistencia química, la resistencia al agrietamiento
ambiental y la resistencia térmica al aimentar el
porcentaje en acrilonitrilo.
El SAN se usa cuando se requieren partes rígidas,
con buena estabilidad dimensional y buena resistencia
térmica, por ejemplo, en partes de las máquinas
lavaplatos y en piezas para radios u televisores. Se lo emplea en
grandes cantidades en la industria alimenticia. los
copolímeros con 30 % estireno y 70 % acrilonitrilo, son
excelentes barreras contra el oxígeno, el CO2 y la
humedad.
ABS
Terpolímero acrilonitrilo-butadieno-estireno. Son
materiales heterogéneos formados por una fase
homogénea rígida y una elastomérica.
Originalmente se mezclaban emulsiones de los dos polímeros
de SAN y polibutadieno. La mezcla era coagulada para obtener
ABS.
Ahora se prefiere polimerizar estireno y acrilonitrilo
en presencia de polibutadieno. De esa manera, una parte del
estireno y del acrilonitrilo se copolimerizan formando SAN y otra
porción se injerta sobre las moléculas de
polibutadieno.
El ABS se originó por la necesidad de mejorar
algunas propiedades del poliestireno de alto impacto. Este
material tiene tres desventajas importantes:
- Baja temperatura de ablandamiento.
- Baja resistencia ambiental.
- Baja resistencia a los agentes
químicos.
La incorporación del acrilonitrilo en la fase
continua, imparte mayor temperatura de ablandamiento y mejora
considerablemente la resistencia química. Sin embargo, la
resistencia ambiental se vuelve todavía menor, pero este
problema se resuelve empleando aditivos. Las propiedades del ABS
son suficientemente buenas para varias aplicaciones:
– Artículos moldeados,
-Artículos extruidos.
Copolímeros estireno-butadieno.
Éstos son los hules sintéticos que han
sustituído practicamente en su totalidad al natural, en
algunas aplicaciones como las llantas para
automóviles.
Los hules sintéticos contienen 25 % de estireno y
75 % butadieno; sus aplicaciones incluyen en oreden de
importancia:
- Llantas,
- Espumas,
- Empaques,
- Suelas para zapatos,
- Aislamiento de alambres y cables
eléctricos, - Mangeras.
Los copolímeros de estirenio-butadieno con mayor
contenido de batadieno, hasta de 60 %, se usan para hacer
pinturas y recubrimientos ahulados. Para mejorar la adhesividad,
en ocasiones se incorpora el ácido acrílico o los
ésteres acrílicos, que elevan la polaridad de los
copolímeros.
Otros copolímeros del estireno.
MBS. Se obtienen injertando metacrilato de metilo o
mezclas de metacrilato y estireno, en las cadenas de un hule de
estireno-batadieno.
Acrílicos. Copolímeros de
metacrilato-butilacrilato-estireno o de
metacrilato-hexilacrilato-estireno.
Otros copolímeros importantes del estireno, se
realizan polimerizando en suspensión, estireno en
presencia de divinil-benceno, para obtener materiales entre
cruzados, que por sulfonación y otras reacciones
químicas se convierten en las conocidas resinas de
intercambio iónico.
Poliestireno de alto
impacto.
Para hacer este material, se dispersa un
elastómero en una matríz que puede ser de
poliestireno o de algunos de sus copolímeros. Las variables
importantes de la fase continua son:
- Distribución de pesos moleculares.
- Composición, cuando se trata de un
copolímero.
Las variables importantes de la fase elastomérica
son:
- Número, tamaño, distribución de
tamaños y formas de las partículas
dispersadas. - Composición, si es un
copolímero. - Grado de entrecrusamiento en el
elastómero.
Existen dos procedimientos
para obtener poliestireno de alto impacto:
- Mezclar poliestireno directamente con el
elastómero. - Mezclar estireno, el elastómero, el
catalizante y el acelerante y se produce la
polimerización.
CPE.
Los polietilenos clorados se obtienen clorando
polietileno de alta densidad con 30 % a 40 % de cloro. Tiene baja
cristalinidad y baja temperatura de transición
vítrea. Un nivel de cloro del 36 % resultó
experimentalmente para un buen balance al
impacto-dispersabilidad-procesabilidad.
EVA.
Copolímero del etileno y acetato de vinilo con 30
% a 50 % del acetato, posee propiedades
elastoméricas.
Lubricantes.
Los lubricantes mejoran la procesabilidad de los
polímeros, realizando varias importantes funciones.
- Reducen la fricción entre las
partículas del material, minimizando el calentamiento
friccional y retrasando la fusión hasta el punto
óptimo. - Reducen la viscocidad del fundido promoviendo el buen
flujo del material. - Evitan que el polímero caliente se pegue a las
superficies del equipo de procesamiento.
A los lubricantes se los clasifican en:
- Lubricantes externos, que son los que reducen la
fricción entre las moléculas del polímero
y disminuyen la adherencia polímero metal. - Ceras parafínicas, con pesos moleculares entre
300 y 1500, y temperaturas de fusión entre 65 a 75
°C. Las lineales son más rígidas, por su
mayor cristalinidad. En las ramificadas, la cristalinidad es
menor y los cristales más pequeños. - Ceras de polietileno, son polietilenos de muy bajo
peso molecular, ligeramente ramificadas, con temperaturas de
fusión de 100 a 130 °C. Son más efectivas que
las parafinas. - Ceras tipo éster, se trata de
glicéridos obtenidos de cebos y contienen ácidos
grasos con 16 a 18 átomos de carbono. El más
importante es el triesterato.
Los lubricantes internos y las amidas de los
ácidos también se emplean con este fin.
Polímeros de bloque e
injertos
Se han desarrollado nuevos métodos interesantes
para la síntesis
de copolimeros de bloque e injertos. Estos métodos han
encontrado aplicación practica en la preparación de
poliestireno de alta resistencia al impacto, de los cauchos de
elevada resistencia a la abrasión y de fibras
acrílicas.
Un principio de la copolimerización por injertos
consiste en polimerizar un monomero, el monomero-B, en presencia
de un polímero, el poli-A, de manera tal que los centros
iniciadores de las reacciones de la segunda polimerización
estén situados todos en el polímero original. Una
forma particularmente efectiva de conseguir este resultado es
someter el poli-A a la degradación mecánica en
presencia del mono-B. Si las cadenas del polímero se
rompen por la acción mecánica, se forman dos
radicales libres en el punto de ruptura de la cadena. Estos dos
radicales pueden utilizarse si se evita que se recombinen o
desproporcionen uno con el otro o que sean consumidos por
algún otra impureza reactiva, como el oxigeno y en
presencia de un monomero vinílico. Muchos tipos de
agitación mecánica, particularmente el prensado en
calandria, la molienda, la compresión en estado plástico y
la agitación y sacudimiento en solución, conducen a
la unión química del segundo monomero y el primer
polímero. Para que la degradación mecánica
sea efectiva, conviene que el poli-A tenga un peso molecular
relativamente alto. Se han echo grandes progresos en la
injertación del estireno, esteres acrílicos y
acrilonitrilo al caucho y a
muchos elastomeros sintéticos; los monomeros
vinílicos también se ha injertado a la celulosa y
derivados de esta, poliésteres, poliamidas,
poliéteres y proteínas. Los productos
resultantes combinan en forma muy interesante las propiedades de
los dos compuestos.
Los trabajos sobre la radiación
de injertos han progresado considerablemente, sobre todo mediante
el empleo de
mejores fuentes de radiación penetrante (aparato de Van de
Graaff, acelerador lineal, Co60 y Cs137) y
por el descubrimiento de que la luz ultravioleta es capaz
también de producir enlaces transversales e injertos en
presencia de sensibilizadores. En muchos casos se ha reducido
substancialmente la degradación indeseable del poli-A
producida por la acción de la radiación y
penetrante, mediante la aplicación de estabilizadores del
tipo amina aromática disulfuro
aromático.
Pueden obtenerse injertos muy efectivos de todos los
tipos de polímeros vinílicos si la cadena del
poli-A lleva un grupo amino
aromático primario. Este grupo es asilado
primero
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
después es nitrosilado.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
La nitrosamina puede isomerizarse al diazoester, este a
su vez, se disocia con desprendimiento de hidrogeno y
produce un radical libre que se fija químicamente a la
cadena:
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
El radical acilo se transfiere rápidamente con
los átomos de hidrogeno disponibles y no inicia la
polimerización del mono-B. Por este método se
ha efectuado un injerto de monomeros vinílicos sobre el
poliestireno parcialmente aminado.
Una nueva forma de preparar los copolimeros de bloque se
basa en la protección de la cadena que crece por
propagación anionica contra la terminación por
solvatacion del extremo de la cadena por el disolvente. Si el
sodio se hace reaccionar a baja temperatura en tetrahidrofurano
con naftaleno, se transfiere un electrón del sodio al
sistema aromático:
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
La solución resultante es verde y muy sensible al
oxigeno. Si se le agrega estireno, el color cambia a rojo debido
a que el electrón solitario se transfiere al monomero
estireno, que se dimeriza inmediatamente para formar un bis-anion
conforme a la siguiente reacción:
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Las cargas negativas están compensadas por dos
iones de sodio, pero permanecen disociadas porque están
fuertemente solvatadas por el tetrahidrofurano. Las cargas
negativas del bis-ion son capaces de iniciar la
polimerización del estireno, y a cada lado del centro
iniciador crece una cadena hasta que es consumido todo el
monomero, puesto que la solvatacion por el disolvente evita la
terminación (polímeros vivientes). Después
de consumido el monoestireno puede agregarse otro monomero, y
como la polimerización continua, se forman copolimeros de
bloque cuya composición y peso molecular pueden regularse
fácilmente por la adición de los componentes y por
la terminación del crecimiento posterior de la cadena con
oxigeno u otro interruptor de la etapa.
Procesos de polimerización.
Existen diversos procesos para unir moléculas
pequeñas con otras para formar moléculas grandes.
Su clasificación se basa en el mecanismo por el cual se
unen estructuras monómeras o en las condiciones
experimentales de reacció.
Mecanismos de polimerización. La
polimerización puede efectuarse por distintos
métodos a saber:
Polimerización por
adición.
- Adición de moléculas pequeñas de
un mismo tipo unas a otras por apertura del doble enlace sin
eliminación de ninguna parte de la molécula
(polimerización de tipo vinilo.). - Adición de pequeñas moléculas de
un mismo tipo unas a otras por apertura de un anillo sin
eliminación de ninguna parte de la molécula
(polimerización tipo epóxido.). - Adición de pequeñas moléculas de
un mismo tipo unas a otras por apertura de un doble enlace con
eliminación de una parte de la molécula
(polimerización alifática del tipo
diazo.). - Adición de pequeñas moléculas
unas a otras por ruptura del anillo con eliminación de
una parte de la molécula (polimerización del tipo
-aminocarboxianhidro.). - Adición de birradicales formados por
deshidrogenación (polimerización tipo
p-xileno.).
Polimerización por
condensación.
- Formación de poliésteres, poliamidas,
poliéteres, polianhidros, etc., por eliminación
de agua o
alcoholes,
con moléculas bifuncionales, como ácidos o
glicoles, diaminas, diésteres entre otros
(polimerización del tipo poliésteres y
poliamidas.). - Formación de polihidrocarburos, por
eliminación de halógenos o haluros de
hidrógeno, con ayuda de catalizadores metálicos o
de haluros metálicos (policondensación del tipo
de Friedel-Craffts y Ullmann.).
Polimerización en suspención,
emulsión y masa.
a. Polimerización en suspensión. En
este caso el peróxido es soluble en el monómero. La
polimerización se realiza en agua, y como el
monómero y polímero que se obtiene de él son
insolubles en agua, se obtiene una suspención. Para evitar
que el polímero se aglomere en el reactor, se disuelve en
el agua una pequeña cantidad de alcohol
polivinílico, el cual cubre la superficie de las gotitas
del polímero y evita que se peguen.
b. Polimerización en emulsión. La
reacción se realiza también en agua, con
peróxidos solubles en agua pero en lugar de adredarle un
agente de suspención como el alcohol polivinílico,
se añade un emulsificante, que puede ser un detergente o
un jabón. En esas condiciones el monómero se
emulsifica, es decir, forma gotitas de un tamaño tan
pequeño que ni con un microscopio
pueden ser vistas. Estas microgotitas quedan estabilizadas por el
jabón durante todo el proceso de la polimerización,
y acaban formando un latex de aspecto lechoso, del cual se hace
presipitar el polímero rompiendo la emulsión.
posteriormente se lava, quedando siempre restos de jabón,
lo que le imprime características esopeciales de
adsorción de aditivos.
c.Polimerización en masa. En este tipo de
reacción, los únicos ingredientes son el
monómero y el peróxido. El polímero que se
obtiene es muy semejante al de suspención, pero es
más puro que éste y tiene algunas ventajas en la
adsorción de aditivos porque no esta contaminado con
alcohol polivinílico. Sin embargo, debido al gran
tamaño de sus partículas no se dispersa en los
plastificantes y no se usa para plastisoles.
RESINA | TAMAÑO DE PARTICULA | PESO MOLECULAR | APLICACIONES |
Suspensión | 45 400 | 24,000 a 80.000 | calandreo extrusión moldeo |
Masa | 70 170 | 28.000 a 80.000 | calandreo extrusión moldeo |
Emulsión | 1 20 | 38.000 a 85.000 | plastisoles |
Propiedades y aplicaciones de las tres variedades para
el caso del PVC
Los biomateriales se
pueden definir como materiales biológicos comunes tales
como piel, madera,
o cualquier elemento que remplace la función de los
tejidos o de
los órganos vivos. En otros términos, un
biomaterial es una sustancia farmacológicamente inerte
diseñada para ser implantada o incorporada dentro del
sistema vivo.
Los biomateriales se implantan con el objeto de
remplazar y/o restaurar tejidos vivientes y sus funciones, lo que
implica que están expuestos de modo temporal o permanente
a fluidos del cuerpo, aunque en realidad pueden estar localizados
fuera del propio cuerpo, incluyéndose en esta
categoría a la mayor parte de los materiales dentales que
tradicionalmente han sido tratados por
separado.
Debido a que los biomateriales restauran funciones de
tejidos vivos y órganos en el cuerpo, es esencial entender
las relaciones existentes entre las propiedades, funciones y
estructuras de los materiales biológicos, por lo que son
estudiados bajo tres aspectos fundamentales: materiales
biológicos, materiales de implante y la interacción
existente entre ellos dentro del cuerpo. Dispositivos como
miembros artificiales, amplificadores de sonido para el
oído y
prótesis faciales externas, no son considerados como
implantes.
La biomecánica se encarga de estudiar la
mecánica y la dinámica de los tejidos y las relaciones
que existen entre ellos; esto es muy importante en el diseño
y el injerto de los implantes. Después de realizado un
injerto, no se puede hablar del éxito
de un implante, este se debe considerar en términos de la
rehabilitación del paciente; por ejemplo, en el implante
de cadera se presentan cuatro factores independientes: fractura,
uso, infección y desprendimiento del mismo.
Figura 32. Dispositivo para el
tratamiento de hidrocefalia y su colocación en cerebro.
Está hecho de silicón.
Si la probabilidad de
que un sistema falle es f, entonces la probabilidad que tiene el
paciente de rehabilitación es: r = 1 – f. La probabilidad
de rehabitación total rt puede expresarse en
términos de las probabilidades reales de los factores que
contribuyen a la falla del sistema rt = r1
. r2 … rn donde r1 = 1 –
f1, r2 = 1 – f2,
etcétera.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura 33. Uso del
estimulador eléctrico para activar y acelerar el
crecimiento del tejido óseo en fracturas, con y sin
tornillos de fijación. Todos son biomateriales.
Por lo anterior, si r = 1, entonces el implante es
perfecto, mientras que si, por ejemplo, ocurre siempre una
infección tendremos r = 0, es decir, no hay probabilidades
de rehabilitación del paciente.
En algunos casos la función de los tejidos u
órganos es tan importante que no tiene sentido el
remplazarlos por biomataeriales; por ejemplo, la médula
espinal o el cerebro.
El éxito de un biomaterial o de un implante
depende de tres factores principales: propiedades y
biocompatibilidad del implante, condiciones de salud del receptor, y
habilidad del cirujano que realiza el implante; la física
sólo se aplica al primero.
Los requisitos que debe cumplir un biomaterial
son:
1. Ser biocompatible, es decir, debe ser aceptado por
el organismo, no provocar que éste desarrolle sistemasde
rechazo ante la presencia del biomaterial
2. No ser tóxico, ni
carcinógeno.
3. Ser químicamente estable (no presentar
degradación en el tiempo) e inerte.
4. Tener una resistencia mecánica
adecuada.
5. Tener un tiempo de fatiga adecuado.
6. Tener densidad y peso adecuados.
7. Tener un diseño de ingeniería perfecto; esto es, el
tamaño y la forma del implante deben ser los
adecuados.
8. Ser relativamente barato, reproducible y
fácil de fabricar y procesar para su producción en gran escala.
Hay, de hecho, cuatro grupos de materiales
sintéticos usados para implantación:
metálicos, cerámicos, poliméricos y
compuestos de ellos; el cuadro IV enumera algunas de las
ventajas, desventajas y aplicaciones para los cuatro grupos de
materiales sintéticos.
Una alternativa para los implantes artificiales es el
trasplante, por ejemplo de riñón o corazón,
aunque este esfuerzo se ve obstaculizado por problemas
sociales, morales, éticos e inmunológicos; sin
embargo, en el caso del riñón, el paciente tiene
muchas desventajas con uno artificial: su costo es elevado, no
tiene movilidad y, además, el mantenimiento
y el cuidado deben ser constantes.
Los usos quirúrgicos de los biomateriales son
múltiples, por ejemplo, para implantes
permanentes:
- En el sistema esquelético muscular, para
uniones en las extremidades superiores e inferiores (hombros,
dedos, rodillas, caderas, etc.) o como miembros artificiales
permanentes; b) en el sistema
cardiovascular, corazón (válvula, pared,
marcapasos, corazón entero), arterias y venas; c)
en el sistema
respiratorio, en laringe, tráquea y bronquios,
diafragma, pulmones y caja torácica; d) en
sistema
digestivo: esófago, conductos biliares e
hígado; e) en sistema genitourinario, en
riñones, uréter, uretra, vejiga; f) en
sistema
nervioso, en marcapasos; g) en los sentidos:
lentes y prótesis de córneas, oídos y
marcapasos caróticos; h) otras aplicaciones se
encuentran por ejemplo en hernias, tendones y adhesión
visceral; i) implantes cosméticos maxilofaciales
(nariz, oreja, maxilar, mandíbula, dientes), pechos,
testículos, penes,
etcétera.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
CUADRO IV. Materiales para
implantación
La caracterización física de las
propiedades requeridas de un material para aplicaciones
médicas, varía de acuerdo con la aplicación
particular. Debemos considerar que las pruebas
fisicoquímicas de los materiales para implante in
vivo son difíciles, si no imposibles. Las pruebas
in vitro deben ser realizadas antes del implante. La fabricación y el uso de los
materiales depende de sus propiedades mecánicas, tales
como resistencia, dureza, ductibilidad, etcétera. Las
propiedades elásticas y viscoelásticas serán
caracterizadas antes que las estáticas y
dinámicas.
La naturaleza (iónico, covalente y
metálico), y la fuerza de los enlaces atómicos
determinan qué tan estable es el material cuando se le
aplica una carga, es decir, cuando se le somete a un esfuerzo de
tipo mecánico; este tipo de propiedades son conocidas como
mecánicas. Cuando se determina la estabilidad del
material en función de cambios en la temperatura, se habla
de propiedades térmicas.
Cuando estiramos un material, son las fuerzas entre los
enlaces moleculares (fuerzas de atracción y
repulsión entre los átomos que las componen) las
que determinan el comportamiento del material. Inicialmente, la
mayor parte de los materiales cumplen con la Ley de Hooke, es
decir, la fuerza que se aplica para estirarlo (o comprimirlos) es
proporcional a la distancia de deformación. La constante
de proporcionalidad se llama constante elástica, y
está relacionada indirectamente con la energía del
enlace, lo que podemos expresar como:
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
donde representa el esfuerzo, que es la
fuerza por unidad de área de sección transversal,
es la deformación o estiramiento del material,
dada por el cambio en la longitud respecto a la longitud original
(l/l0 y E se conoce como módulo elástico
o Módulo de Young el cual es una característica del
material.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Figura 34. Diversos
diseños de componentes de cabezas de fémur y
componentes de cadera.
Cuando un material es sometido a deformación por
estiramiento, es posible determinar dos regiones bien marcadas en
el comportamiento que presenta: la elástica, donde la
deformación es proporcional al esfuerzo aplicado: el
material regresa a su forma original cuando la fuerza que
actúa sobre él se elimina; y la
plástica, en la que no existe proporcionalidad
entre la fuerza aplicada y el estiramiento, en este caso el
material no regresa a su forma original al anularse la fuerza que
actúa sobre él. Generalmente, los materiales
sometidos a fuerzas pequeñas siguen un comportamiento de
tipo elástico, pero a medida que la fuerza crece el
comportamiento pasa a ser del tipo plástico, y si la
fuerza sigue creciendo, puede ocurrir la fractura del
material.
En los materiales cerámicos y en los
vítreos es fácil que ocurra la fractura,
además es impredecible el momento en que esto puede
suceder, por lo que, aunque presentan un alto grado de
biocompatibilidad, no son muy usados en implantes.
La resistencia al impacto es la cantidad que
puede absorber un material de energía debida a la fuerza
ejercida sobre él por un golpe, es decir, por una fuerza
grande en magnitud aplicada durante un tiempo muy corto.
Ésta es otra de las pruebas que tiene que pasar un
material que se requiere para implantación, los requisitos
sobre la medida dependerán del uso que se le
dé.
La dureza es una medida de la deformación
plástica, y se define como la fuerza por unidad de
área de penetración o indentación en el
material. Para determinarla de manera experimental, es claro que
el método dependerá del tipo de material de que se
trate; en el caso de metales, por
ejemplo, se incrusta una punta de diamente en forma de
pirámide en la superficie del material, con una fuerza
conocida, y se mide la penetración que alcanza. Si se
trata de un polietileno, se utiliza una esfera de acero
inoxidable sobre la superficie, midiéndose la
penetración que alcanza para una carga dada.
Otra propiedad importante del material es la de
termofluencia, es decir, la deformación que sufre
con el tiempo al someterse a una carga conocida. La
deformación elástica que sufre inicialmente el
material ante una carga dada, es seguida de una termofluencia
(algo así como el corrimiento entre las capas
atómicas que lo constituyen, similar a lo que sucede con
los fluidos), antes de que se presente la fractura.
El desgaste de un material de implantes tiene
importancia en especial si se trata de remplazar uniones. El
desgaste del material está estrechamente relacionado con
la fricción entre los dos materiales. Es importante
considerar el área real de la superficie que entra en
contacto en la unión requerida ya que, en general, es
mucho menor de lo que aparenta; ésta puede incrementarse
con el peso que se aplica para los materiales dúctiles y
para los elásticos.
En las prótesis de uniones entre huesos, el
desgaste es muy importante, y resulta del movimiento y
recolocación de los materiales usados.
Hay diferentes tipos de desgaste: el corrosivo,
debido a la actividad química de alguno de los materiales
de la unión; el de fatiga superficial, debido a la
formación de pequeñas fracturas que pueden dar
lugar a un rompimiento del material, y el abrasivo, en el
cual partículas de una superficie son empujadas hacia la
otra en la que se adhieren, debido al movimiento que se
tiene.
Cuando hay lubricación entre dos superficies en
contacto, la fricción y las propiedades de desgaste cambia
drásticamente. En la mayoría de las aplicaciones a
implantes existe algún tipo de lubricante.
Como podemos notar, la física está
presente en todas las ramas de la medicina: no
sólo en la investigación básica, también
en la instrumentación, en los implantes, en la
clínica, en diagnosis, en terapia,
etcétera.
Es tradicional que los estudiantes tengan problemas
tanto en física como en matemáticas porque desde muy jóvenes
les han hecho sentir que son materias muy difíciles,
incluso algunas veces se dan por vencidos antes de tratar de
entender los conceptos básicos, y esto obviamente
dificulta su aprendizaje. Este
fenómeno se da en todos los niveles de la educación; sin
embargo, vivimos en un mundo en el que la física
está presente en todo momento, ya que es la ciencia que
explica el comportamiento de la naturaleza. El cuerpo humano
y la tecnología que para él podemos desarrollar no
pueden quedar excluidos.
Con este pequeño libro esperamos que los
estudiantes de medicina ahuyenten su miedo por la física y
que los estudiantes de física se interesen en las
aplicaciones que ésta tiene en medicina.
Los productos cerámicos son materiales
sólidos inorgánicos no metálicos que pueden
ser cristalinos o no cristalinos. Los materiales cerámicos
no cristalinos incluyen el vidrio y unos cuantos materiales
más con estructuras amorfas.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Los materiales cerámicos son muy resistentes al
calor, la corrosión y el desgaste, no se deforman
fácilmente cuando se someten a esfuerzos y son menos
densos que algunos metales empleados en aplicaciones de alta
temperatura. Algunos materiales ceramicos que se usan en aviones,
proyectiles y vehículos espaciales pesan sólo el
40% de lo que pesarían los componentes metálicos a
los que sustituyen.
A pesar de tantas ventajas, el empleo de productos
cerámicos como materiales de ingeniería ha estado
limitado por su naturaleza extremadamente quebradiza. En tanto
que un componente metálico podría abollarse si se
le golpea, una pieza cerámica por lo regular se hace pedazos
porque los enlaces impiden que los átomos se deslicen unos
sobre otros. Además, es difícil fabricar
componentes cerámicos sin defectos. Efectivamente, los
elevados costos de
fabricación y la incierta confiabilidad de los componentes
son barreras que deberán vencerse antes de que los
materiales cerámicos se utilicen más ampliamente
para sustituir a los metales y a otros materiales estructurales.
Es por ello que la atención en años recientes se ha
enfocado en el procesamiento de los materiales cerámicos,
así como en la formación de materiales
cerámicos compuestos y el desarrollo de recubrimientos
cerámicos delgados sobre materiales
convencionales.

Materiales cerámicos
compuestos
Los objetos cerámicos son mucho más
fuertes cuando se forman a partir de una mezcla compleja de dos o
más materiales. Semejantes mezclas se denominan materiales
compuestos o composites. Los materiales compuestos más
eficaces se forman por la adición de fibras
cerámicas a un material cerámico.
Así, el material compuesto consiste en una
matriz
cerámica que contiene fibras embebidas de un material
cerámico, que podría o no tener la misma
composición química que la matriz. Por
definición, una fibra tiene una longitud de por lo menos
100 veces su diámetro. Las fibras suelen tener una
resistencia elevada cuando se someten a cargas aplicadas a lo
largo de su eje longitudinal. Si las fibras están
embebidas en una matriz, la fortalecen porque resisten
deformaciones que ejercen un esfuerzo sobre la fibra a lo largo
de su eje longitudinal.
La formación de fibras cerámicas se
ilustra con el caso del carburo de silicio, SiC, o
carborúndum. El primer paso de la producción de
fibras de SiC es la síntesis de un polimero,
polidimetilsilano:

Si este polímero se calienta a cerca de
400ºC, se convierte en un material que tiene atomos de
carbono y silicio alternantes a lo largo de la cadena:

Las fibras formadas a partir de este polímero se
calientan entonces lentamente a cerca de 1200° C en una
atmósfera
de nitrógeno para expulsar todo el hidrógeno y
todos los átomos de carbono excepto los que enlazan
directamente los átomos de silicio.
El producto final es un material cerámico con
composición SiC, en forma de fibras cuyo diámetro
varía entre 10 y 15 um. Mediante procedimientos similares,
partiendo de un polímero orgánico apropiado, es
posible fabricar fibras cerámicas con otras composiciones,
como el nitruro de boro, BN. Si las fibras cerámicas se
agregan a un material cerámico procesado como se
explicó antes, el producto resultante tiene una
resistencia mucho más alta a las fallas
catastróficas por agrietamiento.
Aplicaciones de los materiales
cerámicos
Los productos cerámicos, sobre todo los nuevos
"composites" cerámicos, se utilizar ampliamente en la
industria de las herramientas
para cortar. Por ejemplo, la alúmina
reforzada con fibras extremadamente finas de carburo de silicio
se usa para cortar y maquinar hierro colado
y aleaciones
más duras a base de níquel. También si
utilizan materiales cerámicos en las ruedas de amolar y
otros abrasivos a causa de si excepcional dureza (Tabla 12.4). El
carburo de silicio es el abrasivo más ampliamente
utilizado.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Los materiales cerámicos
desempeñan un papel importante en la industria
electrónica. Los circuitos integrados semiconductores
generalmente se montan en un sustrato de cerámica, por lo
regular alúmina. Algunos materiales cerámicos,
notablemente el cuarzo (Si O2 cristalino), son
piezoeléctricos, lo que significa que generan un potencial
eléctrico cuando se les somete a un esfuerzo
mecánico. Esta propiedad hace posible el empleo de
materiales piezoeléctricos para controlar las frecuencias
en los circuitos electrónicos, como en los relojes de
cuarzo y los generadores ultrasónicos.
Se usan materiales cerámicos para fabricar placas
cerámicas que cubren las superficies de los
transbordadores espaciales, a fin de protegerlas contra el
sobrecalentamiento durante el reingreso en la atmósfera
terrestre. Las placas se fabrican con fibras de sílice
cortas de alta pureza reforzadas con fibras de boro silicato de
aluminio. El
material se moldea en bloques, se sinteriza a más de
1300° C luego se corta en placas. Las placas tienen una
densidad de apenas 0.2 g/cnr, pero pueden mantener la piel de
aluminio del trasbordador por debajo de los 180º C cuando la
temperatura superficial es de hasta 1250ºC.
Las películas delgadas se utilizaron inicialmente
con fines decorativos. En el siglo XVII, los artistas aprendieron
a pintar un patrón en un objeto cerámico con una
disolución de una sal de plata y calentar después
el objeto para causar la descomposición la sal y dejar una
película delgada de piata metálica. Hoy día,
las películas delgadas se utilizan con fines de
decoración o de protección: para formar
conductores, resistores y otros tipos de películas en
circuitos, microelectrónicas; para formar positivos
fotovoltaicos que convierten energía
solar en electricidad; y
para muchas otras aplicaciones.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Las películas delgadas pueden hacerse con
cualquier tipo de material, incluidos metales, óxidos
metálicos y sustancias orgánicas.
El término película delgada no tiene una
definición precisa; en general se refiere a peliculas cuyo
espesor va de 0.1 um hasta unos 300 um, y normalmente no se
aplica cubrimientos como pinturas o barnices, que suelen ser
mucho más gruesos. Para que una película delgada
sea útil, debe poseer todas o casi todas las propiedades
siguientes: (a) debe ser químicamente estable en el
entorno en el que se usará; debe adherirse bien a la
superficie que cubre (el sustrato); (c) debe tener un espesor
uniforme; (d) debe ser químicamente puro o tener una
composición química controlada; y (e) debe tener
una baja densidad de imperfecciones. Además de estas
características generales, podrían requerirse
propiedades especiales para ciertas aplicaciones. Por ejemplo, la
película podría tener que ser aislante o
semiconductora, o poseer propiedades ópticas o
magnéticas especiales-
Una película delgada so debe adherir al sustrato
subyacente para poder ser util. Dado que la película es
inherentemente frágil, depende del sustrato para su apoyo
estructural. Tal apoyo sólo se logra si la película
está unida al sustrato por fuerzas tensas. Las fuerzas de
unión pueden ser químicas; es decir, una
reacción química en la superficie puede conectar la
película con el material subyacente. Por ejemplo, cuando
un óxido metálico se deposita en vidrio, las redes
de óxido del óxido metálico del vidrio se
combinan en la interfaz para formar una zona delgada de
composición intermedia. En estos casos las energías
de enlace entre la película y el sustrato tienen una
magnitud del mismo orden que la de los enlaces
químicos, es decir, de 250 a 400 KJ/mol. En algunos
casos, empero, la unión entre la película y el
sustrato se basa únicamente en fuerzas intermoleculares de
Van der Waals y electrostáticas, como podría darse
cuando una película de un polímero orgánico
se deposita en una superficie metálica. Las
energías que unen la película al sustrato en tales
casos pudrían ser sólo del orden de 50 a 100
kJ/mol, así que las películas no son tan
robustas.
Usos de las películas delgadas
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Las películas delgadas se usan en
microelectrónica como conductores, resistores condensadores.
También se usan ampliamente como recubrimientos
ópticos en lentes para reducir la cantidad de luz
reflejada en la superficie del lente y para proteger la lente.
Las películas delgadas metálicas se han utilizado
desde hace mucho como recubrimientos protectores de metales; por
lo regular, se depositan a partir de soluciones
empleando corrientes eléctricas, como en el chapeado con
plata y el "cromado".
Las superficies de herramientas metalicas se cubren con
películas delgadas cerámicas para aumentar su
dureza. Aunque consumidor no se
da cuenta de ello, casi todas las botellas de vidrio que compra
estan recubiertas con una o más películas delgadas.
Las películas se aplican al vidrio con objeto de reducir
las rayaduras y la abrasión y aumentar la lubricidad, es
decir, la facilidad con que las botellas pueden deslizarse unas
contra otras. La película delgada más común
es de óxido de estaño (IV), Sn
O2.
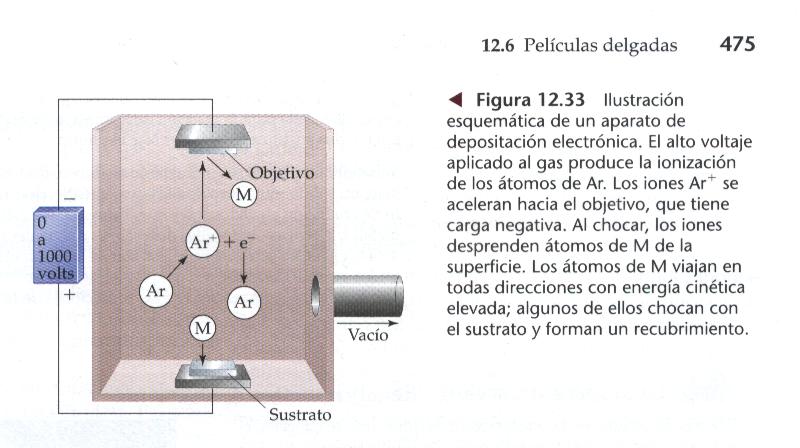
Formación de películas
delgadas
Las películas delgadas se forman por diversas
técnicas, que incluyen depositación
al vacío, depositación electrónica y
depositación de vapor químico.
La depositación al vacío se usa para
formar películas delgadas de sustancias que se pueden
vaporizar o evaporar sin destruir su identidad
química. Tales sustancias incluyen metales, aleaciones
metálicas y compuestos orgánicos simples con
óxidos, sulfures, fluoruros y cloruros.
La depositación electrónica implica el
empleo de un alto voltaje para eliminar material de una fuente, u
objetivo. Los átomos desprendidos del objetivo viaja
través del gas ionizado dentro de la cámara y se
depositan en el sustrato. La superficie del objetivo es el
electrodo negativo, o cátodo, del circuito; el sustrato
puede estar conectado al electrodo positivo, o anodo.
La cámara contiene un gas inerte como
argón que se ioniza en el campo de alto voltaje. Los
iones, cargados positivamente, se aceleran hacia la superficie
del objetivo y chocan contra ella con suficiente energía
como para desprender átomos del material objetivo. Muchos
de estos átomos se aceleran hacia la superficie del
sustrato y, al chocar con ella, forman una película
delgada.
La depositación electrónica se utiliza
ampliamente para formar películas delgadas de elementos
como silicio, titanio, niobio, tungsteno, aluminio, oro y plata.
Tambien se emplea para formar películas delgadas de
materiales refractarios como carburos, boruros y nitruros en las
superficies de herramientas metálicas, para feriar
películas lubricantes suaves como las de disulfuro de
molibdeno, y para aplicar cubrimientos ahorradores de
energía a vidrio arquitectónico.
En la depositación de vapor químico, la
superficie se recubre con un compuesto químico
volátil y estable a una temperatura por debajo del punto
de fusión de la superficie. Entonces, el compuesto sufre
algún tipo de reacción química para formar
un recubrimiento adherente estable.
1. BROWN-
LEMAY Química: Ciencia Central
Paerson Educación México 2004 Unidad 12
2. Internet
Páginas:
http://www.unex.es/qoceres/molmay.htm
http://personal.telefonica.terra.es/web/flromeras/cristal.htm
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen2/ciencia3/104/htm/sec_6.htm
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/37/htm/SEC_14.html
http://members.tripod.com/fotografia/textos/polimeros.htm
Alcoser Serrano Paco Junior
Guayaquil – Ecuador
– 2004
Escuela Superior Politécnica del
Litoral
(ESPOL)


