- Resumen
- Aminoácidos,
péptidos y proteínas. Una mirada básica y
edificante. - Síntesis de
péptidos. - Bibliografía.
Las proteínas,
sn los componentes estructurales mínimos de toda organización compleja con vida: virus y
microorganismos, células,
tejidos,
órganos y sistemas.
La estructura no
solamente permite la continuidad de la vida si no el desarrollo
fisiológico del mismo y la interacción y la replicación del ser
vivo que compone.
Hoy en día, se han sintetizados miles de
moléculas en el laboratorio,
ya se puede obtener síntesis
de cadenas peptídicas, sencillas y complejas,
monitorizandolas bajo procedimientos
sencillo de atracción y rechazo químico en entre
aminoácidos. Aun así, aun no se ha completado el
proceso hasta
convertirlas a la compleja estructura cuaternaria por ello se
apela a diseños sencillos, sin mayor elaboración.
Este trabajo
intenta explicar la sencillez y la complejidad del mismo y
esperamos que sea un estimulo para todos aquello quines comienzan
en el campo de la investigación de las estructuras
proteicas.
2. Aminoácidos,
péptidos y Proteinas. Una mirada basica y
edificante.
2.1 proteinas, algunas nociones
basicas
Las proteínas son los materiales que
desempeñan un mayor numero de funciones en las
células de todos los seres vivos. Por un lado, forman
parte de la estructura básica de los tejidos
(músculos, tendones, piel,
uñas, etc.) y, por otro, desempeñan funciones
metabólicas y reguladoras (asimilación de
nutrientes, transporte de
oxígeno
y de grasas
en la sangre,
inactivación de materiales tóxicos o peligrosos,
etc.). También son los elementos que definen la identidad de
cada ser vivo, ya que son la base de la estructura del código
genético (ADN) y de los
sistemas de reconocimiento de organismos extraños en el
sistema
inmunitario.
Son macromoléculas orgánicas, constituidas
básicamente por carbono (C),
hidrógeno (H), oxígeno (O) y
nitrógeno (N); aunque pueden contener también
azufre (S) y fósforo (P) y, en menor proporción,
hierro (Fe),
cobre (Cu),
magnesio (Mg), yodo (I), etc…
Estos elementos químicos se agrupan para formar
unidades estructurales llamados
AMINOÁCIDOS, a los cuales podríamos
considerar como los "ladrillos de los edificios moleculares
proteicos".
Se clasifican, de forma general, en Holoproteinas
y Heteroproteinas según estén formadas
respectivamente sólo por aminoácidos o bien por
aminoácidos más otras moléculas o elementos
adicionales no aminoacídicos.
http://www.aula21.net/Nutriweb/proteinas.htm –
arriba#arriba
Son sustancias cristalinas, casi siempre de sabor dulce.
Los aminoácidos se caracterizan por poseer un grupo
carboxilo (-COOH) y un grupo amino (-NH2).
Los aminoácidos son las unidades elementales
constitutivas de las moléculas denominadas
Proteínas. Son pues, y en un muy elemental símil,
los "ladrillos" con los cuales el organismo reconstituye
permanentemente sus proteínas específicas
consumidas por la sola acción
de vivir. Los alimentos que
ingerimos nos proveen proteínas. Pero tales
proteínas no se absorben normalmente en tal constitución sino que, luego de su
desdoblamiento ("hidrólisis" o rotura), causado por el
proceso de digestión, atraviesan la pared intestinal en
forma de aminoácidos y cadenas cortas de péptidos.
Esas sustancias se incorporan inicialmente al torrente
sanguíneo y, desde allí, son distribuidas hacia los
tejidos que las necesitan para formar las proteínas,
consumidas durante el ciclo vital.
Se sabe que de los 20 aminoácidos proteicos
conocidos, 8 resultan indispensables (o esenciales) para la vida
humana y 2 resultan "semiindispensables". Son estos 10
aminoácidos los que requieren ser incorporados al
organismo en su cotidiana alimentación y, con
más razón, en los momentos en que el organismo
más los necesita: en la disfunción o enfermedad.
Los aminoácidos esenciales más problemáticos
son el triptófano, la lisina y la metionina. Es
típica su carencia en poblaciones en las que los cereales
o los tubérculos constituyen la base de la
alimentación. Los déficit de aminoácidos
esenciales afectan mucho más a los niños
que a los adultos.
Hay que destacar que, si falta uno solo de ellos
(aminoácido esenciales) no será posible sintetizar
ninguna de las proteínas en la que sea requerido dicho
aminoácido. Esto puede dar lugar a diferentes tipos de
desnutrición, según cual sea el
aminoácido limitante. http://www.aula21.net/Nutriweb/proteinas.htm
– arriba#arriba
En esta imagen puede
verse la fórmula de los
20 aminoácidos más importantes , en color negro la
parte común, mientras que en color azul puede verse la
parte variable, que da a los aminoácidos distinto comportamiento.

Fig 1. Estructura de los aminoacidos
esenciales.
2.3
http://www.aula21.net/Nutriweb/proteinas.htm –
arriba#arriba
Los péptidos y el
enlace peptídico.
Los péptidos están formados por la
unión de aminoácidos mediante un enlace
peptídico. Es un enlace covalente que se establece entre
el grupo carboxilo de un aminoácido y el grupo amino del
siguiente, dando lugar al desprendimiento de una molécula
de agua.
Así pues, para formar péptidos los
aminoácidos se van enlazando entre sí formando
cadenas de longitud y secuencia variable. Para denominar a estas
cadenas se utilizan prefijos convencionales
como:
Clasificación de los Péptidos que
atiende al numero de aminoácidos enlazados.
Oligopeptidos | Menos de 10 aa |
Dipeptidos | 2 aa |
Tripeptidos | 3 aa |
Tetrapeptidos | 4 aa |
Polipéptidos o cadenas
polipeptídicas.- si el n º de
aminoácidos es mayor de 10.
Cada péptido o polipéptido se suele
escribir, convencionalmente, de izquierda a derecha, empezando
por el extremo N-terminal que posee un grupo amino libre y
finalizando por el extremo C-terminal en el que se encuentra un
grupo carboxilo libre, de tal manera que el eje o esqueleto del
péptido, formado por una unidad de seis átomos
(-NH-CH-CO-), es idéntico a todos ellos. Lo que
varía de unos péptidos a otros, y por
extensión, de unas proteínas a otras, es el
número, la naturaleza y
el orden o secuencia de sus aminoácidos.
Si la hidrólisis de una proteína produce
únicamente aminoácidos, la proteína se
denomina simple. Si, en cambio,
produce otros compuestos
orgánicos o inorgánicos, denominados grupo
prostético, la proteína se llama conjugada.
http://www.aula21.net/Nutriweb/proteinas.htm –
arriba#arriba
2.4 ESTRUCTURA DE LAS
PROTEÍNAS
La organización de una proteína viene
definida por cuatro niveles estructurales denominados: estructura
primaria, estructura secundaria, estructura terciaria y
estructura cuaternaria. Cada una de estas estructuras informa de
la disposición de la anterior en el espacio.
2.4.1. Estructura
primaria
La estructura primaria es la secuencia de
aminoácidos de la proteína. Nos indica qué
aminoácidos componen la cadena polipeptídica y el
orden en que dichos aminoácidos se encuentran. La función de
una proteína depende de su secuencia y de la forma que
ésta adopte.

http://www.aula21.net/Nutriweb/proteinas.htm –
arriba#arriba
La estructura secundaria es la disposición de la
secuencia de aminoácidos en el espacio. Los
aminoácidos, a medida que van siendo enlazados durante la
síntesis de proteínas y gracias a la capacidad de
giro de sus enlaces, adquieren una disposición espacial
estable, la estructura secundaria. http://www.aula21.net/Nutriweb/proteinas.htm
– arriba#arriba
Existen dos tipos de estructura secundaria:

Esta estructura se forma al enrollarse
helicoidalmente sobre sí misma la estructura primaria.
Se debe a la formación de enlaces de hidrógeno
entre el -C=O de un aminoácido y el -NH- del cuarto
aminoácido que le sigue.- La a(alfa)-hélice
- La conformación beta
A su vez la conformación beta o de hoja plegada,
mantiene la estructura general del aminoácido pero a su
vez prescinde de los enlaces puente hidrogeno que
pueda hacer con otros aminoácidos parecidos o de semejante
naturaleza, por ello da la impresión de ser un cuadernillo
de hojas semidobladas y a ello debe su nombre.
Estas estructuras cumplen solamente la misión de
organizar a las cadenas polipeptídicas estructuralmente
entre ellas.

La estructura terciaria informa sobre la
disposición de la estructura secundaria de un
polipéptido al plegarse sobre sí misma originando
una conformación globular.
En definitiva, es la estructura primaria la que
determina cuál será la secundaria y por tanto la
terciaria..
Esta conformación globular facilita la
solubilidad en agua y así realizar funciones de transporte
, enzimáticas , hormonales, etc.
Esta conformación globular se mantiene estable
gracias a la existencia de enlaces entre los radicales R de los
aminoácidos. Aparecen varios tipos de enlaces:
- El puente disulfuro entre los radicales de
aminoácidos que tiene azufre. - Los puentes de hidrógeno.
- Los puentes eléctricos.
- Las interacciones hifrófobas.
Esta estructura informa de la unión, mediante
enlaces débiles (no covalentes) de varias cadenas
polipeptídicas con estructura terciaria, para formar un
complejo proteico. Cada una de estas cadenas
polipeptídicas recibe el nombre de
protómero.

El método
más sencillo para sintetizar péptidos es la
polimerizacion de un aminoácido.
El homopolímero resultante es una mezcla de
péptidos que se diferencian en la longitud
de la cadena. Estos homopolímeros no se
encuentran en la naturaleza, pero los de origen
sintético han servido para comprender algunas de
las propiedades físicas y espectrales
de las proteínas.
Rxn.
H3N+-CH2-COO-
H3N+-CH2-CO(NH-CH2-CO)n
NH-CH2-COOEl
primer producto que
resulta de la condensación de los aminoácidos es un
dipéptido.
Los grupos amino y
carboxilo terminales están situados ahora de tal manera
que pueden
interactuar para formar una diamida cíclica de
seis miembros. Se ha visto anteriormente
que las reacciones intramoleculares en que se forman
anillos de cinco y seis miembros
son frecuentemente mucho mas rápidos que sus
análogos intermoleculares. Asi, cuando
se calienta la glicina, se obtiene el dimero ciclico
2,5-dicetopiperazina.
Rxn.

Mas aún, la hidrólisis de uno de los
enlaces amida en una 2,5-dicetopiperazina es uno de
los métodos
para preparar dipéptidos sencillos.
Rxn.

El hallazgo de un método racional de
síntesis de péptidos constituye un importante reto
que solo se ha resuelto en las últimas
décadas.
La síntesis de péptidos automatizada, se
ha convertido asi, en una industria con
vida propia, tratando de generar sustancias orgánicas con
funciones específicas como hormonas y
proteínas.
Debido a un cierto números de razones, la
actividad de la investigación de la síntesis de
péptidos ha sido intensa. Los péptidos sintetizados
son de propio interés
como sustancias biológicas activas, como materiales de
examen para proba detalles de procesos
bioquímicos, y modelos con
los cuales podemos estudiar las propiedades químicas y
físicas delas proteínas. En suma, la
síntesis racional y total de péptidos ha sido
necesaria para confirmar algunas de las estructuras deducidas de
péptidos
sintetizados por naturaleza y fragmentos de
proteínas. Finalmente, y de menos importancia, la
síntesis racional de péptidos representa el ascenso
a un nivel mayor de esa gran montaña que es la química. Los
péptidos son las moléculas más largas que la
química ha sintetizado con gran pureza y en forma
homogénea, y esta síntesis no ha sido nada
fácil teniendo en cuenta la polifuncionalidad de los
componentes desde donde se construyen.
En el laboratorio como en la naturaleza, la
síntesis de péptidos generalmente comienza con los
aminoácidos. Ellos deben ser convertidos a
polímeros de manera indirecta o condensados de manera
gradual para formar especies moleculares especificas. Puesto que
aminoácidos son moléculas di o polifuncionales, el
acoplamiento directo del grupo carboxilo de uno con el grupo
amino del otro es logrado mediante la protección de
algunos de los grupos funcionales. Usualmente se realiza por
ataque temporal de GRUPOS BLOQUEADORES O PROTECTORES que inhiben
la reactividad de las
funciones que serán protegidas.
Estos GRUPOS BLOQUEADORES deberán cumplir
las siguientes características:
- El grupo protector debe introducirse facilmente en
la molecula. - Debe proteger al grupo funcional en las
condiciones de formación de la amida. - Debe poder
eliminarse en condiciones que dejen intacto al nuevo enlace
amida - creado.
Los grupos bloqueadores que son fácilmente
introducidos y fáciles y selectivamente removidos son de
necesidad imperiosa. Después que estos grupos protectores
se introducen uno de los componentes que formara el enlace
peptídico, usualmente el componente que provee el lado
carboxílico, es previamente activado. El componente que
contiene el grupo carboxilo activado y el componente que provee
el grupo amino entonces se les permite reaccionar para formar el
enlace peptídico o péptido, para acortar
términos. Vale decir que la activación del grupo
carboxilo y el acoplamiento son pasos secuenciales inmediatos..
Finalmente, los grupos bloqueadores son removidos. El esquema
general se indica en la Figura
1, donde los pasos individuales son discutidos mas
adelante.
No muchos años atrás, muchos grupos
protectores, activadores y procesos de acoplamiento han sido
desarrollados. En este trabajo solo consideraremos aquellos que
sean de provecho en la síntesis de péptidos de
importancia superior.
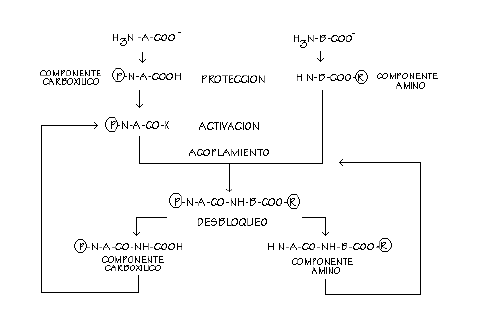
Figura 1: ESQUEMA DE LA SINTESIS DE
PEPTIDOS.
PROTECCIÓN DE GRUPOS AMINOS.
Para el acoplamiento directo, el grupo -amino
del componente carboxílico debe ser restringido de
reaccionar con el grupo carboxilo activo (evitando asi la
dimerizacion y polimerización peptídica
consecuente). Esto se realiza mediante la adición de
sustituyentes que reducen la nucleofilidad de la amina,
usualmente mediante la reducción de la disponibilidad del
par electrónico libre. La basicidad del grupo amino se
convierte así en una dificultad adicional.
La acilación de la amina provee una
protección efectiva, pero los grupos acilos comunes, por
ejemplo, acetilo o benzoílo, no servirán a este
propósito. Un grupo Nacetilo o N-benzoilo no puede ser
removidos sin ruptura del enlace peptídico que se
intentara formar. Los grupos protectores usuales han sido los
sustituyentes alcoxicarbonilos.
El grupo benciloxycarbonilo.
C6H5-CH2-O-CO
En 1932, Max Bergmann y Leonidas Zervas presentaron el
grupo protector benciloxycarbonilo (o carbobenciloxy). Este
invento modernizó la síntesis de péptidos,
el benciloxicarbonilo es aun la primera opción para la
protección o recubrimiento del nitrógeno del grupo
amino en la síntesis de péptidos. El cloruro de
benciloxi carbonilo es preparado mediante reacción del
fosgeno con alcohol
bencilico [Eq.
(1)].
C6H5-CH2-OH + Cl-CO-Cl
C6H5-CH2-O-CO-Cl + HCl [1]
Este cloruro de acilo reacciona con aminas o aminoacidos
para formar el correspondiente uretano, derivados de
N-benciloxicarbonilos, en gran rendimiento [Eq (2)].
Los derivados de N-benciloxicarbonilos, al igual que
otras amidas, no reaccionaran fácilmente con grupos
carboxilos activados, pero a diferencia de otras, deberán
ser convertidas al grupo amino original bajo condiciones no
hidrolíticas.
C6H5-CH2-OOC-Cl + H2N-R + OH-
C6H5-CH2-OOC-NHR + Cl- [2]
El enlace éster bencilico de un grupo
N-benciloxicarbonilo es estable a condiciones alcalinas
relativamente leves en que saponificamos el éster de metil
o etil del péptido, pero experimenta una catálisis
ácida con ruptura del enlace alquil-oxigeno. El
ataque ácido es facilitada por la presencia de un agente
nucleofílico que debe atacar el átomo de
carbono bencílico. La eliminación práctica
de un grupo N-benciloxicarbonilo se lleva a cabo mediante
tratamiento con ácido bromhidrico 2N en algún
solvente orgánico (ácido acético,
nitrometano, ácido trifluoroacético) a temperatura
ambiente [Eq(3)]. La división completa
requiere solo minutos.

Una vez que el enlace bencil-oxigeno ha sido roto, el
átomo de nitrógeno se encuentra aun envuelto en una
estructura ácido carbamica. Los ácidos
carbamicos, sin embargo, tienen una existencia transitoria en
soluciones
ácidas; se descarboxilan inmediatamente para formar
dióxido de carbono y una sal de amonio [Eq(4)].
La sal de amonio debe precipitar por adicion de eter.
Los enlaces peptidicos y la mayoria de los grupos funcionales de
los aminoacidos son estables en estas condiciones, aun cuando no
todos los otros grupos protectores sobreviven a ellas.
[HOOC-NH-R] 0=C=0 + H2N-R
H+H3N+ -R
[4]
Un método alternativo para remover los grupos
benciloxicarbonilos utiliza una diferente peculiaridad de
ésteres y éteres de bencilo. La desunion
bencil-oxigeno debe ser producida por reducción, con la
formación de tolueno. Este proceso es conocido como
hidrogenolisis [Eq(5)]
C6H5-CH2-OOC-NH-R + 2[H]
C6H5-CH3 + [HOOC-NH-R] [5]
La hidrogenolísis de los derivados de
benciloxicarbonilo es mas conveniente mediante el bombeo de
hidrogeno en suspensión con un catalizador de paladio en
una solucion del derivado. El paladio, en comparación con
el platino, es usado como catalizador ya que presenta una menor
tendencia para hidrogenar anillos aromáticos. Si la
contaminación del catalizador hace que el
método sea impracticable en el caso de la presencia de
azufre de ciertos aminoácidos (cisteína y
metionina), la hidrogenolísis se llevará a cabo con
sodio sumergido en amoniaco.
La química orgánica tiene en el grupo
benciloxicarbonil un bloqueador que es fácilmente
introducido en los aminoácidos (o sus ésteres) y es
eliminado de los péptidos bajo condiciones que no son
nocivas para el enlace peptídico. El suceso de este grupo
protector ha conducido al desarrollo de un buen numero de
versiones modificadas. La sustitución del
p-Nitrobenciloxicarbonil rinde sustancias que son mas
fácilmente cristalizables que los mismo derivados de
benciloxicarbonilo. El grupo p-nitrobenciloxicarbonilo es
dificilmente atacado por las soluciones de acido
bromhidrico.
En contraste, el grupo p-metoxibenciloxicarbonilo son
eliminados o removidos a 0oC por el acido trifluoroacetico, un
conjunto de condiciones a las cuales el grupo benciloxicarbonilo
es estable. Los grupos benciloxicarbonilos azo sustituidos han
sido tambie utilizados ; estos dan derivados coloreados, los
cuales son facilmente detectados mediante cromatografía.
El grupo t-butoxycarbonilo.
(CH3)3C-O-CO
Un segundo grupo bloqueador alcoxicarbonilo, el cual,
cuando es usado con el benciloxicarbonilo, provee una
protección diferente de grupos funcionales, hablamos del
grupo t-butoxicarbonil. Este grupo debe, al igual que el grupo
benciloxicarbonilo, ser removido mediante catálisis acida
por ruptura de u enlace alquil-oxigeno, pero solo se usara a
condiciones que no afecten el enlace bencil-oxigeno. El grupo
tbutoxicarbonilo es eliminado a 20oC en una hora o menos bajo
tratamiento con acido
trifluoroacetico anhidro o acido clorhidrico 2N
[Eq(6)].
El grupo t-butoxicarbonilo no es afectado por la
hidrogenacion, y, como todos los esteres terciarios es
extremadamente fuerte a la hidrólisis basica.
(CH3)3C-O-CO-NH-R
H+[(CH3)3C+] +
[HO-CO-NH-R]
[(CH3)3C+] + [HO-CO-NH-R]
H+(CH3)2 C=CH2 + CO2 + H3N+ -R
[6]
Así, en la misma molécula, los grupos
protegidos por el grupo t-butoxicarbonilo deberán ser
desbloqueados sin liberar aquellos protegidos por el grupo
benciloxicarbonilo; este se produce por leve tratamiento con
acido. El resultado opuesto, desbloquear grupos protegidos por el
grupo benciloxicarbonilo mientras salen estos protegidos por
t-butoxicarbonilo, se logra por hidrogenación. Esta suerte
de versatilidad es mas buscada en la síntesis de
algún complejo.
Un grupo t-butoxicarbonilo no puede ser usado mediante
su correspondiente cloruro de acilo, desde que es muy
inestable [Eq(7)], se
usara en todo caso una azida acida [Eq(8)]. La azida reacciona con aminas o
aminoacidos in agua o solventes organicos, en la presencia de
bases débiles.
(CH3)3C-OOC-Cl
10º(CH3)2C=CH2 + HCl
+ CO2 [7]
(CH3)3C-OOC-N3 + H2N-R
(CH3)3C-OOC-NH-R + HN3 [8]
Las t-butoxicarbonil hidrazidas, una via estable para la
preparación de la azida necesaria, es preparada en una
secuencia de dos pasos. [Eq(9),(10)].
Esta es convertida a azida reactiva mediante el
tratamiento con acido nitroso [Eq(11)]
(CH3)3C-OH + Cl-CO-S-C6H5
PYRIDINA(CH3)3C-O-CO-S-C6H5
[9]
(CH3)3C-O-CO-S-C6H5 + NH2-NH2
(CH3)3C-O-CO-NHNH2 + HS-C6H5 [10]
(CH3)3C-O-CO-NHNH2 + HONO
(CH3)3C-O-CO-N3 [11]
El grupo toluenosulfonilo.
CH3-C6H5-SO2
Se produce toluenosulfonamida cuando reacciona una amina
con el cloruro de ptoluenosulfonilo en presencia de base
[Eq(12)].
CH3-C6H5-SO2-Cl + H2N-R + OH-
CH3-C6H5-SO2-NHR + Cl- + H20 [12]
Las toluenosulfonamidas no reaccionan con agentes
acilantes y son estables a casi todas las condiciones que puedan
ser encontradas en la sintesis de peptidos. Ellos son fomrados
mediante el tratamiento con sodio y amonio liquido, cuyos efectos
reductivos rompen el enlace S-N [Eq(13)]
CH3-C6H5-SO2-NHR + 2[H]
Na/NH3CH3-C6H5-SO2- +Na + H2N-R
[13]
El grupo Trifenilmetilo (Tritilo).
(C6H5)3C-Cl
El cloruro de trifenilmetilo (tritilcloruro) reacciona
con aminoacidos y esteres en solventes organicos, en presencia de
base, para formar esteres de N-trifenilmetil (Ntritil)
aminoacidos [Eq(14)].
Aunque bien estos derivados son aun algo basicos, ellos estan
estericamente impedidos de reaccionar con derivados de carboxilos
activados. Los esteres N-tritil--aminoacidos de metilo (o
etilo) deben ser saponificados para producir el
N-tritilo-aminoacido, pero la saponificacion es lenta
,
(C6H5)3C-Cl + H2N-R
(C6H5)3C-NH-R + Cl- + H+ [14]
ya que los sustituyentes tritilos voluminosos
interfieren con las reacciones tanto del grupo carboxilo como las
del grupo amino. Este efecto esterico es una desventaja e el uso
de N-tritilo--aminoacido activado como componente
carboxilico en el acoplamiento peptidico; sin embargo, el residuo
tritilo puede ser usado en la protección de otros grupos a
excepcion de -amino.
El grupo tritilo no se puede eliminar mediante alcalis,
pero a causa de que la estabilidad de los cationes
trifenilmetilos resultantes, un intermediario en la reaccion
acidocatalizador, es en extremo inestable para diluir acidos y es
eliminado por calentamiento por pocos minutos con dilucion acuosa
de acido acetico. [Eq(15)]
(C6H5)3C-NHR + H+
[((C6H5)3C]+ + N2HR H2O
(C6H5)3C-OH [15]
Otros grupos N-protectores.
En suma a los cuatro grupos descritos anterioremente
muchos otros han sido utilizados ocasionalmente en la sisntesis
de peptidos o para la proteccion de grupos amino en otras
sintesis. Tres de ellos deben ser mencionados. Las aminas y
aminoacidos pueden ser convertidos a derivados de N-formilo
mediante el uso de una mezcla de ácido fórmico y
anhidrido acético. La reacción probablemente
procede a través de la mezcla anhidrido
acético-fórmico [Eqs(16), (17)].
CH3-CO-O-CO-CH3 + HCOOH
CH3-CO-O-CO-H + CH3COOH [16]
CH3-CO-O-CO-H + H2N-R
CH3COOH + H-CO-NHR [17]
El grupo formilo es fácilmente eliminado por
tratamiento con HCl 1N en metanol a temperatura
ambiente.
La reaccion de una amina con trifluorotiolacetato de
etilo [Eq. (18)]
resulta en la formación de un derivado de
N-trifluoroacetilo.
CF3-CO-S-Et + H2N-R
CF3-CO-NHR + Et-SH [18]
Las trifluoroacetamidas son de las pocas amidas que son
fácilmente hidrolizadas por base. El hidróxido de
sodio 1N a temperatura ambiente sera suficiente.
Los aminoacidos pueden ser convertidos a derivados de
N-ftaloil mediante fusión con Anh.
Ftálico [Eq.(19)].

Hay peligro que pueda ocurrir la racemización del
átomo de -carbono óptimamente activo en
este proceso, se han diseñado otros metodos más
suaves para introducir el grupo ftaloil. En contraste con otros
N-acil--aminoacidos, los derivados de N-ftaloil pueden
ser convertidos a cloruros de acilo estables por medio de
ácido clorhídrico de tal manera que puedan ser
utilizados como componentes carboxílicos activados en el
acoplamiento de péptidos. Un grupo de condiciones para
eliminar el grupo bloqueador ftaloil sin afectar los enlaces
peptídicos, involucra el tratamiento con hidracina
[Eq.(20)]; desafortunamdamente
este puede derivar en una indeseable hidrazinolisis (esto es
formación de hidrazida) de ésteres que pueden estar
presentes.

PROTECCION DE FUNCIONES CARBOXILICAS.
El acoplamiento de péptidos puede ser llevado a
cabo satisfactoriamente sin la protección del grupo
carboxilo o del componente amino solo si los pasos de
activación y de acoplamiento no son combinados. Si los dos
pasos son combinados en una sola operación, los grupos
carboxilos de ambos componentes competirán por el agente
activante y se producira una mezcla de productos
acoplados.
Esteres de metil y etil
La formación de ésteres es la forma mas
común de protección de grupos carboxilo. Para ello
se realiza la metil y etil esterificación de aminoaciodos
con los alcoholes
respectivos. Cuando se desee estos grupos son eliminados por
saponificación, utilizando mezclas de
solventes orgánicos y alcalis acuosos, (por ejemplo:
agua-dioxano o aguapiridina) a temperatura ambiente. La ruptura
usualmente requiere de minutos a horas.
Sin embargo, el ataque a los enlaces peptídicos
puede ocurrir en algunos casos, y los rendimientos pueden no ser
satisfactorios siempre.
Los ésteres de etilo o metilo son usados como
grupos protectores carboxílicos cuando se desea
eventualmente convertir el grupo carboxilo final el
péptido en una acil-azida (la discusión de este
metodo de acoplamiento se discutirá más
adelante).
Esteres de p-nitrobencil.
Los ésteres bencílicos, los cuales son
convertidos a ácidos carboxílicos libres, mediante
el mismo tratamiento que elimina los grupos N-benciloxicarbonilo,
son generalmente formados por destilación azeotrópica de agua
desde una mezcla de alcohol bencílico y el
aminoácido en la presencia de un acido catalizador como
puede ser benceno o ácido
toluenosulfónico.
Los ésteres p-nitroglicil o bencilos pueden ser
preparados por una esterificación directa usando alcohol
p-nitrobencilico en condiciones ácidas, pero tambien son
convenientemente preparados mediante reacción de bromuro
de p-nitrobencilo con la sal de plata de un aminoácido
N-protegido [Eq.(21)].

La eliminación selectiva de los grupos de
N-benciloxicarbonilo desde los péptidos o ésteres
nitrobencilo de aminoácidos se lleva a cabo a traves de un
tratamiento con bromuro de hidrógeno en ácido
acético.[Eq.(22)]

Esteres de t-butil.
Los ésteres de t-butil no son hidrolizados por
álcalis o atacados por otros agentes nucleofílicos
pero pueden ser eliminados cuando sea necesario por los mismo
agentes que eliminan los grupos t-butoxi carbonilo. El ester de
t-butilo es introducido por esterificación directa de un
aminoácido y un N-acilaminoacido, y el isobutileno y el
catalizador ácido sulfúrico usando cloruro de
metileno como solvente, sirve para este propósito
[Eq(23)]. Se puede utilizar
una reacción de trans esterificación con acetato de
t-butilo [Eq.(24)]
R-COOH + (CH3)2C=CH2
H+R-CO-C(CH3)2 [23]
R-COOH + CH3-CO-O-C(CH3)3
H+R-CO-C(CH3)3 + CH3COOH [24]
PROTECCION DE CADENAS LATERALES:
GRUPOS GUANIDINO, AMINO E IMIDAZOL.
Tres aminoácidos poseen cadenas laterales
sumamente básicas: La histidina contiene un grupo
imidazol; la lisina un grupo -amino; y la arginina un
grupo -guanidino. La cadena lateral de histidina es
algunas veces protegida como derivado de N(im)-bencilo
(im=imidazol), la cual puede ser unida mediante reacción
con sodio en amoniaco líquido; otras veces no es
protegida. Las cadenas laterales de lisina y arginina deben estar
siempre protegidas si se desea prevenir su participación
en las reacciones de acoplamiento.
En el caso de la lisina, todos los grupos protectores
discutidos antes para la protección de grupos aminos
terminales, son utilizables para la protección de esta
cadena lateral. Se utiliza particularmente la combinación
de grupos (Por ej: [E2], [E3]) las cuales permiten la
desprotección selectiva de grupos aminoterminales,
mientras el grupo N-protector es dejado intacto.

La reaccion selectiva del grupo -amino durante
la fase de protección puede ser llevada a cabo mediante el
uso de un complejo de cobre de aminoácido [E4]; y
subsecuentemente puede ser eliminado el cobre, por ejemplo,
mediante reduccion con H2S o mediante el uso de un agente
secuestrador o enmascarante. Este método es de
aplicación general para el bloqueo de grupos
-amino y -carboxilo durante la introducción de funciones dentro de las
cadenas.


El grupo guanidino de la arginina se distingue de los
demás a causa de su pronunciada basicidad
(pKa12,5) el cual es tal que el grupo permanece
completamente protonado bajo condiciones en las cuales el grupo
-amino (pK9,25) se dispone a actuar como un
nucleófilo. De esta manera, la cadena lateral del residuo
argininio puede ser protegida como una sal, por ejemplo, como un
hidrobromuro y usada en la síntesis de péptidos a
pH9
sin la complicación de reacciones laterales. El grupo
guanidino es nucleofílico y puede también ser
bloqueado mediante grupos de enlace covalente o de protectores de
tipo amino. Se usa en particular
N-benciloxicarbonilo-N-tosilarginino
[E5] en esta
forma.

Uno de los metodos más populares para el bloqueo
del grupo guanidino es el del nitrato.
Se han descrito ya muchos derivados de nitro arginina.
El grupo nitro es unido mediante catálisis o
reducción electrolítica, pero los detalles de esta
reacción no son totalmente comprensibles. Aunque bien, se
sabe que el ataque es usualmente exitoso cuando se emplea una
cantidad relativamente pequeña de péptidos, los
productos pueden ser formados por reacciones laterales del
intermediario N-nitrosoguanidino; con péptidos mas grandes
es severamente dificultoso tal procedimiento.
Se utiliza tambien fluoruro de hidrogeno anhidro para
romper o clivar el grupo nitroguanidino y aunque el mecanismo de
esta reacción no es entendido, este debe representar un
avance.

PROTECCION DE CADENAS LATERALES
Grupos Carboxílicos.
Sendas protecciones de los grupos carboxilo de los
acidos glutámico y aspártico
son necesarias si estos residuos van ha ser incorporados dentro
de péptidos.
La esterificación directa del ácido y del
catalizador del ácido aspártico o del ácido
glutámico mediante alcohol metílico, etílico
o bencílico, puede ser echa para rendir el respectivo
diester. Si la esterificación no se maneja hasta completar
la reacción, solo se obtendrá el ester de la cadena
lateral [Eq(27)]. La
esterificación acido-catalizador, la cual requiere la
protonación del grupo carboxilo que va ha ser
esterificado, procede mas rápidamente si el carboxilo
además de la carga positiva alrededor lleva al lado el
grupo -amino.

No se desea la protección de las cadenas
carboxílicas laterales como ésteres de metilo o
etilo debido a que los rearreglos están aptos a ocurrir
durante la hidrólisis alcalina. Se requiere regenerar el
grupo carboxilo libre. Estos rearreglos los cuales proceden a
través de intermediarios cíclicos, resultan en
convertir los péptidos involucrando el - carboxilo
a productos en las cuales las cadenas laterales
carboxílicas son parte del enlace carboxílico
fundamental [Eq.(28)].

Los ésteres -bencílico de ac.
glutámico y ac. aspártico son preparados a partir
de los correspondientes ésteres dibencílicos
mediante control cuidadoso
del ataque utilizando yoduro de hidrógeno en ac.
acético. La ruptura ácida de los ésteres de
bencilo, los cuales requieren la protonacion del oxigeno
estérico [cf. Eq. (3)], ocurre mas rápido que el
lugar desde donde salió el ion amonio.
El medio ester-bencílico del ac. aspártico
y el ac. glutámico puede ser convertido a un ester
bencil-t-butil mediante tratamiento con isobutileno y un ac.
catalizador. De esta manera seran convertidos a el
correspondiente medio t-butilico por saponificiación o
hidrogenolisis [Eq.(29)]

Grupos sulfhidrilo.
El grupo sulfhidrilo de la cisteina debe ser protegido
todas las veces durante la síntesis de péptidos.
Algunos iones mercáptidos estan presentes cuando existe un
grupo mercapto desprotegido. (el pKa de un tiol alifático
es cerca de 10). Los iones mercáptidos son poderosos
nucleófilos capaces de competir satisfactoriamente,
siempre a bajas conentraciones, para reacciones con grupos
carboxilos activados. Mas importante, sin embargo, es el echo, de
que los mercaptanos por medio de los iones
mercáptidos son fácilmente oxidables por
aire u otros
agentes para formar disulfuros [Eq. (30)].
2RSH + [O] RS-SR + H2O
[30]
La cisteina es el péptido mas facilmente
manejable en la síntesis como S-bencil cisterna preparado
mediante tratamiento de cisteina, en la forma de una sal de sodio
en amoniaco líquido , con cloruro de bencilo [Eq.
(31)].

Cuando se desea remover el grupo protector, se utiliza
la hidrogenólisis por sodio en amonio líquido. A
causa de que este tratamiento frecuentemente resulta en bajos
rendimientos cuando se aplica a péptidos grandes, los
grupos S-benciloxi carbonilo y el S-tritil han sido
ocasionalmente sustituidos por el S-bencil.
Otros Grupos
El hidroxilo fenólico de la tirosina y el
hidroxilo alcohólico de la serina y treonina no requiere
normalmente protección durante la síntesis de
péptidos. Ellos pueden sin embargo ser protegidos como
éteres de bencilo y derivados acetilos. La o-acetil serina
es preparada mediante saturación de una suspensión
de serina en ácido acético glacial con cloruro de
hidrógeno, una inversión de la preparación del
éster carboxílico del
-aminoácido.
ACTIVACION Y PROCEDIMIENTOS DE
ACOPLAMIENTO
De la mezcla de una amina alifática con un
ácido carboxílico a temperatura ambiente resulta
solo la formación de una sal. Para convertir esta sal en
una amida [Eq. (35)], requiere temperaturas muy altas como para
que sobrevivan la mayoría de péptidos. Por lo
tanto, la formación de un enlace peptídico es
generalmente llevado a cabo mediante la conversión de un
componente carboxílico a un derivado mas reactivo que es
el acilo, algunos de los cuales reaccionan con el componente
amino en condiciones más suaves.
R-COOH + H2N-R' R-COO-
+H3N-R' R-CO-NH-R' + H2O [35]
El mecanismo en detalle de la reacción entre
aminas y derivados acílicos depende de la naturaleza de la
amina y el grupo originalmente atacado por el grupo acilo, que lo
deja cuando la amida es formada. Cuando los reactantes
normalmente se encuentran en el acoplamiento de péptidos,
el ataque nucleofílico inicial mediante la amina conduce a
una especie intermedia que puede revertir a los materiales
iniciales o descomponer a los productos como se indica en
[Eq(36)]. El mas electronegativo es el grupo saliente [-X] (que
es el -X menos básico o el H-X mas ácido), lo mas
favorable, termodinamicamente hablando, probablemente sera la
formación de la amida. La reacción en general
procede relativamente lenta si el grupo -X es un grupo alcoxi
como en un éster y en general procederá mas
rápidamente si el grupo -X es un haluro como en los
halogenuros de hidrógeno. Sin embargo la Eq [36] consiste
en dos equilibrios sucesivos, donde las reacciones que proceden a
la derecha son altamente favorecidas bajo condiciones en que
usualmente la formación de una amida es
irreversible.

La formación de una amida vía ácido
clorhídrico fue usada en la síntesis de
péptidos en sus inicios: Un componente carboxílico
N-protegido fue convertido a su cloruro de acilo mediante
tratamiento con cloruro de tionilo o pentacloruro de
fósforo, y su derivado activado se le permite reaccionar
con el componente amino. La forma de la protección del
nitrógeno amínico que puede usarse con este
método es limitado, sin embargo, en general los haluros de
N-acilo--aminoacílicos no retienen la actividad
óptica
del -carbono central asimétrico. Se puede preparar
a bajas temperaturas cloruros de
Nbenciloxicarbonilaminoácidos opticamente estables, pero a
temperatura ambiente ellos experimentan la descomposición
a anhidrido de N-carboxiaminoácidos y son por lo tanto de
uso inconveniente.
Cuatro procedimientos de activacion carboxilica y
acoplamiento se describen en las siguientes lineas, han sido
ampliamente aceptados para la síntesis de péptidos
complejos. Su aceptación se basa; primero, en el hecho de
que ellos pueden ser usados con una minima pérdida de la
pureza óptica del componente carboxílico y;
segundo, sobre un conveniente balance libre de reacciones
laterales, y práctico rendimiento.
METODO DE LA MEZCLA DE ANHIDRIDOS.
La reacción de un anhidrido carboxílico
con una amina es un método común de
Nacilación, pero usar el anhidrido simétrico de un
aminoácido N-protegido puede ser destructivo para ese
componente, desde que solo la mitad podría poveer de un
grupo acilo. Sin embargo, la mezcla de anhidridos las cuales
reaccionan con aminas solo si el componente carbonil del
aminoacido N-protegido, puede ser usado en vez.
R-CO-O- + Cl-CO-OR'
R-CO-O-CO-OR' + Cl- [37]
Para la sintesis de peptidos, se utiliza la mezcla de
anhidridos del componente carboxilico con acido etil o isobutil
carbonico. Estos son preparados mediante un procedimiento
estandar para la mezcla de anhidridos: La reaccion de una sal de
un componente con un haluro acilico del otro. Usualmente se usa
la sal de trietilamonio del componente carboxilico del peptido.
[Eq. (37)]. La sintesis de un anhidrido se lleva a cabo con un
solvente no polar, si es posible, alrededor de -10oC. La
formación del
anhidrido se completa en minutos. El componente aminico
se adiciona inmediatamente a la mezcla reactiva, y el
acoplamiento procede a esta baja temperatura [Eq.(38)]
R-CO-O-CO-O-R' + R''-NH2
R-CO-NHR'' + CO2 + R'-OH [38]
El rendimiento se encuentra en el rango de 40 a 95 por
ciento. Una reacción lateral, evitada mediante el uso de
bajas temperaturas (arrriba de -5ºC), es la
descomposición de la mezcla de anhidrido para formar un
éster.[ Eq.(39)]
R-CO-O-CO-OR' R-CO-OR' +
CO2 [39]
La mezcla de anhidridos a excepcion del carbonico han
sido utilizados en elacoplamiento de peptidos. Estos incluyen a
aquellos formados con derivados de acido fosforico y sulfurico,
tambien como acidos carboxilicos con impedimento esterico tales
como el Pivalico.
METODO DE LAS ACIL AZIDAS.
Una reaccion de acoplamiento de peptidos que ha
resistido una gran cantidsad de tests, y fue de echo, una de las
primeras en ser descubierta (por Curtius, en 1902), es la
reaccion de un componente amino con una acil azida [Eq. (40)].
Este es el unico metodo de sisntesis de peptidos que no deja
detectar la racemizacion de un componente carboxilico a pesar de
su naturaleza.
R-CO-N3 + H2N-R'
R-CO-NHR' + HN3 [40]
Sin embargo, es un procedimiento complicado del cual
siempre se obtienen bajos rendimientos, es aun una de las mas
amplias tecnicas de acoplamiento aun usadas.
Para formar una azil azida, un componente de un ester de
metil o etil carboxilico es primeramente tratado con hidrazida
[Eq.(41)].
R-CO-Ome + H2N-NH2
R-CO-NH-NH2 + Me-OH [41]
La acilhidrazina a ser formada es usualmente cristalina
y puede ser purificada por recristalizacion. Es entonces tratada
con acido nitrico en solucion acuosa, o en un medio anhidro
medianamente acido con un nitrito alquilico o un cloruro de
nitrosilo para producir la acil azida [Eq.(42)].
R-CO-NH-NH2 + HONO [
R-CO-N=N+=N- R-CO-N–N+N ]
[42]
El aislamiento y purificación de la azida se basa
en su solubilidad en solventes orgánicos y su
insolubilidad en agua.
Todos los mecanismo de una acil azida pueden ocurrir a
bajas temperaturas (debajo de los 5oC) para suprimir el rearreglo
Curtius. Sin embargo, el rearreglo Curtius [Eq.(43)] a
isocianatos y sus derivados es una herramienta muy utilizada en
otras circunstancias, su ocurrencia en síntesis de
péptidos no solo reduce los rendimientos de la
formación de péptidos si no que también
dificulta la purificación del producto.
Las acil azidas se acoplan con componentes aminos en
solventes orgánicos a 5oc o por debajo de esta
temperatura. Todos los intervalos de su rendimiento están
entre 30 y 70%.

METODO DE LAS CARBODIIMIDAS.
N,N'-dialquilcarbodiimidas, disponibles mediante
deshidratacion o destiolacion de las ureas o tioureas
respectivamente. [Eqs. (44), (45)] , se utilizan como agentes
acoplantes de peptidos en un solo paso.
R-NH-CO-NH-R + Ph-SO2-Cl + Et3N
R-N=C=N-R + Ph-SO3H + [EtNH]+Cl- [44]
R-NH-CS-NH-R + HgO
R-N=C=N-R + HgS + H2O [45]
La N.N'-diciclohexilcarbodiimida fue inicialmente
explotada para la formación de derivados de acido
pirofosforico. [Eq.(46)], pero su utilidad en la
sintesis de derivados carboxilicos fue prontamente
establecida.
2 (RO)2P(O)OH + C6H11N=C=NC6H11
(RO)2P(O)OP(O)(OR)2 + C6H11N-CONC6H11
[46]
Cuando a una dialquilcarbodiimida se le permite
reaccionar con un acido carboxilico se forma inicialmente una
orto aciluea [Eq.(47)]. La ortoacil urea reacciona facilmente con
nucleofilos.

Si una amina esta resente se formara una amida
[Eq(48)].Si ningun otro nucleofilo esta presente o si la reaccion
con los presentes es muy lenta o muy impedida, el reactivo
intermediario experimenta un reareglo a una N-acilurea que es
mucho mas estable, la cual es solo ligeramente suceptible a
reaccionar con nucleofilos. [Eq. (49)].


La acilacion inducida por una dialquilcarbodiimida no es
restrigida a aminas; los fenoles son covertidos a esteres
fenilicos, y si existe un exceso de acido carboxilico como unico
reactante disponible se formaran anhidridos
carboxilicos.
LA N,N'-diciclohexilcarbodiimida es el agente mas
facilmente disponible para la reaccion antes descrita. La
manipulacion inicial requiere para su uso en el acoplamiento de
peptidos es extremadamente simple: los componentes amino y
carboxilo son mezclados en una concentracion tan alta como sea
posible; la solucion es enfriada a OoC- y la carbodiimida es
adicionada. La presencia de agua no es una interferencia seria
con el acoplamiento peptidico inducido por la carbodiimida, y por
consiguiente se pueden usar solventes acuosos.
Ocasionalmente, la separacion de la diciclohexil urea,
el producto de hidratacion de la carbodiimida, desde el producto
peptidico es dificultosa. Para conocer esta dificultad, las
dialquil carbodiimidas que rinden ureas solubles en agua han sido
utilizadas, dispuestas. Un ejemplo es la hidrocloruro de
N-(3-dimetilaminopropil)-N'-etilcarbodiimida:
Formula:
[Me2NH(CH2)3-N=C=N-Et]+Cl-
METODO DE LOS ESTERES ACTIVOS.
La aminolisis de esteres alquilicos simples son
usualmente lentas. Esteres fenilcos son mas reactivos por que los
iones fenolato siendo menos basicos que los iones alcoxidos
(ellos son las bases conjugadas de ac. fuertes) son mejores
grupos salientes [Ver Eq.(36) y su discusion].
La acidez de un fenol y dee esta manera la reactividad
de sus esteres para con aminas y otros nucleofilos es
marcadamente incrementada mediante la sustitucion de grupos
electro-atrayentes en los anilos aromaticos. Ac ausa de esto,
esteres de pentaclorofenilo han sido introducidos y el
p-nitrofenilester es de uso correinte y extensivo como activador
de componentes carboxilicos en la sintesis de peptidos. Los
p-nitrofenilesteres son preparados mediante reaccion de un
componente
carboxilico con el p-nitrofenol usando
N,N'-diciclohexilcarbodiimida como el agente acoplante [Eq.
(50)].

El ester p-nitrofenil de benciloxicarbonilaminoacido es
un material cristalino, el cual, en contraste con otros derivados
carboxil activados pueden ser almacenados (en la oscuridad) en
alguna repisa del laboratorio. Para el acoplamiento, el ester de
nitrofenilo y el componente amino son mezclados en un solvente no
hidroxilico y almacenados a temperatura ambiente
[Eq.(51)].

Los rendimientos cubiertos de los productos peptidicos
son usualmente altos, casi siempre cuantitativos.
El metodo del ester nitrofenilico es especialmente usado
en la construccion de cadenas peptidicas mediante adicion gradual
de un residuo aminoacidico simplea al amino terminal de una
cadena creciente. Cuando este metodo es usado, el paso el cual
podría resultar en pobres rendimientos, seria la
formación del ester activo, la cual ocurre a los mismos
niveles relativamente económicos del
benciloxicarbonil-aminoácido.
RACEMIZACION.
Una sintesis de peptidos satisfactoria debe proceder sin
afectar la configuración de algunos de los centros
asimetricos de los componentes. En el trabajo de
peptidos, la formación de mezclas diasteromericas es al
menos tan indeseable como la formación de enlaces
covalentes entre los átomos equivocados. En la
síntesis de péptidos fisiologicamente activos; por
ejemplo, es importante conocer que alguna propiedad
biologica de la molecula cuya sintesis se busca directamente, y
no señal de algún diasterómero
áltamente activo. Desafortunadamente, es frecuentemente
dificultoso
separar péptidos que difieren solo de su
configuración. Evitar la racemización de centros
opticamente activos es, sin embargo, una de las mayores
importancias en el planeamiento de
sintesis de peptidos. Normalmente, el centro asimetrico corre
peligro de perder la actividad óptica solo durante la
formación del enlace peptidico, es decir durante la
formación del enlace -carbono adyacente al grupo
carboxilo activado. La racemización de este centro ocurre
en gran parte a través de la formación de un
intermediario 5-oxazolona (azlactona), el cual puede ser
sintetizado, con frecuencia reversiblemente, desde algún
derivado acilo de un N-acil-aminoácido que es
suficientemente electrofílico para experimentar el ataque
nucleofílico externo ilustrado en [Eq(52)]

Las 5-oxazolonas forman aniones estabilizados por
resonancia en los cuales el centro asimetrico inicial toma un
arreglo de enlaces trigonales. Alguna base debil presente en una
solucion conteniendo la oxazolona, aún el solvente mismo,
puede catalizar la pérdida de la actividad óptica
via el anión oxazolona, aún a su vez, considerando
que la formación del anion no se ve favorecida hacia el
equilibrio.
[Eq(53)].

La formación del equilibrio de la oxazolona no
necesita ser extensiva para efectuar la racemizacion, pero la
ciclizacion de Eq (52). No interfiere en el acoplamiento de
peptidos, por que las 5-oxazolonas por si mismo reaccionan con
las aminas para dar amidas [Eq.(54)].

La evidencia del mecanismo de la oxazolona para la
racemizacion incluye la identificacion espectrofotometrica de
oxazolonas en soluciones de esteres de pnitrofenil de acilamino
tambien como el estudio cinetico de cantidades de racemizacvion y
apertura de anillos de oxazolonas opticamente activas.
La racemizacion de un derivado carboxilo opticamente
activo se ha observado tambIen que ocurre en ciscunstancias donde
la formación de la azlactona es difícil o
imposible.
En estos casos, la ruta probable involucra la ionizacion
directa de un proton de el -carbono de el derivado de
aminoacido. Este grupo C-H es menos acido que el correspondiente
grupo en una 5-oxazolona, pero su anion es aún
estabilizado por resonancia y similarmente incapaz de retener
asimetría:
-CONH-C: (R)- CO-X
-CONH-C(R)=CO-X
Atendiendo a los factores que afectan la racemizacion,
el proceso de acoplamiento de peptidos y la sintesis de peptidos
puede ser diseniada de tal manera que la perdida de la actividad
optica sea minima. Los factores observados son los
siguientes:
1.- Cuidado en el metodo de activacion y
acoplamiento, la racemizacion es minimizada mediante la
utilizacion de lso solvente menos polares
posibles.
2.- La racemizacion es favorecida por la presencia de
alguna base sobre y por encima de la cantidad necesaria
correspondiente al grupo amino de el segundo
componente.
3.- La racemizacion es favorecida por altas
temperaturas.
4.- Los derivados de Prolina no son facilmente
racemizados. [Un derivado de N-acil prolina el cual carece de un
grupo N-H no puede ciclarse por el mecanismo de la
Eq(3-52)].
5.- Los derivados de N-ftaloil y N-toluenosulfonil no
son facilmente racemizados. (Esto, por supuesto, no pueden formar
5-oxazolonas).
6.- Los derivados de N-alcoxicarbonil aminoacidos no
se racemizan en la activación.
(Se concibe que estos no forman facilmente
5-Oxazolonas, sin embargo, un proceso análogo a la
ciclacion permite la formación de N-carboxianhidridos a
partir de los halogenuros de
benciloxicarbonilaminoacilos.
7.- Las N-acil--aminoacil azidas no se
racemizan. La razón aun no es clara.
Esquema de una Síntesis Clásica : El
Glutation.
El Glutation ha sido sintetizado en mas de una docena de
formas diferentes. La mayoría de las rutas se inician con
la formación de un derivado de cisteinglicina protegido
adecuadamente al cual se le acopla subsecuentemente un derivado
del acido glutamico. (Ver Esquema)

Esquema: Diseño
de la Sintesis del Tripeptido Glutation.
La principal dificultad en la síntesis es
proteger adecuadamente el grupo tiol de la cisteína y
lograr el acoplamiento selectivo del grupo -carboxilico
del acido glutámico.
La proteccion del grupo tiol casi siempre se realiza
mediante el grupo S-bencil, sin embargo se utilizan otros grupos
(como por ejemplo el tritilo -trifenilmetilo-) además de
disulfuro libre para tal fin.
El segundo problema se resuelve con un protector
especificio para grupos -carboxílicos. El
acoplamiento del grupo -carboxílico se logra por
activacion selectiva, como un ácido N-benciloxicarbonil
glutámico--azida, mediante protección
selectiva del grupo -carboxi, como un
-etil-N-benciloxicarbonilglutamato, o mediante otros
métodos.
Otros P'éptidos sintetizados en
laboratorio.
Algunos peptidos de origen natural y funciones en el
cuerpo humano
han sido sintetizados en el laboratrio. A continuacion, una lista
de los mas comunes y representativos de esata
industria.
Angiotensina
Asp-Arg-Val-Tyr-Ile-His-Pro-Phe
Gramicidina S.
Pro-Val-Orn-Leu-Phe
Phe-Leu-Orn-Val-Pro
Oxitocina
Iso- Tir – Cis
Glu-Asp-Cis-Pro-Leu-Gli-NH2
NH2 NH2
Bradiquidina.
Arg-Pro-Pro-Gli-Phe-Ser-Pro-Phe-Arg.
Kalidina.
Lis-Arg-Pro-Pro-Gli-Phe-Ser-Pro-Phe-Arg.
Metionilisilbradiquidina.
Met- Lis-Arg-Pro-Pro-Gli-Phe-Ser-Pro-Phe-Arg.
Filoquinina.
Arg-Pro-Pro-Gli-Phe-Ser-Pro-Phe-Arg.-Ile-Tys.
Hormona Estimulante de los a -melanocitos. (a
-MSH).
Ac-Ser-Tir-Ser-Met-Glu-His-Phe-Arg-Trp-Gli-Lis-Pro-Val-NH2.
Hormona Estimulante de los b -melanocitos (b
-MSH).
Asp-Glu-Gli-Pro-Tir-Lis-Met-Glu-His-Phe-Arg-Trp-Gli-Ser-Pro-Pro-Lis-Asp.
Corticotropina (ACTH).
Ser-Tir-Ser-Met-Glu-His-Phe-Arg-Trp-Glu-Lis-Pro-Val-Gli-Li-s-Lis-Arg-Arg-Pro-Val-
Lis-Val-Tir-Pro-Asp-Gli-Ala-Glu-Asp-Glu-Leu-Ala-Glu-Ala-Phe-Pro-Leu-Glu-Phe.
Síntesis de Péptidos en Fase
Sólida.
El método clásico de síntesis de
péptidos funciona bien para unidades pequeñas, y se
han sintetizado, muchos péptidos co este proceso. Sin
embargo, las proteínas mayores no se sintetizan con
facilidad con este método. Se requiere de un gran numero
de reacciones y purificaciones químicas. Aunque los
rendimientos individuales son excelentes, con un péptido
grande el rendimiento general se hace tan pequeño que no
es practico, y se necesitan varios meses (o años) para
completar tantos pasos. El tiempo
necesario y los bajos rendimientos generales se deben
principalmente a los pasos por
purificacion. Para los péptidos grandes y las
proteínas se prefiere la síntesis en fase
solida.
En 1962, Robert Bruce Merrifield de la Universidad
Rockefeller, desarrolló un método para la
síntesis de péptidos sin tener que purificar los
productos intermediarios. Esto lo logró fijando las
cadenas crecientes de péptidos a perlas sólidas de
poliestireno.
Después de agregar cada aminoácido, se
lava el exceso de los reactivos enjuagando las perlas con
solvente.
En este apartado solo mostraremos la fijación del
péptido al soporte sólida, lo demás es
exactamente igual a la síntesis clásica de
péptidos mencionada líneas arriba.
Fijación del péptido al soporte
sólido.
La diferencia más grande entre la síntesis
clásica y la síntesis en fase sólida es que
esta última se lleva a cabo hacia atrás, es decir
el grupo carboxilo del ultimo residuo aminoacidico del peptido a
ser sintetizado se fija a la resina polimérica que es el
soporte sólido.
El soporte sólido es una perla de poliestireno
especial en que algunos de los anillos
aromáticos tienen grupos clorometilos. Este
polímero que se llama RESINA DE
MERRIFIELD en honor a su inventor, se fabrica
copolmerizando estireno en bajos
porcentajes de p-clorometil estireno.

Ecuación de
Formación de la resina de Merrifield.
Como otros halogenuros de bencilo, los grupos
clorometilo del polímero son bastante reactivos con
respecto al ataque SN2. El grupo carboxilo de un
aminoácido previamente protegido en N desplaza al cloruro,
formando el éster del aminoácido con el
polímero.
En efecto, el polímero funciona como el alcohol
de un éster que es el grupo protector carboxilo del
extremo-C del aminoácido.

Ecuación de
Fijación del aminoácido al extremo-C
Una vez que el aminoácido se ha fijado, la cadena
se construye sobre el grupo amino. Al término de la
síntesis, se rompe el enlace éster con el
polímero mediante HF anhidro.
Como es un enlace éster, se rompe con mas
facilidad que los enlaces amidas del péptido.

Ecuación de
eliminación del Soporte sólido:
La automatización total del sistema, se puede
describir en lineas generales por medio de un "tocador de piano",
instrumento parecido a un cilindro conectado a recipientes de
disolventes de lavado, grupos bloqueadores, grupos activadores y
aminoácidos a través de una serie de válvulas
selectoras. Se programó asi las secuencias de
adición, lavado y drenado necesarias en la síntesis
de un péptido dado, de modo que todo el proceso, una vez
iniciado, pueda continuar hasta completarse por si mismo. El
recipiente de reacción que contiene el soporte
sólido, se divide en dos partes separadas por un disco de
cristal aglomerado y se conecta a un vibrador.
Después que se le ha agregado un reactivo al
soporte sólido y que ha reaccionado por la
vibración, se aplica una succión y cualquier
material que no haya reaccionado pasa a través de los
discos aglomerados a los depósitos de desperdicios y al
final vuelven a reciclarse y se purifican para su uso
futuro. En la figura a continuación, Ud. puede
observar un esquema representativo del aparato diseñado
por Merrifield para la síntesis de
péptidos.
El sístema automatizado se empleo por
primera vez satisfactoriamente para sintetizar el
nonapéptido bradiquidina e 1965. El proceso completo tomo
casi una semana y dio un rendimiento total de casi 68%. Esta
proeza fue notable en comparación con los métodos
comunes empleados en esa época. La versatilidad de esta
técnica fue demostrada por el grupo de Merrifield cuatro
años más tarde en la síntesis total de la
ribonucleasa, proteína que contenía 124 residuos
aminoacídicos en tan solo seis semanas y con un
rendimiento del 17%.
El trabajo de Merrifield en la síntesis de
péptidos en fase sólida ameritó se le
concediera el Premio Nobel en 1984.

Esquema de la
máquina automática de Merrifield para la
síntesis de péptidos.
1. La síntesis de péptidos no es un
proceso dificil de entender desde el punto de vista de la
formacion del enlace tipo amida, pero dadas las condiciones, el
proceso se hace complejo debido a la relativamente debil
asociacion del grupo carbonilo y el grupo amino.
2. La polifuncionalidad de la molecula, es decir, la
tendencia a ser acido y base a la vez, incrementa las
probabilidades de error al momento de formar el enlace peptidico,
pues hay cierta tendencia a desproporcionar las uniones en virtud
del choque molecular.
3. El entorno quimico dificulta aun mas las
probabilidades de union, aun mas, incrementa la acides o
basicidad de la molecula cuando posee grupos funcionales de
tendencia definida (acidos o basicos).
4. Los aminoacidos son moleculas quirales, existen
tendencia a la racemizacion pues no hay un patron que involucre
una forma de ataque especial para respetar la asimetria. Aun asi,
se puede lograr evitando el uso de condiciones fuertes y
reactivos racemificantes. Ese punto no fue motivo de este trabajo
y constituye hoy en dia todo una rama de
investigación.
5. El efecto que se logra con los grupos protectores y
activadores es sobre la permisividad electronica al momento de
asociarse la molecula protegida o activada sobre la otra, si
tenemos en cuenta que los grupos protectores son voluminosos
notaremos un marcado impedimento estérico para lograr el
primer próposito. De la misma forma, el poceso de
activacion consta de adherir al grupo funcional
carboxilico una molecula jaladora de electrones, con lo
que aumenta su afinidad nucleofilica o mejor dicho sus
proibabilidades de union con el grupo amino del aminoácido
contrario.
6. Los rendimientos estan afectados por los lavados
sucecivos al eliminar los grupos protectores, aun asi, no hay
tecnica de
eliminacion de estos que deje intacto los enlaces peptidicos,
siempre hay perdidas, pueslas condiciones en las solucions a
utilizar no son homogeneas.
7. El incremento en la longitud de la cadena disminuye
el porcentaje de rendimiento en virtud de la dificultad entre los
choques moleculares para lograr una asociación efectiva,
sin embargo, con la técnica de Fase Sólida se logra
controlar en cierta forma los movimientos descontrolados de la
misma sujetándola a una resina especial y dejando el
extremo un extremo libre listo para las futuras reacciones. No
podemos dejar de decir que los rendimientos son bastante altos en
comparación con el método utilizado en la
síntesis clásica.
LIBROS
1. GILCHRIST. T. L. "Quimica Heterociclica". 2da
Edicion. Ed. Addison-Wesley
Iberoamericana. 1995. Delaware.
Paginas consultadas: 285-293.
2. LAW, Harry D. Y OTROS " The organic chemistry of
peptides" Ed. Wiley. 1970.
London.
Paginas consultadas:38-150. (Fuente: PUCP-Biblioteca
Ciencias.
COD:
QD/431/L31)
3. KOPPLE D., Kenneth Y OTROS "Peptides and aminoacids".
Ed. W.A. Benjamin.
1966. New York.
Paginas consultadas:42-64. (Fuente: PUCP-Biblioteca
Ciencias. COD:
QP/801.A5/K75)
4. STREITWIESER a. y C.H. Heathcock "Quimica organica".
3ra Edicion. Ed.
McGraw-Hill Interamericana. 1989. Mexico.
Paginas consultadas: 1027 – 1034.
JOURNALS
5. "The Journal of Organic Chemistry" Vol 38, Num 17,
[3034-3038] 1973.
Articulo: "Amino Group Protection in Peptide Synthesis:
The 4,5-Diphenyl-4-
oxazolin-2-one Group" John C. Sheehan and Frank s.
Guziec Jr.
Candy Janice Ruiz Martel
MSc Química Orgánica.
Pontificia Universidad Católica del
Perú.
Lima.
José Luís Escalante
Salinas
Qco Puro especializado en Productos Naturales
Vilduca Int.
Belice (Centro América)
Categoría : Química,
Bioquímica
Fecha de Realización del Trabajo: Noviembre del
2000.
Lugar de Realización: Universidad Nacional
Federico Villarreal. Escuela
Profesional de Quimica.
Programa de Química Oranica III. Lima.
Perú


