Aminoacil RNAt
Sintetasas (aaRs)
- Objetivos
- Introducción
- Estructura de las AARS
- Aminoacil
RNAT sintetasas, clase I - Dominio
del sitio activo de las AARS clase I - Dominio obligatorio del RNAT de las AARS clase
I - Aminoacil RNAT sintetasas, clase II
- Dominio
del sitio activo y dominio obligatorio del RNAT de las AARS de
la clase II - Función de las AARS durante la
traducción - Conclusiones
- Bibliografía
- Conocer las estructuras de las distintas
clases de aminoacil RNAt sintetasas, estableciendo sus
diferencias. - Entender el funcionamiento de
estas enzimas indispensables para la
síntesis
proteica.

Fig.1 Una aminoacil RNAt sintetasa,
unida a un RNAt (Grijalva, N. et al. 2000.)
La síntesis
proteica es uno de los procesos bioquímicos de
mayor importancia y complejidad que ocurren en el interior de
la célula
(1), el cual no tendría lugar sin
la presencia de las aminoacil RNAt sintetasas (Fig.1),
enzimas que constituyen la vía de conexión entre un
determinado amino ácido con su respectivo RNAt
(2), jugando un papel
importantísimo en la unión de estas dos
estructuras.
Este proceso de activación del
aminoácido al RNAt, es llevado a cabo por estas enzimas en
dos pasos fundamentales, activados ambos por ATP
(3).
Hasta hace poco
tiempo, era aceptada
extensamente la idea de que cada aminoácido tenía una y
solamente una aaRs, como lo planteara en 1958 Francis Crick con
su hipótesis del
adaptador que describía la síntesis proteica,
sin embargo, modernos métodos de
investigación han probado que no cada célula contiene un sistema completo de 20 aaRs, pues
han demostrado los mecanismos con los que actúan algunas de
estas enzimas para cargar y emparejar más de un
aminoácido (4).
Aunque las
funciones de estas enzimas es
constante a través de diversas especies, su estructura es bastante
diversa. Su tamaño puede variar a partir de 334 residuos
(TrpRs) a 1112 (PheRs) (5), sus
subunidades, individualmente pueden variar entre 40 y 110 kDa,
presentando la posibilidad de ser monoméricas,
diméricas y tetraméricas, en cuanto su estructura
cuaternaria; siendo raras las homologías entre ellas
(6).
Se han descrito,
entonces, dos dominios de las aaRs, el de la activación del
aminoácido llamado también dominio catalítico, o
dominio del sitio activo; y el dominio obligatorio del
RNAt.
El dominio
catalítico de las aaRs comprende los sitios a los cuales se
unirá el ATP y el respectivo aminoácido que reconozca
la enzima, se lo puede reconocer como una región amplia, que
se ve interrumpida por la inserción del dominio obligatorio
del RNAt(7). Estos dominios del sitio
activo, son los que le confieren dos tipos de especifiçidad
a las aaRs, los cuales son cruciales, pues es su tarea el
reconocer tanto al RNAt y al aminoácido correctos que van a
enlazar (8).
Las aminoacil RNAt
sintetasas han sido clasificadas en base a datos que emergieron de un
estudio giratorio que comparaba las secuencias de varias de
ellas, extraídas de diversas fuentes, distinguiéndose
de esta manera dos clases, cada una de las cuales posee diez
miembros.
Esta
clasificación se basa en la estructura (motifs) y la
localización del sitio activo donde el ATP será ligado
al aminoácido (aminoacilación) , que puede ser en el OH
2’ o el OH 3’ de la ribosa terminal del RNAt. Es de
esta manera como se han agrupado, en base a sus
características físico-químicas, a las distintas
aaRs en dos clases, denominadas I y II, que a su vez contienen a
otras tres subclases, cada una
(9).
Las aaRs de la
Clase I, tienen su sitio
activo en el lado izquierdo de la misma, mientras que las
pertenecientes a la Clase II tienen el suyo al lado derecho.
Podemos apreciar con mayor detalle las diferencias de los sitios
entre las aaRs de cada una de estas clases en la Tabla
1. Cada una de las clases tiene mutuamente motifs
exclusivos en las regiones obligatorias del ATP, estos no
comparten una homología en la secuencia en cualquiera de las
dos clases (en el mejor de los casos solamente comparten un 30%
es esta); encontrándose una conservación terminante en
los residuos críticos a la función y regulación de
estas enzimas (10).
Las fuerzas que
estabilizan estos dominios descritos, en ambas clases están
estrechamente vinculados a puentes de hidrógeno, interacciones
de Van Der Waals e interacciones de ion/ion. Poseen, además
iones de Mg2+ los cuales se encuentran presentes en los sitios
activos, que entre otras
funciones, estabilizan la conformación de ATP
(11).
Tabla
1. Diferencias importantes entre los sitios activos de
las aaRs pertenecientes a la clase I y II (Grijalva, N. et al.
2000.).
Clase | Clase |
El sitio | El sitio |
Sitio | Sitio |
El sitio | El sitio |
El sitio | El sitio |
Acercan el | Acercan el |
El extremo | El extremo |
AMINOACIL RNAt SINTETASAS, CLASE
I

Fig. 2 Glutaminil RNAt
sintetasa, perteneciente a la clase I (Grijalva, N. et al.
2000.).
Los aaRSs de la clase I (Fig. 2)
incluyen 10 enzimas que tienen dos regiones conservadas de
residuos de aminoácidos, conocidas como HIGH y KMSKS, donde
el aminoácido es activado mediante una ligación con
ATP. Esta clase une el aminoácido activado en el OH 2’
de la ribosa del final del aceptor del RNAt. Ambos procesos se
realizan en el dominio activo del sitio, situado en un "bolsillo
abierto" profundo en el terminal amino de la enzima. Los
aminoácidos activados por estas aaRs son más complejos
que los activados por los de la clase II, esto por cuanto este
"bolsillo" es más abierto que el de estas últimas.
Seis de estas sintetasas presentan sus
estructuras tridimensionales mediante dímeros alfa, mientras
que las cuatro restantes la presentan con dímeros alfa2
(12). A continuación, podemos
apreciar las tres subclases de aaRs de la clase I (Tabla
2.):
Tabla 2. Subclasificación
de las aaRs Clase I (Grijalva, N. et al. 2000.).
Ia | Ib | Ic |
Leu (alfa) | Tyr (alfa 2) | Arg (alfa) |
Ile (alfa) | Trp (alfa 2) | Gln (alfa) |
Val (alfa) | Glu (alfa) | |
Cys (alfa 2) | ||
Met (alfa 2) |
DOMINIO
DEL SITIO ACTIVO DE LAS aaRs CLASE I
El dominio del
sitio activo de las aaRs de la clase I, contiene alrededor de 170
residuos y se construye alrededor de 5 o 6 filamentos beta
paralelos rodeados por hélices alfa. Este comienza con la
región HIGH y termina con la región KMSKS, esta
estructura es conocida como el doblez clásico de Rossman
(Fig. 3), la cual consiste en dos mitades simétricas,
una conteniendo a la región HIGH, que agrupa a tres
filamentos beta con entretejidos de hélices; y la otra mitad
conteniendo la región KMSKS, constituida esta por dos
filamentos beta y dos hélices
alfa(13).

Fig.
3 Doblez clásico de Rossman, distinguimos las
regiones HIGH y KMSKS (Grijalva, N. et al.
2000.).
La
conservación de estas dos regiones no es muy evidente, pues
en el caso del tetrepéptido HIGH, solamente la primera
histidina, y los residuos de glicina demuestran la una
conservación terminante; en el caso de la región KMSKS
la conservación terminante se restringe aún más al
coincidir tan solo en la segunda
lisina(14).
En la distancia
que separa las regiones HIGH y KMSKS, hay dos regiones no
conservadas conocidas como péptidos conectivos 1 y 2. El
primero de estos está situado entre el final de la primera
mitad del doblez de Rossmann y el filamento D, y el segundo se
encuentra entre el filamento D y el principio de la segunda mitad
del doblez de Rossmann. La longitud de los péptidos
conectivos 1 y 2 varía grandemente entre aaRSs, y por lo
tanto, estas dos regiones contribuyen a las diversas estructuras
terciarias encontradas entre las enzimas. En algunos aaRSs de la
clase I, los iones del cinc encontrados en estos péptidos
conectivos estabiliza la estructura terciaria además de
servir un papel
funcional(15).
DOMINIO OBLIGATORIO DEL RNAt DE LAS aaRs CLASE
I
En las sintetasas
de la clase I, los aminoácido activados se unen al extremo
aceptor del RNAt en el OH 2’ de la ribosa. Este grupo de aaRs acerca al
extremo aceptor del RNAt al lado menor del surco. En la
unión del extremo CCA del RNAt, están implicadas dos
regiones de la sintetasa, la primera de ellas está situada
downstream de la primera mitad del doblez de Rossmann en
el péptido conectivo 1, la cual proporciona a la unión
un papel puramente estructural, que consiste en la
complementariedad a la conformación de la horquilla del
extremo aceptor CCA del RNAt. El extremo aceptor se une
propiamente, a la segunda región, localizada después de
la segunda mitad del doblez de
Rossmann(16).
La ubicación
del sitio activo de las aaRs de la clase I (a su lado izquierdo),
obliga la deformación del extremo aceptor CCA del RNAt,
doblándose al revés, haciendo que una horquilla de
vuelta para alcanzar el sitio
activo(17).
AMINOACIL RNAt SINTETASAS, CLASE
II

Fig.
4 Complejo Aspartil RNAt sintetasa + Asp + RNAtAsp + ATP (Grijalva, N.
et al. 2000.).
Las sintetasas de
la clase II (Fig. 4) incluyen 10 enzimas que comparten por
lo menos 2 o tres motifs conservados, en los cuales se
encuentran el aminoácido activado, y el ATP necesario para
su activación. A excepción de PheRs, los miembros de
esta clase se unen al aminoácido activado en el OH 3’
de la ribosa final del extremo aceptor del RNAt. El dominio del
sitio activo está situado en un "bolsillo" profundamente
enterrado del terminal carboxilo de la enzima, y es debido a esta
profundidad, que los aminoácidos activados por esta clase de
sintetasas sean más pequeños que los activados por la
primera, y que por lo general son
polares(18).
En cuanto a su
estructura tridimensional, las aaRs miembros de esta clase, siete
presentan dímeros alfa 2 y tres son tetrámeros. (dos
alfa 2/beta2 y el restante alfa 4). Tabla 3.
Tabla
3. Subclasificación de las aaRs Clase II
(Grijalva, N. et al. 2000.).
Iia | IIb | IIc |
El suyo (alfa | ASP (alfa 2) | Gly (alfa 2 / beta |
Favorable (alfa | Asn (alfa 2) | Ala (alfa 4) |
Ser (alfa 2) | Lys (alfa 2) | Phe (alfa 2 / beta |
Thr (alfa 2) |
DOMINIO DEL SITIO ACTIVO Y DOMINIO OBLIGATORIO DEL
RNAt DE LAS aaRs DE LA CLASE II
Tres son los
motifs que forman los dominios obligatorio del RNAt y del
sitio activo en las sintetasas pertenecientes a este grupo.
Juntos, estos tres motifs contienen cerca de 250 residuos,
y se construyen sobre un filamento beta paralelo, 6 contra
paralelos rodeados en su conjunto por 4 hélices alfa
(Fig. 5).

Fig.
5 Dispoción de los tres motifs que conforman
los dominios de las sintetasas de la clase II
"Como con los aaRs
de la clase I, solamente se conservan los residuos
limitados"(19)
El motif
1 siempre se localiza cerca de 50 residuos upstream
a partir del motif 2, siendo el motif 3 más
variable, en un rango desde 150 a 250 residuos lejos del motif
2, o cerca del terminal carboxilo. Esta distancia nos da a
entender un no tan conservado dominio, lo cual contribuye a las
diferentes estructuras encontradas en las sintetasas de la clase
II. Encontramos conservación terminante en la prolina del
motif 1, en la arginina de los motifs 2 y 3
(20).
En las sintetasas
de la clase dos, los aminoácidos activados son unidos al
extremo aceptor del RNAt en el OH 3’ de su ribosa. Los
motifs 1 y 2 participan en el posicionamiento del extremo
aceptor del RNAt, mientras que el motif 2 esta relacionado
más directamente con el dominio obligatorio del
RNAt(21).
El sitio activo de
estas enzimas, se localiza al lado derecho de las mismas, lo que
le provee al extremo aceptor CCA del RNAt un fácil acceso al
aminoácido, por lo cual nunca se ve deformada esta
estructura, como sucede en el caso de las aaRs de la clase I,
manteniéndose, por ende, la normal estructura helicoidal del
RNAt(22).
FUNCIÓN DE LAS aaRs DURANTE LA
TRADUCCIÓN
La exactitud de la
traducción de la
proteína depende de la fidelidad con la cual los
aminoácidos correctos son esterificados a sus moléculas
cognadas del tRNA por las aminoacil RNAt sintetasas. A pesar de
las diferencias estructurales entre la clase I y clase II, todos
las aaRs realizan la misma reacción de dos
etapas(23) (Fig. 6).
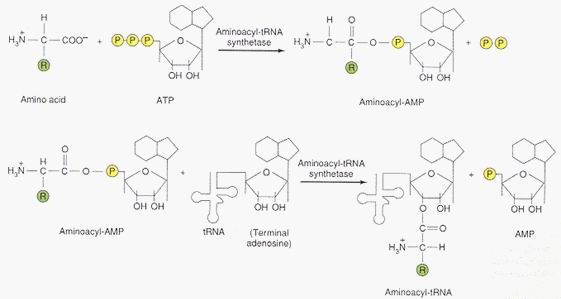
Fig.6 Pasos de la aminoacilación (Grijalva, N. et al. 2000)
Paso 1
En el primer paso,
la enzima une el ATP y el aminoácido, y cataliza la
formación de un intermedio el aminoacil-AMP (o llamado
también aminoacil-adenilato), en el cual un acoplamiento
covalente se forma entre el grupo 5'-fosfato de ATP y el extremo
carboxilo del aminoácido. El aminoacil RNAt sintetasa
utiliza la energía generada por la hidrólisis de ATP
para activar el aminoácido, formando el
aminoacil-AMP.
Paso 2
En el segundo
paso, el aminoácido se transfiere al RNAt apropiado y se
enlaza de manera covalente al OH 2’ o a OH 3’ del
terminal invariante de la adenosina 3' de la molécula del
RNAt. La energía en el aminoacil-AMP se utiliza para
transferir el aminoácido al RNAt que forma
amioacil-RNAt(24).
- Las aminoacil RNAt sintetasas
constituyen enzimas especializadas, sin las cuales sería
imposible la síntesis proteica, por cuanto en
imprescindible su presencia como un medio de conexión
entre un aminoácido y su respectivo RNAt. - A pesar de la aparente
diferencia estructural entre las aaRs, la conservación
terminante de ciertos aminoácidos en su conformación,
así como de las pequeñas homologías que
comparten, nos brindas las bases para afirmar que el origen de
estas enzimas es monofilético, es decir que provienen de
un ancestro en común.
BOYER, R. 2000.
Conceptos de Bioquímica. International
Thomson Editores, S.A. México.
GRIJALVA, N.
PATILLO, D. HOFF, C. 2000. Overview and Structure of
Aminoacyl-tRNA Synthetases. St. Edward’s University.
Austin – Texas – E.E.U.U. http//:
www.cs.stedwards.edu/chem/Chemistry/CHEM43/CHEM43/tRNA/
JUNQUEIRA, L.
CARNEIRO, J. 2000. Biología Celular y Molecular. Ed.
McGRAW HILL INTERAMERICANA HEALTH CARE GROUP. 6ta Ed.
México D.F. – México.
LEWIN, B. 2001.
Genes VII. Ed MARBÁN LIBROS, S.L. Madrid – España.
Mauricio
Martín Moreno Zambrano
Estudiante de
Tercer Nivel de la Facultad de Ciencias Aplicadas, Escuela de Ingeniería en Biotecnología de la
ESCUELA POLITÉCNICA DEL EJÉRCITO (ESPE) Sangolquí
– Ecuador
Fecha de
Realización: Abril 2005
CATEGORÍA:
Biología
