TITULACION DEL ÁCIDO
ACÉTICO
Solución acuosa de Alícuotas de 10ml (* | Volumen y concertación de |
Blanco | 1 ml NaOH 0.02N |
0.2 N | 9.8 ml NaOH 0.2N |
0.15 N | 7.0 ml NaOH 0.2N |
0.12 N | 4.9 ml NaOH 0.02N |
0.10 N | 43.2 ml NaOH 0.02N |
0.08 N | 37.0 ml NaOH 0.02N |
0.05 N | 23.3 ml NaOH 0.02N |
LECTURA DE ABSORBANCIA Y TRANSMITANCIA EN
EL ESPECTOFOTOMETRO DE LAS SOLUCIONES
DE
COLORANTE ORGÁNICO.
Soluciones | ||
Longitud de onda l max de 560nm | ||
Soluciones | Absorbancia | Transmitancia |
10 ppm | 0.274 | 53.2 % |
20 ppm | 0.478 | 33.2 % |
30 ppm | 0.753 | 17.7 % |
40 ppm | 1.031 | 9.3 % |
50 ppm | 1.542 | 2.9 % |
60 ppm | 1.916 | 1.2 % |
Soluciones Filtradas | ||
Longitud de onda l max de 560nm | ||
Soluciones | Absorbancia | Transmitancia |
10 ppm | 0.008 | 98.3 % |
20 ppm | – | – |
30 ppm | 0.025 | 94.3 % |
40 ppm | – | – |
50 ppm | 0.033 | 92.6 % |
60 ppm | 0.092 | 80.8 % |
Los datos de | ||
ANALISIS DE
RESULTADOS
ABSORCIÓN DE AZUL DE
METILENO CON CARBÓN ACTIVADO
Gráfica de Absorbancia contra
concentración de soluciones estándar de colorante
orgánico.

Por regresión
lineal se obtiene la ecuación:
A = -0.169 + 0.03337 C

Concentración (ppm) | Concentración en (ppm) | Concentración (ppm) | Cantidad de soluto (alícuota 80 ml) (gramos) |
10 | 5.30 | 4.7 | 0.376 x 10-3 |
30 | 5.81 | 24.19 | 1.935 x 10-3 |
50 | 6.05 | 43.95 | 3.516 x 10-3 |
60 | 7.82 | 52.18 | 4.174 x 10-3 |

Isoterma de adsorción de
Freundlich

Isoterma de Langmuir


ADSORCIÓN DE ÁCIDO
ACÉTICO CON CARBÓN ACTIVADO
Concentraciones en equilibrio del
ácido acético

Concentración (N) | Concentración en (N) | Concentración (N) | Cantidad de soluto (alícuota 80 ml) (gramos) |
0.2 | 0.196 | 4 x 10-3 | 0.0192 |
0.15 | 0.14 | 0.01 | 0.048 |
0.12 | 0.098 | 0.022 | 0.1056 |
0.10 | 0.086 | 0.0136 | 0.0652 |
0.08 | 0.074 | 6 x 10-3 | 0.0288 |
0.05 | 0.046 | 4 x 10-3 | 0.0192 |
Blanco | 4 x 10-3 | – | – |
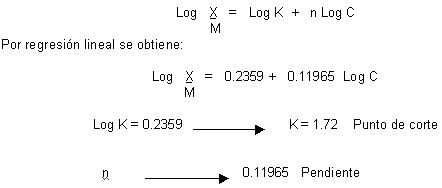
Isoterma de Langmuir


Área Específica del
Adsorbente

Isoterma de adsorción de Freundlich

Generales.
1.1 Estudiar la adsorción del Ácido
acético en carbón activado, al igual que la del
colorante orgánico (azul de metileno).
1.2 Estudiar la relación concentración
– adsorción y la influencia del área de la
partícula en este fenómeno.
Específicos.
2.1 Deducir la relación empírica entre
la adsorción del ácido acético utilizando
carbón activado como adsorbente, al igual que la de un
colorante orgánico.
2.2 Determinar los parámetros de las
isotérmas de Freundlich y Langmuir para el sistema
ácido acético – carbón activado y
colorante orgánico-carbón activado.
2.3 Evaluar los residuales del colorante
orgánico después de la adsorción,
utilizando los principios de
la óptica instrumental
(espectrofotometría).
Existen dos tipos de adsorción: I)
fisisorción y II) quimisorción. La diferencia
fundamental entre ambas es que en el caso de la
fisisorción la especie adsorbida (fisisorbida)
conserva su naturaleza
química mientras que durante la
quimisorción la especie adsorbida (quimisorbida) sufre
una transformación más o menos intensa para dar
lugar a una especie distinta. Como consecuencia existen otras
diferencias tales como i) que en la fisisorción, el
gas (en un
caso específico) se adsorbe formando capa sucesivas
(adsorción en multicapas) mientras que en el caso de
la quimisorción, y debido al enlace
químico que existe entre la superficie del
sólido y el gas adsorbido, la adsorción queda
restringida a una monocapa, ii) el hecho de que en la
quimisorción ocurra una transformación
química origina que la energía de
adsorción sea importante, pudiendo alcanzar valores
similares a las energías de reacción. Por el
contrario la fisisorción es más débil y
siempre exotérmica. Debido a esto la temperatura de desorción de las
especies fisisorbidas es generalmente menor que la de las
especies quimisorbidas, iii) la fisisorción es un
fenómeno más general y menos específico,
y iv) la transformación química de la especie
adsorbida (quimisorción) requiere una cierta
energía de activación, que no es necesaria en
la fisisorción, por lo que esta última suele
ocurrir a temperaturas menores. En algunos casos no es
sencillo distinguir entre ambos tipos de adsorción,
ocurriendo, en algunas ocasiones, situaciones intermedias a
las descritas anteriormente- Tipos de adsorción que
existenEs un proceso
químico que se aplica más que todo para
purificar corrientes líquidas o gaseosas, o limpiarlas
de sólidos suspendidos en ellas. En éste, uno o
más componentes de una corriente se adsorben en la
superficie de un sólido por adherencia y se lleva a
cabo una separación. Es una operación de
transferencia de masas que comprende el contacto de
líquidos y gases con
sólidos.Entre las aplicaciones de este proceso en fase
líquida están la eliminación de compuestos
orgánicos del agua o de
las soluciones orgánicas, la eliminación de
impurezas coloreadas de sustancias orgánicas y la
eliminación de diversos productos
de fermentación de descargas de
fermentadores. Las separaciones incluyen la de parafinas de
compuestos aromáticos y la de fructuosa de glucosa
utilizando zeolitas. Las aplicaciones en fase gaseosa
incluyen la eliminación de agua de hidrocarburos gaseosos, la de componentes
azufrados del gas natural,
la de disolventes del aire y de
otros gases, y las de olores del aire. - Aplicaciones generales de la
adsorciónSe usa la mayoría de las ocasiones en la
purificación de corrientes líquidas o gaseosas,
en la decoloración y para eliminar el sabor y olor de
diversas sustancias que quedan finamente retenidas por los
poros del adsorbente. - Ejemplos de adsorción física usados
industrialmenteAlgunas de las reacciones industriales más
importantes comprenden la catálisis
heterogénea, el uso de un catalizador presentado en
una fase distinta a las especies
reaccionantes, usualmente un catalizador sólido
en contacto con una disolución gaseosa o
líquida de los reactivos . Tal catálisis,
superficial o heterogénea, se cree que se
efectúa por adsorción química de los
reactivos sobre la superficie del catalizador.Los catalizadores de superficie se emplean en los
convertidores catalíticos de los automóviles
para convertir substancias que pueden ser contaminantes
atmosféricos, por ejemplo CO y NO en substancias
inocuas, por ejemplo CO2 y
N2. - Ejemplos de quimiadsorción utilizados en
la industriaA temperatura constante, la cantidad adsorbida
aumenta con la concentración de adsorbato y la
relación entre la cantidad adsorbida (x) y la
concentración (C) de la disolución en el
equilibrio, se conoce como isoterma de
adsorción. Sólo a muy bajas concentraciones
x es proporcional a C. Por regla general, la cantidad
adsorbida se incrementa menos de lo que indicaría la
proporcionalidad a la concentración, lo que se debe a
la gradual saturación de la superficie y, en muchos
casos, la isoterma se puede representar por una
ecuación de la forma:
siendo m la cantidad de sustancia adsorbente, K y n
constantes para el sistema y temperatura dados. La constante
n es, generalmente, menor que la unidad.Esta expresión se conoce como isoterma de
adsorción de FREUNDLICH.Su importancia a nivel industrial se debe a que
gracias al conocimiento de esta, se podrá elegir
el adsorbente apropiado en un proceso definido, que tenga la
mayor eficiencia
posible, evitando desperdicios de material
adsorbente. - Isoterma de adsorción y su importancia a
nivel industrialEs el proceso opuesto a la adsorción, que
consiste en separar una molécula o átomo
de una superficie a la que ha sido adherida. Cuando el lecho,
que es el lugar en donde ocurre la adsorción, acaba de
cumplir su función de adsorbente, es decir se
encuentra saturado el flujo se detiene y el lecho se regenera
térmicamente o por otros métodos, de modo que ocurre un proceso
inverso, la desorción. Así se recupera el
adsorbato y el adsorbente sólido queda listo para otro
ciclo de adsorción. - Desorción
- Diferencia entre adsorción y
absorción
Es importante aclarar la diferencia entre
adsorción; tema de este informe, y la
absorción. En la adsorción la retención de
moléculas se lleva a cabo únicamente en la
superficie del adsorbente y la sustancia retenida o adsorbida se
le denomina fase adsorbida. En la absorción la
retención se sustancias, compuestos o elementos se lleva a
cabo en la estructura
misma de la molécula de absorbente en la que se puede
presentar un intercambio iónico entre los componentes del
absorbato y el absorbente (hay una reacción química
mas o menos permanente).
El proceso de absorción se presenta cuando una
sustancia es químicamente integrada en otra; por ejemplo:
cuando usted bebe un vaso de agua, usted esta "absorbiendo" ya
que el agua pasa a
formar parte de usted; mientras que en la adsorción, una
sustancia esta siendo mantenida dentro de otra por efectos de un
enlace físico. Ejemplo: si usted derrama un vaso de agua
en su pantalón, el agua de ese derrame será
adsorbida por las fibras de la tela, pero estará
ahí hasta que el agua se evapore.
- Las diferentes sustancias orgánicas presentan
una excitación en sus moléculas a una determinada
longitud de onda, por esta razón se realizo la medición en el espectrofotómetro
con una longitud de onda de 560 nm , que es la longitud en la
que las moléculas de azul de metileno absorben
energía y nos proporcionan la absorbancia en cada una de
las soluciones, aspecto que es muy importante para la
determinación cuantitativa de estas. - Con los datos obtenidos en el
espectrofotómetro, se puede deducir que la absorbancia
aumenta con la concentración de las soluciones y la
distancia que recorre el rayo de luz, debido a
que hay mayor cantidad de analito ( mayor cantidad de
moléculas que adsorben energía para excitarse).
Las cuales toman esta energía del ayo de luz,
disminuyendo la intensidad de la radiación, por lo que la transmitancia
disminuye al aumentar la concentración. - La concentración de azul de metileno en
equilibrio por número de gramos adsorbidos por gramo de
adsorbente.(C/Y), disminuye a medida que aumenta la
concentración en equilibrio, hasta la
concentración de 6.05ppm y luego se mantiene
aproximadamente constante.(Isoterma de Langmuir) - A mayor concentración de las soluciones de
azul de metileno, mayor fue la cantidad de azul de metileno
adsorbida por 0.03 gramos de carbón activado. Por lo que
la relación (X/M) aumenta con estas. (Isoterma de
Freundlich), donde el log ( X/M) aumenta con log C.
- A mayor concentración en las soluciones, mayor
será la cantidad de soluto adsorbida cuando se mantiene
la cantidad de adsorbente constante. - La concentración de soluto en equilibrio por
número de gramos adsorbidos por gramo de
adsorbente.(C/Y), disminuye a medida que aumenta la
concentración en equilibrio. - La absorbancia es directamente proporcional a la
concentración y la transmitancia es inversamente
proporcional a esta - Las sustancias orgánicas adsorben
energía a una determina longitud de onda.
